Revisión de la etiopatogenia y clasificación de las anomalías de la diferenciación sexual, así como del desarrollo genital prenatal, para que resulte de utilidad en la evaluación y manejo diagnóstico, mediante una búsqueda bibliográfica de la literatura más actual publicada a través de las bases de datos PubMed, MedLine, Embase, BioMed Central y SciELO.
Las anomalías de la diferenciación sexual comprenden un amplio espectro de enfermedades que pueden desarrollarse en diferentes etapas de la vida. Estas anomalías requieren un manejo y evaluación compleja multidisciplinar en la que el obstetra desarrolla un papel fundamental, siendo referente en el diagnóstico prenatal de estas. La discordancia entre el sexo genético determinado por el test prenatal no invasivo y el fenotípico observado por medio de la ecografía es un hallazgo cada vez más frecuente, con una incidencia de 1 por cada 1.500-2.000 embarazos. La detección temprana de esta discordancia puede orientar la sospecha clínica y mejorar el manejo de las anomalías del desarrollo sexual desde la etapa prenatal.
To review the most current literature on the aetiopathogenesis and classification of abnormalities of sexual differentiation, as well as prenatal genital development. A literature search through PubMed, MedLine, Embase, BioMed Central, and SciELO databases was conducted.
Abnormalities of sexual differentiation comprise a wide spectrum of diseases that can develop at different stages of life. These anomalies require complex evaluation by a multidisciplinary team in which the obstetrician plays a fundamental role in prenatal diagnosis. Discrepancy between the genetic sex determined by non-invasive prenatal testing and the phenotypic sex observed by ultrasound is an increasingly frequent finding, with an incidence of 1 in 1,500-2,000 pregnancies. Early detection of this discrepancy can guide clinical suspicion and improve the management of different sexual developmental anomalies from the prenatal period.
Las anomalías de la diferenciación sexual comprenden un amplio espectro de discordancias cromosómicas, gonadales y fenotípicas1. La clasificación y la terminología empleada para definir estas anomalías ha sufrido distintas modificaciones a lo largo de los años. En 2006, diversas sociedades científicas crearon un grupo de trabajo para revisar el manejo desde una amplia perspectiva, valorar los resultados obtenidos y establecer un consenso basado en la evidencia2. Fue entonces cuando se abogó por eliminar el término de «pseudohermafroditismo-hermafroditismo», y usar en su lugar el de «trastornos o anomalías de la diferenciación sexual (ADS)»2. Posteriormente, el rechazo del colectivo afectado hacia la semiología médica empleada dio lugar a la sustitución del término «intersexual» por el de «desarrollo sexual diferente (DSD)», con mayor aceptación, permaneciendo vigente en el momento actual3.
La mayoría de los casos de DSD tienen una baja prevalencia en la población, a excepción de la forma no clásica de hiperplasia suprarrenal congénita, la hipospadia aislada y las anomalías de los cromosomas sexuales. Se estima una frecuencia de aparición inferior a 1/2.000 por lo que se incluyen dentro del grupo de enfermedades raras4. En función de la presentación clínica, el diagnóstico de estas anomalías puede realizarse en diferentes etapas de la vida, siendo posible desde la etapa prenatal hasta la adulta. La presentación de genitales atípicos o disconcordantes con respecto al sexo genético al nacimiento se denomina ambigüedad genital5. Es una condición infrecuente, con una frecuencia estimada de 1 por cada 4.500 y 5.500 recién nacidos4,6. Dado que el desarrollo sexual depende de diversos factores, es frecuente que las causas que justifican estas anomalías a menudo sean desconocidas y debidas a una combinación de factores genéticos y medioambientales, lo cual dificulta el diagnóstico etiopatogénico4. Estas peculiaridades unidas a la implicación psicosocial de estos trastornos hacen que el manejo temprano y multidisciplinar sea un pilar fundamental para estos pacientes. Se aconseja una valoración por parte de genetistas, ginecoobstetras, pediatras, cirujanos pediátricos, endocrinólogos, psicólogos y psiquiatras, especialmente en los casos que requieren asignación social de sexo3,4. El diagnóstico prenatal de las anomalías del DSD se hace cada vez más relevante, favorecido por los avances en los estudios sonográficos y la accesibilidad a técnicas genéticas que permiten obtener un diagnóstico de seguridad con relación al sexo genético. Sin embargo, aún se considera insuficiente el papel que ocupa el obstetra en el manejo prenatal de estas anomalías7.
El objetivo de este trabajo es presentar una revisión bibliográfica de la literatura sobre la clasificación, diagnóstico y manejo de las anomalías de la diferenciación sexual, en base a la evidencia científica disponible. Se pretende focalizar la misma en las anomalías que cursan con ambigüedad genital, y en cómo los avances introducidos en el diagnóstico genético y en la exploración ecográfica prenatal, suponen una mejora en el manejo y asesoramiento precoz de los pacientes con DSD.
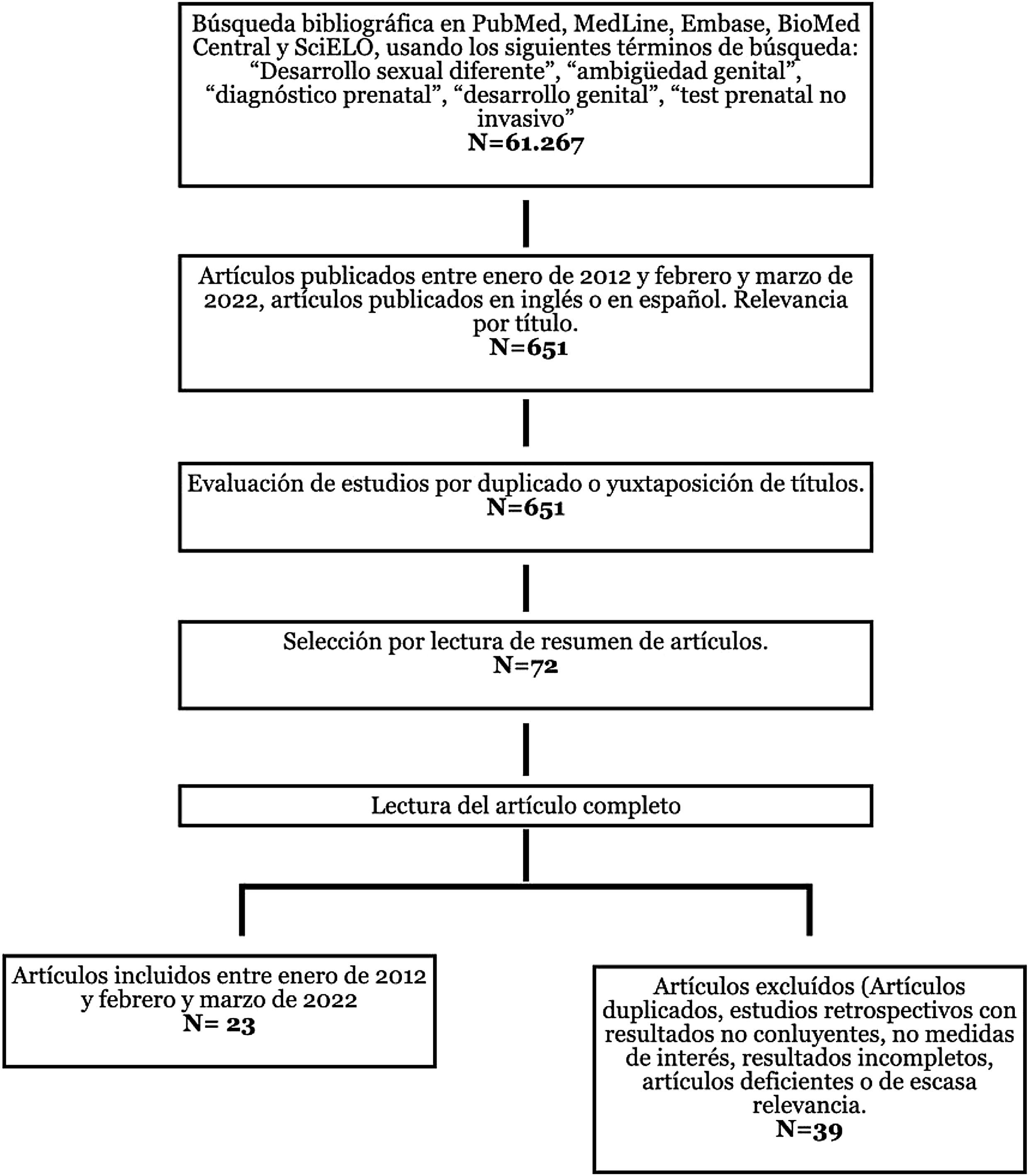
Material y métodosDurante el mes de febrero y marzo de 2022 se realizó una búsqueda bibliográfica de la literatura más relevante y actual publicada sobre el tema a través de las bases de datos PubMed, MedLine, Embase, BioMed Central y SciELO; seleccionando 23 artículos publicados en inglés o español sobre DSD y/o ambigüedad sexual desde enero de 2012 a febrero y marzo de 2022. Aun así, se introducen referencias más antiguas con un total de 33 artículos, para poner en contexto la evolución que han sufrido los conocimientos teóricos referentes a la terminología y a la clasificación del DSD y del desarrollo genital prenatal. Se han excluido los artículos con resultados incompletos, deficientes o de escasa relevancia. Se ha recogido toda la información relacionada con la búsqueda bibliográfica en el siguiente diagrama de flujo (fig. 1).
ResultadosA continuación se presentan los resultados hallados en la revisión bibliográfica, estructurados en tres apartados: fisiología de la diferenciación sexual, clasificación y diagnóstico diferencial del DSD y por último, el desarrollo genital prenatal.
DiscusiónFisiología de la diferenciación sexualEl desarrollo sexual de un individuo depende de la acción coordinada de diversos factores, precisando la activación e inhibición de estos de manera sinérgica y en un espacio temporal determinado8. Desde el punto de vista embriológico pueden diferenciarse una primera etapa común para ambos sexos que engloba las primeras seis semanas de embriogénesis. Se caracteriza por ser una etapa indiferenciada, donde el embrión conserva la capacidad de desarrollar estructuras anatómicas tanto masculinas como femeninas4. Alrededor de la quinta semana de vida intrauterina se desarrolla la cresta gonadal hacia la que migran las células germinales desde el saco alantoideo en la línea media4. Posteriormente, las crestas urogenitales evolucionan a los riñones, las cortezas suprarrenales, las gónadas y los tractos reproductivos8. El desarrollo pluripotencial del embrión en este periodo está sujeto a la participación de varios factores de transcripción como EMX2, LHX9, NR5A1, WT1–KTS Y CBX24, y del gen WT-19. La importancia de la integridad del gen WT-1 fue identificada en la década de los 909. La expresión fetal de este gen es determinante para el desarrollo de la gónada bipotencial y del riñón. Las mutaciones de este se identificaron por primera vez en el tumor de Wilms10, y poco tiempo después, como factor causal del síndrome de Denys-Drash11. Al final de esta etapa comienzan a diferenciarse los conductos de Wolff, los conductos de Müller, el tubérculo genital y los pliegues labio-escrotales y uretrales4. En la séptima semana de vida fetal se inicia la diferenciación sexual, siendo los cromosomas sexuales los responsables de determinar el sexo8. En este punto, la gónada pierde su capacidad bipotencial y se desarrolla hacia el testículo o el ovario en función de la expresión de genes propios de cada vía4. Para el desarrollo testicular de la gónada es fundamental la expresión del gen SRY que se encuentra en el brazo corto del cromosoma Y4,6, y que actúa induciendo la expresión del gen SOX9. Ambos regulan la secreción del factor de crecimiento de fibroblastos (FGF9). El FGF9 ejerce un estímulo de retroalimentación positiva para la diferenciación de las células de Sertoli4,6. Tras el desarrollo de las células de Sertoli se origina la división del testículo en un compartimiento formado por los cordones sexuales, y en otro, compuesto por el intersticio testicular que contienen las células de Leydig y la vascularización del testículo8. Las células de Leydig, productoras de testosterona, originan la diferenciación de los conductos de Wolff en los genitales internos masculinos (epidídimo, conductos deferentes y vesículas seminales)6. Además, la testosterona junto al factor 3 similar a la insulina (INSL3), secretado por el testículo, media el descenso del mismo8. La hormona antimülleriana (AMH), secretada por las células de Sertoli, es responsable de la regresión de las estructuras müllerianas. Por otro lado, el desarrollo de los genitales externos y la regulación de la próstata está condicionada a la expresión de 5-dihidrotestosterona (DHT), gracias a la conversión periférica de la testosterona por la enzima 5-alfa reductasa4. Tradicionalmente se ha considerado al gen SRY como único responsable de la diferenciación gonadal. Sin embargo, los conocimientos actuales han logrado identificar factores propios de cada vía, que además interactúan entre ellos para favorecer la inhibición de una de las vías cuando la otra es activada4,12. En la actualidad se conoce que el desarrollo ovárico es un proceso activo que sucede por la ausencia del gen SRY y por la participación de factores propios como RSPO1, WNT4 Y FOXL212. En la mujer, la ausencia de AMH permite el desarrollo de los conductos müllerianos hacia útero, trompas y dos tercios superiores de vagina. Por otro lado, la falta de testosterona y dihidrotestosterona es responsable de que no se desarrollen los conductos de Wolff y de la ausencia de virilización de los genitales externos8,12.
Clasificación y diagnóstico diferencial del DSDLa clasificación tradicional de los desórdenes del desarrollo sexual fue propuesta en 2006 en el consenso de Chicago1. Esta clasificación divide las anomalías en tres grandes grupos: anomalías de los cromosomas sexuales, DSD con cariotipo 46XX y DSD con cariotipo 46XY6. Sin embargo, esta clasificación no es aceptada unánimemente por todos los autores, existiendo algunas adaptaciones. En 2020, Gomes et al.12 propusieron una nueva clasificación y nomenclatura basada en los conocimientos embriológicos y fisiopatológicos. Los autores manifiestan su recomendación de eliminar de esta clasificación las malformaciones genitourinarias dado su origen embriológico distinto al de las anomalías del desarrollo sexual y diferenciar las anomalías del desarrollo gonadal y cromosómico que cursan con ambigüedad genital.
A la hora de realizar el diagnóstico diferencial de estas anomalías hay que considerar tres entidades:
- -
Anomalías de la diferenciación sexual con cariotipo 46XX: La causa más común es la hiperplasia suprarrenal congénita por el déficit de 21-hidroxilasa. Existen dos tipos, la forma clásica que incluye la pérdida salina o la forma virilizante simple, y la no clásica de presentación más tardía. Otros déficits enzimáticos causantes, aunque mucho menos frecuentes son la deficiencia de 11-b-hidroxilasa y la de 3-b-hidroxiesteroide deshidrogenasa13,14. El déficit de la aromatasa, los tumores virilizantes maternos y las causas iatrogénicas son excepcionales, pero a considerar en casos idiopáticos4,13. Dentro de las causas por anomalías en el desarrollo gonadal se incluyen el DSD ovotesticular, el DSD testicular y la disgenesia gonadal13.
- -
Anomalías de la diferenciación sexual con cariotipo 46XY: Las anomalías del desarrollo gonadal que cursan con una virilización insuficiente son la disgenesia gonadal parcial o completa4. Entre las causas hormonales se identifica la molécula responsable únicamente en 35% de los casos13. En función de donde se origina el déficit distinguimos el síndrome de insensibilidad a los andrógenos, el déficit de 5-α-reductasa, el síndrome persistente de los conductos Müllerianos, la aplasia/agenesia de las células de Leydig y el déficit en la síntesis de testosterona6,13.
- -
Anomalías de los cromosomas sexuales: Dentro de este grupo se incluye: 47XXY (síndrome de Klinefelter), 45X (síndrome de Turner), 45X/46XY (disgenesia gonadal mixta) y 46XX/46XY (quimerismo)6. No siendo ni el síndrome de Turner ni de Klinefelter causas conocidas de ambigüedad genital4,6,13.
El interés en conocer el sexo fetal es un aspecto relevante en nuestros días desde el punto de vista social y cultural. Conocerlo con la mayor exactitud y de manera precoz es una petición cada vez más solicitada en las consultas de obstetricia. Los avances en las técnicas de diagnóstico prenatal han relegado en gran parte el papel de la ecografía prenatal en la determinación del sexo fetal, por ser esta última una prueba más tardía y observador dependiente. En 2013, Colmant et al., revisaron la literatura publicada sobre el uso del test prenatal no invasivo y de los ultrasonidos en la determinación del sexo fetal durante el primer trimestre de gestación15. Los autores hallaron una sensibilidad y especificidad cercana a 100% en ambas técnicas, ofreciendo el test prenatal no invasivo como ventaja principal una determinación más precoz a partir de las ocho semanas15. Con respecto a la determinación del sexo fetal por ultrasonidos, los principales signos ecográficos que facilitan su determinación en el primer trimestre fueron publicados en 2006 por Efrat et al. Se estableció la asignación del sexo fetal en función del ángulo del tubérculo genital, y se asignó el sexo masculino cuando el ángulo era superior a 30° y el sexo femenino si el tubérculo genital era paralelo o formaba un ángulo inferior a 10°. Con este método, se logró asignar correctamente 99,6% de los fetos masculinos y 97,4% de los fetos femeninos16. Resultados similares se obtuvieron en un estudio prospectivo más reciente sobre 534 embarazadas entre las 11 y las 14 semanas de gestación17. La precisión de la determinación ecográfica del sexo fetal aumenta a mayor edad gestacional. En 2014, se desarrolló un estudio transversal prospectivo sobre 640 gestantes con el fin de evaluar la exactitud para predecir el sexo fetal en las ecografías rutinarias de embarazo. Los resultados informaron de una precisión de 100% en las ecografías realizadas después de las 14 semanas. El estudio concluyó que la determinación del sexo fetal a partir de las 12 semanas es una prueba con altas tasas de éxito, pero dependientes de la experiencia del ecografista, así como de la edad gestacional y del propio sexo fetal18. El papel de los ultrasonidos 3-4D en el diagnóstico prenatal de la ambigüedad genital también ha sido evaluado. Los resultados del grupo francés reportaron que la ecografía con volumen puede aplicarse con éxito cuando se requiere evaluar la anatomía de la pelvis fetal y que es útil en el diagnóstico etiopatogénico de la ambigüedad genital19,20. Por ello, independientemente del interés de los progenitores en conocer el sexo fetal es fundamental evaluar prenatalmente el correcto desarrollo de estos. En 2019, la Sociedad Española de Ginecología y Obstetricia (SEGO) actualizó la guía de práctica clínica sobre la sistemática de la exploración ecográfica del segundo trimestre. Con relación a los genitales, establecen que independiente de que la pareja desee conocer el sexo fetal debe observarse de forma rutinaria la normal apariencia anatómica de este21. En la actualidad, las pruebas prenatales no invasivas (TPNI) han supuesto avances fundamentales, logrando determinar de manera más precoz y precisa el sexo fetal, lo cual ha planteado una serie de cuestiones éticas como la interrupción selectiva del embarazo según el sexo22. El TPNI se desarrolló en 2011 como un método de screening no invasivo de cromosomopatías22, que además permite informar del sexo fetal con muy alta precisión a partir de las 10 semanas23. Este hecho resulta de gran utilidad al considerar las enfermedades hereditarias ligadas al cromosoma X o que afectan a la diferenciación sexual23. En 2017 se llevó a cabo una revisión sistemática sobre el rendimiento del TPNI y las conclusiones obtenidas informaron del alto rendimiento del test en la determinación del sexo fetal, con una sensibilidad y especificidad de 98.9 y 99.6%, respectivamente24. Por otro lado, el incremento de la disponibilidad y uso del TPNI ha supuesto un aumento de resultados discordantes entre el sexo genético y fenotípico, que implican un desafío importante en el diagnóstico y manejo del DSD en etapa prenatal13,25,26. En 2017, Richardson et al., reportaron mediante un estudio de cohortes una incidencia de discordancia entre el genotipo y el fenotipo de uno por cada 1.845 embarazos. Las conclusiones obtenidas por los autores ponen de manifiesto el incremento actual de las discordancias, probablemente por el mayor uso y disponibilidad del TPNI, y por las mejoras de los ultrasonidos con ecógrafos de alta resolución25. Se han identificado diferentes causas responsables de la discordancia entre el sexo genético determinado por el TPNI y el sexo fenotípico evaluado por ecografía, las cuales se detallan a continuación. Por un lado, se ha identificado el gemelo evanescente como una causa de discordancia, dado el aumento de las tasas de falsos positivos y falsos negativos en el TPNI. Esta situación ocurre en gestaciones múltiples y está ocasionada por el incremento de la fracción fetal, dado el mayor número de fetos con sexos discordantes26,27. Por otro lado, los mosaicismo confinados a la placenta (MPC) se identifican en 1% de las muestras de vellosidades coriónicas26. Esta situación sucede cuando está presente al menos una población celular distinta en el citotrofoblasto y/o sincitiotrofoblasto28. Por ello, aunque es infrecuente, la dotación cromosómica de la placenta puede no ser idéntica al cariotipo fetal y ser causa de discordancia en el TPNI26. Entre las causas maternas se han identificado el antecedente de trasplante de órganos o médula ósea cuando el donante es masculino26,29. Del mismo modo, las neoplasias de origen materno originan una alteración en el material genético que puede ser responsable de un resultado anómalo del test30. De forma paradójica, se ha observado que 3,75 casos de cada 100.000 leiomiomas benignos pueden originar igualmente resultados aberrantes26. Por último, en 2015, Wang et al., informaron de la implicación del mosaicismo del cromosoma X materno como otra de las causas responsables de discordancia del genotipo y fenotipo31. El mosaicismo fetal verdadero y/o las anomalías fetales que originan discordancia entre el genotipo XX y el fenotipo XY, o entre el genotipo XY y fenotipo XX por una virilización insuficiente, son uno de los motivos fetales principales de discordancia de los resultados obtenidos26. Finalmente, otro escenario a considerar ante el hallazgo de discordancia genético-fenotípica es el diagnóstico ecográfico prenatal de ambigüedad genital26. Cuando se presentan como una anomalía aislada en un genotipo XY, la causa más frecuente es la hipospadias26,32. Los casos con genotipo XX suelen ser más complejos13,26. Aun así, el diagnóstico ecográfico prenatal de la hipospadias puede ser un desafío. Es un hallazgo relativamente frecuente que afecta a 1 de cada 250 fetos masculinos26. Se ha identificado la insuficiencia placentaria como una causa común que podría justificar algunos de los casos en los que la hipospadia coexiste con una restricción del crecimiento intrauterino32. Ecográficamente habrá que realizar el diagnóstico diferencial con genitales de aspectos ambiguos o incluso femeninos, además de evaluar un correcto crecimiento prenatal26,32. Estos resultados son similares a los reportados en 2015 por Jacob et al.,23 y en 2019 por Byers et al27. Los autores identificaron como causas principales de esta discordancia: el gemelo evanescente, las aneuploidías de los cromosomas sexuales con o sin mosaicismo, el quimerismo y el DSD23,27. Con relación a los cromosomas sexuales, en 2017 Reiss et al., analizaron que el TPNI es capaz de detectar 63% de estas anomalías, a excepción de la monosomía X por la alta tasa de falsos positivos encontrados33.
Recientemente, se han notificado otras etiologías posibles a considerar en casos de ambigüedad genital como la restricción del crecimiento intrauterino, la amenaza de parto pretérmino, los síndromes genéticos o un error de laboratorio. El mecanismo fisiopatológico implicado en las dos primeras situaciones podría estar relacionado con una virilización masculina insuficiente por desnutrición materna o por factores ambientales que aún no han sido identificados27. El DSD debe ser considerado una situación compleja desde el punto de vista cultural, social, ético y médico, que va a requerir una evaluación por un equipo multidisciplinar y especializado. Dentro del DSD, pueden hallarse enfermedades aisladas o asociadas a otras anomalías, por lo que habrá que sospechar un síndrome más complejo. Mención especial merece la hiperplasia suprarrenal congénita, al ser una situación potencialmente mortal14. Por ello, dada la complejidad de estas anomalías y las posibles complicaciones, la sospecha clínica prenatal resulta especialmente relevante27.
Manejo de la discordancia entre genotipo y fenotipoTras revisar la literatura, los autores coinciden que el primer paso para el manejo adecuado de la ambigüedad genital prenatal es realizar una anamnesis detallada en búsqueda de antecedentes maternos y/o familiares relevantes13,16,25. Los antecedentes maternos fundamentales que conocer son la edad, método de consecución de la gestación, exposición a fármacos como los andrógenos, antecedente de trasplantes o neoplasias26. Posteriormente hay que realizar una ecografía detallada de la anatomía fetal y posibles anomalías asociadas, así como evaluar la presencia de factores de confusión (gemelo evanescente)25,26. Los hallazgos ecográficos resultan de interés para orientar la etiología. Habrá que analizar si la ambigüedad genital es la única anomalía de interés observada, o si por el contrario presentan anomalías asociadas que suelen formar parte de otros síndromes complejos. En casos aislados de DSD, la visualización del útero mediante ultrasonidos resulta de utilidad. Ante un genotipo XX con útero visible la causa más probable es la anomalía en la producción hormonal. Por el contrario, la ausencia del útero nos hará pensar en anomalías uterinas o agenesia mülleriana. Ante un caso de DSD con cariotipo XY lo más frecuente es no visualizar el útero, siendo las causas más comunes la hipospadia y las anomalías en la producción hormonal. Por el contrario, si se visualiza el útero por ecografía suele ser debido a un síndrome de persistencia de los conductos de Müller o alteraciones del descenso testicular19,20,26. A continuación, en caso de verificarse el resultado por TPNI debe ofrecerse un diagnóstico de seguridad33. Dado que el diagnóstico de sospecha suele establecerse a partir de la ecografía morfológica de las 18-22 semanas de gestación, la prueba complementaria indicada sería la amniocentesis, que además ofrece como ventaja añadida eliminar los casos de mosaicismo confinados a placenta13,26. Por otro lado, el estudio puede completarse con determinaciones moleculares específicas en base a la sospecha clínica como la deficiencia de 21-hidroxilasa, de 5-α-reductasa, de andrógenos, mutación del receptor o del SRY. El diagnóstico debe finalizar y confirmarse mediante un cariotipo postnatal. Por ello, la comunicación con el neonatólogo, así como con genetistas, equipo de laboratorio y endocrinólogos es fundamental en dicho manejo.
ConclusionesEl DSD debe ser considerado una situación compleja desde el punto de vista cultural, social, ético y médico, que va a requerir una evaluación por un equipo multidisciplinar y especializado. Dentro del DSD, pueden hallarse enfermedades aisladas o asociadas a otras anomalías dentro de un síndrome más complejo. Mención especial merece la hiperplasia suprarrenal congénita, al ser una situación potencialmente mortal. Por ello, dada la complejidad de estas anomalías y las posibles complicaciones, la sospecha clínica prenatal resulta especialmente relevante. Sin embargo, el papel del obstetra en la patología de la diferenciación sexual se considera infravalorado en la actualidad. La integración del conocimiento actual, así como la estandarización de la sistemática en la exploración ecográfica proporcionaría una mejora en la sospecha diagnóstica y en la posible confirmación posterior de estos casos. Por otro lado, conocer las causas de discordancia entre el sexo genético determinado por el TPNI y el sexo fenotípico observado por ecografía puede influir de manera positiva en la detección precoz de estas anomalías. Todo ello supondría una mejora para el manejo multidisciplinar del DSD, especialmente en los casos que se requieran asignación del sexo al nacimiento.
FinanciamientoLos autores no recibieron financiamiento para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran que no tienen conflictos de intereses.