La preeclampsia es un trastorno hipertensivo relativamente común durante el embarazo, de presentación progresiva, su causa aún es desconocida y acarrea con frecuencia graves complicaciones maternas y perinatales.
La incidencia de esta patología es amplia ya que influyen numerosos aspectos como la localización geográfica, la raza, los factores nutricionales o inmunológicos, las comorbilidades, y hasta el clima húmedo y frío se ha relacionado con una mayor incidencia de mujeres afectadas. En muchos estudios se han utilizado estimaciones basadas en muestras hospitalarias, y por tanto sesgadas, lo que podría explicar las cifras utilizadas con relativa frecuencia de hasta el 5-10%. Se estima que alrededor del 7% de los embarazos desarrollarán una preeclampsia1, aunque ésta puede ser mayor en entornos socioeconómicos más desfavorecidos y en países donde hay más prevalencia de enfermedades cardiovasculares2.
Si nos referimos a poblaciones de mujeres blancas en países desarrollados, esta cifra es claramente exagerada. Estudios longitudinales en el norte de Europa en cohortes de mujeres seguidas desde el inicio de la gestación sugieren que la incidencia de preeclampsia se sitúa alrededor del 2% en primíparas3. Es muy posible que la incidencia presente variaciones marcadas en diferentes países europeos, sin embargo parece razonable pensar que en nuestra área geográfica la incidencia global en población general se situaría, como concepto aplicable a la mayoría de poblaciones, en alrededor del 1-2%. Hay pocas estimaciones realizadas en España, pero se sitúan dentro de este rango4.
El 5% de las preeclampsias evolucionarán, finalmente, como una eclampsia5, y hasta en un 19% pueden hacerlo como un síndrome HELLP (hemolysis, elevated liver enzymes, and low platelets), lo que se asocia con más complicaciones y mayor mortalidad6.
Los resultados maternales adversos en la preeclampsia se deben, fundamentalmente, a disfunción en el sistema nervioso central, hepático o renal (accidente cerebrovascular hemorrágico, ruptura hepática o fracaso renal agudo) y al sangrado asociado a trombocitopenia. La preeclampsia-eclampsia es una de las 3 causas más frecuentes de mortalidad en la embarazada, junto a la enfermedad tromboembólica y al sangrado7. En Estados Unidos, la tasa de mortalidad materna debida a la preeclampsia-eclampsia es aproximadamente de 1 por cada 100.000 nacimientos vivos, lo que origina una mortalidad fetal de 6,4 casos por cada 10.000 partos8.
Otros factores que influyen negativamente en el pronóstico de estas pacientes son la edad gestacional, la severidad de la aparición y factores coexistentes con la gestación como la diabetes, gestación múltiple, enfermedad renal previa, trombofilia o hipertensión preexistente.
El pronóstico neonatal deriva de una mayor prematuridad en los casos en los que se indica finalización anticipada de la gestación, crecimiento intrauterino retardado o abrupción de placenta. En la preeclampsia leve-moderada, el pronóstico suele ser bueno, comparable a gestaciones normotensivas salvo por la mayor tasa de inducción o intervención durante el parto9, mientras que en las preeclampsias severas sí se ha observado una mayor tasa de disfunción hepática y renal en la madre, además de nacimiento pretérmino, crecimiento retardado y dificultad respiratoria en los neonatos, aunque esto no se asoció a mayor mortalidad fetal o neonatal9.
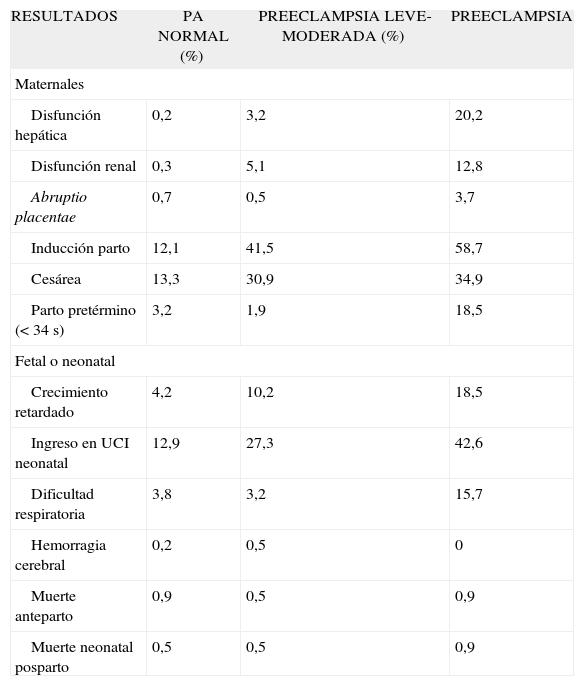
El mayor riesgo de morbilidad, tanto para la madre como para el feto, se ha visto en las preeclampsiaseclampsias que aparecen en el segundo trimestre de gestación, probablemente debido a una mayor influencia de prematuridad y bajo peso en el caso del feto, y un tratamiento más conservador en el caso de la madre para mayor maduración (tabla I).
Morbilidad materno-fetal en gestaciones que cursan con presión arterial normal, preeclampsia leve-moderada o preeclampsia severa
| RESULTADOS | PA NORMAL (%) | PREECLAMPSIA LEVE-MODERADA (%) | PREECLAMPSIA |
| Maternales | |||
| Disfunción hepática | 0,2 | 3,2 | 20,2 |
| Disfunción renal | 0,3 | 5,1 | 12,8 |
| Abruptio placentae | 0,7 | 0,5 | 3,7 |
| Inducción parto | 12,1 | 41,5 | 58,7 |
| Cesárea | 13,3 | 30,9 | 34,9 |
| Parto pretérmino (< 34 s) | 3,2 | 1,9 | 18,5 |
| Fetal o neonatal | |||
| Crecimiento retardado | 4,2 | 10,2 | 18,5 |
| Ingreso en UCI neonatal | 12,9 | 27,3 | 42,6 |
| Dificultad respiratoria | 3,8 | 3,2 | 15,7 |
| Hemorragia cerebral | 0,2 | 0,5 | 0 |
| Muerte anteparto | 0,9 | 0,5 | 0,9 |
| Muerte neonatal posparto | 0,5 | 0,5 | 0,9 |
PA: presión arterial; UCI: unidad de cuidados intensivos.
Adaptada de Hauth et al9.
Hay una variedad de clasificaciones, pero la propuesta por el Colegio Americano de Ginecólogos y Obstetras (ACOG) es la más aceptada10 (tabla II).
Clasificación del Colegio Americano de Ginecólogos y Obtetras (ACOG) de los trastornos hipertensivos del embarazo
|
Se define enfermedad hipertensiva del embarazo (EHE) al trastorno que se presenta durante la gestación, parto o puerperio, y que se caracteriza por la elevación de las cifras tensionales ≥ 140/90 mmHg, acompañadas por signos y síntomas que permiten clasificarla según su severidad.
PreeclampsiaSe habla de preeclampsia cuando hay presencia de hipertensión por encima de los valores mencionados previamente y proteinuria en una mujer embarazada después de la semana 20, salvo la presencia de mola hidatiforme o hydrops fetal.
La hipertensión arterial (HTA) se diagnostica cuando excede en 2 ocasiones separadas, al menos 6 h una de otra, de 140/90 mmHg, o un aumento de la presión arterial sistólica (PAS) de al menos 30 mmHg, o un aumento de la PA diastólica (PAD) de al menos 15 mmHg.
La proteinuria puede diagnosticarse mediante tira reactiva pero debe confirmarse mediante un método cuantitativo (muestra simple u orina de 24 h).
Preeclampsia severaLa preeclampsia severa se define si en 2 ocasiones separadas, al menos de 6 h una de otra, se superan cifras de PA de 160/110 mmHg, o cuando se asocia a una de las situaciones referenciadas en la tabla III.
Signos y síntomas de preeclampsia severa (al menos uno de los siguientes)
| Síntomas de disfunción del SNC: visión borrosa, escotomas, cefalea severa, alteracion del nivel de conciencia |
| Síntomas de distensión de cápsula de Glisson: dolor severo en hipocondrio derecho; náuseas o vómitos |
| Daño hepatocelular: elevación de transaminasas al doble del valor de referencia del laboratorio |
| Hipertension arterial severa: PAS ≥ 160 mmHg o PAD ≥ 110 mmHg en al menos 2 ocasiones separadas 6 h entre sí |
| Trombocitopenia: < 100.000 plaquetas por ml |
| Proteinuria: 5 g o más en 24 h |
| Oliguria < 500 ml en 24 h |
| Crecimiento fetal retardado severo |
| Edema pulmonar o cianosis |
| Accidente cerebrovascular |
PAD: presión arterial diatólica; PAS: presión arterial sistólica; SNC: sistema nervioso central.
Se llama síndrome HELLP al acrónimo de (hemólisis, elevación de enzimas hepáticas y plaquetopenia), este síndrome se presenta entre el 10-20% de las mujeres con preeclampsia o eclampsia y se considera como una forma severa de la enfermedad al ocasionar mayor mortalidad.
EclampsiaSe define por la presencia de convulsiones o coma en una paciente con preeclampsia que no pueden ser explicadas por otra causa subyacente.
Hipertensión crónicaPA > 140/90 mmHg antes del embarazo, o con esas mismas cifras tomadas en 2 ocasiones distintas antes de la 20 semana de gestación, o hipertensión arterial persistente después de la sexta semana del parto.
Hipertensión crónica más hipertensión inducida por el embarazoSe define con el aumento de la PAS en más de 30 mmHg, o más de 15 mmHg en la PAD en 2 ocasiones distintas, antes de la 20 semana de gestación, y comienzo con proteinuria y edemas generalizados.
Hipertensión arterial transitoria o tardíaEs la que ocurre durante el puerperio sin que previamente hubiera preeclampsia; sus valores retornan de nuevo a los basales después del décimo día posparto.
ETIOPATOGENIA. FACTORES IMPLICADOSLa etiología de la EHE sigue sin identificarse, es por ello que se le denomina la enfermedad de las teorías, ya que alrededor de la búsqueda de su causa se han elaborado infinidad de hipótesis, que abarcan prácticamente todos los órganos maternos y fetales, que alteran su fisiología.
En la fisiopatología se han implicado factores como el estrés oxidativo, la respuesta inflamatoria, la maladaptación circulatoria, las alteraciones metabólicas e incluso las alteraciones en el desarrollo placentario que provocan factores circulantes que interfieren con el factor de crecimiento del endotelio vascular (VEGF) y el factor de crecimiento placentario (PIGF)22.
Además de los factores fisiopatológicos que se desarrollarán a continuación, se han mencionado muchos factores predisponentes para la preeclampsia, como las edades extremas (muy jóvenes o añosas), la nuliparidad, la obesidad, el tabaquismo, los antecedentes de preeclampsia en otra gestación, etc. Otros factores asociados menos estudiados son algunas infecciones, el asma y el intervalo intergenésico12–18.
Disfunción endotelial sistémicaDesde hace muchos años se conoce la alteración endotelial sistémica que se produce en estas pacientes, que justifica y explica todas las manifestaciones clínicas que se pueden ver en ellas19,20.
La alteración endotelial produce disfunción en el control del tono muscular de los vasos, que deriva en la hipertensión, el edema por aumento de permeabilidad y también en la proteinuria. Asimismo, la anormal expresión de factores procoagulantes por el endotelio, favorece la coagulopatía. Todas estas alteraciones causarán daño en órganos diana como el riñón, el hígado, el sistema nervioso central y la placenta.
Las mujeres con enfermedad vascular previa tienen mayor riesgo de desarrollar preeclampsia, muy posiblemente por el daño endotelial que ya tienen21.
En la tabla IV se expresan algunos marcadores de laboratorio que apoyan la teoría del daño endotelial sistémico.
Daño endotelial sistémico. Marcadores de laboratorio
| Valores elevados de fibronectina, factor VIII o trombomodulina23 |
| Alteración de la vasodilatación mediada por acetilcolina24 |
| Disminución de la producción de óxido nítrico y prostaciclinas, y aumento en la producción de tromboxanos y endotelinas |
| Aumento de la reactividad vascular a la angiotensina II25,26 |
Está bastante aceptado que la placenta juega un papel principal en el desarrollo de la preeclampsia, ya que solamente ocurre en presencia de ella y la sintomatología remite rápidamente tras el alumbramiento o tras la desaparición de la placenta origen del problema en casos de gestaciones múltiples26 y, sin embargo, se ha visto que no ha mejorado cuando en gestaciones extrauterinas se ha extraído sólo el feto y no los restos placentarios27.
Ha habido numerosas líneas de investigación que han sugerido que la insuficiencia placentaria es la protagonista principal en la patogénesis de la preeclampsia:
- –
Estudios patológicos de placentas de pacientes que presentaron preeclampsia revelaron numerosos infartos y arteriolas escleróticas y de estrecho calibre28,29.
- –
En biopsias placentarias a pie de cama en mujeres con preeclampsia se ha visto que tenían una inadecuada invasión trofoblástica en la decidua30,31.
- –
Algunos factores de riesgo maternales para presentar preeclampsia incluyen enfermedades predisponentes al daño cardiovascular, como la diabetes, el lupus eritematoso sistémico, la HTA crónica y trombofilias32.
- –
Se han desarrollado modelos experimentales con animales mediante interrupción parcial del flujo de sangre uterina33.
Durante el desarrollo de una placentación normal, el citotrofoblasto invade las arteriolas espirales, lo que provocará una remodelación de estos vasos que tendrán baja resistencia y elevada elasticidad o capacitancia.
Esta invasión endovascular citotrofoblástica no sólo afecta a las capas más superficiales, sino que llegará hasta la túnica muscular. En estas pacientes con preeclampsia se ha visto también que la penetración del trofoblasto es incompleta, y no llega a invadir, y por lo tanto a remodelar, completamente las arteriolas espirales, lo que genera una situación de disminución de la perfusión placentaria.
El remodelado de las arteriolas espirales, aunque comienza en el primer trimestre, no se considera completo hasta la semana 18–20 de gestación.
Esta diferenciación del trofoblasto durante la fase invasiva implica además la alteración de otras moléculas como algunas citocinas, metaloproteínas, complejo mayor de compatibilidad (HLA) de clase Ib y HLA-G34–36.
Durante este período invasivo, el trofoblasto sufre un proceso de seudovasculogénesis en el que altera moléculas de adhesión características de células epiteliales (integrinas α6/β4, α/β5 y E-cadherina) por otras características de células endoteliales (integrina α-1/β0-1, α/β-3, PECAM y VE-cadherina)37,38.
Recientemente se ha dado una gran importancia a la angiogénesis debida a moléculas como el VEGF, angiopoetina y otras proteínas de la familia de efrina. El trofoblasto invasivo expresa VEGF, P1GF, VEGF y sus respectivos receptores. Además, en estudios in vitro donde se bloqueaban estas señales, disminuía alarmantemente la integrina α-1, que es un marcador de seudovasculogénesis39.
En estudios cada vez más recientes se ha encontrado que el trofoblasto invasivo expresa L-selectina, que es una molécula de adhesión que media en la migración leucocitaria de la sangre a los tejidos40 y se ha teorizado si esta anormalidad en el sistema de selectinas tendría que ver con la alteración de la implantación placentaria durante esta fase en las mujeres que desarrollan preeclampsia.
Por último, el trofoblasto expresa moléculas HLA-G, que es una molécula poco común del sistema HLA de clase I, y que en estas pacientes parece estar disminuido, lo que podría estar en sintonía con que protegiese al trofoblasto del ataque de las células NK (natural killer) en el lugar de implantación placentario41.
En resumen, se puede decir que la preeclampsia severa se ha relacionado durante muchos años con cambios observados en las placentas, como isquemia, necrosis fibrinoide, infartos placentarios, etc. Y aunque no hay una uniformidad en las lesiones encontradas en los exámenes patológicos y el curso clínico de estas pacientes, sí que parece haber cierta correlación entre ellas, aunque hasta en un tercio de las preeclampsias no se observen alteraciones placentarias42. El remodelado anormal de las arteriolas espirales da lugar a una isquemia placentaria que promueve la secreción de factores al torrente sanguíneo que contribuyen a perpetuar esta alteración de la perfusión. Sin embargo no hay una evidencia rigurosa, in vivo, de la relación causa-efecto entre la placentación anormal y este síndrome42.
Segunda fase: disfunción endotelial sistémicaComo se ha comentado previamente, la disfunción endotelial sistémica en estas pacientes puede explicar todos o casi todos los signos clínicos que se observan en ellas, como la hipertensión, la proteinuria, la coagulopatía o la alteración de órganos diana como el hígado, el sistema nervioso central o los riñones.
Entre los diversos estudios que sustentan esta teoría se encuentran los siguientes:
- –
La elevación plasmática de algunos marcadores como la fibronectina, el factor VIII y la trombomodulina, como marcadores de daño celular endotelial en pacientes con preeclampsia43–45.
- –
La vasodilatación mediada por el flujo también se ha visto en los vasos de mujeres con preeclampsia, sugiriendo una función endotelial alterada46.
- –
La disminución de la producción de vasodilatadores como las prostaciclinas o el aumento de producción de angiotensina II, también son sugestivos de daño endotelial47,48.
- –
Las biopsias renales de estas pacientes revelan una alteración glomerular difusa producida por endoteliosis glomerular.
- –
Asimismo, se ha comprobado que suero de mujeres con preeclampsia provoca activación endotelial en estudios in vitro con células endoteliales de venas umbilicales49.
La identificación de factores circulantes que median en la disfunción endotelial ha sido fuente de numerosos estudios (citocinas, factor de crecimiento, factor de necrosis tumoral [TNF], IL-6, IL-1, neuroquinina-B, productos de la oxidación lipídica, dimetil-arginina, etc.)50–53, aunque en la actualidad no hay evidencia de que ninguna de estas moléculas sea un factor etiológico per se.
Se ha comprobado que estas pacientes tienen una mayor sensibilidad a la angiotensina II, secundaria a un aumento de receptores de bradiquinina B254, así como un aumento de anticuerpos agonistas de los receptores de la angiotensina 155, lo que contribuiría al daño vascular y al aumento de sensibilización a la angiotensina II que hay en la preeclampsia56–59. Estos anticuerpos se han encontrado en otros modelos de daño endotelial, como en el rechazo a trasplantes, lo que sugiere que la preeclampsia pueda deberse a un daño microangiopático generalizado60.
Estudios de laboratorio más recientes han demostrado una mayor expresión placentaria y secreción de sFlt-1 (soluble fms-like tyrosine kinase 1), que es un antagonista del VEGF, en pacientes con preeclampsia39,61,62.
El VEGF es un mitógeno específico endotelial que juega un papel fundamental en la promoción de la angiogénesis. Su actividad está mediada primariamente por su interacción con 2 receptores de alta afinidad: KDR (kinase domain region) y Flt-1, que se expresan en la superficie del endotelio vascular. Una alteración en la codificación del receptor Flt-1, que se llama sFlt-1, mantiene el lugar de unión o ligando extracitoplasmático pero no muestra la parte del receptor intracitoplasmático, lo que remeda en una antagonización del VEGF que a pesar de unirse al receptor, la modificación sufrida impide su correcta funcionalidad63.
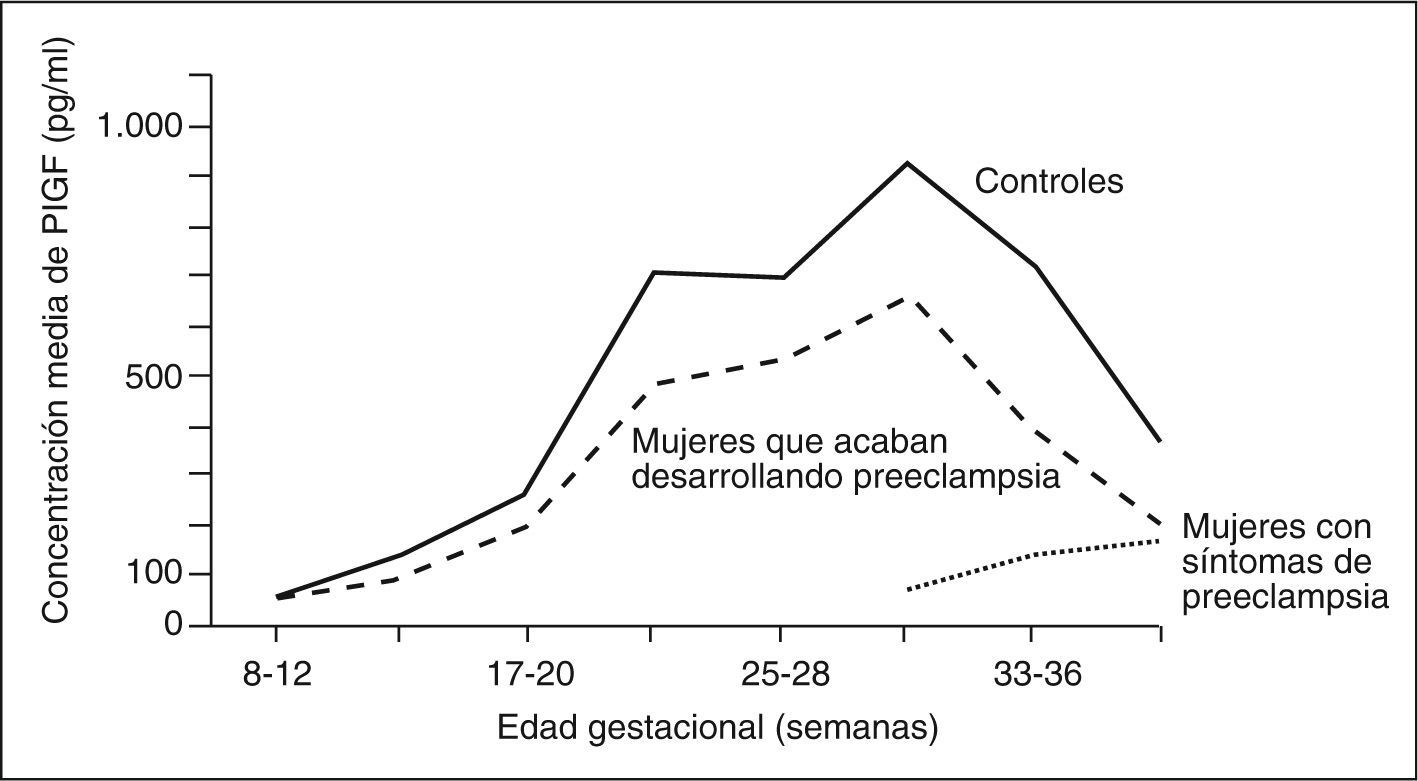
Asimismo, a este receptor también se une el PlGF (placental grow factor), que es otro miembro de la familia del VEGF que principalmente se produce en la placenta62 (fig. 1).
Valores del factor de crecimiento placentario (PlGF) en preeclampsia. Adaptada de Levine et al64.
En estudios de experimentación animal se ha comprobado que la administración de sFlt-1 a ratas embarazadas induce hipertensión, albuminuria y cambios renales, como la endoteliosis glomerular comentada previamente por antagonización de VEGF y PlGF61,62,65.
Aunque también se produce sFlt-1 en otras células (monocitos, células endoteliales, etc.), parece ser que la placenta es la mayor fuente de sFlt-1 circulante, ya que se ha visto que sus valores disminuyen notablemente tras el alumbramiento placentario62.
Un factor importante que hay que tener en cuenta para el futuro, es que el aumento de las concentraciones de sFlt-1 precede generalmente 5 semanas al desarrollo de la clínica64,66 y parece estar más aumentadas en la fase inicial de la preeclampsia severa. Sin embargo, no se ha observado una disminución del PlGF ni del VEGF medidos durante la gestación antes de comenzar los síntomas de la preeclampsia64,67. Muy recientemente se han descrito ya disminuciones del PlGF en orina, precediendo al desarrollo de preeclampsia68.
Se ha especulado con la posibilidad de que el sFlt-1 tenga una función beneficiosa para la circulación fetal, y que la preeclampsia sea un reflejo del efecto maladaptativo de su liberación a la circulación materna. Es decir, en el contexto de unas arteriolas espirales de mayor resistencia, una vasoconstricción de la circulación materna no placentaria provocaría, teóricamente, un aumento del porcentaje de gasto cardíaco que llegaría a la subcirculación placentaria42.
Aunque la mayoría de los casos de preeclampsia es esporádica, hay autores que sugieren que la genética tiene un papel en el desarrollo de esta enfermedad basándose en una serie de hallazgos:
- –
La primíparas con antecedentes familiares de preeclampsia tienen de 2 a 5 veces más riesgo de desarrollar preeclampsia que una primigesta sin historia familiar69–71.
- –
Hay trabajos con hermanas preeclámpticas donde la impronta genética tiene un papel fundamental en el desarrollo de la enfermedad72.
- –
Estudios en mujeres embarazadas de varones que fueron producto de una gestación con preeclampsia, tienen mayor probabilidad de desarrollar esta enfermedad en sus gestaciones70,73.
- –
Las mujeres embarazadas de varones cuya pareja previa tuvo preeclampsia, tienen mayor probabilidad de desarrollar la enfermedad si la gestación con la pareja previa fue normotensiva74.
Todos estos datos sugieren que tanto la contribución materna como la paterna pueden tener algún efecto en la patogénesis de la preeclampsia. Algunos genes que se han estudiado más son variaciones del gen de la angiotensina, de la óxido nítrico sintasa, genes que causan trombofilia, pero no hay estudios que muestren una gran susceptibilidad a esta enfermedad.
El papel inmunológico como posible contribución a la placentación anormal se basa en que la unidad fetoplacentaria contiene antígenos paternales, que van a ser extraños para la madre y van a condicionar el desarrollo de la enfermedad. Hay estudios donde se ha visto mayor incidencia de preeclampsia en gestaciones posteriores con nuevas parejas que con la misma pareja75, o el papel protector de la exposición prolongada al esperma de la misma pareja, como reflejo del tiempo de cohabitación con la misma pareja antes de la concepción7,76, o la mayor incidencia de preeclampsia en las mujeres que usan contraceptivos de barrera y en las inseminaciones artificiales de donante desconocido, más que con donante de pareja77,78.
Otros hallazgos que sugieren el papel inmunológico se han comentado anteriormente, como los hallazgos similares a las reacciones de autoanticuerpos que se ven en los rechazos de trasplantes o la implicación de las células NK en la placentación anormal.
Otros factores asociados o predisponentes al desarrollo de la preeclampsiaAlgunos factores predisponentes se muestran en la tabla V.
Factores predisponentes al desarrollo de preeclampsia
|
DES: dietilstilbestrol; HTA: hipertensión arterial.
Generalmente se dice que la preeclampsia es una enfermedad de los primeros embarazos. Es por ello que se dice que la nuliparidad o la primiparidad son factores asociados para presentar esta enfermedad.
Un embarazo previo normal está asociado con una marcada menor incidencia de preeclampsia, incluso si ha sido solamente un aborto79. El efecto protector de la multiparidad se pierde generalmente con el cambio de pareja como demostraron Trupin et al80 en un estudio prospectivo con 5.068 mujeres nulíparas y 5.800 multíparas, de las cuales 573 habían tenido recientes cambios de pareja, y encontraron que la incidencia de preeclampsia fue similar en las mujeres nulíparas (3,2%) que en las multíparas que habían cambiado de pareja (3%), mientras que fue significativamente menor en las multíparas que mantenían la misma pareja (1,9%).
El factor protector del esperma de la pareja estable fue un concepto que apuntaron Klonoff et al78 en 1989 y posteriormente Robillard et al75 en 1994. Estudios más recientes, como el de Einarsson et al77 de 2003, apuntan en la misma dirección. El primer estudio prospectivo se debe a Robillard et al75, que entrevistaron a 1.011 mujeres que dieron a luz en una unidad obstétrica, acerca de la paternidad y el tiempo de cohabitación con su pareja antes de la concepción. La incidencia de hipertensión inducida por el embarazo fue del 11,9% en las primíparas, del 4,7% en las multíparas con la misma pareja y del 24% en las multíparas con nuevas parejas. Encontraron una relación inversa entre el tiempo de cohabitación sexual y la incidencia de hipertensión inducida por el embarazo, lo que relacionaron por el corto período de exposición al esperma paterno antes de la concepción.
No tener sexo oral parece ser un factor adicional de riesgo, ya que se encontró una menor incidencia de preeclampsia entre las mujeres que si lo tuvieron respecto a las que no (el 44 frente al 82%).
De manera análoga a la exposición continuada al esperma paterno, la inseminación de donante desconocido se ha relacionado por algunos autores con una mayor incidencia de presentar preeclampsia, aproximadamente del doble. Lo mismo ocurre cuando se habla de donación de ovocitos79.
Un estudio en la población noruega reveló que el padre también transmite algún factor de riesgo de presentar preeclampsia tras estudiar nacimientos de primeros y segundos hijos de matrimonios de misma madre y padre, de misma madre y diferente padre y de mismo padre y diferente madre. Uno de los mayores hallazgos de este estudio fue que los varones cuyas parejas anteriores habían presentado una preeclampsia, se encontraban con casi el doble de riesgo de que su nueva pareja tuviera esta enfermedad (1,8; intervalo de confianza [IC] del 95%, 1,2-2,6)74.
Las mujeres que han presentado preeclampsia tienen mayor riesgo de desarrollarla también en sucesivos embarazos. Es más, suele aumentarse más aún conforme avanza la edad de la madre74, e incluso cuando la preeclampsia es más severa, es más temprana o se asocia a un menor peso del recién nacido81,82.
Dado que el síndrome HELLP es una forma severa de preeclampsia, el riesgo de desarrollar esta última en gestaciones posteriores a un HELLP es elevada, aunque no así la de presentar de nuevo un HELLP, que sólo ronda el 3%83.
A lo largo del tiempo se ha visto que la preeclampsia y la eclampsia tienen cierta tendencia familiar. Por ejemplo, Chesley et al84 encontraron que hasta en un 26% las hijas de madres que tuvieron preeclampsia en alguna gestación, desarrollaban también esta patología, mientras que era de tan sólo un 8% en las hijas políticas. Otros estudios posteriores han mostrado a su vez mayor incidencia de preeclampsia en descendencia de madres que a su vez han presentado esta enfermedad en alguna gestación69–71.
En uno de los estudios publicados de factores de riesgo con mayor número de pacientes con preeclampsia, Sibai et al85 encontraron como predictores de esta enfermedad la PA elevada en el momento del ingreso, la obesidad, el número previo de abortos y una historia previa de tabaquismo. Contrariamente a lo que se creía en ese momento, la raza negra no fue un factor de riesgo cuando estaba controlada la PA y la obesidad.
En países desarrollados, la obesidad es una causa prevalente de otras enfermedades, como las alteraciones cardiovasculares o las alteraciones del metabolismo hidrocarbonado. Tanto la obesidad como la resistencia insulínica o la intolerancia hidrocarbonada se asocian fuertemente a la HTA fuera del embarazo. Hay numerosas publicaciones que muestran que la obesidad es un factor predisponente para el desarrollo de preeclampsia85–88, aunque el mecanismo exacto por el que la obesidad favorece su aparición no se conoce totalmente. Se cree que la asociación de obesidad-hipertensión que es frecuente fuera del embarazo pueda ser la causa de que se asocie también en estas pacientes, más si cabe cuando hay un mayor volumen de sangre y un mayor gasto cardíaco en relación con la gestación. Asimismo, la dislipemia, que también se asocia con la obesidad, puede tener algún papel. Los adipocitos producen citocinas, especialmente TNF-α, que esta aumentado en estas pacientes, y como hemos visto anteriormente se relaciona con algún mecanismo patogénico de la enfermedad. Además, la obesidad, especialmente con hiperlipidemia, se asocia con un mayor nivel de estrés oxidativo con disfunción endotelial, con lo que aumenta el riesgo de desarrollar preeclampsia89–91.
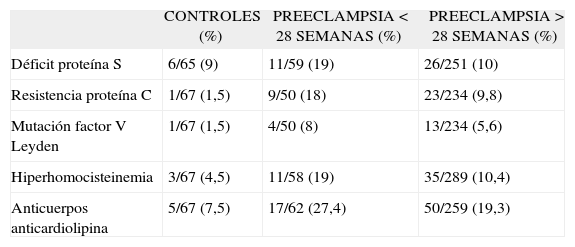
En cuanto a los trastornos de la coagulación, directamente por alteración hemostática, como el déficit de proteína C o S, o indirectamente por alteraciones metabólicas como la homocisteína o enfermedades reumatológicas que cursan con aumento de anticardiolipina, se han encontrado directamente asociados con desarrollo de preeclampsia severa . Dekker et al92,93 encontraron asociación entre preeclampsia y diversos factores, como todos los mencionados antes, especialmente en los casos de desarrollo precoz de preeclampsia antes de la semana 28 de gestación (tabla VI).
Trastornos de la coagulación y preeclampsia
| CONTROLES (%) | PREECLAMPSIA < 28 SEMANAS (%) | PREECLAMPSIA > 28 SEMANAS (%) | |
| Déficit proteína S | 6/65 (9) | 11/59 (19) | 26/251 (10) |
| Resistencia proteína C | 1/67 (1,5) | 9/50 (18) | 23/234 (9,8) |
| Mutación factor V Leyden | 1/67 (1,5) | 4/50 (8) | 13/234 (5,6) |
| Hiperhomocisteinemia | 3/67 (4,5) | 11/58 (19) | 35/289 (10,4) |
| Anticuerpos anticardiolipina | 5/67 (7,5) | 17/62 (27,4) | 50/259 (19,3) |
La anemia de células falciformes ha sido un tema controvertido en cuanto a su asociación con preeclampsia, ya que hay estudios que muestran tanto resultados positivos en cuanto a asociación como todo lo contrario94,95.
Clásicamente, el tabaquismo ha estado relacionado con una menor incidencia de preeclampsia. En un reciente metaanálisis que ha revisado exhaustivamente 48 estudios epidemiológicos y clínicos, se estudió esta asociación desde 1959 hasta 2006, y se observó que había una reducción de prácticamente el 50% de casos de preeclampsia, tanto en nulíparas como en multíparas. Asimismo, se mantenía esta relación en embarazos únicos o múltiples y en los casos de preeclampsia severa así como en la leve-moderada. Aunque los mecanismos biológicos no están claros, se teoriza con que el tabaco puede tener un efecto angiogénico que pueda jugar un papel en la disminución del riesgo de presentar preeclampsia en estas pacientes96.
Algunos autores han considerado el asma como un factor predisponente de preeclampsia. Entre sus factores patogénicos podrían estar los mediadores que actúan sobre el músculo liso, como las endotelinas y la angiotensina, involucrados en la preeclampsia y que también ocasionan broncoconstricción97,98.
Hay estudios que apuntan a que intervalos intergenésicos (intervalo entre partos) mayores de 59 meses estuvieron asociados con un mayor riesgo de preeclampsia y eclampsia99, probablemente debido a que las mujeres multíparas con intervalos largos se comportan como nulíparas, quienes poseen un alto riesgo de presentar esta patología85,100,101.
En algunos estudios, las infecciones urinarias también se han asociado con mayor incidencia de preeclampsia.
La infección urinaria es la invasión microbiana del aparato urinario que sobrepasa la capacidad de los mecanismos de defensa del huésped, produce una reacción inflamatoria y, eventualmente, alteraciones morfológicas o funcionales. La mujer embarazada tiene un riesgo incrementado para la infección del tracto urinario (ITU), de manera que la desarrolla cerca del 8%.
Casi todos los hallazgos clínicos en estas gestantes, en última instancia, son producidos por la endotoxemia. Se ha demostrado que en las mujeres con infección aguda hay una disminución de la resistencia vascular sistémica y un incremento de la eyección cardíaca, ambas significativas. Estos cambios están mediados por citocinas elaboradas por los macrófagos, incluida la interleucina 1 o FNT. Son estos factores los que estimulan la adherencia y segregación de proteasas y citocinas que producen la disfunción endotelial que se asocia a la patogénesis de la preeclampsia, como se ha comentado previamente.
Schieve et al102 realizaron un estudio en 25.746 mujeres embarazadas y encontraron que la presencia de ITU estaba asociada a la aparición de preeclampsia. Pfau y Sacks103 encontraron que las presencia de ITU estaba asociada a la aparición de parto prematuro y desórdenes hipertensivos del embarazo como la preeclampsia (odds ratio, 1,4; IC del 95%, 1,2-1,7).