de ambos sexos atendidos en el Consultorio de Colloto) de 40 a 75 años, así como los factores clínicos y analíticos precisos para aplicar las definiciones de SM según los criterios de la Organización Mundial de la Salud y del ATP-III (cintura, cadera, índice de masa corporal, glucemia basal, insulinemia basal, índice HOMA, colesterol unido a lipoproteínas de alta densidad, triglicéridos y presión arterial sistólica y diastólica). Resultados. La media de PCR-us en pacientes con SM fue superior, al aplicar cualquiera de las definiciones, que en los individuos sin SM, fue mayor cuanto mayor número de factores definitorios reunían los pacientes y, de forma inversa, la prevalencia de SM era mayor cuanto mayor fue el índice de PCR-us. Conclusiones. Se confirma la idea de que la PCR-us tiene una importante relación con la existencia del SM por cualquiera de sus definiciones. Esta relación sería continua y con una tendencia lineal.
En la actualidad asistimos a un aumento de la prevalencia de enfermedades metabólicas como la obesidad y la diabetes mellitus1,2. La presentación agregada de trastornos metabólicos y factores de riesgo cardiovascular constituye el síndrome metabólico (SM). Este síndrome se relaciona con un incremento en el riesgo de experimentar enfermedades cardiovasculares3,4, diabetes mellitus5,6 y, probablemente, con una mayor mortalidad.
No hay un criterio diagnóstico único para establecer qué pacientes presentan un SM. Las definiciones más aceptadas son la del National Cholesterol Education Program, Adult Treatment Panel III (ATP III)7, fácilmente aplicable en atención primaria, y la de la Organización Mundial de la Salud (OMS)8, que combina parámetros fisiopatológicos y hallazgos clínicos. En función de la definición que se utilice, el diagnóstico y la prevalencia pueden variar9-11.
La proteína C reactiva ultrasensible (PCR-us) es un reactante de fase aguda que ha demostrado asociación con la placa ateromatosa12 y la disfunción endotelial13. Dada la hetereogeneidad de los estudios disponibles, aún no está claro su papel en la estimación del riesgo cardiovascular en general10,14-19, aunque puede tener utilidad en la valoración del pronóstico del SM o en la predicción de evolución hacia diabetes mellitus tipo 217-20. En el presente estudio nos propusimos conocer los valores y la distribución de la PCR-us en nuestra población y su relación con el SM.
Materiales y métodos
Estudio descriptivo transversal, realizado en el ámbito de la atención primaria, en la población de 40 a 75 años de ambos sexos adscrita al Consultorio de Colloto del Centro de Salud de Ventanielles-Colloto (Asturias) (n = 2.143 tarjetas sanitarias) entre junio y octubre de 2003.
Para una prevalencia estimada del SM de un 23%, con un intervalo de confianza (IC) del 95%, un margen de error del 4%, y previendo unas pérdidas del 15%, se calculó una muestra representativa de esta población formada por 407 pacientes, que se extrajo de modo aleatorio simple a partir del listado completo de las tarjetas sanitarias asignadas. Se excluyó a los pacientes inmovilizados y terminales, con trastornos mentales graves, los alcohólicos o los que residieran fuera de la Zona Básica de Salud, y se consideraron pérdidas los que no pudieron localizarse o no aceptaron participar.
Se concertó una entrevista con cada paciente en la que se recogieron los siguientes datos: edad, sexo, hábitos tóxicos, factores de riesgo cardiovascular (hipertensión arterial [HTA], diabetes mellitus, intolerancia a la glucosa y dislipemia) peso, talla y obesidad abdominal mediante la determinación de las circunferencias de la cintura y la cadera con una cinta métrica (se consideró circunferencia de la cintura el perímetro de la zona abdominal intermedia entre el último arco costal y la cresta ilíaca medido en un plano horizontal, y circunferencia de la cadera la obtenida en el plano de máximo relieve de los músculos glúteos). Las mediciones las realizó personal de enfermería entrenado al efecto.
La presión arterial se tomó con el individuo en sedestación, con un tensiómetro automático validado (OMRON 705 CP®). Se realizaron 3 determinaciones, separadas entre sí 2 min, y se adoptó como presión arterial final la media de las dos últimas tomas, desechando la primera.
Se realizó una determinación analítica en sangre tras 12 h de ayuno previo, que incluyó: glucosa, urea, creatinina, ácido úrico, triglicéridos, colesterol total, colesterol unido a lipoproteínas de alta densidad y colesterol unido a lipoproteínas de baja densidad (según el método utilizado en el laboratorio de referencia del Hospital Central de Asturias). Se recogió una muestra de la primera orina de la mañana para determinar la microalbuminuria, previo descarte con tira reactiva de presencia de leucocituria y/o hematuria (se consideró microalbuminuria positiva el cociente albúmina/creatinina superior a 30 mg/l). A todos los pacientes se realizó una determinación de insulinemia basal en suero por el método de inmunoquimioluminiscencia DPC INMULITE (WHO 1974. 1.o IRP 66/304). Se consideró hiperinsulinismo, de acuerdo con la definición de la OMS, la cifra de una insulinemia en ayunas que separase los cuartiles tercero y cuarto de la población no diabética8. La PCR-us se determinó según el método inmunoturbidimétrico potenciado con partículas, y se consideró como nivel bajo hasta 1 mg/l, moderado entre 1 y 3 mg/l y elevado mayor de 3 mg/l. Se excluyó del estudio a los pacientes con PCR-us mayor de 1021.
En la tabla 1 se reflejan las definiciones de SM a partir de los criterios de la OMS y del ATP III.
Análisis estadístico
Las variables cuantitativas se expresan como medias ± desviación estándar y las cualitativas, como porcentajes. Para el cálculo del IC de una proporción se utilizó la aproximación cuadrática de Fleiss22. Para comparar medias se utilizó los test de la t de Student si había 2 categorías, y el test de análisis normal de la varianza (ANOVA) para más de dos categorías. Para valorar la asociación de variables cualitativas se utilizó la prueba de la *2 (muestras independientes), y para valorar la magnitud de la asociación se utilizó la odds ratio (OR). Para valorar la tendencia de proporciones se utilizó la prueba de la *2 de tendencia lineal de proporciones (Mantel-Haenszel extendido)23. Para comparar los resultados de SM por criterios ATP III y OMS se utilizó el test de McNemar (muestras apareadas). La estimación de la curva de prevalencia del SM se realizó mediante regresión logística univariante con finalidad descriptiva24, en la que la variable dicotómica fue dependiente (SM = 1, si el paciente tiene el SM; SM = 0, en caso contrario) y el valor de PCR-us, la independiente. Para valorar globalmente la PCR-us en relación con el SM se ha utilizado las llamadas curvas ROC (receiver operating characteristic), son curvas en las que se presenta la sensibilidad en función de los falsos positivos (complementario de la especificidad) para distintos puntos de corte. Para evaluar la PCR-us se ha utilizado el área bajo la curva, que tomará valores entre 1 (prueba perfecta) y 0,5 (prueba inútil). Esta área puede interpretarse como la probabilidad de que ante un par de individuos, uno enfermo y el otro sano, la PCR-us los clasifique correctamente25. El análisis de los datos se realizó con el programa estadístico SPSS 10.0 y EPI INFO 6 (versión 6.04b).
Resultados
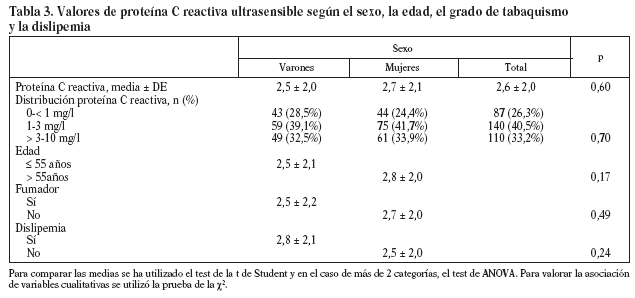
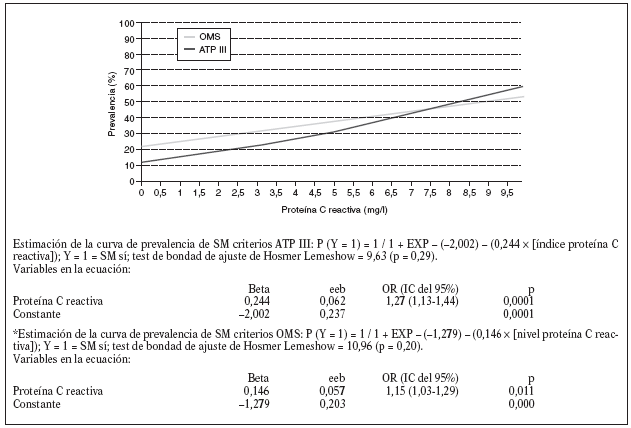
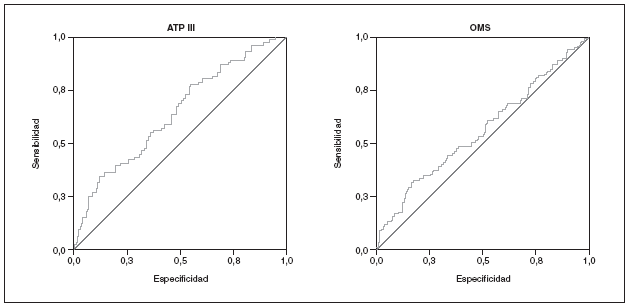
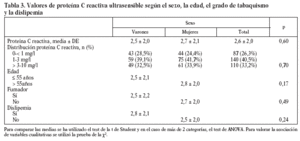
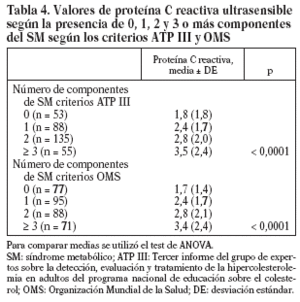
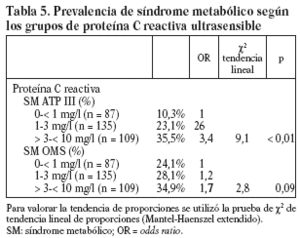
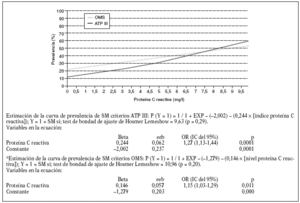
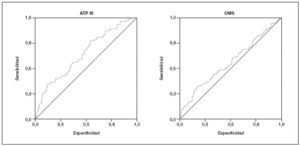
Estudiamos una muestra de 358 pacientes, 161 (45%) varones y 197 mujeres, de los 407 seleccionados (hubo 49 pérdidas, de características equiparables a las del resto de la muestra). Las características de la población están reflejadas en la tabla 2. Se ha excluido a los 27 pacientes que presentaban un valor de la PCR-us superior a 10 mg/l (7,5% del total). La media de la PCR-us fue de 2,6 mg/l ± 2,0. Los pacientes con PCR-us < 1 mg/l fueron el 36,1%; entre 1-3 mg/ l, el 34,4%, y el 29,5% tenía > 3 mg/l. No hubo diferencias en cuanto a sexo, edad (mayores y menores de 55 años), tabaquismo y el diagnóstico de dislipemia (tabla 3). De acuerdo con la definición de la OMS, el punto de corte que definía hiperinsulinismo quedó establecido en é 11,9 mU/l. La prevalencia de SM con criterios de la OMS fue del 31,0% (IC del 95%, 28,143,4), mientras que con los criterios del ATP III fue del 22,3% (IC del 95%, 18,227,1) (p < 0,001). La media de la PCR-us en pacientes con SM por los criterios ATP III fue de 3,5 mg/l ± 2,4 y sin SM fue del 2,4 mg/l ± 1,9, diferencia significativa con p < 0,01. La media de la PCR-us en pacientes con SM por criterios OMS fue de 3,1 mg/l ± 2,4, y sin SM 2,4 mg/l ± 1,8, igualmente significativa con p < 0,001. En la tabla 4 se presentan las medias de la PCR-us según el número de componentes de SM que cumplían los pacientes tanto por los criterios del ATP III como de la OMS. La estimación logística de la prevalencia de SM (tanto por criterios del ATP III como de la OMS) aumenta en función del valor de PCR-us (fig. 1): por cada unidad de incremento de la PCR-us, la prevalencia del SM con los criterios del ATP III se incrementa un 27% (OR = 1,27; IC del 95%, 1,13-1,44) y con criterios de la OMS un 15% (OR = 1,15; IC del 95%, 1,03-1,29) con respecto al valor previo. En la tabla 5 se presenta la prevalencia de SM según la OMS y el ATP III a partir del grupo de PCR-us. En la figura 2 se presentan las curvas ROC de la PCR-us para el diagnóstico de SM.
Figura 1. Estimación logística de la prevalencia de SM según los criterios de la ATP III y la OMS, a partir del índice de proteína C reactiva.
Figura 2. Curvas ROC para la proteína C reactiva ultrasensible para el diagnóstico de SM según los criterios del ATP III y la OMS.
Discusión
Entre las limitaciones de nuestro estudio destacamos en primer lugar que sólo se ha realizado una extracción de PCR-us (se recomienda para calcular las cifras de PCR-us realizar dos extracciones separadas entre 1 y 3 semanas21). Asumimos el sesgo de una única extracción de la PCR-us porque ésta presenta poca fluctuación a corto plazo26, una sola determinación puede ser útil como predictor de enfermedad clínica27 y en la mayoría de los estudios poblacionales se ha utilizado una sola extracción. En segundo lugar, hemos descartado a los individuos con valores de PCR-us superiores a 10. Los valores de la PCR-us en estas personas son inestables y en estos casos se recomienda la repetición de la prueba una vez estabilizado el proceso que produjo la elevación. Por dificultades técnicas y económicas no se repitió la extracción, como se ha hecho en otros estudios21,28. En tercer lugar, nuestro estudio es poblacional y no ha diferenciado entre pacientes tratados y no tratados con fármacos que pueden afectar a la PCR-us. Por último, no se puede obviar el tema de los diferentes métodos definitorios para el SM, que presentan criterios de definición distintos y seleccionan a individuos distintos según el método utilizado, lo que por tanto deja por sentado prevalencias distintas13. Hemos optado por calcular el SM por los dos métodos más utilizados: ATP III y OMS.
La media de PCR-us fue de 2,6 mg/l con una desviación estándar de ± 2,0. Los individuos con SM según el ATP-III presentaban una PCR-us de 3,5 mg/l y en los que no cumplían los criterios ATP-III de SM era de 2,4 mg/l. Cuando valoramos el SM según los criterios de la OMS se encuentran resultados parecidos, en cuyo caso la PCR-us es de 3,1 mg/l y 2,4 mg/l en pacientes con y sin SM, respectivamente.
A diferencia del estudio del Hospital Universitario Vall d'Hebron29 (en pacientes diabéticos), no había diferencias significativas en los valores de PCR-us respecto al sexo. No hemos encontrado diferencias por edad y tabaquismo. El hecho de que no hayamos encontrado diferencias entre los pacientes diagnosticados y no diagnosticados de dislipemia puede estar relacionado con tratamientos con fármacos (el 46,3% de los pacientes dislipémicos estaban tratados con fármacos).
En nuestro estudio, como en el de Ridker et al10 y en el de Festa et al30, al aumentar el número de criterios diagnósticos, tanto según los criterios del ATP III como de la OMS, se comprueba un incremento de los valores de PCR-us. Cuando valoramos la prevalencia de SM en relación con los valores de PCR-us también comprobamos una tendencia lineal entre los valores de PCR-us y la prevalencia de SM según los criterios del ATP III. En el grupo de PCR-us > de 3 mg/l (punto de corte de riesgo elevado) la prevalencia encontrada fue del 35,5% SM-ATP III y del 34,9% SM-OMS, similares a las observadas por Ford et al11. Del mismo modo, la prevalencia de SM estimada por regresión logística se incrementa al aumentar el valor de PCR-us para cualquiera de las definiciones de SM. Hemos estimado que por cada unidad de incremento de la PCR-us, la prevalencia del SM con criterios del ATP III se incrementa un 27% y con criterios de la OMS un 15% en relación con el valor anterior.
En nuestro estudio, la PCR-us como indicador de SM tiene una utilidad limitada si se utiliza de forma aislada, aunque significativa. La curva ROC predice mejor el SM utilizando criterios diagnósticos del ATP III que los criterios diagnósticos de la OMS.
En resumen, los datos que se presentan confirman la idea ya apuntada de que la PCR-us tiene una importante relación con la existencia de SM por cualquiera de las definiciones de él. Esta relación sería continua y con una tendencia lineal. La asociación entre las concentraciones séricas de PCR-us y el SM parece sugerir la presencia de un estado inflamatorio crónico subyacente como mecanismo etiopatogénico del daño vascular asociado a este síndrome.