En la actualidad se encuentran en constante revisión los mecanismos determinantes primarios y las posibles terapéuticas de una de las principales entidades patológicas considerada epidémica y constituida como problema de salud pública mundial: la aterosclerosis. En tal sentido, pacientes que la padecen presentan como común denominador disfunción mitocondrial, estrés oxidativo e inflamación. De especial interés, el óxido nítrico, un conocido gas mensajero vasoactivo, ha sido estrechamente relacionado con el proceso inflamatorio, oxidativo y disfuncional mitocondrial propio de la aterosclerosis. Por otro lado, muy recientemente se ha demostrado que alteraciones en la biodisponibilidad del óxido nítrico inducirían la expresión de proteínas de shock térmico. Este mecanismo sería inducido también por el uso de los denominados alimentos funcionales como estrategia para prevenir el envejecimiento vascular así como el desarrollo de aterosclerosis. Finalmente, el mayor conocimiento de los mecanismos implicados en el desarrollo de la aterosclerosis nos permitirá proponer nuevas y posibles intervenciones higiénicas, sanitarias y terapéuticas.
Atherosclerosis, one of the main pathologic entities considered epidemic and a worldwide public health problem, is currently under constant review as regards its basic determining mechanisms and therapeutic possibilities. In this regard, all patients afflicted with the disease exhibit mitochondrial dysfunction, oxidative stress and inflammation. Interestingly, nitric oxide — a known vasoactive messenger gas — has been closely related to the inflammatory, oxidative and mitochondrial dysfunctional process that characterizes atherosclerosis. In addition, it has recently been demonstrated that alterations in the bioavailability of nitric oxide would induce the expression of heat shock proteins. This agrees with the use of functional foods as a strategy to prevent both vascular aging and the development of atherosclerosis. Finally, a greater knowledge regarding the mechanisms implied in the development of atherosclerosis will enable proposing new and possible hygiene, health and therapeutic interventions.
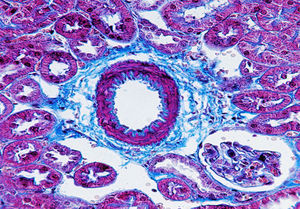
La ateroesclerosis como entidad patológica emergente en los países industrializados responde a un síndrome caracterizado por el depósito y la infiltración de sustancias lipídicas en las paredes de las arterias de mediano y grueso calibre. Además, provoca inflamación, multiplicación y migración de las células musculares lisas condicionando el estrechamiento de la luz arterial1, para finalmente conducir a la aparición de enfermedades cardiovasculares (ECV). En el proceso inflamatorio crónico propio de la ateroesclerosis el daño tisular y la reparación pueden ocurrir en simultáneo y el depósito de tejido conjuntivo produce una fibrosis con anormal cantidad de tejido conjuntivo (fig. 1).
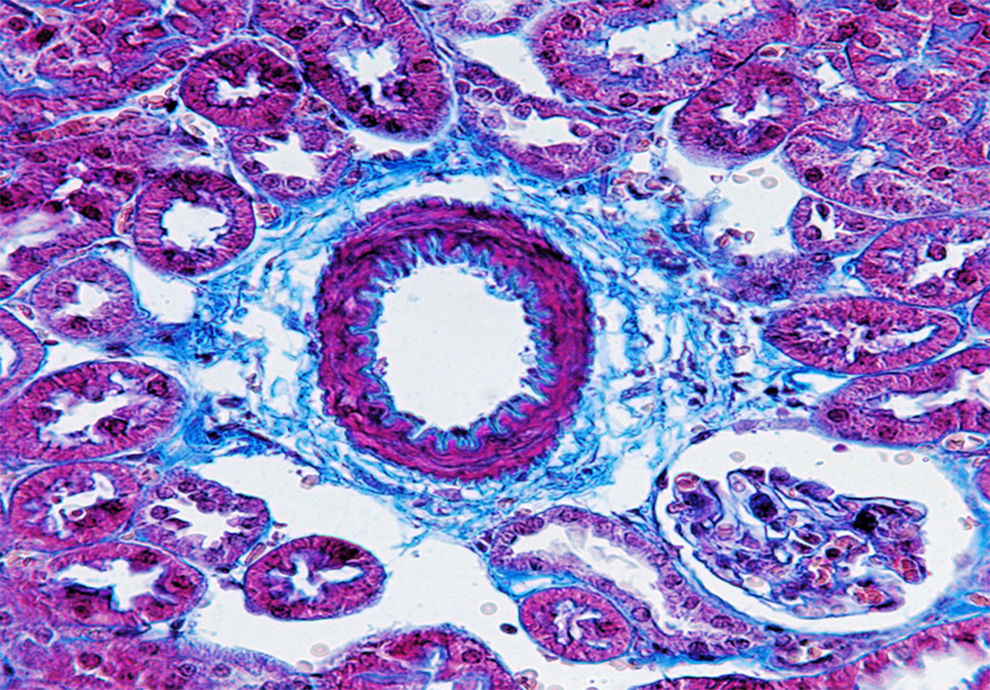
Tinción de fibras de colágeno por técnica de Masson. Imagen representativa: vaso procedente de corteza renal del ratón deficiente en apolipoproteína E como modelo de aterosclerosis. El depósito de matriz extracelular fibrilar en el tejido conjuntivo se aprecia en color azul. Se observa fibrosis con depósito incrementado de matriz extracelular. Magnificación 400×.
De especial interés, la Organización Mundial de la Salud se refirió a las ECV como una epidemia mundial desatendida, y destacó que se encuentran presentes en todos los países, con excepción de algunos muy pobres, y alertó además que representan una amenaza seria a nivel de salud pública, con gran impacto sobre el desarrollo social y económico. Los factores de riesgo que la agravan sirven como indicadores del estado de salud poblacional, y 5 de ellos guardan estrecha relación con enfermedades no transmisibles, como son la hipertensión arterial, el tabaquismo, el consumo de alcohol, la hipercolesterolemia, la obesidad o el sobrepeso2. Estos factores de riesgo promueven el desarrollo del proceso inflamatorio propio de la aterosclerosis3-6.
El impacto sobre la salud pública y las proyecciones de la aterosclerosis a nivel mundial justifican que permanentemente se profundicen los estudios tendientes a comprender mejor los mecanismos determinantes primarios así como también sus terapéuticas. En tal sentido, pacientes que padecen aterosclerosis presentan como común denominador disfunción mitocondrial, estrés oxidativo e inflamación7,8. El estrés oxidativo asociado a una menor biodisponibilidad del óxido nítrico (NO) parece desempeñar un papel clave en la patogénesis de la aterosclerosis, la inflamación vascular y la disfunción endotelial9. En concordancia y de especial interés para la presente revisión, el NO, un conocido gas mensajero vasoactivo, ha sido muy recientemente relacionado con el proceso inflamatorio, oxidativo y disfuncional mitocondrial propio de la aterosclerosis10.
Por otro lado, nuestro grupo de trabajo demostró, en acuerdo con otros laboratorios, que el aumento en la biodisponibilidad del NO induce la expresión de proteínas de shock térmico (HSP)11-16. Las HSP son una familia altamente conservada de proteínas con diversas funciones expresadas por todas las células expuestas a estrés ambiental. Los estudios más recientes dan cuenta que ciertas HSP pueden ser potenciales marcadoras de riesgo de aterosclerosis y ECV relacionadas17, en tanto que otras, como la proteína de shock térmico 70 (Hsp70), parecen estar directamente relacionadas con efectos protectores sobre el desarrollo y el mantenimiento de la aterosclerosis18. La inducción de estas proteínas sería también modulada positivamente por el uso de los denominados alimentos funcionales como estrategia para prevenir el envejecimiento vascular así como el desarrollo de aterosclerosis19. Lo cual resulta coherente desde que se conoce que la dieta occidental se asocia con el proceso inflamatorio crónico involucrado en todas las etapas de desarrollo de la aterosclerosis, y que también se reconoce cada vez más como un mecanismo universal de desarrollo de diversas enfermedades degenerativas crónicas, tales como las autoinmunes, algunas neoplasias e inclusive la osteoporosis20.
El concepto de alimentos funcionales se introdujo originalmente en oriente, hace más de 3 décadas, por autoridades sanitarias para garantizar una mejor calidad de vida frente al incremento de la longevidad. Se propuso así una nueva concepción de alimentos desarrollados específicamente para mejorar la salud y reducir el riesgo de contraer enfermedades21. Entre ellos destacan los que contienen determinados minerales, vitaminas, ácidos grasos o fibra alimentaria, los alimentos a los que se han añadido sustancias biológicamente activas como los fitoquímicos u otros antioxidantes, y los probióticos, que tienen cultivos vivos de microorganismos beneficiosos22. En consecuencia, los productos naturales están ganando mayor popularidad para combatir diversas amenazas que incluyen el estrés oxidativo, patologías cardiovasculares, el cáncer y hasta la disfunción inmune, entre las más destacadas. Específicamente y en relación a ECV, el uso de los alimentos funcionales y/o nutracéuticos representan nuevos aportes al conocimiento, a la prevención y al posible tratamiento. En este sentido, el ajo tiene una posición privilegiada en la historia y fue reconocido por su potencial terapéutico23. Además, en los últimos tiempos se ha demostrado que la alicina (compuesto biológicamente activo del ajo) ejerce protección asociada a reducción del estrés oxidativo, modulación del NO e incremento significativo de Hsp7024. Esto es relevante desde que se sabe que la disfunción de la enzima óxido nítrico sintasa endotelial (eNOS) es causa primaria de la aterosclerosis y que ciertas HSP inhiben la proliferación de células musculares lisas y participarían de la reparación vascular25.
La etiología de las principales ECV, tales como la aterosclerosis, permanecen aún sin estar completamente dilucidadas. Sin embargo, recientes evidencias sugieren que el NO y las HSP como Hsp70 resultan elementos clave en el proceso de estrés oxidativo que subyace a estas enfermedades. Por otra parte, de particular interés para los conocimientos actuales, ha sido recientemente sugerido un papel emergente de las vías de NO y de Hsp70 vinculadas al uso de alimentos funcionales. Por lo tanto, una mayor comprensión de los mecanismos implicados en el desarrollo de la aterosclerosis nos permitirá proponer nuevas y posibles intervenciones higiénicas, sanitarias y terapéuticas.
Óxido nítrico y Hsp70 en aterosclerosisEl NO, una especie reactiva del nitrógeno de vida media ultracorta, participa como factor regulador de una diversa gama de funciones fisiológicas como el control de la resistencia vascular, la neurotransmisión y la modulación de procesos inflamatorios, entre otras11,26-30. Bioquímicamente y a nivel citosólico, el NO es una molécula sintetizada por enzimas NOS con L-arginina, NADPH y O2 como sustratos básicos31. Por otro lado, también se ha descrito una producción mitocondrial regulada por una isoforma local de NOS (mNOS) y/o por reacciones no enzimáticas con O2 y ubiquinol (UQH2)32. En comparación con otras especies reactivas, el NO tiene una alta difusión en sistemas biológicos dada su naturaleza lipofílica, carga neutra y una relativa baja reactividad33. En la matriz mitocondrial, el NO reacciona con el anión superóxido (O2−) dando peroxinitrito (ONOO−), que es un potente citotóxico fácilmente difusible desde el espacio intramitocondrial34. Tanto el NO como el ONOO− son pro-oxidantes que pueden conducir a estrés oxidativo y daño celular por oxidación y nitración de lípidos, proteínas, ADN y deterioro de la función mitocondrial35.
El NO se genera en todo el organismo por diferentes isoformas de la enzima NOS, y es la producción local lo que determina sus acciones fisiológicas. Específicamente, la isoforma endotelial (eNOS) es abundante en el endotelio vascular, pero también se encuentra en cardiomiocitos, neuronas, células epiteliales, adipocitos y hepatocitos36,37. La isoforma inducible (iNOS), que tiene la mayor capacidad para generar NO, es —como su nombre lo refiere— de naturaleza inducible y se expresa en varios tipos celulares tales como macrófagos, en respuesta a estímulos inflamatorios por citoquinas, lipopolisacáridos y otros agentes inmunológicos. La expresión de iNOS se regula a nivel transcripcional y postranscripcional por vías de señalización que implican mediadores tales como el factor NF-kappa B o MAPK38. Por último, la nNOS se expresa sobre todo en las neuronas, el músculo esquelético y las células epiteliales. Es una isoforma Ca2/calmodulina dependiente que puede ser activada por agonistas del receptor de N-metil-D-aspartato39. A diferencia de la isoforma inducible, tanto la neuronal como la endotelial se expresan constitutivamente, pero su actividad está regulada por la concentración de calcio intracelular. En consecuencia, la enzima iNOS, así como el propio NO, están involucrados en una variedad de estados patológicos agudos y/o crónicos tales como la inflamación, la isquemia-reperfusión, la diabetes, el cáncer, las enfermedades neurológicas, el envejecimiento y la enfermedad renal40-44. En este sentido, y a pesar de las controversias sobre efectos tóxicos o benéficos del NO, nuestro grupo comunicó inéditamente, en un modelo de enfermedad renal, disminución de la biodisponibilidad del NO con menor expresión de iNOS asociado a déficit de Hsp70 y significativa inducción de la apoptosis. En tanto que la administración in vivo de L-arginina indujo la expresión de Hsp70 asociada a menor apoptosis y reducción de la actividad de NADPH. Además verificamos incremento de la interacción Bcl2 y Hsp70. Estos hallazgos sugirieron que NO puede producir resistencia a la muerte celular promovida por el modelo de enfermedad renal modulando señales de la mitocondria a través de la inducción Hsp7045.
Hsp70 es una de las HSP más ubicua y altamente conservada. Las HSP son chaperonas moleculares constituidas por familias de polipéptidos que ayudan a moléculas dañadas en la recuperación de su conformación funcional. Se sintetizan en respuesta a diferentes factores de estrés como el calor, la hipotermia, la hipoxia, los radicales libres, la isquemia, el etanol, la radiación ultravioleta y la infección viral, entre los más estudiados46. Protegen además a proteínas, lípidos y ácidos nucleicos de daños mediante la reducción de la oxidación y pueden modular función celular y la expresión génica contribuyendo a la homeostasis proteica47. Otras funciones de interés incluyen la supresión de citoquinas proinflamatorias, reparación de canales iónicos, preservación de mitocondrias, membranas, retículo endoplasmático y núcleo. Finalmente, también participa en el transporte intracelular48,49. Más específicamente, Hsp70 ayuda a las proteínas mal plegadas para que adopten su conformación nativa y recuperen su función. Además, protege a las proteínas nacientes, fomenta el transporte proteico de las organelas y reduce los agregados tóxicos50. También, Hsp70 tiene un importante papel en la señalización de la respuesta inflamatoria e inmune51. En cuanto al estrés oxidativo y la apoptosis mitocondrial, estos pueden prevenirse por inducción de Hsp7052. Esto resulta relevante desde que se conoce que las NADPH oxidasas participan activamente en el mecanismo de la inflamación, ya que catalizan la producción de O2− y otras especies reactivas del oxígeno (ERO), componentes ampliamente reconocidos como responsables principales del daño celular53. En adición, un reciente estudio mostró que Hsp70 está relacionada con las complicaciones vasculares asociadas a la insulinorresistencia. Promueve la vasodilatación e inhibe la trombosis y la proliferación celular mediante el aumento de la angiotensina 1-7 a través de la expresión de eNOS54. Por lo tanto, resulta protagónico el rol de Hsp70 en la modulación del proceso inflamatorio55. Cabe destacar que el aumento de Hsp70 respondería a una elevación crónica de NO56. Si esto se sostiene en el tiempo, aumentará la fosforilación de AKT, AMPK y eNOS, mejorando la biodisponibilidad del NO endógeno y optimizándose así la respuesta vasomotora y vasoprotectora57. En contraposición, la insulinorresistencia y/o la diabetes se asocian con una alteración en los niveles del NO endotelial, lo que conduce a inflamación y aterosclerosis relacionada con el estrés oxidativo58,59.
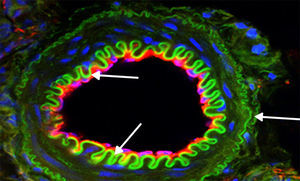
Por otro lado, un original reporte de Xu et al.60, partiendo de la base de que las HSP se encuentran incrementadas en las células de músculo liso vascular durante la hipertensión aguda y la aterosclerosis con perturbaciones en los niveles del NO, propuso que el NO induciría la expresión de Hsp70 en dichas células a través de la activación de su factor de transcripción1 (Hsf1). Específicamente, sugirió que la inducción de Hsp70 podría ser importante en la protección de las células musculares lisas lesionadas por sobreproducción de NO. Esto fue consistente con estudios ulteriores donde se evaluaron efectos pleiotrópicos de ciertas estatinas. Aquí se verificó la inducción y translocación nuclear de Hsf1 con el consecuente incremento de Hsp70, eNOS y trombomodulina61. Estos resultados contribuyen al conocimiento sobre la disfunción de la eNOS como un determinante clave de la aterosclerosis y que ciertas HSP inhiben la proliferación de células musculares lisas y participarían de la reparación vascular25. Además, un estudio realizado sobre los efectos de un fármaco antiulceroso conocido como geranilgeranilacetona (GGA) en un modelo de aterosclerosis demostró supresión de iNOS en las células lisas vasculares estimuladas previamente por citoquinas a través de la modulación de NF-kappa B. Este efecto fue asociado también a la producción de Hsp7062. Por lo tanto, en estados inflamatorios tales como el proceso aterosclerótico (fig. 2), la modulación de los niveles del NO por inhibición de iNOS y/o la inducción de eNOS condicionaría la mayor expresión de Hsp70, y esto se vería reflejado en efectos protectores sobre el aparato cardiovascular.
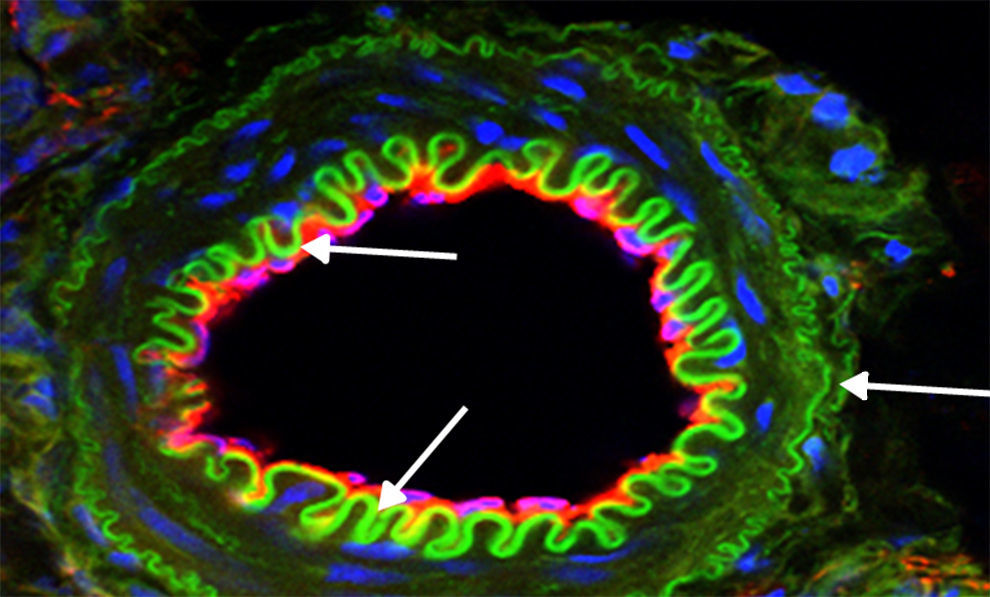
Expresión de proteínas de interés por inmunofluorescencia. Imagen representativa: vaso procedente de corteza renal de rata tratada durante 15 días con L-arginina. La mayor biodisponibilidad de NO indujo una significativa expresión verde de Hsp70 (flechas), y esto fue relacionado con una menor apoptosis y la reducción de la actividad de NADPH. Magnificación 600×.
Si bien el concepto de alimentos funcionales fue introducido, es menester destacar que en la actualidad existen controversias respecto a trazar una línea que precise las características específicas de este grupo de alimentos que los diferencien del resto. En consecuencia, no se encuentra una definición de alimentos funcionales que sea universalmente aceptada y, por lo tanto, son escasas las regulaciones específicas en países de occidente63. Diferente es la situación en oriente, donde los alimentos funcionales están regulados y son comercializados tras su aprobación con la identificación «FOSHU» (Food for Specified Health Uses). De interés, los beneficios atribuidos a estos alimentos vienen dados por componentes o ingredientes funcionales que tienen principios bioactivos capaces de prevenir diferentes patologías crónicas.
Los alimentos funcionales pueden ser de origen animal y/o vegetal. Los últimos destacan por su alto contenido de compuestos activos, además de aquellos que son considerados nutrientes (p.ej., vitaminas y minerales). En particular, se trata de compuestos fisiológicamente activos, producto del metabolismo secundario de vegetales, también denominados fitoquímicos. En función de sus estructuras químicas, se los agrupa como: terpenos, fenoles, alcaloides y compuestos azufrados, que ejercen efectos positivos sobre la salud humana64. Entre los fitoquímicos que evidencian propiedades benéficas en relación con la salud cardiovascular —y en particular con la reducción de los niveles del colesterol— se pueden mencionar componentes tales como la proteína de soja, fibra soluble, vitaminasE, C, β-caroteno, compuestos fenólicos y los compuestos organoazufrados (OSC)65,66. Además, y de particular interés, una revisión reciente67 ha reunido evidencias que describen protección cardiovascular en pacientes asociada al consumo de compuestos tales como catequinas, flavonoides y aliina (un OSC), entre otros. En relación con los compuestos OSC, se hallan presentes en 2 tipos de cultivos: en los géneros Brassicae y Allium, evidenciando similitudes y diferencias para cada uno de ellos. Estos OSC han llamado la atención desde tiempos ancestrales, proponiéndose diversos destinos como alimentos, condimentos y la preparación de fitoterápicos. Los efectos benéficos asociados al consumo de Allium, como Allium sativum L. (ajo), son atribuidos a compuestos encontrados en las plantas cuando el tejido se halla intacto, odorantes formados durante la rotura de los tejidos, sustancias derivadas de reacciones posteriores, o bien productos de degradación metabólica de estos 3 tipos de compuestos68.
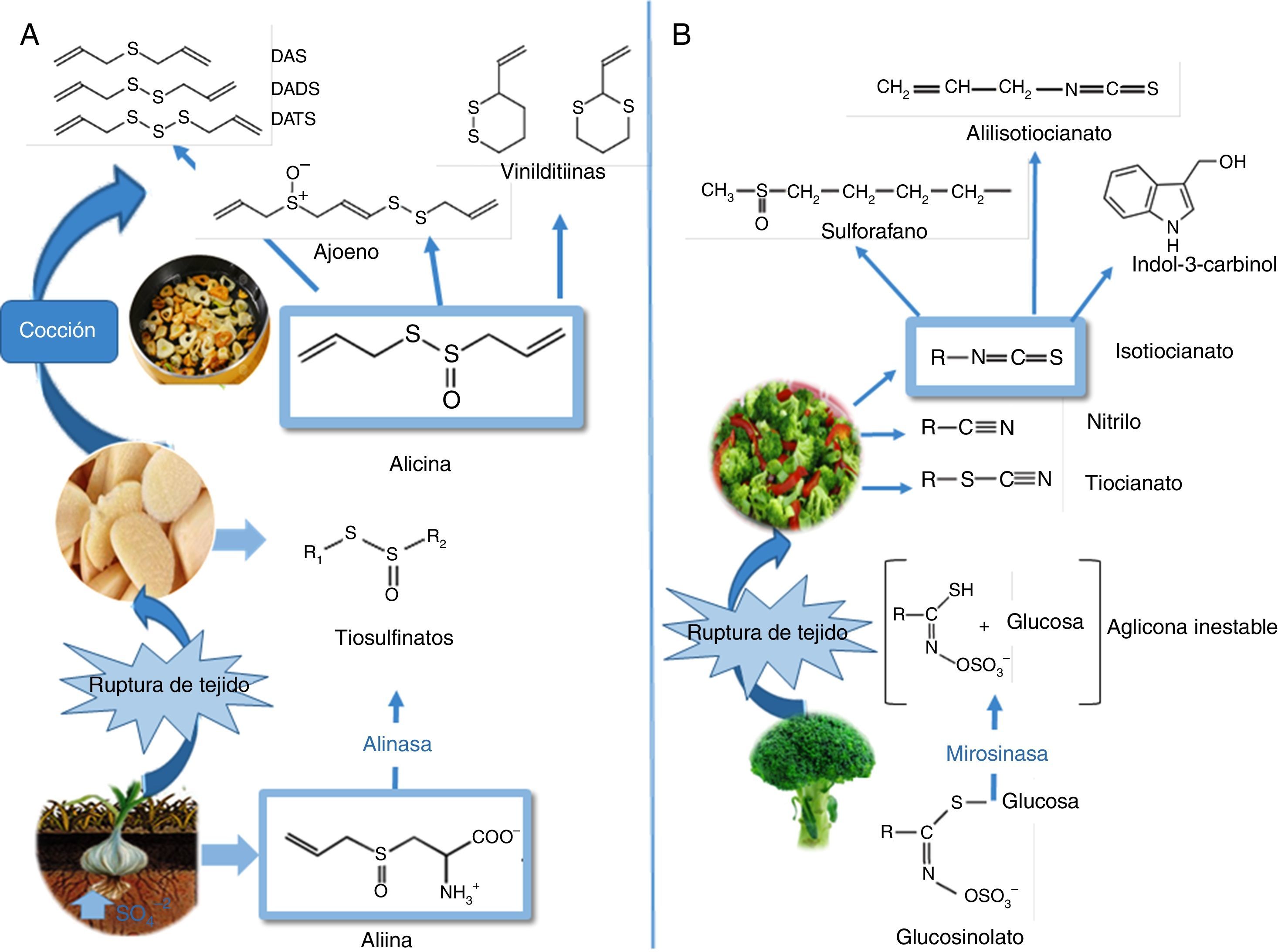
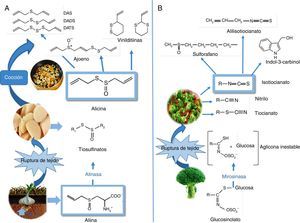
Para comprender los efectos positivos en salud cardiovascular conviene referir que la biosíntesis de los OSC se inicia cuando el azufre es absorbido del suelo, luego experimenta una serie de transformaciones metabólicas para generar diversos productos a posteriori almacenados como γ-glutamil-péptidos, y que más tarde se biotransforman en alquenil-cisteín-sulfóxidos (ACSO), también llamados compuestos precursores del flavor. Cuando el tejido de ajo fresco es dañado, la enzima alinasa (situada en las vacuolas) actúa sobre los ACSO (presentes en el citoplasma celular), liberando los tiosulfinatos, siendo en el ajo la alicina (dialil tiosulfinato) el producto que se encuentra en mayor proporción (65-75%) (fig. 3A). En consecuencia, muchas de las propiedades benéficas para la salud cardiovascular son atribuidas a este compuesto mayoritario, que a su vez se descompone para originar otra serie de productos como polisulfuros (mono, di y tri-sulfuros), ajoenos y vinilditiinas, que también evidencian propiedades protectoras. Además, múltiples estudios refieren que los efectos positivos sobre salud cardiovascular del ajo se observan cuando es consumido fresco69 y/o cocido70,71. Con especial atención a la presente revisión, numerosos trabajos se refieren a los efectos positivos del consumo de ajo y/o sus preparaciones sobre los perfiles de lípidos en sangre, incluyendo una reducción en el colesterol total, el cLDL, y un aumento en los niveles de HDL y triglicéridos72-74. En tanto que un estudio conducido por Gardner et al.75 no constató beneficios equivalentes en pacientes adultos con hipercolesterolemia moderada.
Fitoquímicos organoazufrados presentes en hortalizas de los géneros Allium sp. y Brassica sp. A) Estructuras químicas y transformaciones de los organoazufrados presentes en el ajo (Allium sativum L). Biosíntesis de compuestos alquenil-cisteín-sulfóxidos (entre ellos, aliina), a partir de sulfato absorbido por las raíces. Lisis de aliina mediada por la enzima alinasa y producción de alicina. Descomposición de alicina mediante cocción. B) En Brassica, isotiocianatos formados como consecuencia de la hidrólisis de los glucosinolatos por la mirosinasa. En la figura se muestran los principales isotiocianatos que se forman en brócoli (Brassica oleracea italica L): sulforafano, indol-3-carbinol y alil-isotiocianato.
Por otro lado, en el caso del género Brassicae, los OSC de importancia biológica se originan durante el procesado de los alimentos y/o la masticación, en donde la enzima mirosinasa (MS) (fig. 3B) entra en contacto con los glucosinolatos (GLS) hidrolizándolos y generando una aglicona, compuesto intermedio inestable (tiohidroxamato-O-sulfonato), el cual se convierte rápidamente en un amplio grupo de metabolitos bioactivos tales como: los isotiocianatos (ITC)76, tiocianatos, nitrilos y cianoepitioalcanos. En relación a los ITC, la bibliografía describe una amplia variedad entre las distintas especies e incluso dentro de una misma especie77.
Finalmente y en relación a los vegetales de la familia Brassicaceae, recientes evidencias demuestran propiedades relacionadas con la quimioprevención del cáncer78. También existen resultados que demuestran modulación de procesos inflamatorios, reducción de marcadores oxidativos, aumento del metabolismo de colesterol79 y prevención de las ECV80.
Alimentos funcionales, óxido nítrico y Hsp70 en aterosclerosisEl estado de conocimiento actual discute sobre las múltiples causas de la enfermedad ateroesclerótica; sin embargo, la inflamación y el estrés oxidativo juegan un papel fundamental en la patogénesis de la disfunción endotelial que se atribuye comúnmente a una alteración en la disponibilidad de NO. En adición, Hsp70 protegería a los elementos celulares de la lesión mediante la reducción de la oxidación, la inflamación y la apoptosis81. Por lo tanto, existen evidencias concretas que sugieren al NO y a la proteína Hsp70 como elementos clave en el proceso inflamatorio y oxidativo que subyace a esta patología. En consecuencia, existe un creciente interés sobre los estudios de la implementación de dietas a base de los denominados alimentos funcionales y su impacto en patologías inflamatorias crónicas como la aterosclerosis. Al respecto, ha sido sugerido un papel emergente de las vías de NO y de Hsp70 vinculadas al uso de estos nutrientes especiales. Más específicamente y relacionado con ECV, el uso de los alimentos funcionales y/o nutracéuticos representa nuevos aportes al conocimiento, prevención y posible tratamiento. En este sentido, el ajo y la alicina son ampliamente reconocidos por su potencial terapéutico23. La alicina ejerce protección asociada con reducción del estrés oxidativo, modulación del NO e incremento significativo de Hsp7024. Esto es significativo desde que la disfunción de la enzima eNOS es uno de los determinantes primarios de la aterosclerosis, y además el hecho de que ciertas HSP que inhiben la proliferación de células musculares lisas participarían de la reparación vascular25.
Con referencia a las vías del NO vinculado al uso de alimentos funcionales, previos y originales trabajos en ECV informaron que el ajo podría prevenir múltiples alteraciones, destacándose la inhibición de la agregación plaquetaria. Los estudios indicaban inhibición de la actividad de la ciclooxigenasa y la formación de tromboxanoA2, supresión de la movilización de Ca2+ plaquetario y aumento de los niveles de AMPc y GMPc. Por otro lado, el ajo también mostró propiedades antioxidantes y modulación de la actividad enzimática de la enzima NOS y su producto, el NO. Además, el ajo demostró propiedades como hipolipemiante y mejoró la disfunción endotelial. Los autores concluyeron que el ajo inhibe la agregación plaquetaria por múltiples mecanismos, y sugirieron que podría tener un papel en la prevención de la ECV82,83. Más recientemente, el ajo ha sido caracterizado y reconocido por su inmenso potencial terapéutico con efectos positivos frente a un amplio espectro de enfermedades incluyendo el cáncer, la diabetes, infecciones microbianas, así como trastornos inmunológicos y ECV. En este sentido, un grupo importante de investigaciones sugieren reducción del riesgo cardiovascular y metabólico mediante la normalización de los lípidos plasmáticos, lipoproteínas oxidadas de baja densidad, modulación de la agregación plaquetaria, regulación de la presión arterial y prevención de la lesión cardiaca. Dichos beneficios responderían mayoritariamente al consumo de alimentos como el ajo, y por mecanismos directos y/o indirectos condicionarían la generación de sulfuro de hidrógeno y NO tanto en cardiomiocitos como en células endoteliales84. Además, estudios sobre hipertensión y el uso de compuestos activos del ajo demostraron mejoras en parámetros que incluyen el estrés oxidativo, la biodisponibilidad de NO, la producción de sulfuro de hidrógeno, la actividad de la enzima convertidora de angiotensina, la expresión de NF-kappa B y la proliferación de células musculares lisas vasculares. Esta revisión sugiere que ciertos alimentos funcionales tienen propiedades medicinales significativas con el potencial de mejorar la hipertensión y la morbilidad asociada85. Por lo tanto, y en correspondencia con la naturaleza inflamatoria y oxidativa de la ECV, entre los conceptos emergentes sobre el uso de alimentos funcionales y salud cardiovascular destacan los efectos antioxidantes y antiinflamatorios que estos manifiestan. Así, el uso de alimentos funcionales como el ajo y sus derivados activos podría reducir el incremento de la producción de ERO, lo que restablecería la función vascular, mejoraría la permeabilidad vascular alterada y reduciría la inflamación, acompañado esto por la recuperación de la función moduladora vascular, el equilibrio entre la relajación vascular y la vasoconstricción, y la reducción de moléculas de adhesión inflamatorias86. En este sentido, muy recientemente Lopez-Jaramillo87 ha discutido el papel de la adiponectina en la ECV y destaca que la adiponectina se asociaría con un menor riesgo de enfermedad coronaria, con una mejora en la diferenciación de los preadipocitos/adipocitos y con aumento en la producción de NO endotelial. Además, el mismo autor propone y discute que la restricción calórica, el consumo moderado de alcohol y la dieta mediterránea incrementarían las concentraciones de adiponectina. Más específicamente, la administración de extracto de ajo envejecido y alimentos con pistachos podría aumentar las concentraciones de adiponectina en individuos con síndrome metabólico.
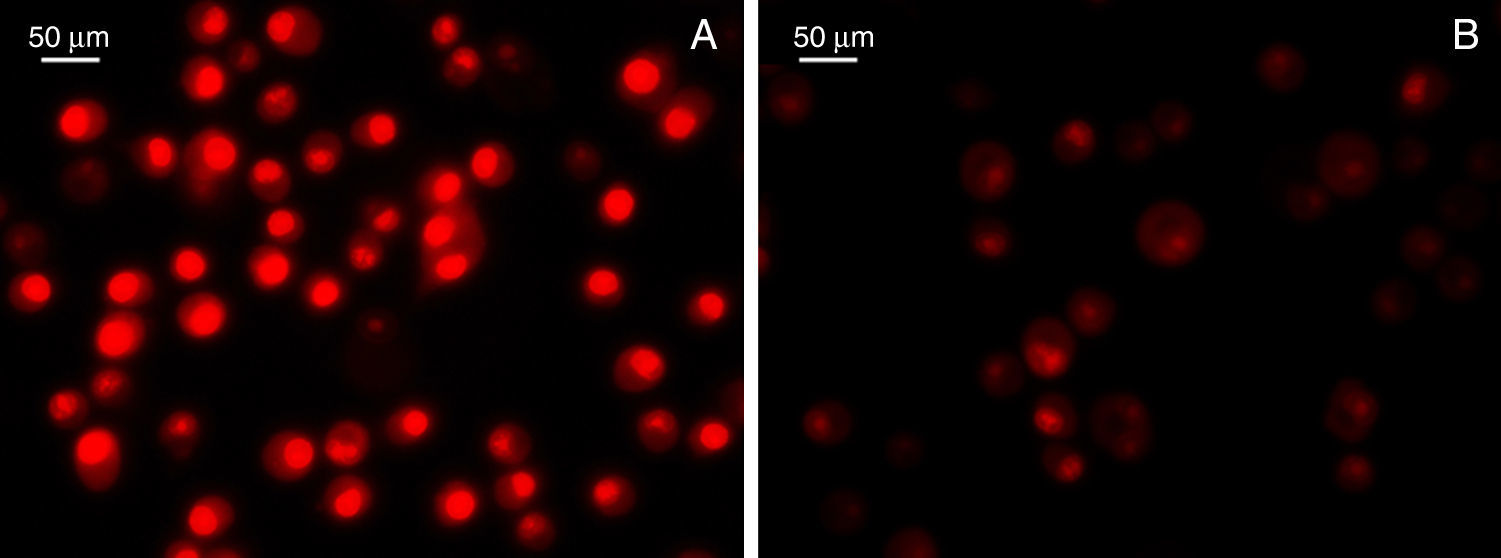
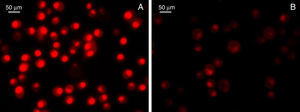
Por otro lado, y siguiendo nuestra línea de razonamiento, la evidencia actual sugiere que las HSP estarían implicadas en el mecanismo inmunológico e inflamatorio durante el desarrollo y la progresión de la aterosclerosis. No obstante lo controversial de ciertas chaperonas moleculares como Hsp60 en la ECV, resulta relevante la participación de Hsp70 como citoprotectora tanto en estudios básicos17,81 como en estudios clínicos88,89. Además, la asociación altos niveles de Hsp70 con bajo riesgo de enfermedad coronaria y gravedad de la misma fue independiente de los factores de riesgo tradicionales90,91. Por lo tanto, resulta válido postular en ECV que una posible intervención higiénica, sanitaria y/o terapéutica que contribuya a modular la expresión de Hsp70 eventualmente podría mejorar la evolución de la misma o de cualquier enfermedad inflamatoria crónica92. En acuerdo con este postulado, un número importante de alimentos funcionales han sido estudiados intensamente y representan una alternativa útil para preservar la salud; en consecuencia, la inducción de Hsp70 a través de la dieta constituye un nuevo enfoque preventivo o incluso terapéutico en enfermedades inflamatorias93, como lo demostró el uso de un compuesto tipo OSC soluble en agua, que indujo la expresión de Hsp70 y redujo la toxicidad inflamatoria inducida por paracetamol94. También un estudio realizado en aterosclerosis demostró que una dieta rica en taurina inhibió la apoptosis miocárdica, y esto fue asociado con un aumento significativo de la Hsp70 miocárdica95. Estos resultados fueron reforzados por otros estudios de compuestos biológicamente activos del ajo que demostraron protección por reducción del estrés oxidativo evidenciado por la disminución de las ERO, peroxidación lipídica y preservación de la actividad de las enzimas antioxidantes. Dichos eventos fueron también vinculados directamente con una significativa inducción de Hsp70 y la consecuente modulación del NO24. Resultados preliminares aún no publicados de nuestro laboratorio y en colaboración en el Dr. Lahera confirmaron la modulación del estrés oxidativo asociado al uso de principios activos del ajo con reducción de marcadores inflamatorios (fig. 4).
Detección de la producción del anión superóxido. Se utilizó el colorante fluorescente dihidroetidio (DHE; Invitrogen, Grand Island, NY, EE.UU.), y un score de la intensidad del color rojo permitió evaluar la producción del anión superóxido en cultivo de células Bv-2 gliales de ratón sometidas a lesión por lipopolisacáridos en ausencia (A) o presencia (B) de alicina.
El estado de conocimiento actual reconoce un importante número de causas de la enfermedad ateroesclerótica. Sin embargo, la inflamación y el estrés oxidativo destacan como determinantes fundamentales en la patogénesis de la disfunción endotelial atribuida comúnmente a una alteración en la disponibilidad de NO. En adición, Hsp70 protegería a los elementos celulares de la lesión mediante la reducción de la oxidación, la inflamación y la apoptosis. De interés, se encuentran en constante revisión las posibles terapéuticas. En tal sentido, el NO, un conocido gas mensajero vasoactivo, ha sido estrechamente relacionado con el proceso inflamatorio, oxidativo y disfuncional mitocondrial propio de la aterosclerosis. Por otro lado, muy recientemente se ha demostrado que alteraciones en la biodisponibilidad del NO inducirían la expresión de HSP. Este mecanismo podría ser inducido también por el uso de ciertos alimentos funcionales como estrategia para prevenir el envejecimiento vascular así como el desarrollo de aterosclerosis. Específicamente, alimentos funcionales como la alicina ejercerían protección asociada a reducción del estrés oxidativo, modulación del NO e incremento significativo de Hsp70. Esto es relevante desde que se sabe que la disfunción de la enzima eNOS es causa primaria de la aterosclerosis y que ciertas HSP inhiben la proliferación de células musculares lisas y participarían de la reparación vascular. Finalmente, el mayor conocimiento de los mecanismos implicados en el desarrollo de la aterosclerosis nos permitirá proponer nuevas estrategias higiénicas, sanitarias y terapéuticas, como la implementación de alimentos saludables.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses potencial con respecto a la investigación, la autoría y/o la publicación de este artículo de revisión.