El tratamiento hipolipemiante ha sido responsable de una significativa mejoría en los resultados clínicos obtenidos en prevención cardiovascular cuando se emplean fármacos. Las estatinas han demostrado su elevada eficacia, tanto en prevención primaria como en secundaria. Su efecto se debe, de forma muy mayoritaria, al descenso de los valores de colesterol y de las lipoproteínas de baja intensidad (LDL). Por otra parte, se dispone de potentes fármacos con efecto primordial sobre las dislipemias no dependientes de las LDL. De ellos, los fibratos son los más empleados, por su eficacia y seguridad. A la luz de las evidencias disponibles procede, en consecuencia, delimitar cuál es el impacto de los fibratos sobre el metabolismo lipídico y, de manera muy específica, los grupos de población que más se pueden beneficiar de su uso, así como la eficacia, tanto en prevención primaria como secundaria.
¿Cuál es la magnitud del efecto de los fibratos sobre los valores de lípidos?Los fibratos activan los PPARα (receptores activados por factores de proliferación peroxisomal-alfa) y a través de este efecto estimulan la expresión de apolipoproteína (apo) AI, apo AII y ABCA1, que provocan un incremento de la producción de partículas de lipoproteínas de alta densidad (HDL) y un mayor transporte reverso del colesterol. Los fibratos también reducen la producción de apo CIII e incrementan la síntesis de lipoproteinlipasa (LPL), lo que da lugar a un mayor aclaramiento de lipoproteínas de muy baja densidad (VLDL) y a la producción de partículas de LDL con mayor flotabilidad. Finalmente, los fibratos potencian la expresión de acil-CoA sintetasa, que cataliza la conversión de ácidos grasos libres (AGL) a acetil CoA. Ello reduce los valores de AGL en los hepatocitos, lo que da lugar a una reducción de la producción de triglicéridos y una disminución de la producción de VLDL1.
Según las evidencias aportadas por los ensayos clínicos aleatorizados, doble ciego y controlados con placebo o mediante la comparación con otros fármacos hipolipemiantes, el tratamiento con fenofibrato se asocia a una mejoría global del perfil lipídico, incluyendo una disminución de las concentraciones plasmáticas de colesterol total, colesterol unido a LDL (cLDL) y triglicéridos, y un incremento del colesterol unido a HDL (cHDL)2.
En cuanto a los efectos de los fibratos en general, y del fenofibrato en particular, sobre el metabolismo lipídico, el efecto más acusado se manifiesta sobre los triglicéridos plasmáticos, con una disminución que oscila entre el 20 y por encima del 50%, dependiendo del trastorno metabólico de base y de la magnitud de la hipertrigliceridemia. El efecto del fenofibrato sobre los triglicéridos se ha demostrado en distintos ensayos clínicos realizados en pacientes con dislipemia mixta3,4 y con dislipemia mixta o con hipercolesterolemia5, por lo que los fibratos son el tratamiento de elección en los casos de hipetrigliceridemia6. Los efectos sobre el colesterol son más variables, dependiendo del fenotipo lipídico basal, y oscilan en general entre un 5 y un 20%. Los fibratos pueden incrementar el cHDL entre un 5 y un 20%, y este aumento es menor en la población diabética.
El fenofibrato disminuye los triglicéridos al disminuir la secreción hepática de las VLDL y facilitar el aclaramiento de estos7. Por medio del PPARα, el fenofibrato estimula la producción de LPL y de apo AV y reduce la producción por parte del hígado de la apo CIII (inhibidora de la LPL). Así, se aumenta la lipólisis y el aclaramiento plasmático de las partículas más aterogénicas ricas en triglicéridos, que son las VLDL y las IDL (lipoproteínas de intensidad intermedia). Además, el fenofibrato favorece la absorción hepática de AGL y su betaoxidación, inhibiendo su síntesis de novo mediante la reducción de la actividad de la ácido graso sintasa y la acetil-CoA carboxilasa. Con ello se reduce la disponibilidad de AGL para la síntesis de triglicéridos.
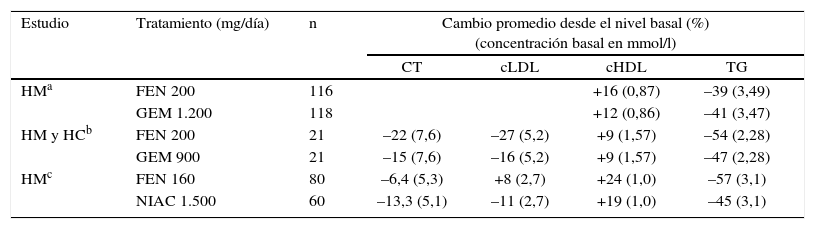
Resultados comparativos sobre el perfil lipídico global.
| Estudio | Tratamiento (mg/día) | n | Cambio promedio desde el nivel basal (%) (concentración basal en mmol/l) | |||
| CT | cLDL | cHDL | TG | |||
| HMa | FEN 200 | 116 | +16 (0,87) | –39 (3,49) | ||
| GEM 1.200 | 118 | +12 (0,86) | –41 (3,47) | |||
| HM y HCb | FEN 200 | 21 | –22 (7,6) | –27 (5,2) | +9 (1,57) | –54 (2,28) |
| GEM 900 | 21 | –15 (7,6) | –16 (5,2) | +9 (1,57) | –47 (2,28) | |
| HMc | FEN 160 | 80 | –6,4 (5,3) | +8 (2,7) | +24 (1,0) | –57 (3,1) |
| NIAC 1.500 | 60 | –13,3 (5,1) | –11 (2,7) | +19 (1,0) | –45 (3,1) | |
cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; CT: colesterol total; FEN: fenofibrato; GEM: gemfibrozilo; HC: hiperlipemia combinada; HM: hiperlipemia mixta; NIAC: niacina; TG: triglicéridos.
El fenofibrato aumenta el cHDL de forma variable, en general entre un 5 y un 20% gracias a la estimulación directa de la síntesis hepática de las apo AI y AII. La activación del PPARα por fenofibrato acrecienta los valores de cHDL por medio de la síntesis hepática de apo AI y AII, que son las principales apolipoproteínas de las partículas HDL. El tratamiento con fenofibrato aumenta los valores de partículas HDL nacientes (pre-βi-HDL)8. Las partículas pre-βi-HDL son producidas por los hepatocitos y por las células de la mucosa intestinal, y son el primer aceptor del colesterol celular y, por tanto, elementos clave en el transporte reverso del colesterol.
El fenofibrato disminuye la concentración de cLDL y favorece un cambio cualitativo de las partículas LDL, produciendo el aumento de su tamaño y la disminución de su densidad, por lo que disminuye la proporción de partículas pequeñas y densas características de los pacientes con dislipemia aterogénica. Por medio de la disminución de la apo B y la modulación de la síntesis y catabolismo de las VLDL, el fenofibrato potencia el aclaramiento de las LDL e induce la formación de partículas LDL con mayor afinidad por el receptor LDL, que son más rápidamente catabolizadas9,10.
Recomendación
Los fibratos se consideran el tratamiento de primera elección para disminuir los valores de triglicéridos, y así tratar la hipertrigliceridemia aislada en los pacientes de alto riesgo cardiovascular. Es decir, se consideran indicados formalmente. Los fibratos también se consideran una indicación de primera elección en los pacientes en situación de riesgo de pancreatitis, por presentar una hipertrigliceridemia grave.
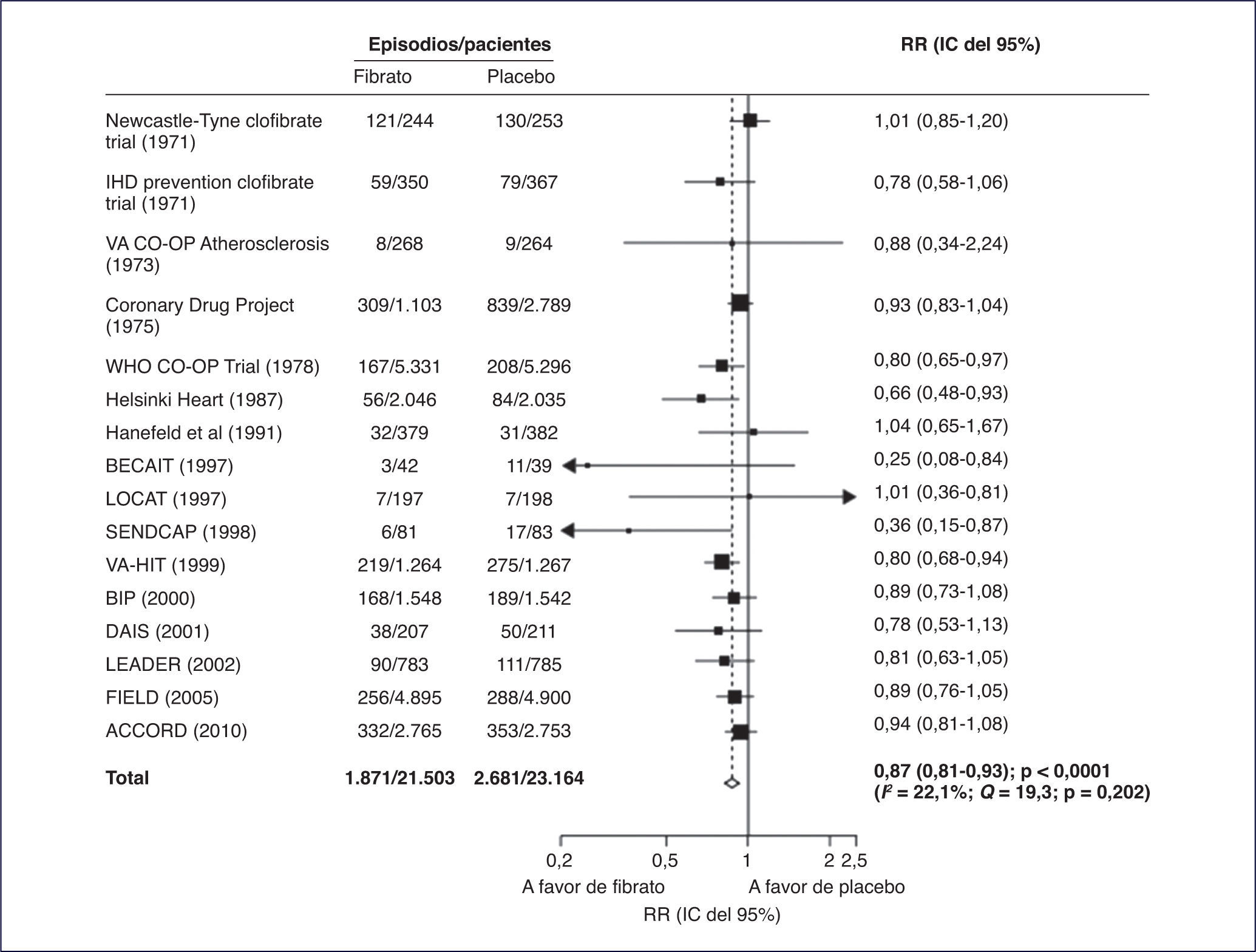
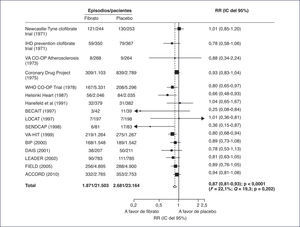
En el principal metaanálisis realizado sobre el efecto de los fibratos en prevención cardiovascular, se incluyeron 18 ensayos clínicos prospectivos y aleatorizados de prevención cardiovascular, que proporcionaron datos de 45.058 participantes y 2.870 episodios cardiovasculares mayores, 4.552 episodios coronarios y 3.880 muertes1. Se observó que el tratamiento con fibratos disminuye un 10% el riesgo de sufrir un episodio de enfermedad cardiovascular mayor (intervalo de confianza [IC] del 95%, 0-18; p = 0,048), pero el riesgo coronario fue el que experimentó una mayor disminución mediante el tratamiento con fibratos, un 13% (riesgo relativo [RR]: 0,87; IC del 95%, 0,81-0,93; p < 0,0001), sin que existiera evidencia de heterogeneidad. No se observó un efecto significativo sobre la mortalidad por todas las causas, la mortalidad cardiovascular o el ictus, pero sí frente a la necesidad de revascularización coronaria.
Según los autores del metaanálisis, si bien la disminución del riesgo cardiovascular de un 10% es inferior a la observada con otras medidas de prevención cardiovascular, esta es adecuada en cuanto a la relación coste-efectividad y al número necesario a tratar, teniendo en cuenta que se trata de poblaciones de alto riesgo, en las que el número absoluto de episodios evitados es alto. Así, por ejemplo, en el estudio ACCORD, por cada 20 pacientes tratados con fenofibrato durante 5 años se evitaba 1 episodio de enfermedad cardiovascular2.
En el metaanálisis de Jun et al1, la prevención secundaria de la enfermedad cardiovascular fue objeto de 12 estudios, la prevención primaria de 4 y el resto incluyó a ambas. En un análisis de metarregresión univariado del mencionado metaanálisis, el mayor beneficio en prevención cardiovascular con el tratamiento con fibratos se observó en los pacientes que experimentaron una disminución de los triglicéridos (p = 0,026) y la magnitud del efecto preventivo fue proporcional al grado de descenso de estos. Un descenso de los triglicéridos de 0,1 mmol/l se traducía en un 5% de disminución del riesgo de enfermedad cardiovascular3.
En distintos metaanálisis ha quedado bien demostrado que el efecto preventivo de los fibratos frente a la enfermedad cardiovascular es más acusado en los pacientes con hipertrigliceridemia o déficit de cHDL y en los pacientes con dislipemia aterogénica, ya sea en el paciente diabético o en el no diabético3
Atendiendo a este mayor beneficio de los fibratos en los pacientes con exceso de triglicéridos o déficit de cHDL, Lee et al realizaron una revisión sistemática de los ensayos clínicos en los que se incluyeron pacientes con dislipemia aterogénica tratados con estos fármacos. Se incluyeron 6 ensayos clínicos controlados con placebo. El mayor beneficio de los fibratos se observó en los 7.389 pacientes con hipertrigliceridemia, en los que los fibratos disminuyeron el riesgo cardiovascular un 25% (RR: 0,75; IC del 95%, 0,65-0,86; p < 0,001), y en los 5.068 pacientes con hipertrigliceridemia y déficit de cHDL (RR: 0,71; IC del 95%, 0,62-0,82; p < 0,001). Se observó un beneficio no tan acusado en los 15.303 pacientes con déficit de cHDL sin hipertrigliceridemia (RR: 0,84; IC del 95%, 0,77-0,91; p < 0,001) y una ausencia de beneficio en los que no presentaron ni un déficit de cHDL ni una hipertrigliceridemia4.
Un aspecto destacable del metaanálisis de Lee et al es que, al igual que se observó en el previamente citado de Jun et al1, el efecto preventivo de los fibratos se observó de forma similar en los pacientes con enfermedad cardiovascular, como en los que carecían de este antecedente.
En síntesis, las revisiones y metaanálisis presentados, que incluyen grandes ensayos clínicos de prevención primaria controlados con placebo en población con hipercolesterolemia, diabética y no diabética, como el Helsinky Heart Study5, y en población diabética, como el FIELD6 y el ACCORD2, demuestran que el tratamiento con un fibrato disminuye el riesgo de enfermedad cardiovascular en el primero, en el conjunto de la población estudiada, y en los 2 restantes en los pacientes con dislipemia aterogénica. En los grandes metaanálisis, como el de Jun et al1, se observa que el efecto preventivo de los fibratos ocurre tanto en la población isquémica como en la no isquémica. En el mismo sentido, en el metaanálisis de Lee et al4 de los grandes ensayos clínicos con fibratos que han incluido pacientes con dislipemia aterogénica, se observó que el efecto preventivo de los fibratos en pacientes isquémicos y no isquémicos se evidencia en los pacientes con hipertrigliceridemia, con déficit de cHDL o con ambas alteraciones, pero no en los pacientes sin ninguna de ellas. En dicho metaanálisis, el efecto preventivo de los fibratos se mantenía al separar los ensayos de prevención primaria y los de prevención secundaria.
Recomendación
La indicación de tratamiento con fibratos para la prevención primaria de la enfermedad cardiovascular se puede considerar en los pacientes de alto riesgo cardiovascular con dislipemia aterogénica que presentan un cLDL o un colesterol no HDL normal, en general tras el tratamiento con una estatina. Ya que se trata de análisis subrogados de grandes ensayos clínicos, la calidad de la evidencia puede definirse como de clase B y establecerse una recomendación II B.
Las revisiones y metaanálisis presentados, que incluyen grandes ensayos clínicos de prevención secundaria controlados con placebo, como el BIP1 y el VA-HIT2, demuestran que el tratamiento con un fibrato disminuye el riesgo de enfermedad cardiovascular en los pacientes isquémicos, en el primero en el conjunto de la población estudiada y en el segundo en los pacientes con dislipemia aterogénica. Igual que ha sido comentado para la prevención primaria, en los grandes metaanálisis, como el de Jun et al3, se observa que el efecto preventivo de los fibratos ocurre también en la población isquémica y que este es más acusado en los pacientes con dislipemia aterogénica. En el metaanálisis de Lee et al4, de los grandes ensayos clínicos con fibratos en los que se han incluido pacientes con dislipemia aterogénica, igual que ha sido referido para la prevención primaria, se observó que el efecto preventivo de los fibratos en los pacientes isquémicos se evidencia en los pacientes con hipertrigliceridemia, con déficit de cHDL o con ambas alteraciones, pero no en los pacientes sin ninguna de ellas.
Ya que se trata de análisis subrogados de grandes ensayos clínicos, la calidad de la evidencia puede definirse como de clase B y establecerse una recomendación II B, en consonancia con la indicación de “considerar” el tratamiento con fibratos en los pacientes isquémicos con dislipemia aterogénica que presentan un cLDL o un colesterol no HDL normal, en general tras el tratamiento con una estatina, recogida en las guías europeas5.
Recomendación
La indicación de tratamiento con fibratos para la prevención secundaria de la enfermedad cardiovascular se puede considerar en los pacientes con dislipemia aterogénica que presentan un cLDL o un colesterol no HDL normal, en general tras el tratamiento con una estatina. Ya que se trata de análisis subrogados de grandes ensayos clínicos, la calidad de la evidencia puede definirse como de clase B y establecerse una recomendación II B.
En los pacientes diabéticos es muy prevalente la dislipemia aterogénica, por lo que se considera imprescindible realizar un perfil lipídico inicial y periódico para controlar la dislipemia cuando está presente.
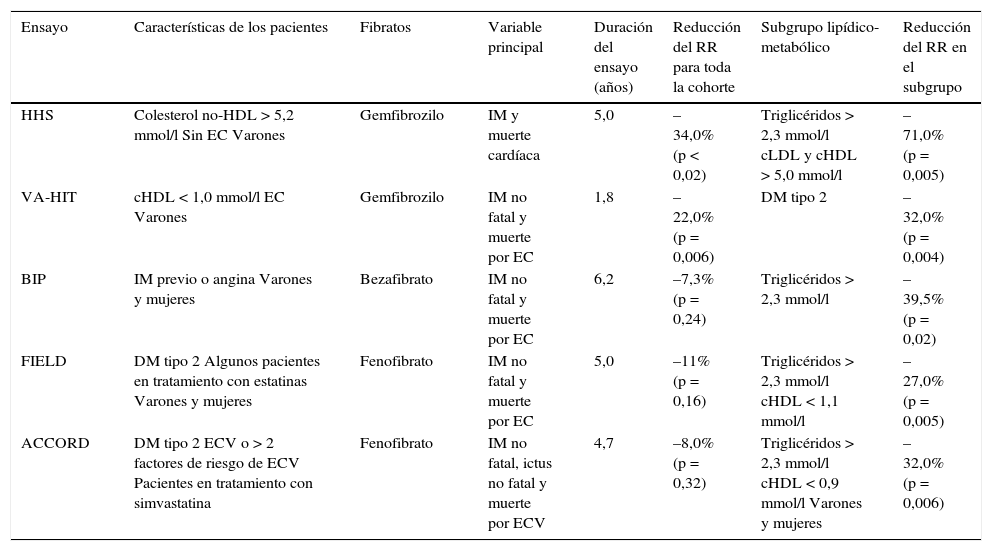
Resultados con fibratos en los grandes ensayos clínicos de prevención cardiovascular.
| Ensayo | Características de los pacientes | Fibratos | Variable principal | Duración del ensayo (años) | Reducción del RR para toda la cohorte | Subgrupo lipídico-metabólico | Reducción del RR en el subgrupo |
|---|---|---|---|---|---|---|---|
| HHS | Colesterol no-HDL > 5,2 mmol/l Sin EC Varones | Gemfibrozilo | IM y muerte cardíaca | 5,0 | –34,0%(p < 0,02) | Triglicéridos > 2,3 mmol/l cLDL y cHDL > 5,0 mmol/l | –71,0%(p = 0,005) |
| VA-HIT | cHDL < 1,0 mmol/l EC Varones | Gemfibrozilo | IM no fatal y muerte por EC | 1,8 | –22,0%(p = 0,006) | DM tipo 2 | –32,0%(p = 0,004) |
| BIP | IM previo o angina Varones y mujeres | Bezafibrato | IM no fatal y muerte por EC | 6,2 | –7,3%(p = 0,24) | Triglicéridos > 2,3 mmol/l | –39,5%(p = 0,02) |
| FIELD | DM tipo 2 Algunos pacientes en tratamiento con estatinas Varones y mujeres | Fenofibrato | IM no fatal y muerte por EC | 5,0 | –11%(p = 0,16) | Triglicéridos > 2,3 mmol/l cHDL < 1,1 mmol/l | –27,0%(p = 0,005) |
| ACCORD | DM tipo 2 ECV o > 2 factores de riesgo de ECV Pacientes en tratamiento con simvastatina | Fenofibrato | IM no fatal, ictus no fatal y muerte por ECV | 4,7 | –8,0%(p = 0,32) | Triglicéridos > 2,3 mmol/l cHDL < 0,9 mmol/l Varones y mujeres | –32,0%(p = 0,006) |
cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; DM: diabetes mellitus; EC: enfermedad coronaria; ECV: enfermedad cardiovascular; HDL: lipoproteínas de alta densidad; IM: infarto de miocardio; RR: riesgo relativo.
Modificada de Watts et al. Heart. 2011;97:350-6.
Dejando al margen que la modificación del estilo de vida forma parte de las medidas iniciales e imprescindibles, un tratamiento con estatinas se encuentra indicado como primera alternativa farmacológica, empleando dosis moderadas en los diabéticos sin antecedentes de enfermedad cardiovascular, salvo que mantengan otros factores de riesgo, en cuyo caso se emplearán dosis altas1. En los pacientes con enfermedad cardiovascular previa de cualquier localización, el tratamiento será siempre intensivo con valores exigentes para el objetivo de cLDL, específicamente < 100 mg/dl de forma general en diabéticos y < 70 mg/dl si existe lesión en órganos diana, acumulación de factores de riesgo mayores o enfermedad cardiovascular previa1. Naturalmente, la selección de una estatina concreta y de su dosis dependerá de la cifra basal de cLDL, la tolerabilidad o los efectos secundarios.
Dado que la dislipemia asociada a la diabetes mellitus se caracteriza por un aumento de triglicéridos y un descenso del cHDL, los fibratos se han de considerar como fármacos adecuados para esta. Sin embargo, en la población diabética global no se recomienda el empleo de una terapia combinada estatina + fibrato. No obstante, en los pacientes diabéticos con triglicéridos > 204 mg/dl y cHDL < 34 mg/dl se puede considerar la asociación de estatina + fenofibrato, porque ha demostrado eficacia y beneficio clínico. La combinación con otro fibrato (gemfibrocil) tiene un alto riesgo de efectos adversos: riesgo elevado de elevación enzimàtica, miositis, rabdomiositis o deterioro de la función renal2, por lo que se encuentra contraindicada. Otras combinaciones, como por ejemplo la de estatina con niacina, son sin beneficio adicional y pueden incrementar el riesgo de ictus.
En estos pacientes diabéticos, una hipertrigliceridemia intensa (> 1.000 mg/dl) se ha de tratar con fibratos y/o ácidos grasos omega-3, con el objeto de recurrir el riesgo de pancreatitis aguda3. Si ya se encuentran en tratamiento con estatinas, el fibrato de elección es el fenofibrato.
No existen evidencias convincentes para el empleo de fármacos específicos en monoterapia con el objeto de elevar el cHDL, dado que el descenso de cHDL se encuentra asociado a la hipertrigliceridemia con extraordinaria frecuencia (en un 50% de los casos)4.
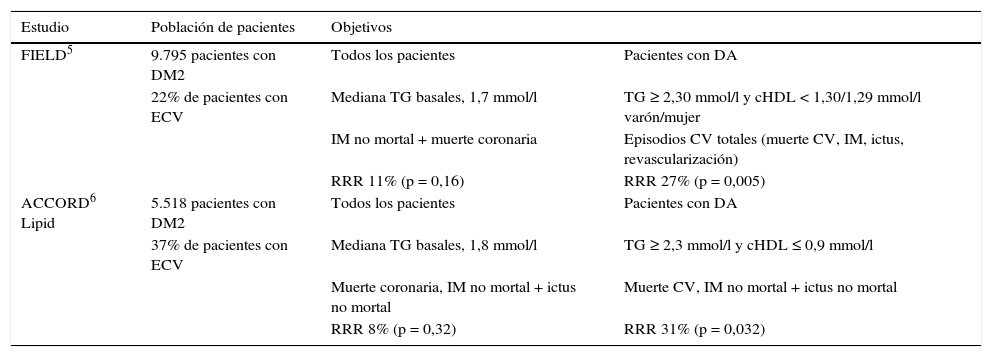
Con respecto al empleo de fenofibrato en la población diabética, existen 2 grandes estudios de intervención: el estudio FIELD5 y el estudio ACCORD6.
En el estudio FIELD, después de 5 años de seguimiento de pacientes diabéticos tratados con fenofibrato que no estaban tratados con estatinas en el inicio del estudio, se produjo una reducción no significativa (11%) de accidentes coronarios (fatales y no fatales), pero una reducción significativa (11%) en el número total de accidentes cardiovasculares (muerte de origen cardiovascular, infarto, ictus, revascularización), principalmente en relación con la reducción de infartos no fatales (reducción del 24%) y revascularizaciones. El análisis de subgrupos permitió identificar a los pacientes con triglicéridos > 150 mg/dl y cHDL < 40 mg/dl, en los que se produjeron reducciones significativas de muerte de origen cardiovascular (14%), infarto de miocardio (13%) y revascularización (27%).
Un efecto adicional muy llamativo y significativo observado en el estudio FIELD fue la menor progresión de albuminuria y la necesidad de tratamiento con láser de la retinopatía, lo que sugiere decididamente un beneficio en las complicaciones microvasculares del diabético.
En el estudio ACCORD, con una media de seguimiento de 4,7 años, los pacientes diabéticos eran tratados con estatina (simvastatina), con o sin fenofibrato adicional. Se produjo la reducción de un 8% en el objetivo compuesto de infarto o ictus no fatal y muerte de origen cardiovascular. Sin embargo, en los pacientes con dislipemia aterogénica (triglicéridos > 204 mg/dl y cHDL > 34 mg/dl), que suponían un 17% de los pacientes incluidos en el estudio, la reducción fue del 31%, estadísticamente significativa, en el objetivo combinado de muerte cardiovascular, infarto de miocardio o ictus, y el número de pacientes necesario de tratar para evitar un evento fue 206.
Por tanto, el tratamiento con fenofibrato no reduce los accidentes cardiovasculares en la población diabética en la que los triglicéridos no se encuentran elevados. Sin embargo, el fenofibrato reduce significativamente los accidentes cardiovasculares en los pacientes diabéticos con dislipemia aterogénica7. De esta forma, el empleo de un fibrato asociado a la estatina en los pacientes diabéticos está justificado cuando se encuentra presente la dislipemia aterogénica, y esto es de una aceptación generalizada y recomendación expresa, particularmente cuando la hipertrigliceridemia es llamativa. La reducción del riesgo de accidentes coronarios con el empleo de un fibrato en pacientes diabéticos con dislipemia aterogénica es, aproximadamente, de un 35%7, cuando se analizan de forma conjunta los estudios con fibratos (FIELD, ACCORD, BIP, VA-HIT, HHS). Es una combinación bien tolerada cuando se emplea fenofibrato, aumentando los efectos adversos con gemfibrocilo.
Resultados del tratamiento con fenofibrato en los pacientes con diabetes mellitus (DM).
| Estudio | Población de pacientes | Objetivos | |
|---|---|---|---|
| FIELD5 | 9.795 pacientes con DM2 | Todos los pacientes | Pacientes con DA |
| 22% de pacientes con ECV | Mediana TG basales, 1,7 mmol/l | TG ≥ 2,30 mmol/l y cHDL < 1,30/1,29 mmol/l varón/mujer | |
| IM no mortal + muerte coronaria | Episodios CV totales (muerte CV, IM, ictus, revascularización) | ||
| RRR 11% (p = 0,16) | RRR 27% (p = 0,005) | ||
| ACCORD6 Lipid | 5.518 pacientes con DM2 | Todos los pacientes | Pacientes con DA |
| 37% de pacientes con ECV | Mediana TG basales, 1,8 mmol/l | TG ≥ 2,3 mmol/l y cHDL ≤ 0,9 mmol/l | |
| Muerte coronaria, IM no mortal + ictus no mortal | Muerte CV, IM no mortal + ictus no mortal | ||
| RRR 8% (p = 0,32) | RRR 31% (p = 0,032) | ||
cHDL: colesterol unido a lipoproteínas de alta densidad; CV: cardiovascular; DA: dislipemia aterogénica; ECV: enfermedad cardiovascular; IM: infarto de miocardio; RRR: reducción del riesgo relativo; TG: triglicéridos.
Un metaanálisis de 18 ensayos clínicos aleatorizados con fibratos, que incluye a más de 45.000 pacientes, muestra una reducción significativa global del riesgo relativo del 10% para accidentes cardiovasculares mayores y del 13% para accidentes coronarios. Esto sugiere de forma inequívoca que los fibratos pueden tener un papel importante en la prevención del riesgo en pacientes con alto riesgo cardiovascular1. Un metaanálisis subsiguiente, que buscaba el efecto de los fibratos en los pacientes de alto riesgo con elevación de triglicéridos y descenso de cHDL, muestra un mayor beneficio cuando este patrón de dislipemia se encuentra presente, con una reducción del riesgo relativo del 29%2
Los resultados del estudio ACCORD son contundentes en la demostración de un incremento de riesgo (evaluado en un 71% superior) en los pacientes que, a pesar de tener el cLDL controlado merced a una estatina, mantienen cifras elevadas de triglicéridos y/o bajas de cHDL. En consecuencia, el tratamiento de este riesgo residual lipídico asociando fenofibrato a la estatina puede ofrecer resultados significativos en reducir el riesgo residual. Este beneficio se puede deber a distintos efectos sobre la concentración de las lipoproteínas aterogénicas ricas en triglicéridos y remanentes, que contienen apo B, así como sobre su tamaño; hechos que pueden ser determinantes de su penetración en la pared arterial y su unión a la matriz conectiva, con la consiguiente contribución a la formación y desarrollo de la placa ateromatosa3.
Dado que en una considerable proporción de pacientes de alto riesgo (calculado por métodos estandarizados o por la agrupación de factores de riesgo) no se consigue alcanzar un control del cLDL, aun manteniendo dosis máximas de estatina o empleando una combinación de estatina con ezetimiba, los expertos han señalado que en estas circunstancias los pacientes con aumento de triglicéridos y/o descenso de cHDL son candidatos a un tratamiento adicional con fenofibrato31, que es el fármaco de elección comparado con cualquier otro fibrato (por una interacción farmacológica más segura)4.
Este abordaje terapéutico se puede ofrecer en prevención primaria a los pacientes que tienen dislipemia aterogénica y un alto riesgo de origen cardiometabólico o en los que se ha constatado una arteriesclerosis subclínica. Pero es mucho más útil en prevención secundaria o en los pacientes diabéticos, tal y como se indica previamente. No obstante, es preciso señalar que el concepto de prevención primaria o de prevención secundaria es un tanto arbitrario cuando existen factores de riesgo de importante repercusión5 y si consideramos el proceso aterosclerótico como un proceso continuo y progresivo. En este sentido, el empleo de un fibrato está más determinado por la preexistencia de una dislipemia aterogénica6 o la lesión de órganos diana7, según se señala en las diferentes guías de práctica clínica.
En la práctica, muchos enfermos sin historia previa de enfermedad vascular, pero con dislipemia aterogénica y síndrome metabólico, obesidad visceral o diabetes mellitus (tal y como se señala en el apartado anterior) son susceptibles de emplear una terapia combinada estatina-fenofibra-to, y los triglicéridos, el cHDL y particularmente el colesterol no HDL (30 mg/dl más del objetivo de cLDL) se consideran como objetivos secundarios de la terapia hipolipemiante. El fenofibrato se puede emplear para reducir el riesgo residual asociado al aumento de triglicéridos (> 200 mg/dl) o al descenso de cHDL. En estos pacientes, una combinación de dosis fija de estatina y fenofibrato puede mejorar la adherencia terapéutica3
¿Cuándo emplear un fibrato como agente hipolipemiante de segunda línea?El fenofibrato se emplea, de forma habitual, para el tratamiento del riesgo residual cuando está presente la dislipemia aterogénica. Las indicaciones aprobadas por la EMA (European Medicines Agency)1 son básicamente 3:
- •
Hipertrigliceridemia grave, con o sin valores bajos de cHDL.
- •
Hiperlipemia mixta, cuando la estatina se encuentra contraindicada o no se tolera.
- •
Hiperlipemia mixta en pacientes con alto riesgo cardiovascular, además de una estatina, cuando no se encuentran controlados los valores de triglicéridos y cHDL.
Los análisis de resultados agrupados han mostrado que la asociación de una estatina con fenofibrato mejora el perfil lipídico global de los pacientes con dislipemia aterogénica2,3. En consecuencia, el fenofibrato se puede emplear en primera o segunda línea (e incluso en tercera) inicialmente en monoterapia o bien asociado a fármacos hipocolesterolemiantes, muy particularmente en los casos de aumento de triglicéridos y descenso del cHDL en pacientes de alto o muy alto riesgo según las guías4
El fenofibrato se puede emplear en monoterapia en los pacientes con hipertrigliceridemia grave (> 500 mg/dl), con el objeto de prevenir episodios de pancreatitis aguda. También en primera línea en los pacientes con resistencia a la insulina y dislipemia aterogénica, aun con cifras normales de cLDL. Además, también se empleará como fármaco de primera línea en prevención primaria y secundaria de accidentes cardiovasculares en los pacientes con intolerancia o resistencia a estatinas y que tienen un alto o muy alto riesgo cardiovascular, aunque la hipertrigliceridemia sea solo moderada. De hecho, en los pacientes con efectos adversos por estatinas, las recomendaciones europeas5 señalan que la adición de ezetimiba con fenofibrato (no gemfibrocil) puede ser una opción de segunda o tercera línea para alcanzar objetivos en cLDL.
También se empleará fenofibrato como fármaco de segunda y tercera línea en los pacientes sin cLDL en objetivos y que mantengan cifras elevadas de triglicéridos, con o sin descenso del cHDL figura 1.
Recomendación
Los fibratos se pueden emplear como fármacos de primera línea en pacientes intolerantes a las estatinas y que tienen alto o muy alto riesgo cardiovascular. El fenofibrato se empleará como fármaco de segunda línea en pacientes con estatinas y cLDL en objetivos, pero en los que persistan triglicéridos > 200 mg/dl o dislipemia aterogénica residual. El fenofibrato también se puede emplear como fármaco de tercera línea en pacientes tratados con estatinas y ezetimiba y con cLDL en objetivo, pero que mantengan cifras de triglicéridos > 200 mg/dl o dislipemia aterogénica residual.