La hipoxia participa en el desarrollo de enfermedades cardiovasculares por la regulación coordinada de múltiples genes, incluidos aquellos implicados en la síntesis/reparación de la matriz extracelular (MEC). La lisil oxidasa (LOX), enzima implicada en la maduración de la MEC, parece tener un papel clave en el mantenimiento de la homeostasis del endotelio. Nuestro objetivo fue determinar si la hipoxia modula la expresión de la LOX en células endoteliales.
MétodosLa expresión de LOX en células endoteliales bovinas de aorta (BAEC) y humanas de vena de cordón umbilical (HUVEC) se determinó mediante PCR a tiempo real. La actividad enzimática de LOX se analizó mediante un método fluorimétrico de alta sensibilidad y la actividad transcripcional de LOX, mediante estudios de transfección transitoria.
ResultadosLa hipoxia (1% de O2) incrementó la expresión de LOX en células BAEC y HUVEC (aproximadamente, 3 veces) en condiciones en que este estímulo indujo los valores del factor inducible por hipoxia-1α (HIF-1α), la expresión de VEGF y la formación de neovasos. Este efecto se asoció a un aumento en la actividad enzimática LOX.
Análogamente, la incubación de células endoteliales con dimetil oxal glicina, inhibidor de prolil hidroxilasas, incrementó la concentración de ARNm de LOX. La inhibición de la transcripción con 5,6-diclorobencimidazol previno este efecto, lo que indica la implicación de un mecanismo transcripcional. Mediante estudios de transfección transitoria determinamos que tanto la hipoxia como la sobreexpresión de HIF-1α incrementa la actividad del promotor de LOX de forma similar.
ConclusionesLa hipoxia induce la expresión y la actividad de LOX en células endoteliales por un mecanismo transcripcional en el que estaría implicado HIF-1.
Hypoxia actively participates in the pathogenesis of cardiovascular diseases through the coordinate regulation of several genes including those involved in extracellular matrix (ECM) synthesis/repair. Lysyl oxidase (LOX) is an enzyme involved in the maturation of ECM that seems to play a key role in the maintenance of endothelial homeostasis. Our aim was to determine if hypoxia could modulate endothelial LOX expression.
MethodsLOX expression in bovine aortic endothelial cells (BAEC) and human umbilical cord vein endothelial cells (HUVEC) was assessed by real time PCR. LOX activity was evaluated by a fluorimetric method and LOX transcriptional activity by means of transient transfection studies.
ResultsHypoxia (1% O2) increased LOX expression in both BAEC and HUVEC in conditions in which HIF-1α levels, VEGF expression and neovessel formation were induced. We observed that this effect was associated to a significant increase in LOX enzymatic activity. Similarly, stimulation of endothelial cells with dimethyl-oxal-glycine, an inhibitor of prolyl hydroxylases, augmented mRNA LOX levels. Transcription inhibition with 5,6-dichlorobenzimidazole prevented this effect, suggesting the involvement of a transcripcional mechanism. In agreement, transient transfection studies demonstrated that both hypoxia and HIF-1α over-expression induced LOX transcripcional activity to a similar extent.
ConclusionsHypoxia induces LOX expression and activity in endothelial cells through an HIF-1-dependent transcriptional mechanism.
La lisil oxidasa (LOX) es una aminooxidasa dependiente de cobre que inicia el ensamblaje covalente de las fibras de colágeno y elastina de la matriz extracelular (MEC). Este enzima cataliza la desaminación oxidativa de residuos de lisina e hidroxilisina dando lugar a la formación de peptidil semialdehídos altamente reactivos que condensan entre sí formando enlaces tanto intramoleculares como intermoleculares1–3. De este modo, la actividad de LOX determina las propiedades mecánicas de la MEC y asegura su integridad, estabilidad y correcto funcionamiento. La LOX se sintetiza en forma de proenzima que, secretada al espacio extracelular, se proteoliza y libera el propéptido de la enzima y la forma madura y catalíticamente activa3.
La generación de animales deficientes en LOX ha revelado su papel clave en el desarrollo y la funcionalidad del sistema cardiovascular. Las graves alteraciones vasculares y la mortalidad perinatal de estos animales indican que LOX tendría un papel único y clave en el mantenimiento de la homeostasis vascular4. En este sentido, los análisis inmunohistoquímicos muestran una expresión muy prominente de la LOX en el endotelio vascular5. De hecho, nuestros estudios previos indican que la inhibición de la actividad/expresión de la LOX estaría relacionada con la disfunción endotelial desencadenada por factores de riesgo aterosclerótico y por citocinas proinflamatorias, lo que indica la implicación de esta enzima en la fisiopatología de la enfermedad aterosclerótica6–9.
La progresión de la lesión aterosclerótica lleva implícita la generación de regiones de hipoxia intraplaca10,11 que promueven una respuesta adaptativa que implica la regulación de múltiples procesos, incluidas la angiogénesis, la transición epitelio-mesenquimal (EMT), la proliferación celular y la apoptosis, entre otros12,13. En esta respuesta adaptativa el factor inducible por hipoxia-1 (HIF-1) es causal de la regulación coordinada de múltiples genes, entre los que se incluyen los implicados en la síntesis/degradación de la MEC12–14. En este trabajo hemos analizado la regulación de la LOX por hipoxia en células endoteliales y hemos caracterizado la implicación del factor HIF-1 en este fenómeno.
Material y métodosCultivo celularLas células endoteliales de aorta bovina (BAEC) se obtuvieron a partir de animales adultos normolipémicos mediante digestión con colagenasa, tal y como se describió previamente15. Las células se cultivaron en medio M199 (GIBCO), suplementado con el 10% de suero fetal bovino inactivado por calor (FCS) (Biological Industries), antibióticos (0,1mg/ml de estreptomicina y 100 U/ml de penicilina G) y 2mmol/l de L-glutamina. Las células endoteliales humanas de vena de cordón umbilical (HUVEC) se cultivaron en medio M199 (Biological Industries) suplementado con 20mmol de Hepes (pH, 7,4), el 20 % de FCS, 1mmol de piruvato sódico (Biological Industries), 30μg/ml de suplemento de crecimiento para células endoteliales (ECGS) (Upstate Reactiva), 100μg/ml de heparina (SIGMA), antibióticos y glutamina. Las células se usaron entre los pases 3 y 5. Cuando las células alcanzaban un 80% de confluencia (aproximadamente, 48h), se reemplazaba el medio de cultivo y las células se mantenían en condiciones de normoxia (el 21% de O2, el 5% de CO2 y el 95% de humedad) o se sometían a hipoxia (el 1% de O2, el 5% de CO2 y equilibrado con N2) durante diferentes periodos.
Extracción de ARNEl ARN total procedente de las células en cultivo se aisló mediante el reactivo Ultraspec (Biotecx) según las instrucciones del fabricante. La concentración y la pureza del ARN se determinaban a partir de la absorbancia a 260nm y de la relación de absorbancia 260nm/280nm, respectivamente.
PCR a tiempo realSe retranscribió 1μg de ARN total utilizando el High Capacity cDNA Reverse Transcription Kit (Applied Biosystems). La cuantificación de los valores relativos de ARNm de la LOX y del VEGF se realizó mediante PCR a tiempo real utilizando el sistema ABIPRISM 7900 (Applied Biosystems) y oligonucleótidos y sondas TaqmanTM específicas proporcionados por el sistema Assay-on-DemandTM (Applied Biosystems), tal y como se describió previamente16. Los valores de expresión de la proteína de unión a TATA (TBP, TATA-binding protein) se usaron para normalizar los resultados.
Actividad de lisil oxidasaLa actividad de LOX se evaluó en el sobrenadante de BAEC mediante un ensayo fluorescente muy sensible, como se ha descrito previamente6. Para ello se sembraron 100.000 células/pozo en placas de 6 pozos. Cuando alcanzaron la confluencia, el medio se reemplazó por M199 libre de rojo fenol y de FCS y las células se sometieron a hipoxia o normoxia durante los tiempos indicados. La actividad de LOX se evaluó en 200μl de medio que se incubó en presencia y ausencia de 500μmol/l de betaaminopropionitrilo (BAPN) a 37°C durante 30min con 1 U/ml de peroxidasa de rábano, 10μmol/l de Amplex red (Molecular Probes) y 10mmol/l de 1,5-diaminopentano en 1,2mol/l de urea y 0,05mol/l de borato sódico pH 8,2. La reacción se detuvo en hielo y se determinó la diferencia en intensidad de fluorescencia (longitud de onda de excitación, 563nm; longitud de onda de emisión, 587nm) en presencia y ausencia de BAPN. Los resultados se normalizaron por el contenido de proteína celular.
Transfección transitoriaLas células BAEC se transfectaron transitoriamente con LipofectinTM (Invitrogen) y el vector reportero acoplado a luciferasa pGL3/LOX que contiene el promotor de la LOX junto al pSVβ-gal, como se describió previamente8. En los estudios de cotransfección se utilizó un vector de expresión de HIF-1α (pHIF-1α), proporcionado por el Dr. E. Huang (Departament of Health & Human Services, HIH, Bethesda, Maryland) o el correspondiente vector vacío (pcDNA3). Los complejos ADN/liposoma se añadieron a las células durante 5h. A continuación el medio se reemplazó por medio fresco y las células se mantuvieron en normoxia o se sometieron a condiciones de hipoxia durante 24h. La actividad luciferasa se determinó en el lisado celular con el Luciferase assay kit (Promega) y usando el luminómetro Orion I (Berthold Detection Systems), según las recomendaciones del fabricante. Los resultados se normalizaron por la actividad beta-galactosidasa determinada mediante el Enzyme Assay System™ (Promega).
Análisis de promotorEl promotor de la LOX se analizó en busca de posibles elementos de respuesta a hipoxia (HRE) utilizando el programa MatInspector (www.genomatix.de).
Obtención de extractos nuclearesSe cultivaron células BAEC en placas de Petri de 100mm de diámetro bajo condiciones de normoxia o hipoxia durante 24h. Las células se recogieron en tampón fosfato salino (PBS) frío y los extractos nucleares se obtuvieron usando el NucBuster Protein Extraction kit (Novagen), según las instrucciones del fabricante. La concentración proteínica de los extractos se determinó mediante el método del ácido bicinconínico (BCA), según el BCA Protein Assay (Pierce). Los extractos se alicuotaron, se congelaron en N2 y se almacenaron a –80°C hasta su utilización.
Western-blotLos extractos nucleares se resolvieron mediante electroforesis en SDS (SDS-PAGE) en condiciones reductoras. Las proteínas se transfirieron a membranas de nitrocelulosa de 0,45μmol (Bio-Rad) que se incubaron con anticuerpos contra HIF-1α (NB100-449A, Novus). Los complejos antígeno-anticuerpo se detectaron mediante la incubación con un anticuerpo secundario conjugado a peroxidada usando como sustrato el reactivo SuperSignal West Dura Extendend Duration Substrate (Thermo Scientific). Las bandas correspondientes a la proteína de interés se visualizaron mediante autorradiografía por exposición en películas CURIX RP2 PLUS (Agfa). La homogeneidad de la carga proteínica en cada carril se verificó mediante la tinción de Ponceau17.
Análisis de la formación de neovasos en MatrigelEl efecto de la hipoxia en la capacidad de formación de neovasos de BAEC se evaluó en estudios in vitro en Matrigel. Para ello se trataron placas de 24 pozos con 250μl/pozo de Matrigel (BD Biosciences) que se dejó polimerizar durante 1h a 37°C. A continuación se añadieron las células (20.000 células/pozo) en 200μl de medio. La formación de tubos se siguió mediante observación bajo microscopio invertido (18h) y las imágenes se captaron con una cámara Leica DMIRE2. La cuantificación de la longitud de los tubos formados en ambas condiciones se realizó mediante el programa de procesado de imagen Image J (National Institute of Health)18.
Análisis estadísticoLos resultados se expresan como media ± error estándar Las diferencias entre grupos se determinaron mediante ANOVA. Las diferencias se consideraron significativas a partir de p < 0,05.
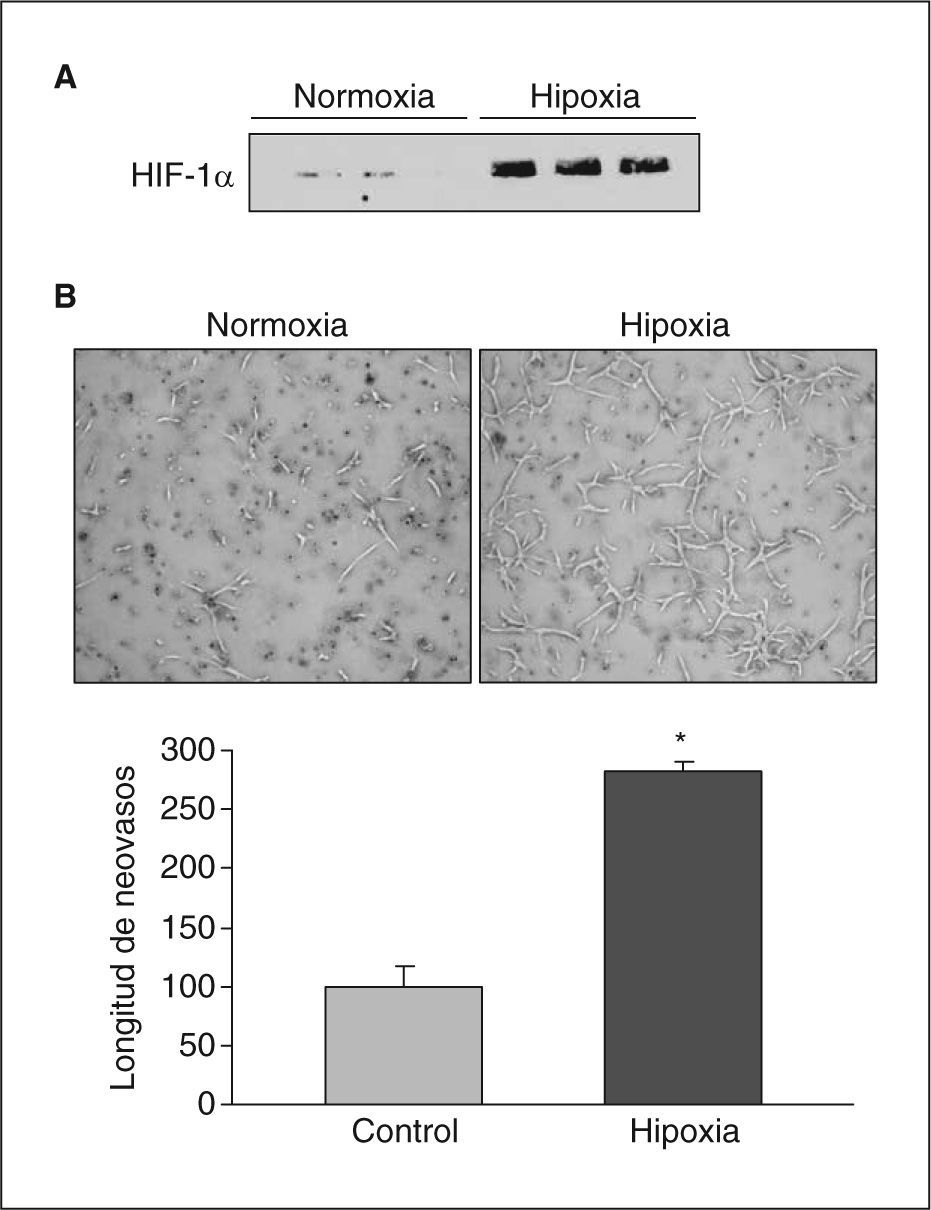
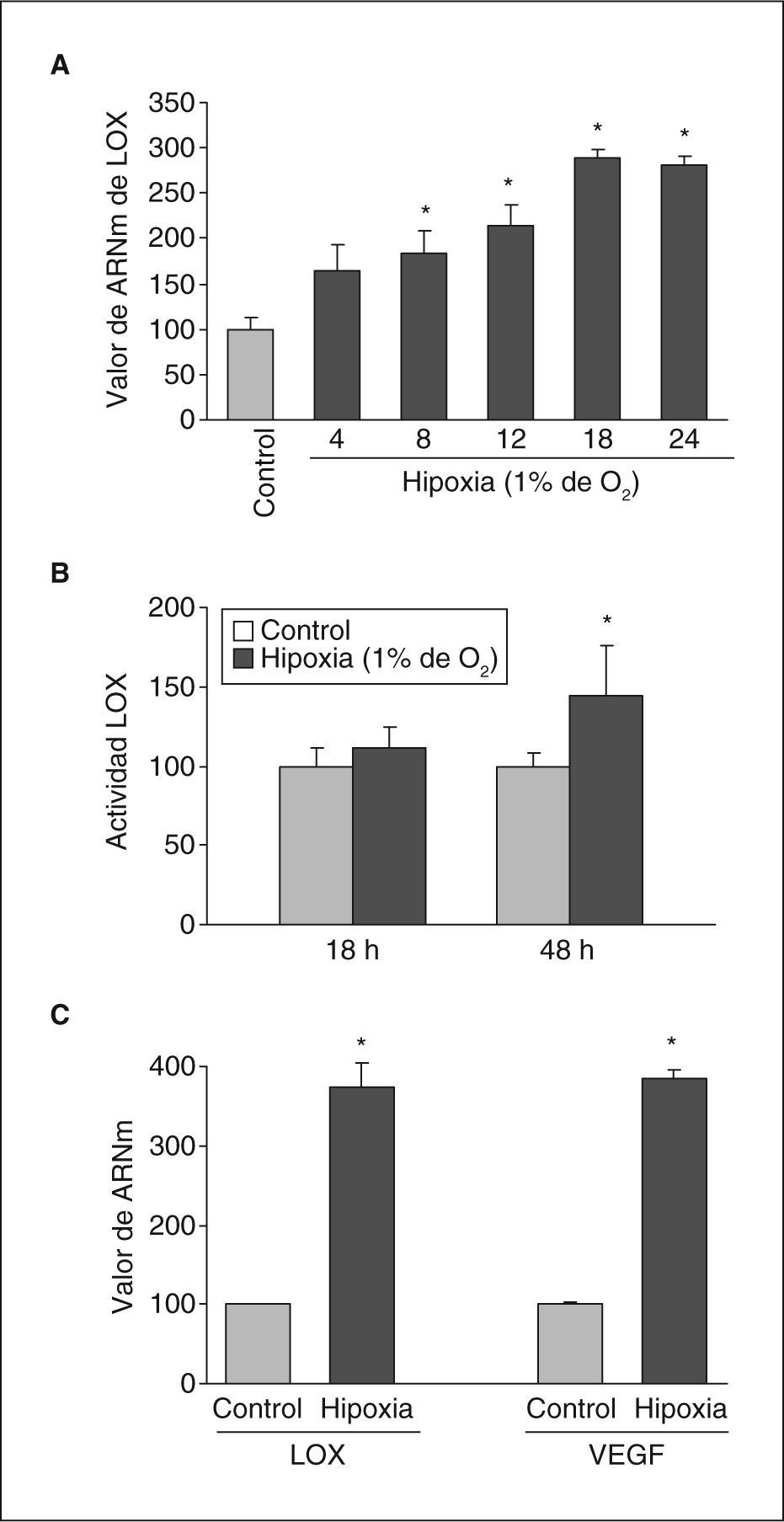
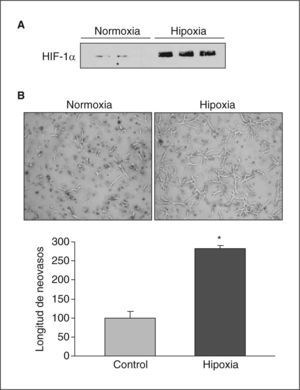
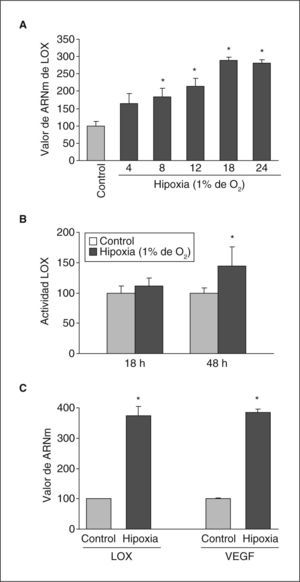
ResultadosLa hipoxia induce la expresión y la actividad de la LOX en células endotelialesSe analizó el efecto de la hipoxia en la expresión de LOX en células endoteliales. La exposición de células BAEC a hipoxia (1%, 18h) causó un incremento en los valores nucleares del factor HIF-1α (fig. 1A) e indujo la formación de neovasos en estudios en Matrigel (fig. 1B). En estas células la hipoxia aumentó la expresión de LOX de manera dependiente del tiempo de incubación, un efecto significativo al cabo de 8h de estimulación y que fue máximo al cabo de 16h (aproximadamente, 3 veces) (fig. 2A). Este efecto se tradujo en un incremento en la actividad de LOX evaluada en el sobrenadante de las células (fig. 2B). Análogamente, la hipoxia indujo la expresión de LOX en HUVEC, efecto que se acompañó por un incremento en el valor de ARNm del VEGF, que se utilizó como control positivo de respuesta a hipoxia (fig. 2C).
La hipoxia induce la expresión de HIF-1α y la formación de neovasos en Matrigel. A: se muestran las concentraciones de proteína HIF-1α analizados por Western blot en extractos nucleares de células BAEC sometidas a condiciones de normoxia o hipoxia (1% de O2) durante 24h. Se muestra una autorradiografía representativa de 3 ensayos realizados por triplicado. B: análisis de la formación de tubos en células BAEC sembradas en Matrigel mantenidas en condiciones de normoxia o hipoxia (1% de O2) durante 24h. Se muestra una imagen representativa de 3 experimentos realizados por triplicado. *p < 0,01 respecto a normoxia.
La hipoxia induce la expresión de LOX en células endoteliales. A: ensayo de dependencia del tiempo de incubación realizado en células BAEC mantenidas en condiciones de normoxia (control) o sometidas a hipoxia (1% de O2) durante los tiempos indicados. Los valores de ARNm se evaluaron mediante PCR a tiempo real. Los resultados, normalizados por el gen control (TBP), se expresan como la media ± error estándar de 3 experimentos independientes realizados por triplicado. B: grado de actividad de LOX evaluado en el sobrenadante de células BAEC mantenidas en condiciones de normoxia (control) o sometidas a hipoxia (1% de O2) durante los tiempos indicados. El resultado se expresa en porcentaje respecto a las células mantenidas en normoxia y se normalizó por el contenido de proteína celular. C: valor de ARNm de LOX y VEGF evaluado mediante PCR a tiempo real en células HUVEC mantenidas en condiciones de normoxia (control) o sometidas a hipoxia (1% de O2) durante 18h. Como control endógeno se evaluó el valor de expresión de la TBP. Los resultados corresponden a la media ± error estándar de 2 experimentos independientes realizados por triplicado. *p < 0,05 respecto a controles.
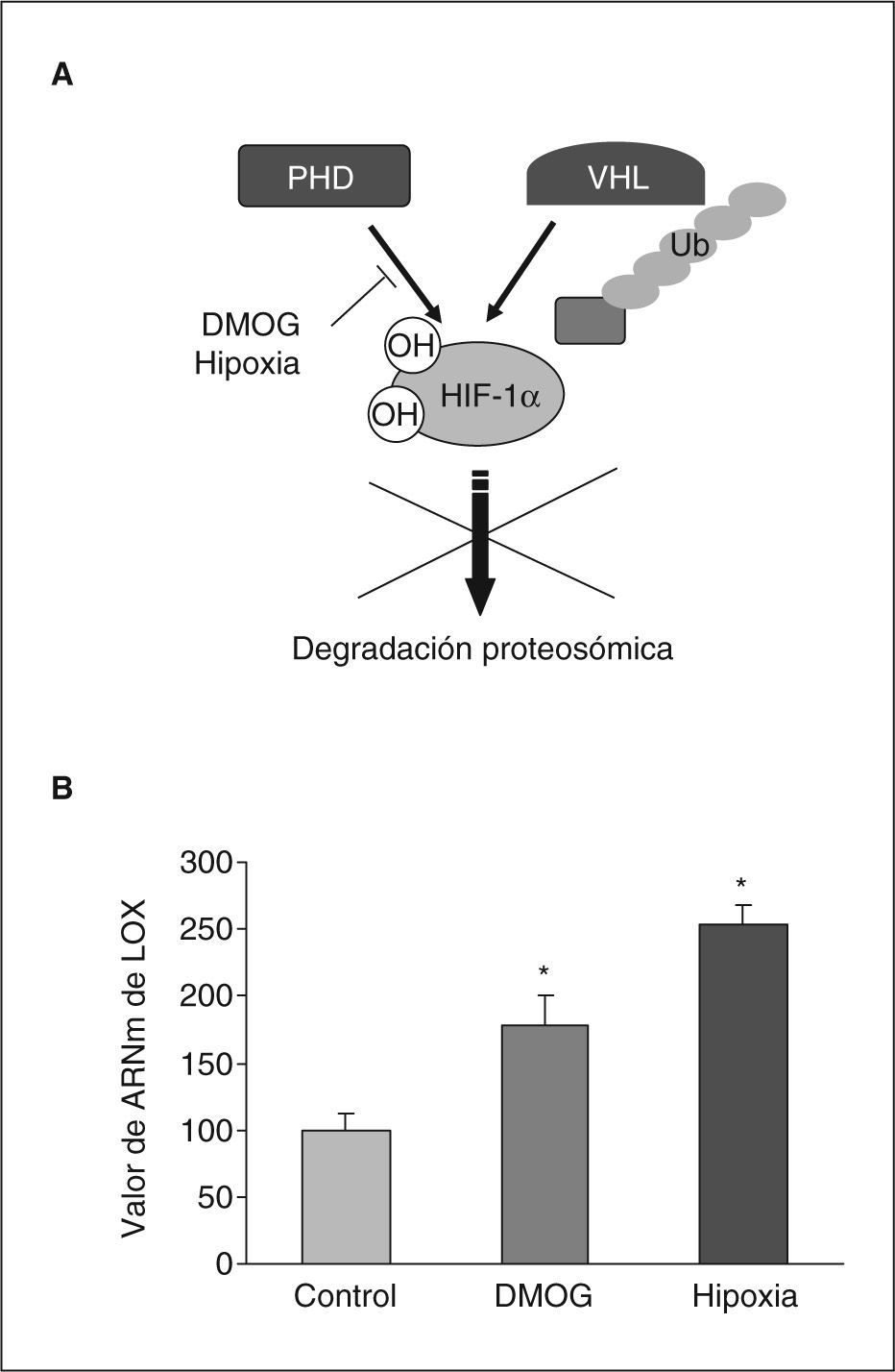
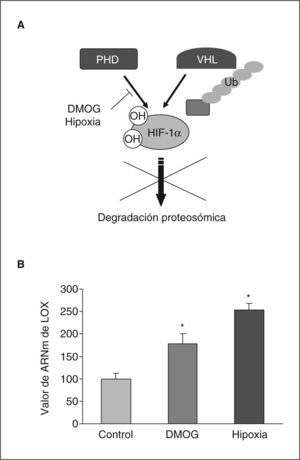
Para determinar la posible implicación de HIF-1 en la inducción de la expresión de LOX por hipoxia, determinamos las consecuencias de la inhibición de la actividad prolil hidroxilasa mediante dimetil oxal glicina (DMOG). El tratamiento con este agente produce un incremento de las concentraciones intracelulares de proteína HIF-1α al inhibir su degradación proteosómica (fig. 3A)19. Como se muestra en la figura 3B el tratamiento de células BAEC con DMOG produjo un incremento en la expresión de LOX al igual que la propia hipoxia. Este resultado indica la implicación del factor HIF-1 en la inducción de LOX por la hipoxia.
La inhibición de la actividad prolil hidroxilasa induce la expresión de la LOX en células endoteliales. A: se detalla el mecanismo de regulación postransduccional del factor HIF-1 que implica la hidroxilación enzimática dependiente de oxígeno en residuos específicos mediante la actividad prolil hidroxilasa (PHD). Esta hidroxilación promueve la proteólisis dependiente del factor Von-Hippel-Lindau-tumour supressor (VHL) que supone la degradación proteosómica de la subunidad HIF-1α. Se indica la inactivación de la actividad prolil hidroxilasa ejercida por la dimetil oxal glicina (DMOG) y la hipoxia que lleva consigo un incremento en la estabilidad de HIF-1α. B: efecto de la hipoxia y de la DMOG en el valor de ARNm de la LOX evaluado mediante PCR a tiempo real en células BAEC. El resultado corresponde a la media ± error estándar de 2 experimentos independientes realizados por triplicado. *p < 0,05 respecto a controles.
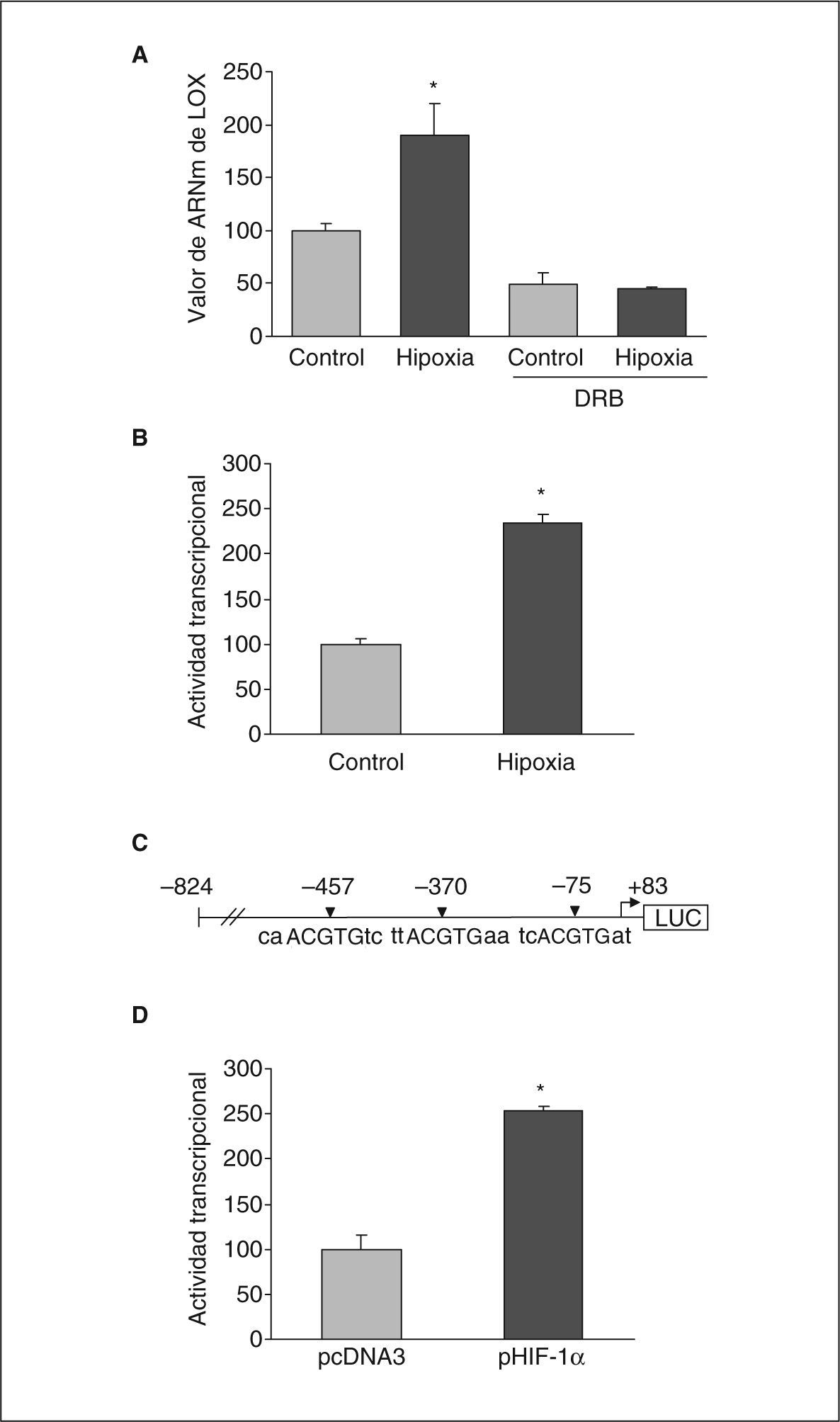
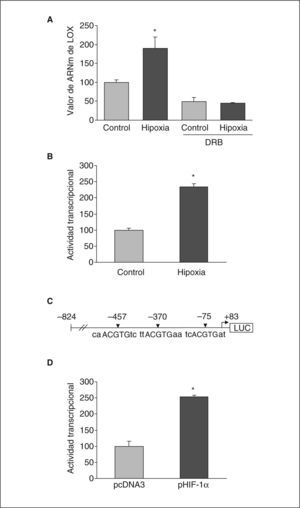
Con el objetivo de caracterizar los mecanismos implicados en la inducción de la expresión de LOX por la hipoxia en células endoteliales determinamos el efecto del 5,6-diclorobencimidazol (DRB), un inhibidor de la transcripción. Se incubaron células BAEC en condiciones de normoxia o hipoxia en presencia y ausencia de DRB (50μmol/l, 18h). La figura 4A muestra cómo la inhibición de la transcripción con DRB inhibió totalmente el incremento en la expresión de LOX causado por la hipoxia. En concordancia, los estudios de transfección transitoria con una construcción que contiene el promotor de la LOX acoplado a luciferasa mostraron que la hipoxia incrementó la actividad transcripcional de la LOX aproximadamente 2,5 veces (fig. 4B). Los estudios in silico realizados con el programa de análisis de secuencia MatInspector indicaban la presencia de 3 elementos posibles de respuesta a hipoxia (HRE) en el promotor de la LOX, situados en las posiciones –75, –370 y –457 (fig. 4C).
La hipoxia induce la expresión de LOX por un mecanismo transcripcional en el que estaría implicado HIF-1. A: las células BAEC se incubaron en normoxia (control) o en condiciones de hipoxia (1% de O2) durante 24h en presencia y ausencia de DRB (50μmol/l). El resultado corresponde a la media ± error estándar de 2 experimentos independientes realizados por triplicado (*p < 0,05 respecto a controles). B: análisis de la actividad transcripcional de la LOX en células BAEC transfectadas con una construcción que contiene la región de –824 a +83 del gen de la LOX acoplado a luciferasa. Las células se mantuvieron en normoxia (control) o se sometieron a hipoxia (1% de O2) durante 18h. El resultado se expresa en porcentaje respecto a las células control y corresponde a la media ± error estándar de 3 experimentos independientes realizados por triplicado (*p < 0,05 respecto a controles). C: esquema de la construcción del promotor de la LOX acoplada a luciferasa en el que se sitúan los 3 posibles HRE identificados mediante análisis in silico con el programa MatInspector (HRE: elemento de respuesta a hipoxia). D: efecto de la cotransfección de un vector de expresión para HIF-1α (pHIF-1α) en la actividad transcripcional LOX. El resultado se expresa en porcentaje respecto a las células transfectadas con el correspondiente plásmido vacío (pcDNA3) y corresponde a la media ± error estándar de 3 experimentos independientes realizados por triplicado (*p < 0,05 respecto a pcDNA3).
Quisimos corroborar la participación de HIF-1 en la regulación de LOX por hipoxia. Para ello, realizamos estudios de cotransfección con un vector de expresión para HIF-1α. Nuestros resultados mostraron que la sobreexpresión de este factor produjo un incremento en la actividad transcripcional de la LOX similar al ejercido por la hipoxia, lo que apoya la implicación de este factor de transcripción en la regulación de esta enzima (fig. 4D).
DiscusiónLa LOX es una enzima clave en la síntesis y estabilización de la MEC3. En los últimos años el hallazgo de la implicación de esta enzima en distintos procesos patológicos ha aumentado el interés por su estudio20. En lo que respecta al sistema cardiovascular nuestros trabajos previos apuntan a que la inhibición de LOX podría ser un mecanismo común a la disfunción endotelial desencadenada por distintos factores de riesgo aterosclerótico y que esta enzima podría ser clave en el mantenimiento de la homeostasis del endotelio6–9,21.
La hipoxia tiene un papel fundamental en distintos procesos patológicos, entre ellos, las enfermedades cardiovasculares, en las que podría controlar el remodelado vascular asociado al desarrollo de la lesión22. La hipoxia que se desencadena en las regiones más internas de la placa aterosclerótica incrementa la expresión de HIF-1, cuyos valores se correlacionan con el grado de engrosamiento de la neoíntima10,11. El factor de transcripción HIF-1 regula en gran medida la respuesta celular a la hipoxia por la modulación de múltiples genes que actúan de manera coordinada facilitando el aporte de nutrientes y oxígeno a las áreas isquémicas y regulando la supervivencia, la migración y el crecimiento celular12,23. Asimismo, este factor de transcripción controla la expresión de proteínas componentes y modificadoras de MEC en células endoteliales y regula los procesos de fibrogénesis y la transición epitelio-mesénquima mediante, al menos en parte, la modulación de genes de la familia de LOX13,14.
En nuestros estudios realizados en células endoteliales, hemos corroborado que la hipoxia aumenta los valores nucleares del factor de transcripción HIF-1α y de expresión de VEGF, así como induce la formación de neovasos in vitro. En estas condiciones, la hipoxia conlleva un incremento en la expresión de la LOX en células endoteliales tanto bovinas como humanas. En el endotelio vascular la inhibición de LOX va asociada a la disfunción endotelial característica de las fases más tempranas del proceso aterosclerótico6,9,21. Sin embargo, en modelos de aterosclerosis avanzada, la expresión de LOX se incrementa en las lesiones muy engrosadas, con un alto grado de fibrosis y altamente estables24. Por lo tanto, estos datos indican que la expresión de esta enzima se regula de forma diferencial en función del estadio de desarrollo de la lesión. La inducción de LOX por hipoxia en células endoteliales indica su implicación en el proceso de angiogénesis. De hecho, Erler et al25 demostraron que la hipoxia induce la expresión de LOX en distintos tipos de células tumorales, que la sobreexpresión de esta enzima incrementa el poder metastásico e invasivo de células de cáncer de mama y que su inhibición previene la adhesión y la migración de las células tumorales26. Estos resultados indican que la LOX es una enzima fundamental en la metástasis inducida por la hipoxia y apuntan a que podría tener un papel crítico en los procesos de neovascularización, aunque, obviamente, la implicación de esta enzima en el desarrollo de nuevos vasos deberá evaluarse en profundidad en células endoteliales.
El incremento en la expresión de LOX se traduce en un aumento significativo de su actividad enzimática. Sorprendentemente, Postovit et al27 no observaron incremento en la actividad de LOX en células tumorales sometidas a hipoxia, pese a detectar un aumento en las concentraciones de proteína madura. En este trabajo, la actividad de LOX tan sólo se induce tras la posterior reoxigenación de las células, un resultado coherente con el hecho de que la actividad de LOX es dependiente de O2. Las discrepancias con nuestro estudio estribarían en las diferencias metodológicas a la hora de evaluar la actividad de LOX. El método de citometría de flujo utilizado en el trabajo de Postovit analiza la actividad de LOX intracelular y técnicamente se desarrolla bajo un 1% de O2. Por el contrario, el método fluorimétrico con el que hemos evaluado la actividad de LOX extracelular no puede desarrollarse en condiciones de hipoxia; por lo tanto, nuestros resultados indican que en las células endoteliales la hipoxia estaría induciendo las concentraciones de proteína LOX madura y que ésta es catalíticamente activa en presencia de O2.
La actividad de HIF-1 se regula por la hidroxilación postranslacional de residuos específicos de prolina, lo que dirige a este factor de transcripción a la degradación por la vía del proteosoma19,28. Este proceso catalizado por prolil hidroxilasas es inhibido con DMOG que incrementa el valor de HIF-1 en condiciones de normoxia. La inducción de LOX en presencia de DMOG apoya la posible implicación del factor de transcripción HIF-1 en la regulación de esta enzima. De hecho, los datos obtenidos en los ensayos con DRB, un inhibidor de la transcripción, indican que la regulación de LOX por hipoxia se produce mediante un mecanismo transcripcional, lo que corroboran los estudios de transfección transitoria en los que demostramos que la sobreexpresión de HIF-1α en células endoteliales induce la actividad transcripcional de la LOX. Si bien otros efectores regulan la expresión de la LOX mediante la modulación de la actividad transcripcional, no se ha llevado a cabo una caracterización exhaustiva de los elementos funcionales del promotor de LOX6–8,29. El análisis in silico de esta región promotora revela la presencia de 3 elementos HRE posibles, uno de los cuales, el situado en la posición –75 respecto al inicio de la transcripción, se había involucrado previamente en la regulación de LOX por hipoxia en células de cáncer de mama25.
Un aspecto interesante es que el incremento en la expresión de LOX inducido por la hipoxia en células tumorales es mayor que el observado en células endoteliales y muy dependiente de la capacidad invasiva de las células, lo que indica que debe haber otros factores que controlen la regulación de LOX por hipoxia27. Efectivamente, se ha demostrado que la inducción de LOX en células tumorales es sólo parcialmente dependiente de HIF-1. De hecho, el tratamiento de células de cáncer de mama con agentes que mimetizan la hipoxia incrementando los valores de HIF-1 (CoCl2 o DFO) produce un menor aumento en la expresión de LOX que la propia hipoxia27, resultado similar al obtenido en nuestro estudio en células endoteliales estimuladas con el inhibidor de la prolil hidroxilasa (DMOG). Por lo tanto, si bien nuestros resultados indican la participación de HIF-1 en la regulación de LOX por hipoxia en células endoteliales, basados en nuestros datos experimentales no podemos descartar la participación de otros factores de transcripción en este efecto. En este contexto, se requerirán nuevos estudios que permitan definir con precisión cuál es el mecanismo implicado en la regulación de la LOX por hipoxia en células endoteliales y la relevancia patofisiológica de este fenómeno en el inicio y la progresión de la lesión aterosclerótica.
Agradecemos a Silvia Aguiló su apoyo técnico.