Las complicaciones macrovasculares son la causa principal de morbilidad y mortalidad en la diabetes mellitus tipo 2. Y como sustrato fundamental se encuentra la enfermedad aterosclerótica, que en el paciente diabético tiene unas características diferenciadas y responde peor al tratamiento. Por ello, la prevención de la macroangiopatía diabética debe ser la principal estrategia para estos pacientes. Si bien ha quedado demostrado que la mejora del control metabólico (HbA1c < 8%) disminuye la incidencia de complicaciones microvasculares, ello no ocurre igualmente para la enfermedad aterosclerótica, debido, en parte, al carácter multifactorial de ésta. Por tanto, es necesario un control metabólico más estricto y desde las fases iniciales de la diabetes, e incluso en los estados prediabéticos. En este contexto, la insulinización basal es una alternativa fisiológica, que puede permitir enlentecer el deterioro de la célula beta, mejorar el control metabólico y, posiblemente, reducir la incidencia de episodios cardiovasculares. La mayoría de los estudios de insulinización basal se han realizado con insulina glargina, que ha demostrado ser al menos igual de eficaz que otras insulinas, pero con una reducción significativa de efectos adversos, en concreto de las hipoglucemias graves y las hipoglucemias nocturnas.
Macrovascular complications are the main cause of morbidity and mortality in type 2 diabetics. And as the fundamental substrate we find atherosclerosis, which in the diabetic patient has characteristic differentiations and a worse response to treatment. This is the principal reason why diabetic macroangiopathy prevention is our main goal in these patients. It has been proved that good metabolic control reduces microvascular complications, however, this does not occur with atherosclerosis most likely due to a multifactorial origin. We need a more strict metabolic control in the initial phases of diabetes and even in the prediabetes stages. In this context basal insulinization is a physiological alternative that may allow a slower deterioration of beta cells, a better metabolic control and even a decrease in the incidence of cardiovascular events. The majority of the basal insulinization studies have been undertaken with Glargin Insulin, which has proved to be at least as effective as other insulins, but with a significant reduction in adverse events, especially severe hypoglycemias and night hypoglycemias.
La cardiopatía coronaria, la enfermedad cerebrovascular y la arteriopatía periférica son la causa principal de morbilidad y mortalidad en la diabetes mellitus tipo 2 (DM2)1. Se estima que el riesgo relativo de tener enfermedad coronaria es de 1,5-2,5 y de 4 veces superior para los varones y mujeres diabéticos, respectivamente, en comparación con la población no diabética2. Asimismo, tanto la glucemia basal alterada (GBA), como la tolerancia anómala a la glucosa (TAG), se asocian a una incidencia mayor de complicaciones cardiovasculares3. Tanto la diabetes como los estados prediabéticos son factores independientes de aterosclerosis acelerada, sustrato fundamental de las complicaciones macrovasculares. Además, con frecuencia, la diabetes se asocia con otros factores de riesgo aterogénicos, lo que incrementa aún más el riesgo cardiovascular. El resultado es la aparición de las complicaciones ateroscleróticas en edades más tempranas en la población diabética, que tienen una extensión difusa por el árbol cardiovascular y responden peor al tratamiento.
Por lo tanto, el tratamiento de la enfermedad aterosclerótica en el paciente con DM2 debe ser multifactorial. La eficacia del control estricto de la presión arterial, el tratamiento de la dislipemia diabética y el cese del hábito tabáquico han demostrado reducir la incidencia de las complicaciones macrovasculares4–6. La evidencia disponible, a partir de los estudios epidemiológicos y de intervención, en los beneficios del control glucémico en la incidencia de la enfermedad aterosclerótica, no es tan concluyente, si bien es cierto que, en la mayoría de estos estudios, el control glucémico ha distado mucho de ser óptimo7,8. La mejora de este control metabólico es, por tanto, un objetivo prioritario en el tratamiento de la DM2. Por ello, las directrices actuales recomiendan alcanzar valores de control glucémico próximos a la normalidad, así como realizar una intervención terapéutica lo más pronto e intensiva posible, siempre y cuando el paciente la pueda asumir9,10. La insulinización basal temprana es una estrategia terapéutica de instauración reciente, que permite mejorar el control glucémico y, al menos teóricamente, podría reducir la incidencia de las complicaciones cardiovasculares de la DM2.
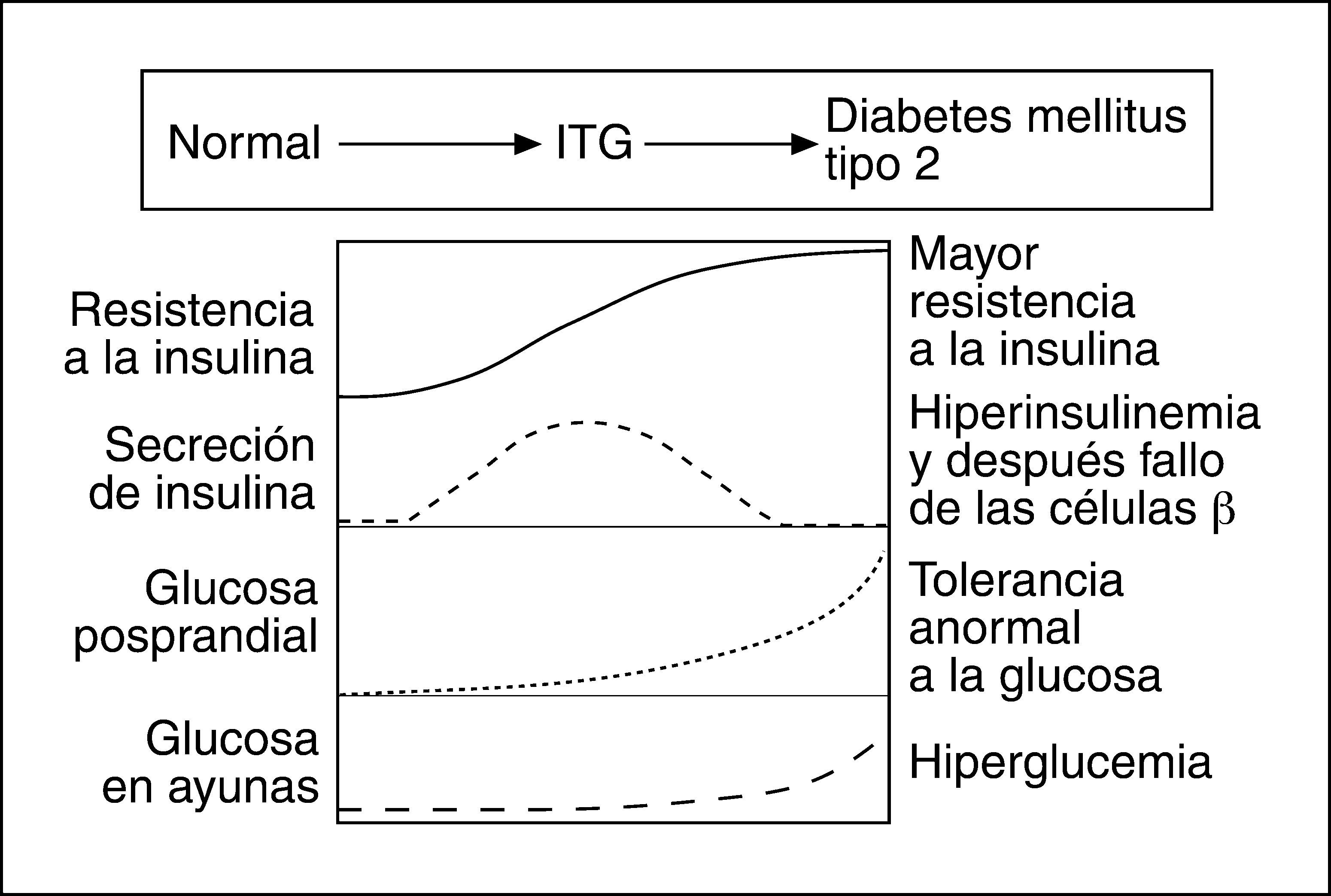
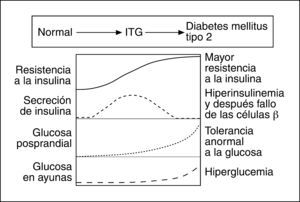
Fundamentos de la insulinización basalEn las fases iniciales de la evolución de la DM2, y antes de llegarse al diagnóstico, hay un estado de resistencia insulínica íntimamente ligado con la obesidad abdominal. Como consecuencia, las células beta del páncreas deben aumentar la producción de insulina para poder mantener el equilibrio del metabolismo de los hidratos de carbono. El resultado es un hiperinsulinismo compensador que, si bien permite mantener en valores normales la glucemia basal, no suele ser suficiente para regular la sobrecarga hidrocarbonada de la dieta (fig. 1).
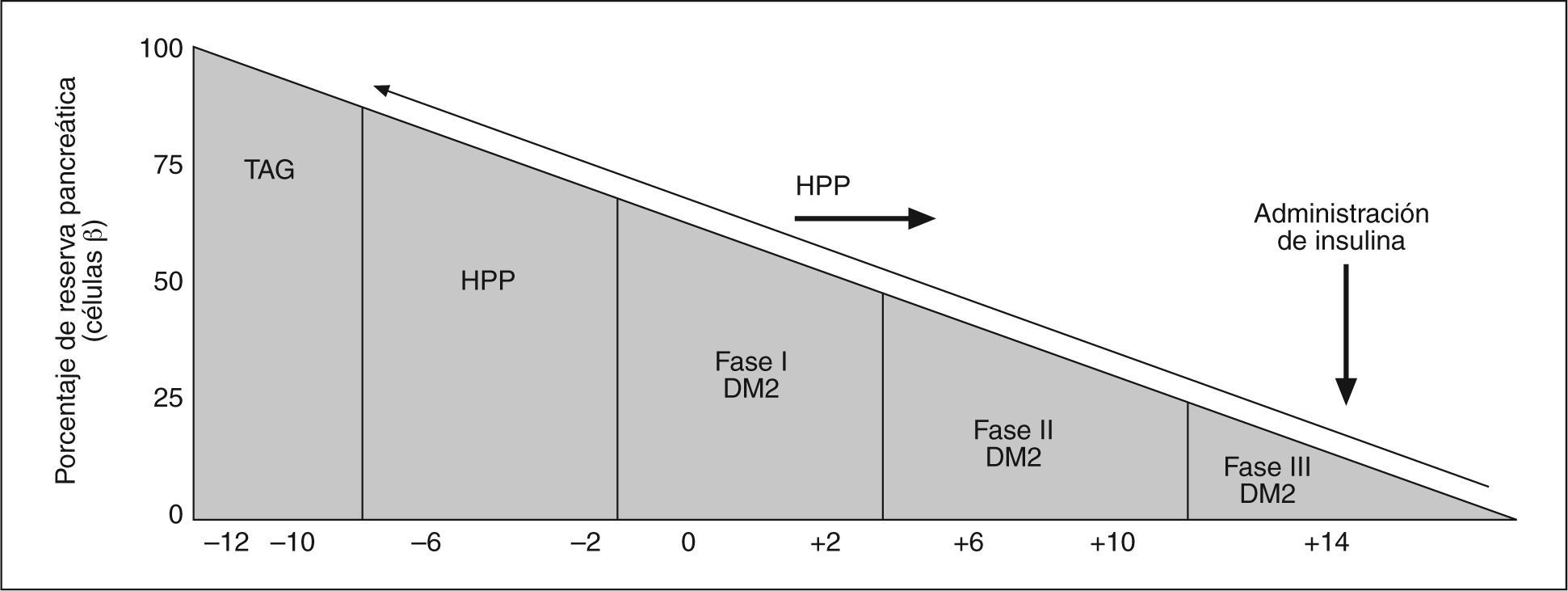
En esta fase, puede llegarse al diagnóstico de diabetes a partir de una sobrecarga oral de glucosa (SOG). A medida que el proceso evoluciona, la capacidad de respuesta del páncreas decrece y el hiperinsulinismo es insuficiente para mantener la glucemia basal dentro de los límites normales. En esta fase, que suele ser habitualmente cuando se diagnostica la DM2, el porcentaje de células beta del páncreas se ha reducido como mínimo en un 50% (fig. 2). En la evolución posterior, la tendencia natural es que la reserva insulínica continúe disminuyendo, de modo que, a los 10 años, más del 75% de los pacientes necesita utilizar insulina para controlar la glucemia11.
A diferencia de otras alternativas terapéuticas, la implantación de una estrategia de insulinización basal, sobre todo si se realiza en las fases iniciales de la evolución de la DM2, pretende preservar el deterioro acelerado de la célula beta pancreática, derivado de la situación de resistencia insulínica. De este modo, sería posible reducir la sobrecarga secretora del páncreas, y prolongar en el tiempo la vida media de las células beta. Como resultado, cabría esperar un control metabólico más estricto, incluida la hiperglucemia posprandial y, consecuentemente, una reducción en la incidencia de las complicaciones macrovasculares. Desde el punto de vista clínico, la insulinización basal consiste en la administración exógena de una sola dosis diaria de insulina, generalmente nocturna, que permita compensar la secreción basal del páncreas, deteriorada en la DM2. En el momento actual, hay 3 tipos de insulina que se pueden utilizar con esta función.
Por un lado, la NPH (Neutral Protamine Haegdorn) se comercializó hace más de 30 años con otras indicaciones y, recientemente, se ha utilizado para la insulinización basal. Su principal limitación es que su efecto no cubre las 24h del día, oscilando entre 3 y 16h, con un pico máximo entre las 4 y las 6h.
En los últimos años, se han comercializado los análogos de la insulina de acción prolongada, como la glargina y el levemir. La mayor parte de la evidencia clínica en insulinización basal procede de los estudios realizados con insulina glargina, por lo que revisaremos a continuación sus características farmacológicas y su aplicabilidad en la práctica clínica.
Insulinización basal con insulina glarginaCaracterísticas farmacológicasLa insulina glargina es una análogo de la insulina, recombinante, con una duración de acción de 24h. La modificación de 3 aminoácidos en las cadenas A y B de la insulina humana permite que la insulina glargina, al inyectarla por vía subcutánea, forme unos microprecipitados amorfos, a partir de los cuales se libere de forma constante12. Este mecanismo de acción permite 2 efectos fundamentales:
- 1.
Secreción constante de insulina durante 24h, similar a la secreción basal del páncreas en condiciones normales13.
- 2.
Ausencia de picos absortivos14 que, junto a la liberación prolongada, disminuye la incidencia de hipoglucemias.
En comparación con la insulina NPH, el comienzo de acción es más lento, pero su duración es más prolongada15. Se ha comprobado que tanto la variabilidad intraindividual, como interindividual, son menores para la glargina que para la NPH y otras insulinas lentas o ultralentas16.
Los efectos de la insulina glargina son:
- 1.
Descenso progresivo de la glucemia durante 24h. Se ha demostrado que el lugar de inyección, ya sea abdomen, extremidades superiores o inferiores, no afecta a la absorción de glargina14. Algunos estudios han demostrado también que la absorción no se afecta por el grado de grasa subcutánea.
- 2.
Inhibición de la lipólisis y proteólisis, que incrementa la síntesis proteica17.
- 3.
Reducción de los valores plasmáticos de ácidos grasos libres18.
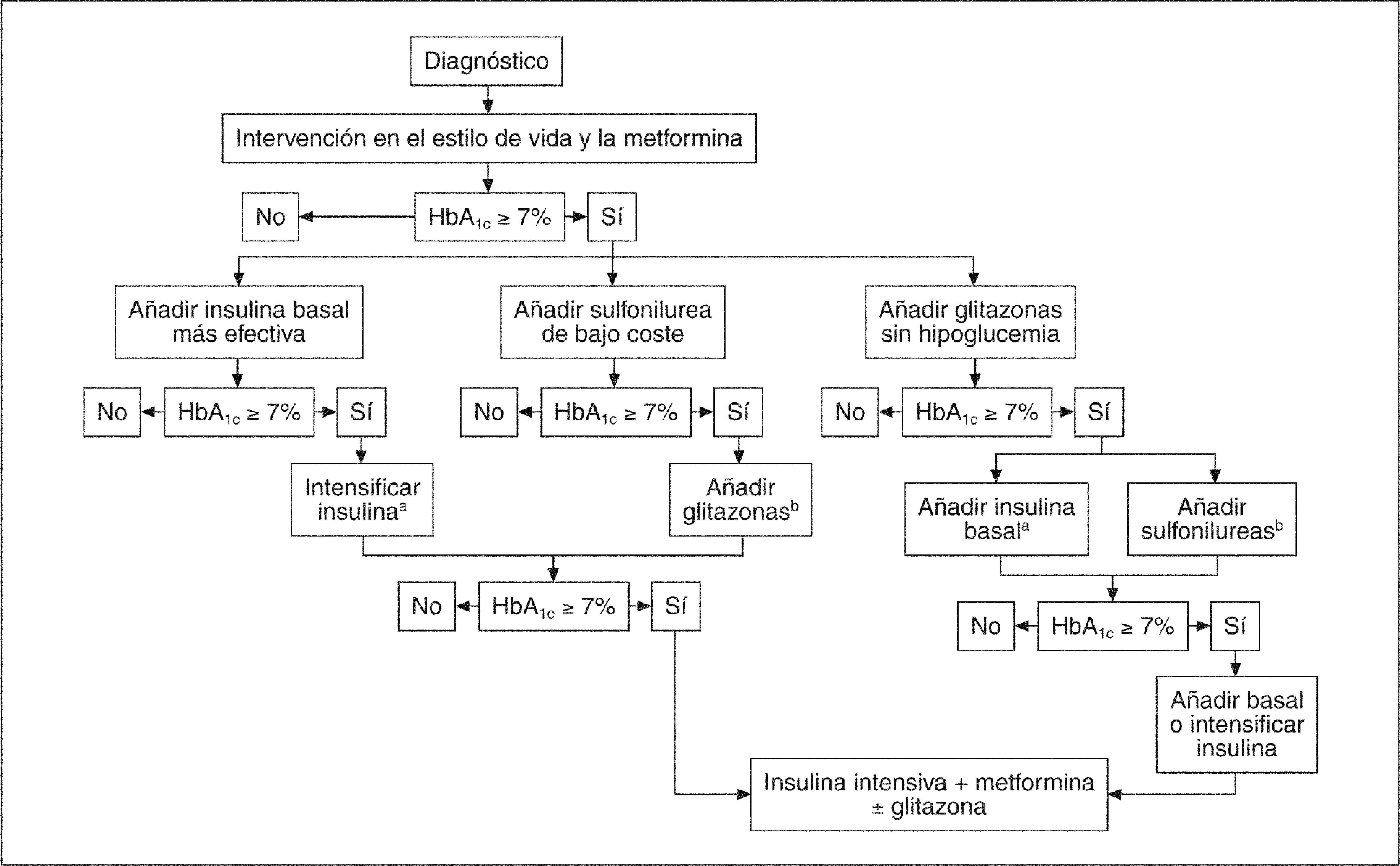
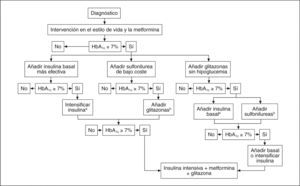
Se han diseñado diferentes estudios para evaluar la eficacia de la insulinización basal con glargina en el tratamiento de la DM2. Se ha analizado su utilidad asociada a uno o más antidiabéticos orales, se ha comparado su eficacia frente al tratamiento estándar con antidiabéticos orales (ADO), e igualmente se ha contrastado su eficacia y seguridad con otras formulaciones de insulina, fundamentalmente NPH e insulinas mixtas. Los resultados de estos estudios han permitido que en el último consenso de la European Association for the Study of Diabetes/American Diabetes Association de 20069, se considere la insulinización basal en el segundo escalón de tratamiento, y al mismo nivel que otras alternativas, como las glitazonas o las sulfonilureas, para los pacientes en los que no se logra un control adecuado mediante las modificaciones del estilo de vida y la metformina (fig. 3).
Algoritmo terapéutico de la diabetes mellitus tipo 2. Consenso de la European Association for the Study of Diabetes/American Diabetes Association 2006. HbA1c: hemoglobina glucosilada.
aControlar la HbA1c cada 3 meses, y si la HbA1c es < 7%, controlarla cada 6 meses.
bAunque se pueden utilizar 3 agentes orales de forma simultánea, el tratamiento con insulina es preferible por ser más eficaz y económico.
Tomada de Nathan et al9.
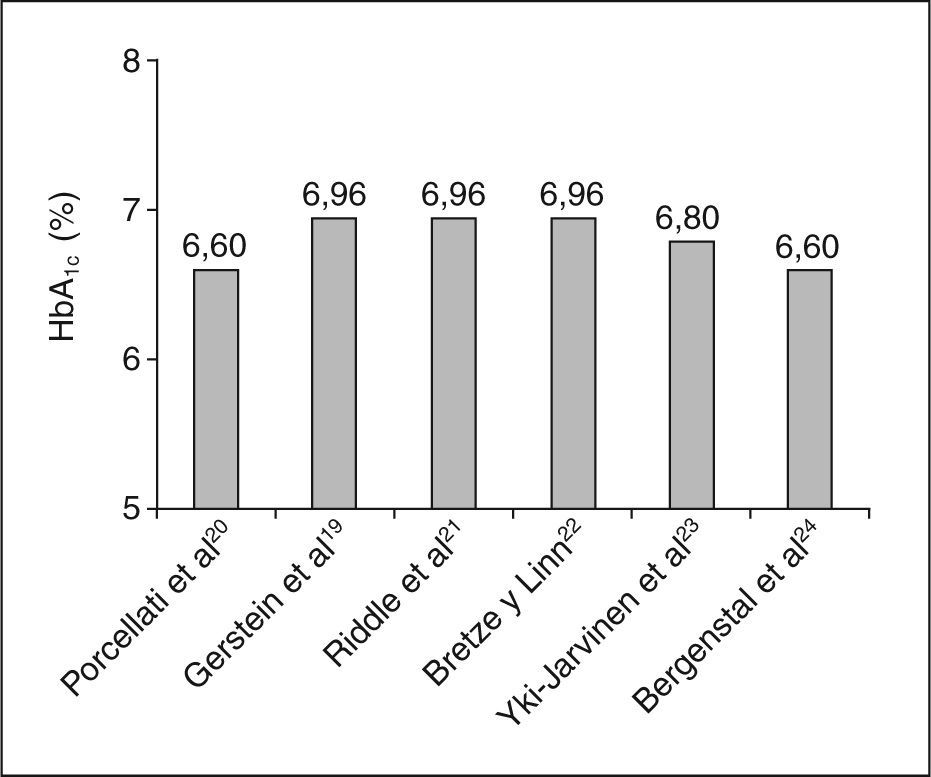
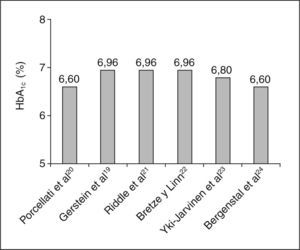
El estudio INSIGHT19 se diseñó para comparar el grado de control metabólico entre una estrategia basada en la adición de insulina glargina al tratamiento habitual con ADO, frente a una estrategia de intensificación del tratamiento oral. Se incluyó a pacientes con DM2 no controlados (HbA1c > 7%) en tratamiento estable durante los 3 meses previos a la inclusión con 0, 1 o 2 agentes orales. El diseño del estudio se realizó en abierto, y se incluyó a unos 200 pacientes por grupo, con una duración de 24 semanas. Los resultados mostraron que la adición de insulina glargina al tratamiento previo mejoraba el control metabólico, en comparación con el grupo control. Los pacientes del grupo glargina alcanzaban antes el objetivo principal del estudio (2 valores consecutivos de HbA1c < 6,5%), que el grupo de intensificación con agentes orales (p < 0,05). Este resultado era más consistente después de ajustar por los valores basales de HbA1c y por número de agentes orales. El porcentaje de pacientes que alcanzaban el objetivo primario, así como el descenso absoluto de HbA1c, fueron significativamente mejores en el grupo de glargina (el 17,5 frente al 10,1%; p = 0,032, y el 1,55 frente al 1,25%; p < 0,05, respectivamente) (fig. 4).
Aun no siendo un estudio de comparación con tratamiento estándar, los beneficios de la adición de insulina glargina en condiciones de práctica clínica se han evaluado en un estudio observacional25 donde se incluyó a más de 12.000 pacientes con DM2 no controlados con diferentes combinaciones de ADO. La titulación de glargina se realizó según criterio médico, y se analizaron los cambios en la HbA1c a los 3 y 9 meses y a los 20 meses en 2.721 pacientes incluidos en el subestudio de extensión. Si bien el estudio presenta la limitación de no disponer de grupo control, se pueden resaltar 2 resultados relevantes. En primer lugar, el descenso de 1,7% en la HbA1c a los 3 meses de tratamiento (HbA1c basal del 8,7%) se mantuvo tanto a los 9 (1,9%) como a los 20 meses. Y en segundo lugar, la mejora del control metabólico fue independiente del índice de masa corporal, y el descenso de la HbA1c a los 20 meses fue similar en pacientes con normopeso (−1,5%), sobrepeso (−1,7%), obesidad (−1,7%) y obesidad mórbida (−1,7%).
Los beneficios de la insulinización basal frente al tratamiento estándar podrán ser definitivamente aclarados en los próximos años cuando se conozcan los resultados del estudio ORIGIN26, actualmente en marcha. Se trata de un ensayo clínico en abierto de prevención primaria, de diseño factorial 2 × 2 (glargina y ácidos omega 3) de 48 meses de duración. El objetivo principal es comparar la incidencia de episodios cardiovasculares mayores entre el grupo en tratamiento con glargina y el grupo de tratamiento estándar en una población de pacientes prediabéticos o diabéticos, de reciente diagnóstico, con factores de riesgo cardiovascular asociados. En el grupo de tratamiento con glargina, se establecen unos valores de control estrictos (glucemia basal < 95mg/dl), mientras que en el grupo de tratamiento estándar se siguen los criterios basados en las guías vigentes. También será realmente interesante el análisis de la seguridad de ambos tratamientos, y en concreto, la incidencia de hipoglucemias graves, más aun teniendo en cuenta que en la rama de glargina el control glucémico es muy estricto.
Estudios de comparación con otras insulinasSe han diseñado muchos estudios para evaluar la eficacia y la seguridad de la insulina glargina con otros tipos de insulina, tanto en monoterapia como en combinación con agentes orales. Rosenstock et al27, en un ensayo durante 28 semanas, compararon la eficacia y la seguridad de 1 dosis nocturna de glargina con 1 o 2 dosis de NPH en pacientes con DM2 no controlados con NPH y aleatorizados 1:1 a cada una de las ramas. Aunque el descenso de la HbA1c y la glucemia basal no mostró diferencias entre ambos grupos de tratamiento, sí fue relevante que el porcentaje de hipoglucemias graves fuera significativamente menor en el grupo de insulina glargina.
Posteriormente se confirmó la menor incidencia de hipoglucemias en el estudio Treat-to-Target21, donde se comparó la eficacia y la seguridad de la glargina y la NPH añadidas al tratamiento con agentes orales en pacientes no controlados. Tanto el porcentaje de hipoglucemias sintomáticas, como el porcentaje de hipoglucemias confirmadas por debajo de 72 y 56mg/dl, fueron un 21, 29 y 41% menores, respectivamente, en la rama de glargina. Aunque ambos grupos obtuvieron un control metabólico similar, el porcentaje de pacientes que alcanzó una HbA1c < 7% en ausencia de hipoglucemias fue significativamente mayor en la rama de glargina. Los resultados de ambos estudios ponen de manifiesto que, cuando se plantean objetivos de control glucémico estrictos, el porcentaje de hipoglucemias, en especial las graves y/o nocturnas, es mayor con NPH. La menor duración de acción de la NPH, así como su pico máximo de acción entre 6–8h, explicarían al menos parcialmente estos resultados.
La combinación de una dosis de insulina con agentes orales es el concepto fundamental de la estrategia de insulinización basal. Dos estudios han comparado glargina y NPH y, en ambos, el control metabólico ha sido mejor en la rama de glargina. En el estudio de Fritsche et al28, se compararon 2 estrategias de insulina glargina y glimepirida 3mg con insulina NPH más glimepirida 3mg. En general, los grupos de glargina obtuvieron un control metabólico mejor medido por el descenso de la HbA1c, así como una incidencia menor de hipoglucemias que la rama de NPH. Sin embargo, el resultado más relevante fue que, en el grupo que se inyectaba la insulina glargina por la mañana, tanto el descenso de la HbA1c, como la incidencia de hipoglucemias era menor que en el grupo de insulina inyectada por la noche y en el grupo de NPH. El máximo efecto de la combinación de insulina matutina y glimepirida sería durante las primeras 12h, lo que podría mejorar el control glucémico durante el período de más variabilidad metabólica. Es también un hecho que la hipoglucemia nocturna es uno de los efectos adversos más temidos por pacientes y médicos. El ajuste de dosis en las ramas de insulina glargina nocturna y NPH podría ser, por este motivo, menos riguroso. Sin embargo, aunque la dosis de insulina glargina inyectada por la mañana fue ligeramente superior, la diferencia no fue clínicamente relevante. Posteriormente, se confirmó la mayor eficacia de la combinación de glargina y sulfonilureas del estudio de Fritsche et al28, al menos parcialmente, para la asociación con metformina. En el estudio LANMET29, la combinación de glargina y metformina produjo inicialmente (3 meses) un mayor descenso de la glucemia basal y, al finalizar el estudio (9 meses), mejoró las cifras de glucemia antes de la cena en comparación con la asociación de NPH y metformina. El control metabólico medido por la HbA1c fue similar en ambos grupos, así como la glucemia basal a los 9 meses.
La insulinización basal también se ha comparado con la utilización de insulina mixta (30/70). En el estudio de Janka et al30, la combinación de glargina y agentes orales se mostró más eficaz que la estrategia basada en insulina 30/70 en 2 dosis. La rama de glargina obtuvo descensos significativos, en comparación con el grupo control, para el descenso de la HbA1c (−1,64 frente a −1,31; p = 0,0003) y la glucemia basal (−17mg/dl para la diferencia ajustada). Asimismo, el porcentaje de pacientes que alcanzaron el objetivo de control (HbA1c < 7%) en ausencia de hipoglucemia fue superior (el 45,5 frente al 28,6%; p = 0,0013). Estos resultados no se confirmaron en un estudio posterior realizado por Raskin et al31, donde el grado de control metabólico fue mejor en la rama de insulina mixta más agentes orales, que en la rama de glargina más agentes orales. En este segundo estudio, la rama de insulina mixta se combinaba con agentes orales, circunstancia que no se daba en el estudio de Janka et al30, lo que puede explicar en parte las diferencias. Además, la dosis de insulina glargina en el estudio de Raskin et al31 fue muy inferior a la de insulina mixta y a la de insulina glargina del estudio de Janka et al30, lo cual no se justificó por un aumento de efectos adversos (hipoglucemias).
Un estudio reciente ha comparado la eficacia de glargina y rosiglitazona cuando se asocian al tratamiento con 2 agentes orales. El descenso de la HbA1c a los 3 meses fue significativamente mayor en la rama de glargina (p < 0,05), mientras que el control de la glucemia a largo plazo (24 semanas) mostró una tendencia a ser mejor también en el grupo de glargina32. A la vista de la evidencia mostrada por los diferentes estudios, podemos afirmar que la insulinización basal con insulina glargina es una estrategia con una eficacia igual o superior a otras alternativas, como NPH o insulinas mixtas en el paciente con DM2, tanto si está en tratamiento con agentes orales, como si no. En la mayoría de los estudios en los que se ha utilizado la insulinización basal con glargina, el valor de la HbA1c ha sido inferior al 7%, lo que se corresponde con un control metabólico adecuado (fig. 4). Asimismo, todos los estudios muestran, de forma consistente, que cuando se establecen objetivos de control metabólico moderadamente estrictos, el porcentaje de pacientes que los alcanzan en ausencia de hipoglucemias es superior cuando se utiliza insulina glargina que cuando se eligen otras insulinas.
Seguridad de la insulina glarginaLa hipoglucemia es el efecto adverso más temido por médicos y pacientes tratados con insulina. Es un factor determinante no sólo en el inicio de la insulinización, sino también en el cumplimiento terapéutico, y consecuentemente en el grado de control metabólico. La mayoría de los estudios han demostrado una incidencia menor de hipoglucemias con insulina glargina en comparación con la NPH, en especial en las hipoglucemias nocturnas.
En un metaanálisis33 reciente se ha comparado la incidencia de hipoglucemias entre NPH e insulina glargina. Se seleccionaron 4 estudios, en el que se incluyó a un total de 2.304 pacientes, 1.142 en tratamiento con glargina y 1.162 con NPH. Los resultados mostraron que con valores de control metabólico similares, la incidencia de hipoglucemia global y nocturna fue menor en la rama de glargina (el 11 y el 26%, respectivamente; p < 0,0005, en ambos casos) sin que hubiera diferencias en las hipoglucemias diurnas. Más aún, la incidencia de hipoglucemias graves (asistencia de otra persona y glucemia inferior a 56mg/dl con síntomas compatibles), tanto globales, como nocturnas, también fueron inferiores con insulina glargina (el 46 y el 52%, respectivamente; p < 0,05). Probablemente, la menor duración y el pico de acción a las 4–6h de la NPH frente a la liberación constante de glargina expliquen estas diferencias. Es muy importante reseñar que estos resultados se mantenían cuando se analizaban únicamente los pacientes que alcanzaban los objetivos de tratamiento. Este aspecto es especialmente relevante, si tenemos en cuenta que cada vez se fijan unos límites más estrictos, y la hipoglucemia es un limitante importante para poder alcanzar estos objetivos.
Otro efecto adverso a tener en cuenta es el aumento de peso que produce el tratamiento insulínico. xestudio de Rosenstock et al27 y el LANMET29 mostraron el efecto opuesto. En cambio, la ganancia ponderal fue menor con glargina, al comparar con insulina mixta o con rosiglitazona en triple tratamiento. En cualquiera de los casos, el incremento de peso osciló entre 0,4 y 3,7kg.
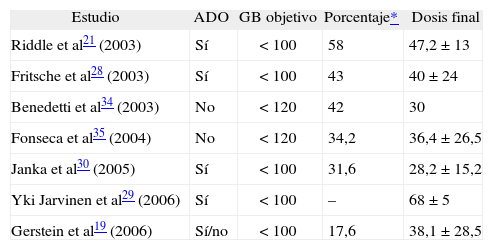
Aspectos prácticos de la insulinización basal con glarginaDosificación y ajuste de la dosisAunque la insulinización basal suele iniciarse cuando el control metabólico no es aceptable con las modificaciones del estilo de vida, pérdida de peso y metformina a dosis máximas o submáximas, cada vez son más los datos que indican un comienzo más temprano del tratamiento insulínico. Al iniciar la insulinización es fundamental definir claramente los objetivos terapéuticos en función del grado de control metabólico. A la hora de utilizar glargina como insulina basal, es muy importante conocer que las dosis medias para alcanzar un control metabólico aceptable (HbA1c < 7%) en los diferentes ensayos clínicos oscilan entre 35–50 U (tabla 1). Una dosis habitual para comenzar son 10 U, en administración bien diurna, bien nocturna. Cuando se tiene amplia experiencia y el control metabólico es malo (HbA1c > 8,5%), puede ser recomendable comenzar con dosis más elevadas.
Dosis medias de insulina glargina en los diferentes estudios
| Estudio | ADO | GB objetivo | Porcentaje* | Dosis final |
| Riddle et al21 (2003) | Sí | < 100 | 58 | 47,2 ± 13 |
| Fritsche et al28 (2003) | Sí | < 100 | 43 | 40 ±24 |
| Benedetti et al34 (2003) | No | < 120 | 42 | 30 |
| Fonseca et al35 (2004) | No | < 120 | 34,2 | 36,4 ± 26,5 |
| Janka et al30 (2005) | Sí | < 100 | 31,6 | 28,2 ± 15,2 |
| Yki Jarvinen et al29 (2006) | Sí | < 100 | – | 68 ± 5 |
| Gerstein et al19 (2006) | Sí/no | < 100 | 17,6 | 38,1 ± 28,5 |
ADO: antidiabéticos orales; GB: glucemia basal objetivo.
El ajuste posterior de la dosis va a depender del control de las glucemias capilares. Un aspecto relevante es que este ajuste se realiza exclusivamente en función de las cifras de glucemia en ayunas, Zeficaz, consiste en aumentar 1 U cada día hasta conseguir que la media de las últimas 3 glucemias capilares se encuentre en el objetivo marcado. Se pueden alcanzar resultados similares aumentando 2 U cada 3 días hasta obtener los resultados prefijados. Una tercera opción es aumentar la dosis cada 3–4 días en 2, 4, 6 u 8 U, según las cifras de glucemia capilar basal superen los 120, 140, 160 o 180mg/dl, respectivamente. Cualquiera de los 3 algoritmos es perfectamente válido, y su elección puede depender de la experiencia del médico y de las características clínicas, psicológicas y sociales del paciente. En este sentido, es muy importante conseguir implicar al paciente en el propio ajuste de la insulina, cuando las circunstancias así lo permitan. Datos del estudio AT-LANTUS demostraron que el control metabólico tendía a ser mejor en los pacientes que seguían una pauta de autoajuste preestablecida, que cuando la dosis era modificada semanalmente por el médico36. La HbA1c descendió en 1,22% en el primer grupo y en 1,08 en el grupo de ajuste por el médico (p < 0,01).
Otro aspecto de especial importancia al ajustar la dosis es que no hay un límite superior para administrar insulina glargina. El riesgo de hipoglucemias no se incrementa notoriamente a medida que aumentamos la dosis de glargina, sino a medida que nos acercamos a los valores normales de glucemia. Aunque no es lo más frecuente, se pueden utilizar dosis superiores a 80 U cuando sea necesario, sin que haya un aumento clínicamente relevante en la incidencia de efectos adversos.
FlexibilidadLas características farmacocinéticas de la insulina glargina permiten su administración a cualquier hora del día. Si bien los resultados del estudio de Fritsche et al28 mostraban una tendencia a un mejor control metabólico y menos hipoglucemias cuando se administraba por la mañana, su administración nocturna o a cualquier hora del día se ha mostrado también muy eficaz y segura. Ello es muy importante, ya que permite adaptar el tratamiento a las necesidades del paciente, lo que no puede realizarse con la NPH. En cualquier caso, lo importante es mantener un período constante de 24h entre cada dosis. No se ha demostrado ningún beneficio al dividir las dosis de glargina en 2 administraciones diarias. Incluso en estudios de comparación de glargina, con 2 dosis diarias de NPH, se ha demostrado que la eficacia es similar, mientras que la incidencia de hipoglucemias es más elevada en el caso de la NPH.
Otro aspecto importante a la hora de comenzar con la insulinización basal es qué hacer con los ADO cuando están asociados. La retirada de uno o todos los ADO puede dar lugar a un período de desajuste metabólico que nos puede hacer pensar en el fracaso del tratamiento insulínico. Por ello, la recomendación es mantener al menos uno de ellos, preferentemente la metformina, por tener un efecto sinérgico con la insulina, al disminuir la resistencia insulínica. Otra alternativa es mantener 2 o más ADO y retirar uno, preferentemente sulfonilureas, cuando se vaya a alcanzar o se alcancen los objetivos metabólicos de control. En cualquier caso, el mantenimiento de la metformina es la estrategia más eficaz y eficiente.
En resumen, podemos concluir que la insulinización basal es una alternativa de primera elección en el segundo escalón terapéutico, cuando el paciente con DM2 tiene un mal control metabólico. Sin embargo, la posible preservación de la célula beta del páncreas, cuando se administra insulina, puede ser una razón importante para iniciar la insulinización temprana en fases iniciales y, de este modo, intentar prevenir las complicaciones macrovasculares. Esta sugerente hipótesis podrá desvelarse en los próximos años.