Recientemente nuestro grupo ha demostrado que ezetimibe, un inhibidor específico de la absorción intestinal, es capaz de inhibir la inflamación vascular en un modelo de arteriosclerosis en conejo. Nuestro objetivo ha sido investigar el efecto de ezetimibe sobre la adhesión y la migración de monocitos humanos THP-1, así como la participación de la vía de señalización de las proteincinasas activadas extracelularmente (p44/p42ERK1/2) sobre el efecto observado.
Material y métodosLa adhesión se valoró como la capacidad de las células THP-1 para unirse a placas de cultivo, y la migración se determinó con el empleo de cámaras de quimiotaxis. La expresión de moléculas de adhesión se cuantificó mediante citometría de flujo, y la activación de p44/p42ERK1/2 se estudió mediante Western Blot.
ResultadosLa adhesión y la migración de los monocitos THP-1 inducidas con PMA o MCP-1, respectivamente, se inhibió de forma dependiente de la dosis al preincubar las células con ezetimibe. Además, el tratamiento con ezetimibe inhibió la expresión de las integrinas CD11a y CD11b, así como la fosforilación de p44/p42ERK1/2 (la forma activa) inducida por MCP-1. Más del 90% de las células (evaluadas mediante azul tripán) eran viables tras 1 ó 2 días de exposición a ezetimibe.
ConclusionesNuestros resultados indican que ezetimibe, además de su actividad hipolipemiante, puede inhibir el proceso de adhesión y migración de los monocitos. Parece que el bloqueo de la ruta de señalización de las MAPK p44/p42ERK1/2 podría estar implicado en el efecto observado.
Recently, our group has demonstrated that ezetimibe, a specific inhibitor of intestinal absorption, is able to inhibit vascular inflammation in a rabbit model of atherosclerosis. In this study, we investigated the effect of ezetimibe on the adhesion and migration of human THP-1 monocytes in vitro. We also studied the involvement of the MAP kinase signalling pathway, p44/p42ERK1/2, as a potential mechanism responsible for the observed effect.
Material and methodsAdhesion of THP-1 monocytes was measured as the ability of cells to bind to plates. Migration was studied using two-compartment chambers. The expression of adhesion molecules was assessed by flow cytometry. Activation of p44/p42ERK1/2 was measured by Western Blot.
ResultsPreincubation of THP-1 monocytes with ezetimibe prevented PMA-induced adhesion and MCP-1-induced migration in a dose-dependent manner. Preincubation of THP-1 monocytes with ezetimibe also inhibited the expression of the integrins CD11a and CD11b, as well as phosphorylation of p-p44/p42ERK1/2 (the active form) induced by MCP-1. More than 90% of cells (evaluated through trypan blue) were viable 1 or 2 days after exposure to ezetimibe.
ConclusionsOur results indicate that, in addition to its lipid lowering activity, ezetimibe is able to inhibit the process of adhesion and migration of monocytes in vitro. Blocking of the p44/p42ERK1/2 MAPK signalling pathway seems to play a role in this anti-inflammatory effect.
Aunque la arteriosclerosis es sin duda un proceso multifactorial, universalmente se acepta el papel del colesterol en la conformación de la placa aterosclerosa, no solo por su presencia esencial en el núcleo lipídico de la misma sino por su relación con la incidencia de accidentes vasculares, principalmente a nivel coronario1.
Ezetimibe es el primero de una nueva clase de agentes hipolipemiantes que inhiben selectivamente la absorción del colesterol intestinal y biliar de la dieta, así como otros esteroles de origen vegetal relacionados2,3. En la actualidad se dispone de una amplia experiencia clínica que demuestra la eficacia hipolipemiante de ezetimibe tanto en monoterapia como en combinación con cualquier estatina4.
Sin embargo, a pesar de su capacidad hipolipemiante, no existen todavía estudios clínicos que valoren directamente el efecto de ezetimibe sobre los eventos cardiovasculares. Por ello, en los últimos años, varios trabajos han evaluado su efecto ateroprotector empleando distintos modelos experimentales. Se ha demostrado que la administración de ezetimibe a ratones deficientes en ApoE reduce el área de la lesión aterosclerótica tanto en aortas como en arterias carótidas5. Este efecto ateroprotector de ezetimibe ha sido recientemente corroborado en un estudio de Dietrich et al6 que demuestra una reducción significativa en el grosor de la pared de la aorta de los animales tratados con ezetimibe medido por resonancia magnética. En comparación con ratones deficientes en ApoE, el tratamiento con ezetimibe de ratones deficientes en ApoE y en la óxido nítrico sintetasa endotelial (eNOS) produce un mayor efecto ateroprotector, sugiriendo así que la ruta de eNOS, aunque no imprescindible, es capaz de aumentar el efecto anti-aterosclerótico de ezetimibe7. En algunos estudios se ha sugerido que ezetimibe podría tener algún otro efecto además de la reducción de lípidos. En este sentido, Nakagami et al8 han demostrado que ezetimibe mejora la función endotelial en ratones deficientes en ApoE, y que este efecto se asocia con un aumento en la expresión génica de eNOS y una disminución en la de la interleucina 6 (IL-6)8. Recientemente, en un modelo de aterosclerosis acelerada en conejo, nuestro grupo ha demostrado que ezetimibe es capaz de reducir el contenido de monocitos/macrófagos de la placa de aterosclerosis a través de la inhibición de la expresión de la proteína quimiotáctica de monocitos MCP-1 (del inglés monocyte chemoattractant protein)9. Además, en comparación con los conejos no tratados, los que recibieron ezetimibe presentaron una menor concentración plasmática de proteína C reactiva (PCR), un marcador inflamatorio que se ha asociado con un aumento del riesgo cardiovascular.
En los últimos años se ha puesto en evidencia que los monocitos/macrófagos juegan un papel fundamental tanto en la formación de la placa de arteriosclerosis como en sus complicaciones trombóticas10,11. Una de las primeras etapas en el desarrollo de la placa de aterosclerosis es la unión de los monocitos circulantes al endotelio vascular a través de moléculas de adhesión, con la posterior transmigración hacia la capa subintimal. Este proceso está favorecido por quimiocinas como MCP-112.
En este trabajo hemos investigado la eficacia antiinflamatoria de ezetimibe in vitro. Para ello, hemos estudiado el efecto de ezetimibe sobre la adhesión y la migración de monocitos humanos y sobre la expresión de diferentes moléculas de adhesión. Puesto que existe amplia evidencia sobre la participación de las cinasas activadas por mitógenos (MAPK), principalmente p42/p44ERK1/2 y p38, sobre la migración celular inducida por quimiocinas13, además hemos investigado la participación de la vía de señalización de las MAPK/p42/p44ERK1/2 en el efecto de ezetimibe.
Material y métodosCultivo celularLas células de la línea de monocitos humanos THP-1 se adquirió en la American Type Culture Collection (ATCC) y se cultivaron en medio RPMI 1640 (BioWhittaker) suplementado con 10% de suero bovino fetal (SBF) decomplementado, 2 mmol/l de L-Glutamina y 50 U/ml de penicilina y estreptomicina a 37°C en una atmósfera con 5% de CO2.
Ensayo de adhesión celularLas células se mantuvieron en medio RPMI 1640 con 0,5% de SBF durante 24h para hacerlas quiescentes, se sembraron en placas de 96 pocillos a razón de 25×103 células/pocillo y se estimularon con forbol 12-miristato 13-acetato (PMA; Sigma-Aldrich) a una concentración de 100 ng/ml durante 20h a 37°C. En algunos experimentos las células se preincubaron con diferentes concentraciones de ezetimibe durante 2h antes de ser estimuladas con PMA. Pasado el tiempo de incubación, se eliminó el medio y se añadió paraformaldehído al 4% en tampón fosfato salino (PBS) durante 20min. Las células fijadas se lavaron y se tiñeron con una solución de cristal violeta al 0,5%. Tras eliminar el exceso de colorante, se añadió acético glacial y se cuantificó la absorbancia a 595nm en un espectrofotómetro (TECAN-Sunrise). Todos los ensayos se realizaron por triplicado.
Ensayo de quimiotaxis celularEl estudio de la respuesta quimiotáctica de las células THP-1 se llevó a cabo usando insertos transwell® de 6,5mm de diámetro con membrana de policarbonato de 5μm de poro (Costar). Un total de 3×105 células se resuspendieron en medio RPMI 1640 con 0,5% de SBF y se colocaron en el pocillo superior. En algunos experimentos las células se incubaron con distintas concentraciones de ezetimibe durante 2h a 37°C una vez colocadas en el pocillo superior. A continuación se añadieron 100 ng/ml de MCP-1 (Preprotech) al pocillo inferior y se permitió que las células migraran durante 1h a 37°C. Finalizado este tiempo, se recogió el contenido del pocillo inferior y se cuantificó el número de células usando un citómetro de flujo EPIS XL-MCL (Beckman Coulter), pasando cada muestra en las mismas condiciones de flujo y tiempo. La quimiotaxis específica se expresó en relación con el porcentaje de células THP-1 que migraron en respuesta a MCP-1, que se tomó como 100%. Todos los estudios se midieron por duplicado.
Citometría de flujoLas células THP-1 resuspendidas en medio RPMI 1640 con 0,5% de SBF se activaron con PMA (100 ng/ml) o MCP-1 (100 ng/ml) durante 24h a 37°C. En algunos experimentos se trataron previamente con ezetimibe (10–5 mol/l) durante 24h a 37°C. Pasado el tiempo de activación, las células se centrifugaron y se incubaron con distintos anticuerpos: anti-CD11a (dilución 1/10), anti-CD11b (dilución 1/10) y anti-CD11c (dilución 1/10) (Beckman Coulter) durante 30min a temperatura ambiente en oscuridad. A continuación se incubaron con un anticuerpo secundario anti-IgG de ratón conjugado con isotiocianato de fluoresceína (FITC) (dilución 1/100; Becton Dickinson) durante 30min. Después de un lavado con PBS, las células se resuspendieron en paraformaldehído al 0,2% en PBS y se pasaron por un citómetro de flujo Cytomics FC500 (Beckman Coulter). Para comprobar si había uniones inespecíficas, todas las muestras se marcaron con un control de isotipo de IgG1-FITC (Beckman Coulter). En cada experimento se midió la intensidad de fluorescencia media (IFM).
Estudios de Western blotLas células se lisaron con un tampón comercial (NE-PER kit; Pierce) suplementado con inhibidores de proteasas: PMSF 0,25mM, aprotinina 2μl/ml, leupeptina 2μg/ml, NaF 1 mmol/l y ortovanadato sódico 100μmol/l. 30μg de extracto de proteínas totales se separaron electroforéticamente en geles de SDS-poliacrilamida al 10% en condiciones reductoras y se transfirieron a membranas de nitrocelulosa (Immobilon P, Millipore). Las uniones inespecíficas de las membranas se bloquearon con tampón tris-borato-salino (TBS) con albúmina de suero bovina (BSA) 5% y Tween-20 al 0,5% durante 1h a temperatura ambiente. Posteriormente la membrana se incubó con un anticuerpo policlonal que reconoce los residuos fosforilados de p44/42ERK1/2 (p-p44/42ERK1/2, dilución 1/1000; Cell Signalling) durante 18h a 4°C. A continuación las membranas se lavaron y se incubaron con un anticuerpo anti-IgG de conejo conjugado con peroxidasa (dilución 1/2.500; Amersham) durante 1h en agitación. Las bandas de las proteínas se detectaron mediante quimioluminiscencia (ECL; Amersham). Como control de carga, las membranas se incubaron con un anticuerpo que reconoce la α-tubulina (dilución 1/8.000, Sigma-Aldrich) durante 2h a temperatura ambiente.
Los resultados se expresan como unidades arbitrarias de densitometrado (UAD) respecto a la expresión de α-tubulina.
Viabilidad celularPara evaluar el efecto de ezetimibe sobre la supervivencia celular se incubaron 3×105 células/pocillo con diferentes concentraciones de ezetimibe. Pasados uno o dos días, la viabilidad celular se determinó mediante un ensayo de exclusión con azul tripán. Para la coloración se mezclaron 10μl de suspensión celular y 10μl de solución de azul tripán al 0,4%. El recuento de las células viables se hizo en un microscopio óptico usando una cámara de Neubauer. La supervivencia celular se expresa como: (número de células vivas tras la incubación con ezetimibe/número de células vivas del grupo control sin ezetimibe)×100.
Análisis estadísticoTodos los datos se expresan como media±error estándar de la media (EEM). Las variables se analizaron mediante los test no paramétricos de Kruskal-Wallis o Mann-Whitney. Los análisis estadísticos se realizaron con el software SPSS para Windows versión 15.0. Las diferencias se consideraron estadísticamente significativas cuando p<0,05.
ResultadosEfecto de ezetimibe sobre la viabilidad celularAntes de proceder a los ensayos de adhesión y quimiotaxis, realizamos estudios de citotoxicidad de ezetimibe. Los monocitos humanos THP-1 se incubaron con las concentraciones más altas de ezetimibe (10–6-10–4 mol/l) a distintos tiempos (24 y 48h). Tras 48h de exposición a ezetimibe, más del 90% de los monocitos eran viables a cualquiera de las dosis estudiadas (10–6 mol/l: 94±8; 10–5 mol/l: 96±6; 10–4 mol/l: 93±3% células vivas).
Ezetimibe disminuye la adhesión de monocitos humanosLas células THP-1 derivan de una línea celular monocítica que crece en suspensión y que no se adhiere a las superficies de plástico de las placas de cultivo14. Sin embargo, tras la activación con PMA estas células se diferencian y adquieren características morfológicas de macrófagos, siendo capaces de adherirse a plástico. Este efecto aumenta a medida que crece la dosis de PMA a la que son expuestas las células (basal: 100±3, PMA 0,1 ng/mL: 109±3, PMA 1 ng/mL: 206±8, PMA 10 ng/ml: 296±19, PMA 100 ng/ml: 410±17% células adheridas, p<0,05).
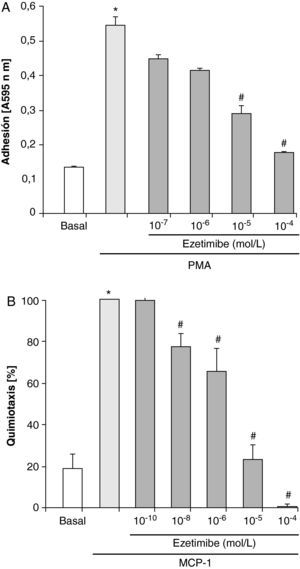
Para estudiar si ezetimibe era capaz de interferir este proceso, en los experimentos siguientes los monocitos se preincubaron con diferentes concentraciones de ezetimibe (10–10-10–4 mol/l) durante 2h y posteriormente se estimularon con PMA 100 ng/ml. El tratamiento de los monocitos con dosis de ezetimibe de 10–10 y 10–9 mol/l no tuvo ningún efecto sobre la adhesión celular inducida por PMA (datos no mostrados), siendo necesarias dosis de 10–7 mol/l y superiores para observar una disminución en la cantidad de células adheridas tras la estimulación con PMA (fig. 1A). La adhesión de los monocitos se redujo más de un 60% con ezetimibe a dosis de 10–5 mol/l y más de un 90% con la dosis de 10–4 mol/l respecto a las células estimuladas solo con PMA.
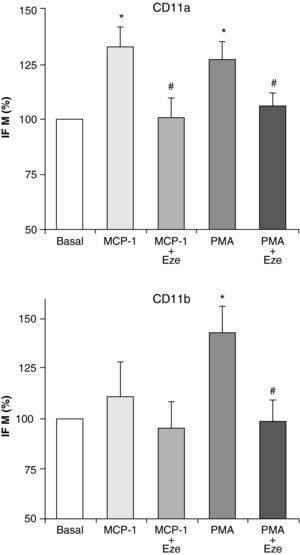
Efecto de distintas concentraciones de ezetimibe sobre la adhesión (A) y la migración (B) de monocitos/macrófagos humanos THP-1 estimulados con PMA (100 ng/ml) o MCP-1 (100 ng/ml), respectivamente. Los datos son la media±EEM, n=5 experimentos por triplicado o duplicado. *p<0,05 vs basal, #p<0,05 vs PMA o MCP-1 solo.
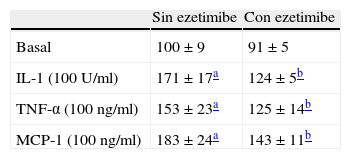
Ezetimibe también fue capaz de inhibir la adhesión de los monocitos inducida por proteínas proinflamatorias como IL-1, TNF-α y MCP-1 (tabla 1).
Efecto de ezetimibe (10–5 mol/l) sobre la adhesión de monocitos THP-1 estimulados con citoquinas proinflamatorias
| Sin ezetimibe | Con ezetimibe | |
| Basal | 100±9 | 91±5 |
| IL-1 (100 U/ml) | 171±17a | 124±5b |
| TNF-α (100 ng/ml) | 153±23a | 125±14b |
| MCP-1 (100 ng/ml) | 183±24a | 143±11b |
Los resultados se expresan como media±EEM, n=3 experimentos por triplicado.
Para evaluar el efecto de ezetimibe sobre la quimiotaxis de los monocitos THP-1 utilizamos MCP-1 (100 ng/ml) como inductor. En la figura 1B se muestra que ezetimibe fue capaz de inhibir la quimiotaxis de estas células de forma dependiente de la dosis, alcanzando casi el 100% de inhibición a una concentración de 10–5 mol/l. Un dato un tanto sorprendente fue que la incubación de las células con ezetimibe 10–4 mol/l inhibió la migración de las células por debajo de los valores basales.
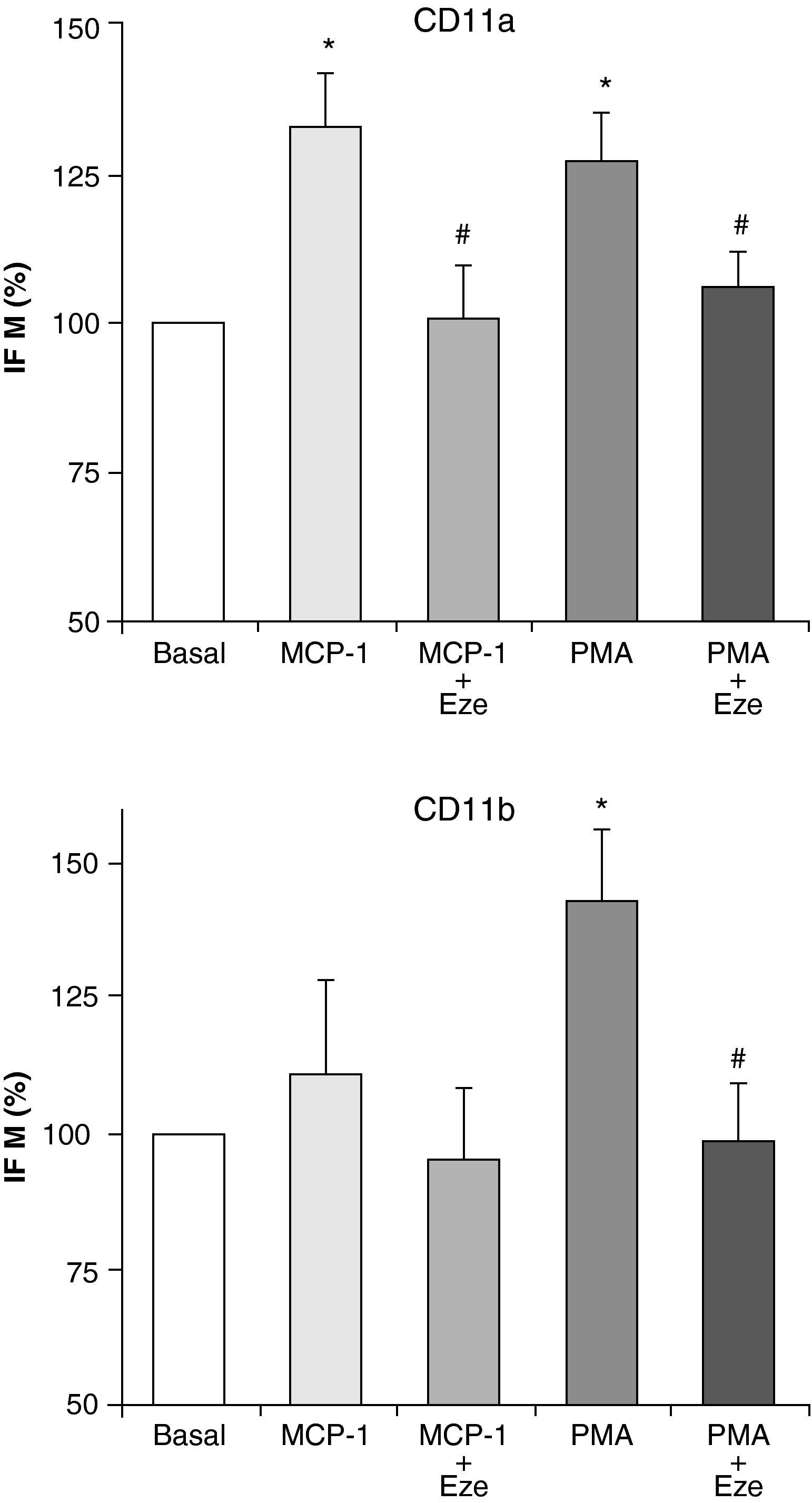
Ezetimibe disminuye la expresión de moléculas de adhesiónDada la importancia de las moléculas de adhesión en el proceso de adhesión de los monocitos al endotelio y su posterior migración, se ha postulado que la inhibición de su expresión podría ser una opción terapéutica antiaterogénica. Por ello, una vez investigados los efectos de ezetimibe sobre la adhesión celular y la quimiotaxis, nos planteamos estudiar si el efecto de ezetimibe podía deberse a su interferencia con la expresión de las integrinas CD11a, CD11b y CD11c. Estas moléculas de adhesión han sido implicadas en el proceso aterosclerótico y se expresan solamente en los leucocitos12. La estimulación de las células con PMA (100 ng/ml) y MCP-1 (100 ng/ml) indujo un aumento en la expresión de CD11a y CD11b analiza por citometría de flujo, aunque el efecto de MCP-1 sobre la expresión de CD11b no alcanzó significación estadística (fig. 2). Ninguno de los dos estímulos fue capaz de alterar la expresión de CD11c (datos no mostrados). Como se muestra en la figura 2, la preincubación de los monocitos con ezetimibe inhibió el efecto de PMA y de MCP-1 sobre la expresión de ambas integrinas, llegando incluso a valores basales.
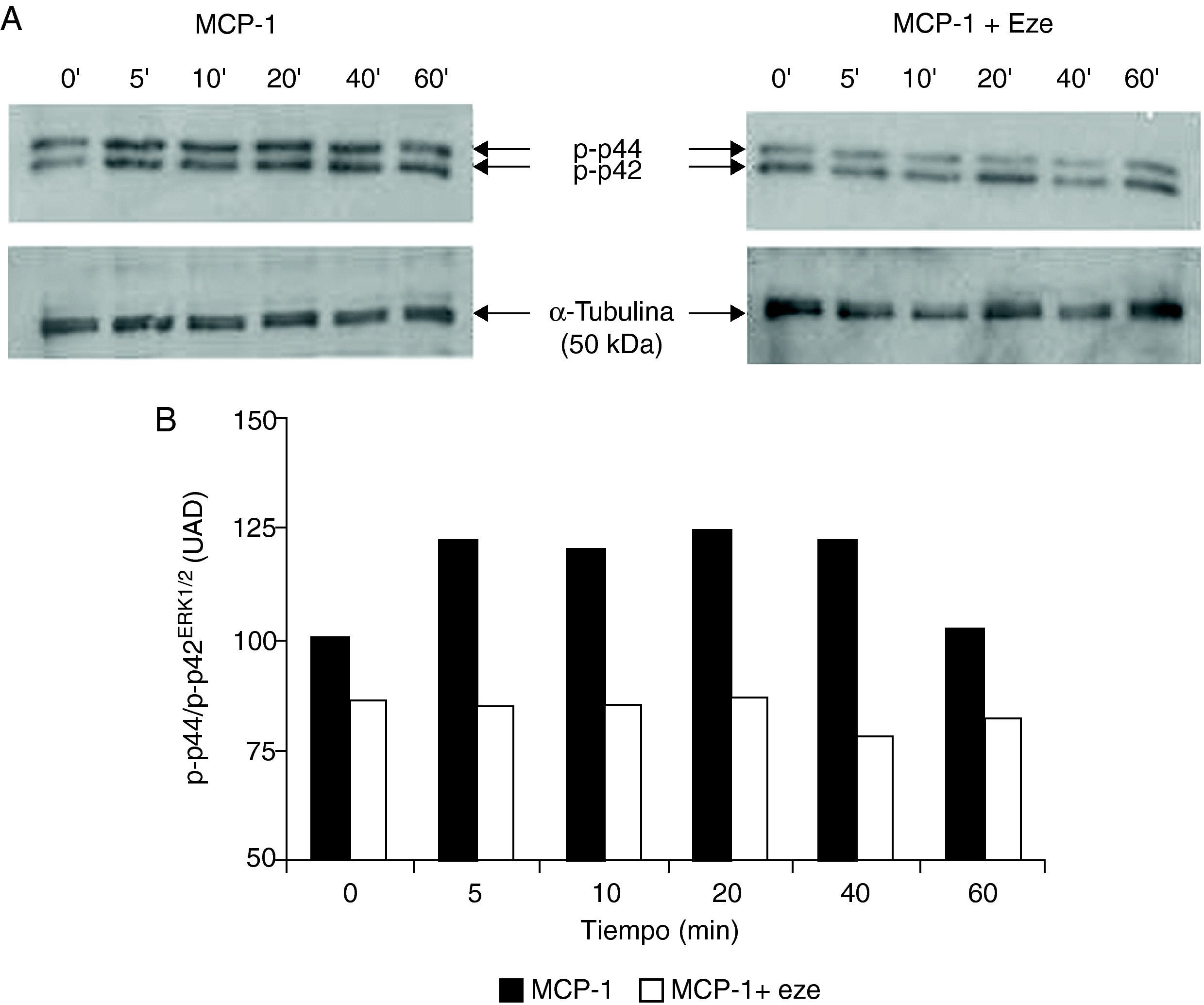
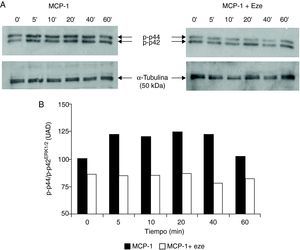
Efecto de ezetimibe sobre la activación de MAPK/p44/p42ERK1/2Puesto que es bien conocida la implicación de la ruta de señalización de las MAPKs, principalmente las cinasas reguladas por señales extracelulares p44/p42ERK1/2, en el proceso de adhesión y migración celular15, nuestro siguiente objetivo fue estudiar el efecto de ezetimibe sobre su activación. Para ello utilizamos un anticuerpo específico que reconoce los residuos fosforilados de treonina y serina de p44/p42ERK1/2, responsables de la actividad de esta proteína. Como se había descrito previamente, la estimulación de monocitos con MCP-1da lugar a la activación de p44/p42ERK1/2. El pretratamiento de las células con ezetimibe durante 24h redujo la activación de p44/p42ERK1/2 inducida por MCP-1 a todos los tiempos estudiados (fig. 3).
Efecto de ezetimibe sobre la activación de p44/p42ERK1/2 en monocitos humanos THP-1 evaluada por Western blot. (A). Las autorradiografías muestran un experimento representativo. Las células se incubaron en ausencia o presencia de ezetimibe (10–5 mol/l) y se estimularon con MCP-1 (100 ng/ml) a diferentes tiempos. Los lisados de las células se revelaron con un anticuerpo que reconoce los residuos de serina y treonina fosforilados (p-p44/p42ERK1/2). (B). Análisis densitométrico de la expresión de la forma fosforilada p44/p42ERK1/2. Los resultados se expresan como unidades arbitrarias de densitometrado (UAD) respecto a la α-tubulina que se utilizó como control de carga.
Los monocitos/macrófagos desempeñan un papel fundamental en todas las etapas de la aterosclerosis, por lo que constituyen una importante diana terapéutica anti-aterosclerótica. Recientemente, nuestro grupo ha demostrado que ezetimibe es capaz de reducir el contenido de monocitos/macrófagos de la placa de aterosclerosis a través de la inhibición de la expresión de MCP-19. En este trabajo hemos demostrado que ezetimibe es capaz de interferir el proceso de adhesión de los monocitos diferenciados con PMA o estimulados por citoquinas proinflamatorias como IL-1, TNF-α o MCP-1 y la quimiotaxis inducida por MCP-1 in vitro a través de la inhibición de la expresión de las integrinas leucocitarias CD11a y CD11b. Además, este efecto antiinflamatorio de ezetimibe podría estar mediado, al menos en parte, por la inhibición de la ruta de señalización de las MAPK/ p44/p42ERK1/2.
En la actualidad la arteriosclerosis se considera una enfermedad inmunológico-inflamatoria sistémica de la sangre y de los vasos. Los macrófagos, las células endoteliales y las células musculares lisas producen citoquinas inflamatorias como TNF-α, interferón gamma (IFN-γ), IL-1 e IL-6. Diversos estudios han demostrado que niveles plasmáticos elevados de estas citoquinas predicen la existencia de futuros episodios cardiovasculares, incluso en sujetos aparentemente sanos16. Estas citoquinas rompen el equilibrio fisiológico que mantienen las células endoteliales en relación con la producción de óxido nítrico y el número de moléculas de adhesión, generando disfunción celular. Tanto en modelos animales de aterosclerosis como en lesiones ateroscleróticas humanas, las moléculas de adhesión se encuentran sobreexpresadas en relación con el tejido vascular normal17. Además, se ha demostrado que los ratones deficientes en selectina-E, selectina-P o ICAM-1 desarrollan menos arteriosclerosis que los ratones normales. También en humanos, tanto en sujetos sanos como en pacientes con enfermedad coronaria previa, se observó que un aumento en los valores plasmáticos de selectina-E, ICAM-1 o VCAM-1 predecía la posibilidad de presentar un episodio cardiovascular. La interacción entre el endotelio y los monocitos/macrófagos se realiza a través de la unión entre las integrinas de la familia β2, principalmente CD11a/CD18 y CD11b/CD18, y las moléculas de adhesión expresadas por el endotelio ICAM-1 y VCAM-112. Una vez que las células están adheridas al endotelio, migran al espacio subendotelial atraídas por citoquinas como MCP-1 o la IL-810–12. MCP-1 es el principal factor encargado del reclutamiento de monocitos. Se ha demostrado que ratones deficientes en MCP-1, o en su receptor, poseen un menor número de monocitos infiltrados, a la vez que una disminución en el desarrollo de la lesión ateromatosa18,19. En pacientes con síndrome coronario agudo las concentraciones plasmáticas de MCP-1 se han asociado con diferentes factores de riesgo cardiovascular, así como con un mayor riesgo de padecer un episodio cardiovascular en el futuro20. En nuestro trabajo hemos observado que la preincubación de los monocitos con ezetimibe inhibe la adhesión y la migración celular coincidiendo con la disminución en la expresión de CD11a y CD11b. Algunos estudios han demostrado que la expresión de estas moléculas de adhesión está mediada por la activación del factor de transcripción NF-κB. En un trabajo previo, nuestro grupo ha demostrado que la administración de ezetimibe disminuye la actividad NF-κB en monocitos circulantes9. En conjunto, nuestros resultados sugieren un mecanismo por el cual ezetimibe podría interferir con el reclutamiento de las células en los sitios de la lesión.
Un dato importante que hay que destacar de nuestros resultados es que el PMA no es en rigor un inductor de adhesión sino de diferenciación de THP-1 a macrófagos, por lo que en este caso el efecto de ezetimibe sería inhibidor de la diferenciación más que propiamente de la adhesión. Sin embargo, el hecho de que ezetimibe inhiba también la adhesión de citoquinas proinflamatorias que no inducen la diferenciación de los monocitos sugiere que ezetimibe podría interferir tanto en el reclutamiento de monocitos como en su posterior diferenciación, un proceso que ha demostrado ser clave en el desarrollo de la arteriosclerosis10–12.
Aunque la interacción dinámica entre los leucocitos y las células endoteliales está mayoritariamente regulada por uniones físicas entre moléculas de adhesión12,17, se ha visto que las cascadas de transducción de señales también tienen un importante papel en este mecanismo. Actualmente hay muchas evidencias que apoyan que las MAPKs juegan un papel importante en la regulación no solo de procesos como la proliferación celular, la apoptosis, la migración o la diferenciación, sino también en la expresión de muchos genes proinflamatorios implicados en el desarrollo de la aterosclerosis13. Además, se ha descrito que las diferentes cascadas de las MAPKs están implicadas en la activación de las integrinas y en la quimiotaxis de monocitos THP-1. Por ejemplo, la diferenciación de monocitos THP-1 a macrófagos con PMA induce la activación de la cascada de señalización de p44/p42ERK1/2, que activa a su vez el factor de transcripción NF-κB regulando la expresión de ICAM-1 entre otras moléculas21,22. También la migración de los monocitos inducida por MCP-1 depende de la activación de varias MAPK, como p44/p42ERK1/2 o p3823. Nuestros resultados sugieren que ezetimibe podría inhibir la expresión de moléculas de adhesión a través de la inhibición de la activación de p44/p42ERK1/2.
La relación entre hipercolesterolemia e inflamación es bien conocida. La estatinas, los fármacos hipolipemiantes más utilizados, han demostrado su capacidad de inhibir la expresión de proteínas proinflamatorias (por ej., TNF-α, IL-1 e IL-6) y proteínas quimiotácticas (por ej., IL-8, RANTES y MCP-1)24,25. También se las ha involucrado en la inhibición del factor de transcripción NF-κB, relacionado con la expresión de genes proinflamatorios, y en el aumento de la actividad de factores de transcripción que antagonizan la expresión de genes proinflamatorios como el sistema PPAR26–28. Algunas estatinas reducen la adhesión celular y la expresión de integrinas29,30. Incluso algunos estudios, como el JUPITER (Justification for the Use of statins in Primary prevention: an Intervention Trial Evaluating Rosuvastatin), apoyan la utilidad de la monitorización de los niveles de inflamación como guía terapéutica en la prevención de episodios cardiovasculares31.
No hay muchos estudios que evalúen el efecto antiinflamatorio de ezetimibe, aunque los que existen sugieren que este efecto existe, sobre todo cuando se administra con una estatina. En pacientes con hipercolesterolemia, la administración de ezetimibe disminuyó los niveles plasmáticos de PCR con respecto a pacientes no tratados, aunque esta disminución solo alcanzó significación estadística cuando el ezetimibe se administró en combinación con simvastatina32. Por el contrario, en pacientes con artritis reumatoide tratados con ezetimibe en monoterapia sí se observó una reducción significativa de los niveles de PCR de forma similar a como lo hizo simvastatina32. Es interesante destacar que la administración de ezetimibe junto con una estatina se asoció con una mayor reducción de los valores de PCR, aunque no cuando se administró junto a un fibrato33. Ezetimibe también ha demostrado que puede disminuir los niveles plasmáticos de la lipoproteína asociada a fosfolipasa A2 (Lp-PLA2), otro parámetro inflamatorio implicado en el proceso aterogénico32. En modelos experimentales, todos los trabajos publicados hasta el momento demuestran un efecto antiinflamatorio de ezetimibe7–9.
La ruta de señalización por la cual ezetimibe podría ejercer su efecto antiinflamatorio no se conoce aún. Sin embargo, la aminopeptidasa N (APN) o CD13, recientemente identificada como una molécula diana de ezetimibe34, se ha relacionado con fenómenos de adhesión y migración de los leucocitos35. Se ha demostrado que los monocitos localizados en los sitios de inflamación expresan grandes cantidades de APN/CD13 en sus membranas35. Además, inhibidores de su actividad han demostrado ser potentes compuestos inmunomoduladores, antiinflamatorios y antiproliferativos35. En los monocitos se ha descrito que APN/CD13 induce una activación rápida de las quinasas de tirosina36. Además, la incubación de monocitos/macrófagos con ezetimibe reduce la expresión superficial de APN/CD13, así como de CD16, CD64 y el receptor «basura» (scavenger) CD36, lo que impide la diferenciación de las células y la absorción de lípidos37, otro de los pasos claves en el proceso inflamatorio.
Una limitación de nuestro estudio es que la dosis de ezetimibe es más de 400 veces mayor que la encontrada en plasma humano. Sin embargo, ni siquiera a dosis tan elevadas se ha observado inhibición de procesos bioquímicos o celulares. Además, en estudios toxicológicos y de carcinogénesis realizados en ratas, ratones y perros con dosis de ezetimibe hasta 1.000 veces mayores que las encontradas en plasma humano no se han descrito lesiones proliferativas ni toxicidad en órganos diana38.
En resumen, en este trabajo hemos demostrado que ezetimibe es capaz de interferir el proceso de la adhesión y la quimiotaxis de monocitos in vitro a través de la reducción en la expresión de moléculas de adhesión. Además, este efecto antiinflamatorio de ezetimibe parece estar mediado, al menos en parte, por la inhibición de la ruta de señalización de las MAPK p44/p42ERK1/2. El esclarecimiento de los mecanismos de acción de ezetimibe nos puede ayudar a identificar con más detalle los pacientes que mejor se pueden beneficiar de esta terapia.
Queremos agradecer la asistencia técnica en la realización de los estudios de Western Blot del Laboratorio de Fisiopatología osteoarticular de la Fundación Jiménez Díaz. Este trabajo ha sido financiado en parte con ayudas del Fondo de Investigación Sanitaria (07/882, 09/2322, 10/1009) y la Red de Investigación en Insuficiencia Cardiaca (REDINSCOR, 06/0003/0011). DG-G pertenece al Programa de Estabilización de Personal Investigador del Instituto de Salud Carlos III y la Comunidad de Madrid. Una comunicación referente a esta línea de trabajo titulada «Ezetimibe inhibe la adhesión y migración de monocitos humanos inducida por citoquinas proinflamatorias» fue presentada en el XXIII Congreso Nacional de la SE, en Pamplona (2009), y galardonada con una Mención Especial.