Este estudio se diseñó para establecer la correlación entre la concentración de lipoproteína(a) [Lp(a)], apolipoproteínas y lípidos con los parámetros bioquímicos de función hepática en un grupo de pacientes con colestasis reversible, así como la concentración de estos parámetros una vez resuelto el proceso de obstrucción biliar.
Material y métodosSe incluyeron en el estudio de forma prospectiva 18adultos mayores de 17años con colestasis extrahepática y se determinaron los parámetros de función hepática, así como los parámetros del metabolismo lipídico y lipoproteico, especialmente Lp(a) antes y después de la desobstrucción.
ResultadosLa concentración de Lp(a) previa a la desobstrucción se correlacionó inversamente de forma estadísticamente significativa con la concentración de gamma glutamil transpeptidasa (coeficiente de correlación [r]=–0,757; p=0,018).
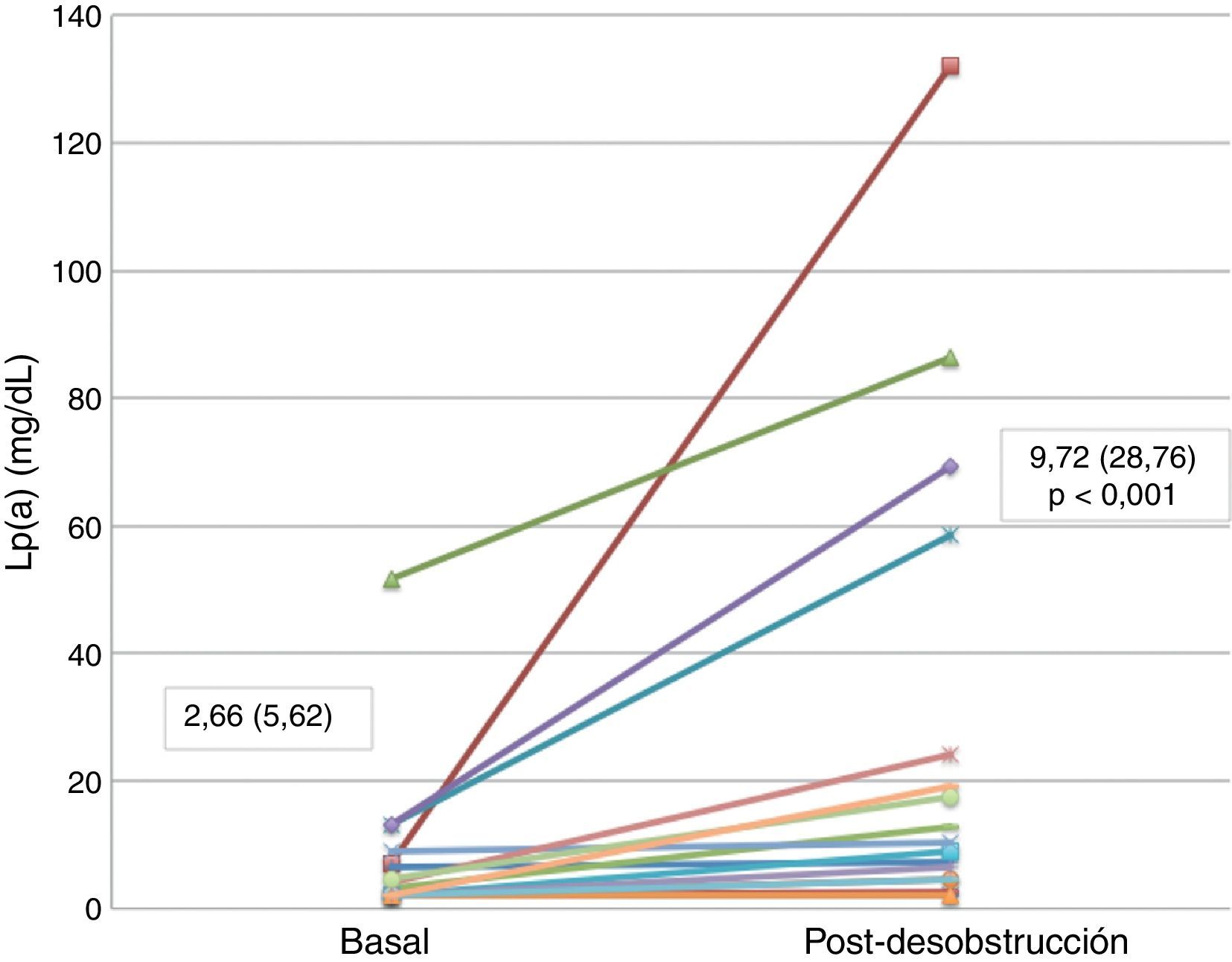
La concentración de Lp(a) (mediana=2,66mg/dl; rango intercuartílico=5,62) se elevó de forma estadísticamente significativa tras la desobstrucción (mediana=9,72mg/dl; rango intercuartílico=28,76; p=0,001).
Hubo descensos estadísticamente significativos tras la desobstrucción en las concentraciones de colesterol total y triglicéridos y ascensos estadísticamente significativos en colesterol HDL y apolipoproteínaA-1.
ConclusionesLa concentración de Lp(a) se encuentra disminuida durante la colestasis, a pesar de existir una importante hipercolesterolemia simultánea. La colestasis ejerce un papel causal en el descenso de Lp(a), ya que la desobstrucción de la vía biliar recupera las concentraciones de Lp(a).
Nuestro estudio apoya el concepto de que los ácidos biliares ejercen un efecto represor en la síntesis de Lp(a) y abre un mecanismo para el tratamiento de la hiper Lp(a).
This study was appointed to determine the correlation between the concentration of lipoprotein(a) [Lp(a)], apolipoproteins and lipids with biochemical parameters of liver function in a group of patients with reversible cholestasis. We have also determined the concentration of these parameters once solved the biliary obstruction process.
Material and methodsEighteen adults over 17years with extrahepatic cholestasis were included in the study on a prospective basis, and we determined in them biochemical liver function parameters and lipoprotein metabolism parameters, particularly Lp(a) before and after unblocking.
ResultsThe concentration of Lp(a) prior to desobstruction was inverse and statistically significantly correlated with the concentration of gamma glutamyl transpeptidase (correlation coefficient [r]=–0.757, P=.018).
The concentration of Lp(a) (median=2.66mg/dL, interquartile range=5,62) showed a statistically significant increase (median=9.72mg/dL, interquartile range=28.76, P<.001), once the unblocking was performed. Concentrations of total cholesterol and triglycerides had a statistically significant decrease, and HDL cholesterol and apolipoproteinA-1 showed a statistically significant increase once the unblocking was carried out.
ConclusionsThe concentration of Lp(a) is decreased during cholestasis, although there is a significant simultaneous hypercholesterolemia. Cholestasis has a causal role in lowering Lp(a), because the unblocking of bile duct recovers Lp(a) concentration.
Our study supports the concept that bile acids exert a controlling effect on the synthesis of Lp(a) and open a mechanism for the treatment of hyper Lp(a).
La lipoproteína(a) [Lp(a)] es una lipoproteína rica en colesterol descubierta hace ya 50años por Kaare Berg1. La concentración de Lp(a) en suero varía entre 0,1 y 300mg/dl y se encuentra genéticamente determinada, fundamentalmente, por el tamaño de la apolipoproteína(a) (apo[a]). Las isoformas de tamaño pequeño tienen una mayor concentración de Lp(a) y presuntamente mayor aterogenicidad que las isoformas de mayor tamaño2.
Distintos metaanálisis han demostrado que la concentración plasmática de Lp(a) se asocia positivamente con el riesgo de padecer enfermedad cardiovascular, especialmente enfermedad coronaria e ictus isquémico3-7. Cuando la concentración plasmática de Lp(a) supera los 30mg/dl se incrementa en 2,3 veces el riesgo de padecer episodios cardiovasculares mayores5,8.
El efecto deletéreo cardiovascular de Lp(a) no se conoce con exactitud9,10, aunque se le atribuyen efectos tanto proaterogénicos como protrombóticos, estos últimos debidos a la gran analogía estructural de la apo(a) con el plasminógeno (alrededor del 80%)11.
La síntesis de Lp(a) se lleva a cabo principalmente en el hígado, aunque la localización del lugar exacto donde se produce el ensamblaje entre la partícula LDL y la apo(a) sigue siendo controvertida, ya que los estudios in vivo para conocer la localización del ensamblaje son difíciles, y los pocos de que se dispone son inconsistentes en sus resultados12,13.
Debido a la presencia de apo(a), la partícula Lp(a) es metabólicamente diferente a LDL, ya que presenta una baja afinidad por el receptor de las LDL, muy probablemente debido a la proximidad del enlace disulfuro al lugar de unión de la apoB con el receptor LDL14. La Lp(a) puede unirse a varios receptores de la familia del receptor LDL, incluyendo el receptor para VLDL, LRP1 y megalin/LRP2, incluso con mayor afinidad que por el propio receptor LDL, y de esta forma puede ser captada por hepatocitos, fibroblastos o macrófagos.
Su catabolismo también se desconoce en su mayor parte. Los pacientes con insuficiencia renal presentan concentraciones aumentadas de Lp(a), y se han encontrado fragmentos de la misma en la orina de individuos sanos.
Sin embargo, la contribución cuantitativa del riñón en el catabolismo de Lp(a) calculada a partir de la eliminación de fragmentos de apo(a) parece ser pequeña.
El papel que juega la vía biliar en el metabolismo de la Lp(a) es asimismo desconocido, habiéndose descrito concentraciones bajas de Lp(a) en sujetos con colestasis, a pesar de que la hipercolesterolemia es un fenómeno habitual en este tipo de pacientes. Sin embargo, se desconoce si la colestasis es causa de este descenso, o este es debido a un epifenómeno asociado a la misma15.
Por todo ello, los objetivos del presente estudio fueron: analizar la concentración de Lp(a) en sujetos con colestasis reversible; establecer la relación entre intensidad de colestasis, concentración de colesterol total, colesterol HDL, colesterol LDL y Lp(a), así como analizar las modificaciones en las concentraciones de colesterol LDL, colesterol HDL, apoA-1, apoB y Lp(a) tras desobstrucción de la vía biliar.
Material y métodosSujetosSe han incluido en el estudio de forma prospectiva adultos mayores de 17años con colestasis (definida por aumento importante de la concentración de bilirrubina total a expensas básicamente de la fracción conjugada: bilirrubina directa mayor de 5mg/dl) debida a obstrucción extrahepática de la vía biliar demostrable por técnicas de imagen, y ser la colestasis previsiblemente reversible total o parcialmente a corto plazo (menor de un mes). Los criterios de exclusión fueron: pacientes que presentaban una hepatopatía crónica conocida previa a la colestasis; consumo de fármacos hipolipemiantes en el momento del diagnóstico de la colestasis, e imposibilidad de seguimiento posdesobstrucción de la vía biliar.
MétodosLas determinaciones analíticas incluyeron: alanina aminotransferasa (ALT), aspartato aminotransferasa (AST), gamma glutamil transpeptidasa (gamma GT), fosfatasa alcalina, bilirrubina total, bilirrubina directa, colesterol total, triglicéridos, colesterol HDL, colesterol LDL, apoA-1, apoB y Lp(a).
Todas las determinaciones bioquímicas del perfil hepático fueron realizadas mediante métodos completamente automatizados en un Autoanalizador Olympus 2700 (Beckmann Coulter, EE.UU.). Colesterol total y triglicéridos se determinaron también de forma automatizada (Autoanalizador Olympus 2700) por métodos enzimáticos convencionales (Beckmann Coulter, EE.UU.). LDL colesterol se calculó utilizando la fórmula de Friedewald, cuando los triglicéridos eran inferiores a 400mg/dl.
ApoA-1 y apoB, así como Lp(a) en suero, se determinaron mediante un método de nefelometría cinética automatizado en un Analizador Immage 800 (Beckmann Coulter, EE.UU.). Esta técnica se basa en la medida de la luz dispersada por las partículas originadas en la solución como consecuencia de los complejos formados en la reacción antígeno-anticuerpo. En el caso de la determinación de Lp(a), la técnica presenta una sensibilidad analítica de 0,002g/l, no hay reactividad cruzada con apoB (<1%) y la reactividad cruzada con plasminógeno es <5%.
La heterogeneidad respecto al tamaño de apo(a) presenta un efecto moderado en la recuperación de Lp(a)16.
En todos los pacientes se realizó una medición antes y otra al menos una semana después de la desobstrucción.
Estudio estadísticoLas variables cuantitativas, al no cumplir los criterios de distribución normal, se describen con la mediana y el rango intercuartílico (percentil 75-percentil 25).
Para medir la asociación entre parejas de variables cuantitativas se calcularon los coeficientes de correlación de Spearman con sus correspondientes niveles de significación estadística. Además se utilizó el test no paramétrico de Wilcoxon para las comparaciones entre los valores de las variables cuantitativas pre y posdesobstrucción de las vía biliar. Se consideraron estadísticamente significativos los valores de p<0,05. El análisis estadístico se realizó con el software IBM-SPSS 20.
ResultadosSe estudiaron un total de 18 pacientes, todos ellos afectados de obstrucción biliar extrahepática, bien de naturaleza benigna (6pacientes padecían coledocolitiasis) o maligna (3pacientes presentaban colangiocarcinoma, 6adenocarcinoma, un paciente padecía neoplasia quística mucinosa, y 2 de ellos, ampuloma).
La totalidad de pacientes presentaron elevación de la concentración de bilirrubina total en plasma (mediana=13,20mg/dl; rango intercuartílico=12,26), siempre a expensas de la fracción conjugada (mediana bilirrubina directa=7,29mg/dl; rango intercuartílico=7,10).
La mediana de Lp(a) fue de 2,66mg/dl, y el rango intercuartílico=5,62.
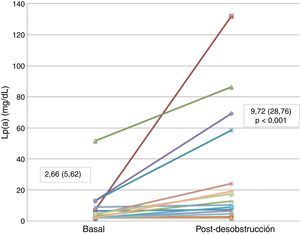
De los 18pacientes, 8 presentaron una concentración de Lp(a) inferior a 2mg/dl (límite de detección del ensayo), 7 presentaban una concentración de Lp(a) entre 2 y 10mg/dl, 2 entre 10 y 30mg/dl, y solamente uno presentó una concentración superior a 30mg/dl (fig. 1).
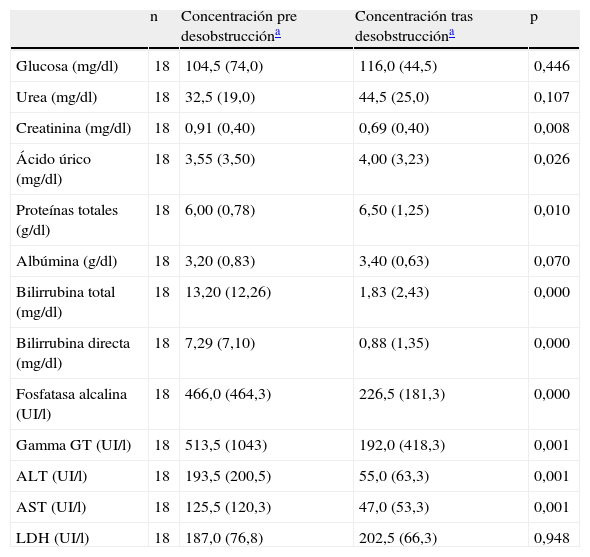
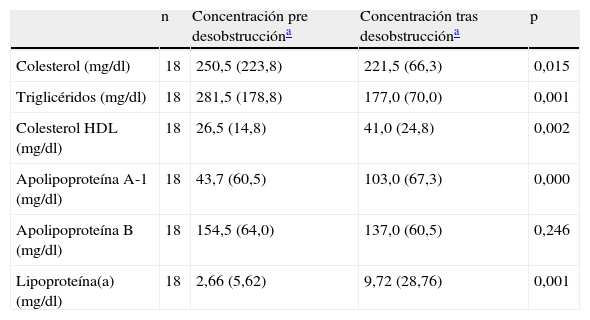
La concentración de las enzimas hepáticas y de las variables lipídicas pre y posdesobstrucción se describen en las tablas 1 y 2, respectivamente, destacando la importante elevación de colesterol total en el momento de la obstrucción.
Concentración de los diferentes parámetros bioquímicos antes y después de la desobstrucción de las vías biliares
| n | Concentración pre desobstruccióna | Concentración tras desobstruccióna | p | |
| Glucosa (mg/dl) | 18 | 104,5 (74,0) | 116,0 (44,5) | 0,446 |
| Urea (mg/dl) | 18 | 32,5 (19,0) | 44,5 (25,0) | 0,107 |
| Creatinina (mg/dl) | 18 | 0,91 (0,40) | 0,69 (0,40) | 0,008 |
| Ácido úrico (mg/dl) | 18 | 3,55 (3,50) | 4,00 (3,23) | 0,026 |
| Proteínas totales (g/dl) | 18 | 6,00 (0,78) | 6,50 (1,25) | 0,010 |
| Albúmina (g/dl) | 18 | 3,20 (0,83) | 3,40 (0,63) | 0,070 |
| Bilirrubina total (mg/dl) | 18 | 13,20 (12,26) | 1,83 (2,43) | 0,000 |
| Bilirrubina directa (mg/dl) | 18 | 7,29 (7,10) | 0,88 (1,35) | 0,000 |
| Fosfatasa alcalina (UI/l) | 18 | 466,0 (464,3) | 226,5 (181,3) | 0,000 |
| Gamma GT (UI/l) | 18 | 513,5 (1043) | 192,0 (418,3) | 0,001 |
| ALT (UI/l) | 18 | 193,5 (200,5) | 55,0 (63,3) | 0,001 |
| AST (UI/l) | 18 | 125,5 (120,3) | 47,0 (53,3) | 0,001 |
| LDH (UI/l) | 18 | 187,0 (76,8) | 202,5 (66,3) | 0,948 |
Concentraciones de los diferentes parámetros lipídicos antes y después de la desobstrucción de las vías biliares
| n | Concentración pre desobstruccióna | Concentración tras desobstruccióna | p | |
| Colesterol (mg/dl) | 18 | 250,5 (223,8) | 221,5 (66,3) | 0,015 |
| Triglicéridos (mg/dl) | 18 | 281,5 (178,8) | 177,0 (70,0) | 0,001 |
| Colesterol HDL (mg/dl) | 18 | 26,5 (14,8) | 41,0 (24,8) | 0,002 |
| Apolipoproteína A-1 (mg/dl) | 18 | 43,7 (60,5) | 103,0 (67,3) | 0,000 |
| Apolipoproteína B (mg/dl) | 18 | 154,5 (64,0) | 137,0 (60,5) | 0,246 |
| Lipoproteína(a) (mg/dl) | 18 | 2,66 (5,62) | 9,72 (28,76) | 0,001 |
No se han presentado los valores de colesterol LDL por tener un gran número de pérdidas (9pacientes presentaron una concentración de triglicéridos previa a la desobstrucción superior a 400mg/dl).
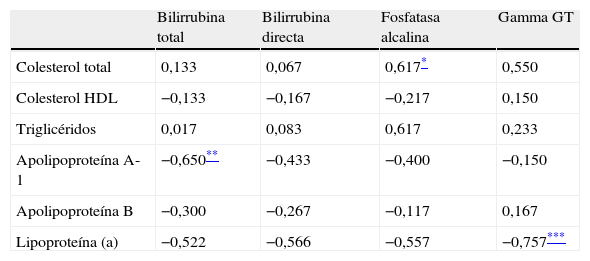
La concentración de Lp(a) previa a la desobstrucción se correlacionó inversamente de forma estadísticamente significativa con la concentración de gamma GT (coeficiente de correlación [r]=–0,757; p=0,018), correlación que desapareció tras la desobstrucción. No se encontró correlación estadísticamente significativa entre Lp(a) y el resto de parámetros bioquímicos de función hepática (tabla 3).
Correlación entre los parámetros lipídicos y los parámetros bioquímicos de función hepática previos a la desobstrucción biliar
| Bilirrubina total | Bilirrubina directa | Fosfatasa alcalina | Gamma GT | |
| Colesterol total | 0,133 | 0,067 | 0,617* | 0,550 |
| Colesterol HDL | −0,133 | −0,167 | −0,217 | 0,150 |
| Triglicéridos | 0,017 | 0,083 | 0,617 | 0,233 |
| Apolipoproteína A-1 | −0,650** | −0,433 | −0,400 | −0,150 |
| Apolipoproteína B | −0,300 | −0,267 | −0,117 | 0,167 |
| Lipoproteína (a) | −0,522 | −0,566 | −0,557 | −0,757*** |
En cuanto al resto de parámetros, colesterol total se correlacionó de forma directa y estadísticamente significativa con fosfatasa alcalina (r=0,617, p=0,077), y apoA-1 de forma inversa y estadísticamente significativa con bilirrubina total (r=0,650; p=0,058) (tabla 3).
Tras la resolución del proceso, en su mayor parte tras colocación de una prótesis biliar, las concentraciones plasmáticas de bilirrubina total y directa se normalizaron o disminuyeron >80% con respecto a la fase obstructiva (mediana bilirrubina total tras desobstrucción=1,83mg/dl; rango intercuartílico=2,43; p<0,001; y mediana de bilirrubina directa=0,88mg/dl; rango intercuartílico=1,35; p<0,001), elevándose de forma estadísticamente significativa la concentración de Lp(a) (mediana tras desobstrucción=9,72mg/dl; rango intercuartílico=28,76; p=0,001) (tablas 1 y 2).
Además, hubo descensos estadísticamente significativos tras la desobstrucción en las concentraciones de colesterol total y triglicéridos y ascensos estadísticamente significativos en colesterol HDL y apoA-1, no obteniéndose diferencias estadísticamente significativas en la concentración de apoB (tabla 2). Cuando subdividimos a los pacientes en 2grupos según si la obstrucción era debida a un proceso benigno o maligno, se mantuvieron las diferencias en ambos grupos.
En la figura 1 se muestra la concentración de Lp(a) de cada uno de los pacientes pre y posdesobstrucción.
DiscusiónComo hallazgos relevantes del estudio lipídico de estos pacientes podemos destacar la existencia de concentraciones elevadas de colesterol total y triglicéridos, que disminuyeron significativamente tras la desobstrucción, y concentraciones bajas de colesterol HDL y apoA-1, que se elevaron tras la desobstrucción. Estos cambios en el perfil lipídico asociados a la colestasis han sido muy bien establecidos en los múltiples estudios que se han realizado en los últimos años en pacientes con patología de la vía biliar15,17. La hipercolesterolemia en pacientes con colestasis se debe a la extravasación del colesterol libre biliar al torrente sanguíneo con el consiguiente aumento del colesterol no unido a lipoproteínas clásicas y al transporte de dicho colesterol ligado a la albúmina, dando lugar a una lipoproteína conocida como LpX18.
Sin embargo, la bibliografía en torno a la Lp(a) en la obstrucción biliar es muy escasa, y la que estudia la Lp(a) de forma prospectiva durante el proceso obstructivo, casi inexistente.
En 1994 Gregory et al.19 encontraron niveles disminuidos de Lp(a) en pacientes afectados de cirrosis biliar primaria (CBP). Estos autores estudiaron los niveles de Lp(a) en 42pacientes diagnosticados de CBP, todos ellos con anticuerpos antimitocondriales positivos e histología hepática compatible con dicha enfermedad y se compararon con 39pacientes (emparejados en cuanto a edad y sexo a los primeros) afectados por otras enfermedades hepáticas crónicas, y con 432controles voluntarios sanos. La mediana de Lp(a) en el grupo de pacientes con CBP (28,5mg/l) fue inferior a la del grupo control (75mg/dl) y no fue significativamente diferente a la mediana del grupo de pacientes con enfermedad hepática distinta de CBP (52mg/l).
En ambos grupos hubo una mayor proporción de pacientes con niveles séricos indetectables de Lp(a) comparados con el grupo control (p<0,001 tanto para el grupo de CBP vs. controles como para el grupo de otras enfermedades hepáticas vs. controles).
Se encontró correlación negativa estadísticamente significativa entre Lp(a) y bilirrubina tanto en CBP como en el grupo de otras enfermedades hepáticas.
Chennamsetty et al.20, en un estudio muy similar al nuestro, parten de un grupo de pacientes con obstrucción biliar extrahepática y también constatan que todos estos pacientes tienen niveles bajos de Lp(a), niveles que aumentan significativamente tras el tratamiento ya sea quirúrgico o endoscópico exitoso de la obstrucción.
En este estudio los autores identificaron el receptor nuclear FXR como un represor importante de la producción de Lp(a), tanto en pacientes como en ratones con niveles elevados de ácidos biliares. Dicho receptor ya se había descrito anteriormente como ligando de ácidos biliares21-25.
La ligadura de los conductos biliares en los ratones transgénicos para LPA humana, gen que codifica apo(a), era capaz de suprimir la expresión hepática de apo(a). Además, se puso de manifiesto que la transcripción del gen LPA está fuertemente controlada por el receptor farnesoide (FXR), el cual se une a un elemento de control negativo localizado en el promotor humano de LPA. De esta forma, FXR interfiere con el factor nuclear4alfa mediado del hepatocito (HNF4 alfa mediado, también conocido como NR2A1) en la activación de la transcripción de LPA26.
Para demostrar firmemente que FXR activado por los ácidos biliares reprimía la expresión de apo(a) en condiciones más fisiológicas, estos autores alimentaron ratones transgénicos LPA y ratones transgénicos LPA/FXR−/− con ácidos biliares. Esta alimentación con ácidos biliares disminuyó la concentración plasmática de apo(a), así como la expresión de los genes y los niveles de proteína en los ratones transgénicos LPA, efecto que estaba abolido en los ratones transgénicos LPA/FXR−/−.
En los individuos sanos la concentración plasmática de Lp(a) se ha demostrado que se correlaciona significativamente con la velocidad de síntesis de apo(a)27,28 y parece estar mínimamente afectada por su catabolismo. Por ello, la activación farmacológica de FXR podría constituir una nueva y prometedora aproximación para tratar a los individuos con concentración elevada de Lp(a), reduciendo así los efectos cardiovasculares adversos en esta población de alto riesgo.
Es interesante comprobar que los nuevos agonistas de FXR muestran efectos antiescleróticos en ratones29 y normalizan la dislipidemia30 en modelos animales de roedores que carecen de la expresión de LPA y será necesario monitorizar los posibles efectos adversos que puedan presentar mediante la realización de ensayos clínicos.
El hecho de que aparezcan nuevos medicamentos que puedan conseguir disminuir los niveles plasmáticos de Lp(a) es muy importante, ya que en la actualidad no se dispone de fármacos que consigan la disminución de la concentración plasmática de Lp(a).
ConclusionesEn resumen, nuestro estudio demuestra que la concentración de Lp(a) se encuentra disminuida durante la colestasis, a pesar de existir una importante hipercolesterolemia simultánea. La colestasis ejerce un papel causal en el descenso de Lp(a), ya que la desobstrucción de la vía biliar recupera las concentraciones de Lp(a).
Nuestro estudio apoya el concepto de que los ácidos biliares ejercen un efecto represor en la síntesis de Lp(a) y abre un mecanismo para el tratamiento de la hiper Lp(a).
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.