Se ha demostrado que el inflamasoma NLRP1 es clave en la disfunción endotelial, estando las plaquetas implicadas en las reacciones inflamatorias que la desencadenan.
Investigamos la inhibición in vivo de la inflamación plaquetario-dependiente mediante inhibición del receptor P2Y vía ADP comparada con la de la enzima COX sobre la transcripción del NLRP1 en las células endoteliales.
MétodosEstudio prospectivo, aleatorizado, abierto y cruzado con 2 periodos de inhibición plaquetaria en 20 voluntarios sanos, administrando clopidogrel 75mg/día/7días y aspirina 100mg/día/7días de forma cruzada tras un periodo de lavado de una semana.
Las células endoteliales aórticas humanas (HAEC) fueron estimuladas 2h con plasma obtenido de los pacientes antes y después de la inhibición plaquetaria. La cuantificación de la expresión de NLRP1 se determinó mediante análisis qRT PCR.
ResultadosLas HAEC expuestas a plasma basal de individuos sanos presentaron niveles más elevados del NLRP1 que las expuestas a plasma de los participantes tras la administración de aspirina o clopidogrel [cuantificación relativa (CR), 1,077±0,05 vs. 1,002±0,06; OR, 1,8; IC95, 1,1-2,9; p<0,01 y 1,077±0,05 vs. 1,04±0,03; OR, 1,7; IC95, 1,2-2,6; p<0,001, respectivamente]. La expresión del NLRP1 en HAEC expuestas a plasma de los participantes tras la administración de aspirina o clopidogrel fue similar a las HAEC sin exposición a plasma humano (PBS) [CR 1,002±0,06 vs. 1,009±0,03; OR, 0,9; IC95, 0,5-1,4; p=0,7 y 1,04±0,03 vs. 1,009±0,03; OR, 0,8; IC95, 0,3-1,2; p=0,5, respectivamente].
No hubo diferencias en el porcentaje de reducción del NLRP1 en las HAEC expuestas al plasma tras la toma de aspirina comparado con la provocada por el plasma de estos mismos sujetos tras clopidogrel (3,8% vs. 2,8%, p=0,3, respectivamente).
ConclusionesLa inhibición plaquetaria por vías P2Y y COX provoca similar efecto en la inhibición del inflamasoma proaterogénico NLRP1 en las HAEC.
NRP1 inflammasome is crucial in endothelial dysfunction. Platelets are mandatory for the inflammation that precedes it. Aspirin could inhibit NLRP1 inflammasome in endothelial cells, and clopidogrel could also provoke a reduction in vascular inflammation.
A study was carried out on the influence of platelet inflammatory inhibition by P2Y receptor inhibition versus COX enzyme inhibition on the transcription of NLRP1 inflammasome in endothelial cells.
MethodsAn open-label, prospective, randomised crossover study with two periods of platelet inhibition enrolled 20 healthy volunteers. They received clopidogrel 75mg/day/7days and aspirin 100mg/day/7days. A venous blood sample was collected from all participants before and after this period. Human aortic endothelial cells (HAECs) were exposed for 2h in cultures. NLRP1 gene expression was then analysed in these cultures.
ResultsHAEC cultures that were exposed to baseline plasma showed higher expression of NLRP1 than HAECs exposed to plasma after one week of aspirin or clopidogrel intake [relative quantification (RQ), 1.077±0.05 vs. 1.002±0.06; OR, 1.8; 95% CI, 1.1-2.9; P<.01 and 1.077±0.05 vs. 1.04±0.03; OR, 1.7; 95% CI, 1.2-2.6; P<.001, respectively]. NLRP1 expression in HAEC cultures exposed to plasma after one week of aspirin or clopidogrel was similar to that observed in control HAECs that was no exposed to human plasma (PBS) [RQ; 1.002±0.06 vs. 1.009±0.03; OR, 0.9; 95% CI, 0.5-1.4; P=.7, and 1.04±0.03 vs. 1.009±0.03; OR, 0.8; 95% CI, 0.3-1.2; P=.5, respectively]. No difference was observed in NLRP1 percentage reduction in HAEC after aspirin or clopidogrel exposure (3.8% vs. 2.8%, P=.3, respectively).
ConclusionsPlatelet inhibition by P2Y pathway is similar to COX pathway in NLRP1 expression inhibition in HAECs.
Actualmente se considera la aterosclerosis como una enfermedad inflamatoria sistémica que comienza mediante un proceso inmune-inflamatorio desencadenando una disfunción endotelial1. Esta disfunción endotelial es un marcador precoz de aterosclerosis que acontece incluso antes de poder evidenciar mediante imágenes diagnósticas la presencia de las placas de ateroma.
Existe abundante evidencia que apoya la importancia de la respuesta inmune tanto innata como adaptativa en el proceso aterosclerótico2. De hecho, la activación de los linfocitos T es esencial en la progresión de la aterosclerosis3. Son varios los autoantígenos que se han localizado en la placa de ateroma, siendo capaces de provocar una respuesta inmune a través de la activación de los linfocitos T y de la generación de autoanticuerpos4. Todos estos mecanismos son esenciales en el desarrollo de la disfunción endotelial responsable del origen de la aterosclerosis y de la formación de la placa de ateroma5.
Además, esta disfunción endotelial es responsable de disminuir la biodisponibilidad de las prostaglandinas y del óxido nítrico, produciéndose así una activación plaquetaria6. Las plaquetas son células pequeñas anucleadas producidas en la médula ósea que presentan importantes acciones a nivel vascular. Más allá de las funciones específicas hemostáticas, disponemos de evidencia que indica que las plaquetas juegan un papel importante en las reacciones inflamatorias que se desencadenan en la pared vascular. La adhesión plaquetaria provoca una inflamación y disfunción endotelial que precede a la adhesión leucocitaria. Así mismo, la activación de la adhesión plaquetaria es fundamental para que se desencadene en la pared arterial el reclutamiento de los leucocitos en las etapas iniciales de la aterosclerosis7.
Recientemente los inflamasomas han emergido como una pieza clave en la regulación de la respuesta inmune e inflamatoria responsable de la etiopatogénesis de la aterosclerosis8. Los inflamasomas son responsables del procesamiento de la pro-interleucina beta (pro-IL-β) a su forma activa y de su posterior secreción y activación de la caspasa-19. La IL-1-β es una potente citoquina proinflamatoria crucial en el efecto proaterogénico de la enfermedad vascular.
El inflamasoma NLRP1 es capaz de provocar la activación de la caspasa-1 desencadenando una respuesta innata inmune e inflamatoria10. Aunque los mecanismos exactos que desencadenan la activación de este inflamasoma no están completamente elucidados, recientes investigaciones han arrojado información sobre el papel que el inflamasoma NLRP1 presenta en la disfunción endotelial11. Pacientes con enfermedad arterial periférica que fueron tratados con aspirina presentaron una menor expresión del inflamasoma NLRP1 en las células endoteliales, siendo esta disminución de la expresión posiblemente provocada a través de una inhibición en la vía del factor nuclear kappaB12,13. Un estudio posterior llevado a cabo en sujetos sanos que recibieron este fármaco profundizó más en el conocimiento de la función que juega la aspirina en la inhibición de la expresión del inflamasoma NLRP1 en las células endoteliales. Los datos desprendidos de dicho estudio indicaron que en las células endoteliales la expresión intracitosólica del inflamasoma NLRP1 está atenuada por la acción inhibitoria auto/paracrina que tiene la aspirina sobre la plaqueta, sin que exista una interacción directa entre la plaqueta y la célula endotelial, modulándose de esta manera el proceso inmune-inflamatorio que desencadena los mecanismos inflamatorios responsables de la aterosclerosis14.
Así mismo, estudios recientes sugieren que el clopidogrel, un inhibidor del receptor P2Y que bloquea la función plaquetaria vía adenosindifosfato (ADP), podría reducir la inflamación vascular secundariamente a la acción paracrina de la inhibición de la activación plaquetaria15. Sin embargo, hasta la fecha la acción que pueda tener el tratamiento con clopidogrel sobre la expresión del inflamasoma NLRP1 en la célula endotelial es desconocida.
Por ello, en el presente estudio nos planteamos investigar el efecto de la inhibición invivo de la inflamación plaquetario-dependiente mediante la inhibición del receptor P2Y vía ADP comparada con la inhibición de la enzima COX sobre la transcripción intracitosólica del inflamasoma NLRP1 en las células endoteliales.
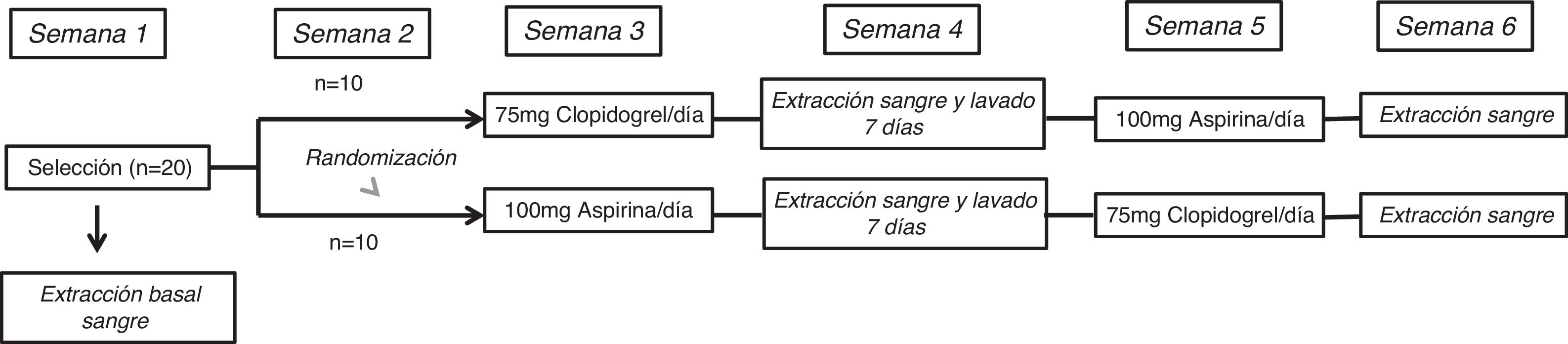
MétodosDiseño del estudioEl estudio ECLOAS es un estudio prospectivo, aleatorizado, abierto y cruzado con 2 periodos de inhibición plaquetaria llevado a cabo en 20 voluntarios sanos procedentes de la Universidad Europea de Madrid. Los participantes en el estudio no presentaban antecedentes médico-quirúrgicos de interés, ni factores de riesgo cardiovasculares asociados, con una exploración física vascular dentro de la normalidad. Ninguno se encontraba con indicación de tratamientos farmacológicos concomitantes, y fue motivo de exclusión el presentar un hábito tabáquico activo o de abuso de sustancias. La edad media de los voluntarios del estudio fue de 21±1años. El 60% (n=12) fueron mujeres. El índice de masa corporal medio de la muestra fue de 24±3. El estudio se completó tras concluir un protocolo de 6 semanas de duración. Todos los participantes fueron asignados a uno de los 2 brazos del estudio bajo 2 condiciones experimentales, que consistieron en recibir una dosis diaria de 75mg de clopidogrel durante 7días y 100mg de aspirina de forma cruzada tras un periodo de lavado de una semana. El diseño del estudio queda representado en la figura 1.
Se realizó una extracción de sangre venosa de cada participante de manera basal y tras finalizar cada una de las semanas de administración del fármaco correspondiente. Las muestras de sangre fueron centrifugadas a 1.500rpm durante 10min y el plasma obtenido fue congelado a −20°C hasta su análisis.
El estudio se llevó a cabo en el Hospital Universitario de Getafe. Todos los participantes incluidos en el estudio firmaron un consentimiento informado, pudiendo abandonar la participación en el estudio en el momento que lo solicitasen. El estudio cumplió con los requisitos éticos establecidos en la Declaración de Helsinki y fue aprobado por el Comité ético del Hospital.
La semana cuarta del protocolo, en la que los participantes no recibieron ninguno de los fármacos, sirvió como un periodo de lavado entre fármacos para eliminar cualquier efecto producido por la medicación previamente administrada. Al final de cada semana de administración del fármaco, los participantes fueron evaluados mediante una visita médica para valorar los posibles efectos adversos que pudiesen haber surgido.
Visita de selección y aleatorizaciónDurante la primera semana del protocolo se llevó a cabo la visita de selección donde se reclutaron los 20 voluntarios sanos que cumplieron los criterios de inclusión-exclusión anteriormente descritos. En esa primera visita de selección se procedió a la firma del consentimiento informado y a la extracción de la primera muestra de sangre basal de cada uno de los participantes previa a la toma de los antiagregantes a testar.
Los pacientes fueron aleatorizados utilizando una aplicación digital16. Los investigadores que llevaron a cabo el reclutamiento de los voluntarios y su aleatorización no estuvieron involucrados ni en la recogida ni en el análisis de datos posterior.
Preparación de los cultivos celularesLas células endoteliales de aorta humana (HAEC) (Lonza, Workingham, Reino Unido) fueron cultivadas a 37̊C sobre placas con un 5% de dióxido de carbono, en un medio de crecimiento celular endotelial compuesto por 10ng/ml de factor de crecimiento epidérmico humano, 1,0mg/ml de hidrocortisona, 50mg/ml de gentamicina, 50mg/ml de amfotericina-B, 3mg/ml de extracto de cerebro bovino y 5% de suero fetal (Clonetics; Lonza).
Los ensayos se realizaron sobre monocapas de HAEC, hasta conseguir una confluencia del 70-90%, utilizándose las células obtenidas entre el pasaje 3 y el 6 para la investigación. Posteriormente, se descongelaron las muestras de plasma obtenidas de los voluntarios sanos en cada una de las fases del protocolo, añadiéndose a los cultivos celulares para estimularlos durante 2h. Cada tejido celular fue expuesto a una muestra de plasma de los diferentes participantes del estudio, extraída en cada uno de los momentos previamente descritos en el protocolo.
Determinación del inflamasoma NLRP1El ácido ribonucleico (ARN) total de los cultivos sembrados se obtuvo utilizando el kit comercial RNAeasy Fibrous MiniKit (Qiagen, Hilden, Alemania) siguiendo las recomendaciones del fabricante. Determinamos la cantidad de ARN purificado utilizando espectrometría a 260nm en un analizador ND-100 Nanodrop (Nanodrop Technologies, Wilmington, DE). La pureza de las muestras se verificó en función del ratio de medida de 260/280nm, cuyos valores entre 1,8 y 2,1 indican que la calidad del ARN obtenido es óptima para su análisis cuantitativo mediante la reacción en cadena de la polimerasa en tiempo real (qRT PCR).
La cuantificación de la transcripción del inflamasoma NLRP1 se realizó utilizando la qRT PCR (Real Time PCR 7500 Fast. Version 2.0, Applied Biosystems, Carlsbad, CA). Para el estudio, 1μg de todo el ARN se transcribió en su complementario ácido desoxirribonucleico (cADN) usando el kit comercial High Capacity cADN Reverse Transcription Kit (Applied Biosystems, Carlsbad, CA).
Posteriormente, en un volumen final de 12μl, se utilizaron 30ng de cADN como molde para analizar la PCR en tiempo real del gen específico para el inflamasoma NLRP1 y para el gen constitutivo RN18S1 a través del test TaqMan Master Mix Universal Fast (2×) (Roche Diagnostics, Indianápolis, IN). Los pasos para la amplificación genética fueron los siguientes: una primera desnaturalización a 95̊C, seguidos de otros 40 ciclos de desnaturalización a 95̊C de 15segundos de duración y finalmente una extensión de 1min a 60̊C.
La cuantificación relativa de la expresión del inflamasoma NLRP1 se obtuvo usando el método comparativo ΔΔCT17. Para abolir la posibilidad de la variabilidad técnica, cada una de las muestras fue analizada por triplicado. Los resultados se estandarizaron mediante un control endógeno sin transcripción reversa para controlar de esta manera la amplificación mediante PCR del ADN genómico contaminante. El programa calculó el ΔCts y el ΔΔCT con las fórmulas abajo indicadas:
ΔCt=Ct_Media(18S)−Ct_Media(Caso)
ΔΔCt=ΔCt−ΔCt_Media
Nivel de expresión del inflamasoma=2−DDCt
Análisis estadísticoEl análisis estadístico se realizó utilizando el programa SPSS 17.0 para Windows (SPSS, Chicago, IL). La normalidad de las variables continuas se analizó usando los test de Kolmogorov-Smirnov y Shapiro-Wilk. La distribución de la transcripción del inflamasoma NLRP1 fue gaussiana, expresando su valor como media±desviación estándar. La comparación de los niveles de transcripción del inflamasoma NLRP1 se expresó mediante odds ratio (OR) con un intervalo de confianza del 95% (IC 95). Se consideraron estadísticamente significativos valores de p<0,05.
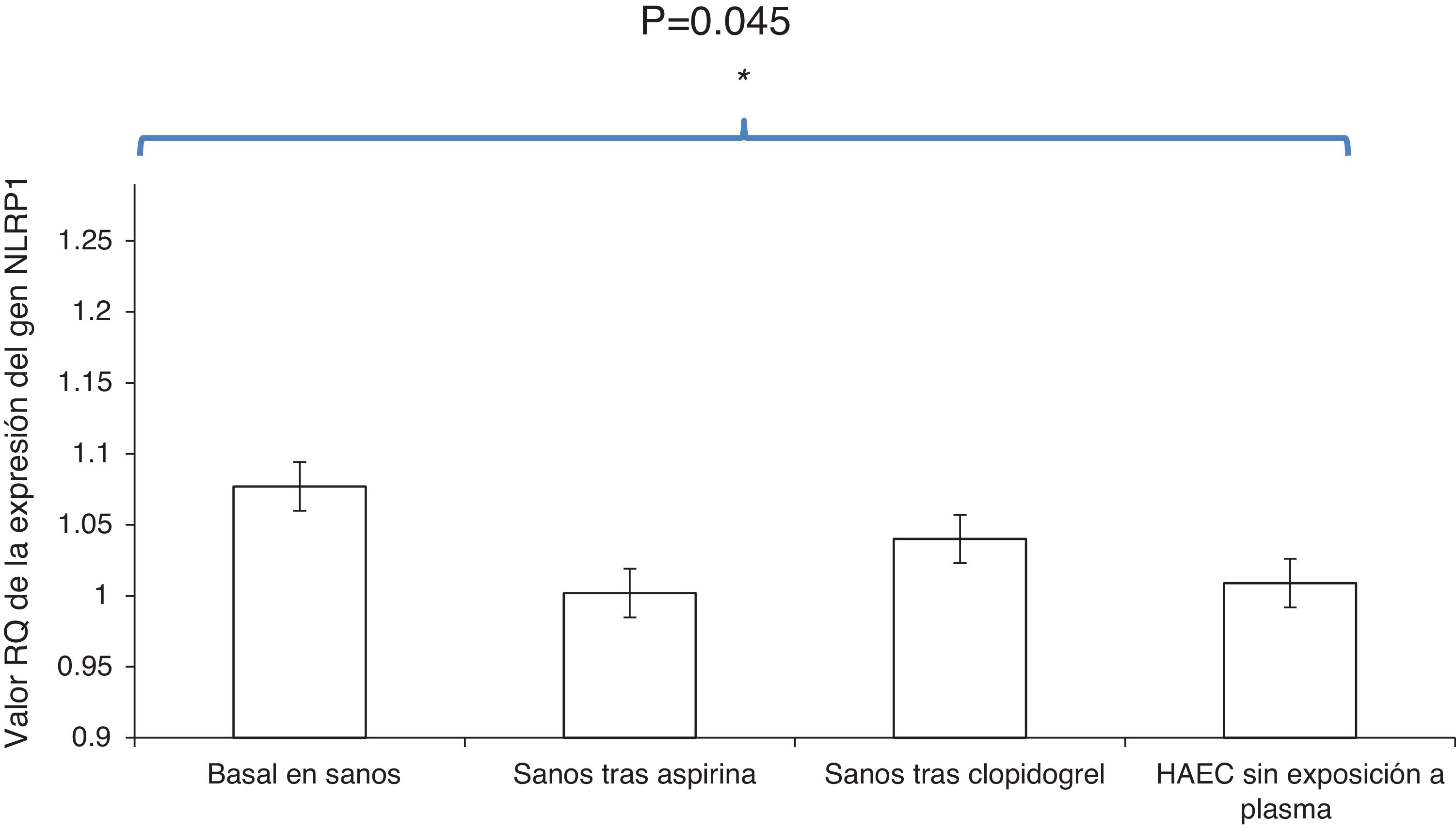
ResultadosLos cultivos de células HAEC expuestos al plasma basal de los sujetos sanos presentaron niveles más elevados en la expresión del inflamasoma NLRP1 que aquellos que fueron estimulados con plasma de sujetos sanos tras una semana de administración de aspirina o clopidogrel [cuantificación relativa (CR), 1,077±0,05 vs. 1,002±0,06; OR, 1,8; IC 95, 1,1-2,9; p<0,01 y 1,077±0,05 vs. 1,04±0,03; OR, 1,7; IC 95, 1,2-2,6; p<0,001, respectivamente].
Además, la expresión del inflamasoma NLRP1 en los cultivos HAEC expuestos a plasma de sujetos sanos tras una semana con tratamiento antiagregante con aspirina o con clopidogrel fue similar a la que presentaron aquellos cultivos HAEC sin exposición a plasma humano (PBS) [CR, 1,002±0,06 vs. 1,009±0,03; OR, 0,9; IC 95, 0,5-1,4; p=0,7 y 1,04±0,03 vs. 1,009±0,03; OR, 0,8; IC 95, 0,3-1,2; p=0,5, respectivamente].
No se encontraron diferencias significativas en el porcentaje de reducción de la expresión del inflamasoma NLRP1 en las células HAEC expuestas a plasma de sujetos sanos que tomaron aspirina durante una semana comparado con la reducción de la expresión del inflamasoma NLRP1 provocada por el suero de estos mismos sujetos tras la toma de clopidogrel (3,8% vs. 2,8%, p=0,3, respectivamente) (fig. 2).
Comparación de la expresión del inflamasoma NLRP1 en las células HAEC expuestas a plasma basal de sujetos sanos, plasma de sujetos sanos tras una semana de administración de aspirina, plasma desujetos sanos tras una semana de administración de clopidogrel y cultivos HAEC sin exposición a plasma humano. Los datos de los histogramas se expresan como media ± desviación estándar.
Igualmente, no encontramos diferencias individuales entre los participantes en lo que respecta a la respuesta específica inducida sobre la expresión del inflamasoma NLRP1 en las células HAEC al ser expuestas a sus muestras de plasma tras la administración de la aspirina y del clopidogrel (diferencia de expresión en CR: 0,031±0,011; IC 95%, −0,005 a 0,041).
DiscusiónLa importancia que tienen los mediadores inflamatorios tanto en el origen como en la progresión de las placas ateroscleróticas ha sido ampliamente demostrada1,2. En el presente estudio hemos observado como las células HAECs expuestas a plasma de voluntarios sanos a los que se ha administrado durante una semana fármacos antiagregantes, aspirina y clopidogrel, presentaban una menor activación del inflamasoma NLRP1.
Además, los niveles de expresión del inflamasoma NLRP1 por parte de las células endoteliales aórticas tras la exposición al plasma de los sujetos sanos después de recibir durante una semana cualquiera de los 2 fármacos antiagregantes fue comparable al que presentaban las células HAEC previamente a la exposición a cualquier plasma. Este hallazgo es de crucial importancia ya que demuestra que tanto la aspirina como el clopidogrel, vía acción auto/paracrina sobre las plaquetas, son capaces de aliviar el daño vascular endotelial a través de la inhibición de la activación del inflamasoma NLRP1 en dicho endotelio, por tanto estos 2 antiagregantes protegen de manera directa la integridad del endotelio vascular.
De nuestros resultados se desprende que tanto la aspirina como el clopidogrel tienen capacidad de producir una inhibición auto/paracrina significativa sobre la expresión del inflamasoma NLRP1 en el endotelio; el porcentaje de reducción es similar entre ambos fármacos, por tanto, la inhibición plaquetaria por vías P2Y y COX provoca similar efecto en la inhibición del inflamasoma proaterogénico NLRP1 en las células endoteliales arteriales.
Todos estos datos confirman los resultados de estudios previos sobre que la plaqueta mediante su acción auto/paracrina está involucrada de manera directa en la modulación del proceso inmune-inflamatorio que acaba desencadenando los mecanismos inflamatorios que provocan la disfunción endotelial12,14. Además, se sugiere la existencia de una estrecha relación entre la aspirina y el clopidogrel y sus efectos antiinflamatorios en el tratamiento de las enfermedades cardiovasculares.
Clínicamente se ha demostrado en numerosas ocasiones que el tratamiento a largo plazo con aspirina o clopidogrel previene de manera efectiva la aparición de eventos cardiovasculares18,19. Sin embargo, el mecanismo exacto por el cual estos 2 antiagregantes son capaces de inhibir la expresión del inflamasoma NLRP1 en la célula endotelial es desconocido. No obstante, la aspirina parece actuar a través de la inhibición que el ácido acetilsalicílico provoca sobre la vía del factor nuclear kappaB y sobre la inhibición de la vía especies reactivas de oxígeno/interacción de la proteína de la tiorredoxina13,20.
La activación de los inflamasomas contribuye al inicio de la respuesta inflamatoria que desencadena el desarrollo y la progresión de la aterosclerosis8–10. Esta asociación entre inflamación y aterosclerosis ha abierto una línea importante de investigación sobre nuevos tratamientos para el grupo de enfermedades que conforman la aterosclerosis.
Recientemente, el estudio CANTOS ha demostrado que el anticuerpo monoclonal canakinumab es capaz de reducir la incidencia de nuevos eventos cardiovasculares en aquellos pacientes que presentan una alta carga inflamatoria, siendo este fármaco capaz de producir una disminución significativa en los niveles de proteína C reactiva (PCR)21,22. El canakinumab se une con alta afinidad específicamente a la IL-β humana y neutraliza su actividad biológica mediante el bloqueo de la interacción con los receptores de IL-1, lo que permite prevenir la activación del gen inducida por IL-β y la producción de mediadores inflamatorios. Sin embargo, en el estudio CIRT, otro inmunosupresor como es el metotrexato no fue capaz de disminuir los niveles de IL-β, de IL-6 o de PCR, así como tampoco redujo la incidencia de eventos cardiovasculares en los pacientes reclutados23. Un análisis más detallado de los pacientes incluidos en este último ensayo clínico reveló que los niveles de PCR que presentaban antes del inicio del tratamiento se encontraban dentro del rango de la normalidad, siendo factible la hipótesis de que la inhibición de la inflamación solamente frenaría el proceso aterosclerótico cuando existiese de manera persistente una respuesta proinflamatoria previa. Además, investigaciones publicadas con anterioridad muestran que el metotrexato es capaz de inhibir el desarrollo de la lesión aterosclerótica24, por lo que quizás la capacidad del metotrexato de disminuir la inflamación depende del estadio previo inflamatorio.
La importancia y novedad de nuestro estudio radica en que es, hasta nuestro conocimiento, el primer estudio en evaluar el potencial papel proinflamatorio que la acción auto/paracrina de la plaqueta ejerce sobre la expresión del inflamasoma NLRP1 en la célula endotelial, a través de la evaluación de la acción de 2 fármacos con efecto inhibidor de la respuesta inflamatoria en las plaquetas, comparando a su vez la posible diferencia en cuanto a la potencia en la capacidad de inhibición entre estos 2 fármacos. Hemos confirmado la implicación de los inflamasomas en la disfunción endotelial11,20,25. Asumiendo la importancia que representa el inflamasoma NLRP1 en la disfunción endotelial que desencadena la aterosclerosis, hay que considerar que estamos frente a una nueva diana terapéutica sobre la que centrar la atención a la hora de diseñar futuras estrategias de tratamiento para las enfermedades cardiovasculares.
Nuestro estudio tiene varias limitaciones. En primer lugar, el diseño de este estudio no permite dilucidar los mecanismos precisos por los que el clopidogrel y la aspirina son capaces de promover la inhibición de la acción auto/paracrina plaquetaria inhibiendo así la expresión del inflamasoma NLRP1 en la célula endotelial, y tampoco evaluar el efecto que estos fármacos tienen sobre la secreción de la IL-β y la posterior activación a través de esta de la caspasa-1. Se necesitan nuevos estudios de investigación básica para esclarecer estos mecanismos de acción, así como los efectos biológicos derivados de la misma. Otra de las limitaciones del estudio se encuentra en el pequeño tamaño muestral, que limita el poder estadístico. Sin embargo, los datos que se desprenden de este estudio de diseño experimental cruzado sobre tejidos celulares están dotados de suficiente fiabilidad para arrojar conclusiones precisas. Por último, hemos realizado la determinación de la expresión del ARN mensajero del inflamasoma NLRP1 mediante un análisis cuantitativo con la reacción en cadena de la polimerasa sin determinar la actividad proteica del gen. La determinación de los niveles de expresión de la proteína del NLRP1 mediante métodos de inmunohistoquímica o Western blot podría aportar información adicional, aunque conseguir la extracción de estos complejos moleculares intracitosólicos y realizar un análisis cuantitativo de la actividad enzimática es poco eficiente. De hecho, la evaluación de la expresión del ARN mensajero del inflamasoma NLRP1 a través de la técnica empleada en este estudio es fiable para realizar la cuantificación de la producción del NLRP1 en los tejidos celulares en este estudio en particular.
ConclusionesBajas concentraciones de aspirina y clopidogrel protegen la función endotelial gracias a la inhibición que produce sobre la activación del inflamasoma NLRP1. La inhibición plaquetaria por vías P2Y y COX provoca similar efecto en la inhibición del inflamasoma proaterogénico NLRP1 en las células endoteliales arteriales. Los datos que se desprenden de este estudio demuestran que en las células HAEC la expresión intracitosólica del inflamasoma NLRP1 se encuentra atenuada por la acción inhibitoria que sobre la actividad auto/paracrina de la plaqueta presenta la aspirina y el clopidogrel, modulando de esta manera el proceso inmune-inflamatorio que pone en marcha los mecanismos inflamatorios que originan la aterosclerosis.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.