Hemos estudiado el efecto de 3 modelos de dieta en la respuesta de glucose e insulina, el perfil lipídico y la función endothelial en individuos con resistencia a la insulina.
Pacientes y métodosOnce voluntarios con sobrepeso abdominal y resistencia a la insulina realizaron 3 fases de dieta en mantenimiento de peso, en un estudio aleatorizado y cruzado: una rica en grasas saturadas (SAT), otra en grasas monoinsaturadas (MUFA) y otra en hidratos de carbono (HC). Hemos determinado los valores de glucosa e insulina, el perfil lipídico y la vasodilatación endotelial mediada por el flujo con láser Doppler.
ResultadosEl peso corporal y el gasto energético basal no cambiaron durante las 3 fases de la dieta. El homeostasis model assessmentinsulin resistance (HOMA-ir) mejoró tras la dieta rica en MUFA, comparada con las dietas altas en SAT e HC (2,32±0,35; 2,72±0,37, y 2,52±0,37; p<0,05). Un desayuno rico en HC incrementa los valores posprandiales de glucosa, insulina y nitrosamina, y disminuye los valores de colesterol unido a lipoproteínas de alta densidad (cHDL) comparados con las dietas MUFA y SAT. La reactividad endotelial en ayuno y posprandial tras 150 min de la ingesta fue mayor con MUFA, comparada con las dietas ricas en SAT y en HC (271,1±16,63; 220,8±13,6; 244,9±37,7; p<0,05; y 251,9±16,3; 180,1±10,6; 181,4 ±16; ANOVA; p<0,05, respectivamente).
ConclusionesEn pacientes con resistencia a la insulina, una dieta alta en MUFA mejora el HOMA-ir, disminuye los valores posprandiales de glucosa, insulina y nitrosamina, incrementa los valores de cHDL y mejora la reactividad endotelial.
We have studied the effect of 3 model diets on glucose and insulin response, lipid profile and endothelial function in insulin resistant subjects.
Patients and methodsEleven volunteers with insulin resistance and central overweight underwent 3 phases of diet on weightmaintenance, in a randomized and crossed study: a rich-saturated fat diet (SAT), another one rich in monounsaturated fat (MUFA, rich in olive oil) and another rich in carbohydrates (CH). We determined the glucose and insulin levels, the lipid profile and the half-full flow mediated endothelial vasodilation by means of Laser-Doppler.
ResultsBody weight and basal energy expenditure were unchanged throughout the study. The homeostasis model assessment-insulin resistance (HOMA-ir) was improved during the MUFA-rich diet as compared with SAT and CH diets (2.32±0.35; 2.72±0.37 and 2.52±0.37; p<0.05). During a CH rich breakfast, postprandial glucose, insulin and nitrotyrosine levels were increased and the HDL-C levels remained lowered as compared with those during MUFA and SAT diets. Endothelial reactivity, measured fasting and after 150 min of meal test, was higher with olive oil rich diet compared with SAT and CH rich diets (baseline values: 271.1±16.63, 220.8±13.6, 244.9±37.7, ANOVA p<0.05; postprandial values: 251.9±16.3, 180.1±10.6, 181.4±16, ANOVA p<0.05).
ConclusionsIn insulin resistant subjects a MUFA-rich diet improves HOMA-ir, decreases postprandial glucose, insulin and nitrotyrosine levels, increases HDL-C levels and improves basal and postprandial endothelial reactivity.
La diabetes mellitus tipo 2 (DM2) continúa aumentando en España, en paralelo con el cambio del estilo de vida y el aumento de la obesidad de la población1. El sobrepeso y la obesidad se asocian de forma temprana a un estado de resistencia a la insulina que incrementa el riesgo de diabetes y de enfermedad cardiovascular. En este modelo fisiopatológico, los valores de glucosa e insulina se elevan de forma temprana en la fase posprandial y preceden al desarrollo de una hiperglucemia franca2. En el síndrome de resistencia a la insulina, se puede observar una disminución rápida en la vasodilatación dependiente de endotelio, que es un marcador de enfermedad cardiovascular3. La hiperglucemia, la hiperinsulinemia y la hiperlipidemia son factores que influyen en la función endotelial, y una composición nutricional diferente puede dar lugar a cambios metabólicos posprandiales asociados a un diferente efecto en la función endotelial4,5. En pacientes diabéticos, la disfunción endotelial (DE) observada en el estado basal se agrava con la hiperglucemia posprandial y mejora con el control de los picos hiperglucémicos6,7. Así, un aumento del contenido de hidratos de carbono (HC) simples en la dieta puede incrementar los valores posprandiales de glucosa e insulina, y ambos pueden tener efectos directos en el endotelio. Sin embargo, el aumento en la proporción de grasas en las dietas cursa, en individuos sanos y prediabéticos, con elevación de los ácidos grasos libres en la fase posprandial, que igualmente pueden afectar a la función endotelial de pacientes con resistencia a la insulina8–10. Así, el incremento en la proporción de grasas saturadas (SAT) en la dieta, con el aumento de los valores de ácidos grasos libres en plasma y el incremento de la actividad oxidativa e inflamatoria posprandial, disminuyen la función endotelial11,12. Sin embargo, la dieta mediterránea, también alta en grasas, igualmente eleva el valor de ácidos grasos en suero, pero tiene como componente principal el aceite de oliva virgen, que contiene micronutrientes, que poseen actividad antioxidante, antiinflamatoria y antitrombótica13–15. Además, la dieta mediterránea puede reducir la resistencia a la insulina, así como la hiperglucemia e hiperinsulinemia posprandial, disminuir la oxidación de las partículas de lipoproteínas de baja densidad (LDL) y mejorar la función endotelial6,16. Finalmente, estudios epidemiológicos demuestran que la resistencia a la insulina se relaciona con una tríada de anormalidades lipídicas, que incluyen hipertrigliceridemia, disminución de los valores de colesterol unido a lipoproteínas de alta densidad (cHDL) e incremento de las partículas de LDL pequeñas y densas17. Se ha demostrado que la sustitución de una dieta alta en HC por una dieta alta en grasa monoinsaturada (MUFA) mejora el perfil lipídico18. Sin embargo, los efectos que la diferente composición nutricional tiene en los valores basales y posprandiales de glucosa e insulina, el perfil lipídico, el estrés oxidativo y la función endotelial en individuos con resistencia a la insulina, se han estudiado menos. Nuestro trabajo aborda esta cuestión y hemos estudiado estos efectos en 3 modelos de dieta con distinta proporción de HC y grasas en voluntarios hijos de padres diabéticos, con sobrepeso abdominal y resistencia a la insulina.
Pacientes y métodosDesde el año 2003 hasta el 2004, se seleccionó a 59 voluntarios, a los que se invitó a realizar una sesión de cribado. Los criterios de inclusión fueron los siguientes: historia de glucemia en ayunas < 125mg/dl; hemoglobina glucosilada (HbA1c) sin tratamiento hipoglucemiante < al 6,5%; índice de masa corporal (IMC) > 25kg/m2 con circunferencia abdominal ≥ 102cm en varones y ≥ 88cm para las mujeres, y resultados normales en los test hepáticos, renales y de función adrenal. Los criterios clínicos de exclusión fueron los siguientes: complicaciones microvasculares y macrovasculares; consumo de cigarrillos y alcohol; uso de diuréticos, esteroides y bloqueadores beta, o uso de medicación que pueda afectar al metabolismo de la glucosa.
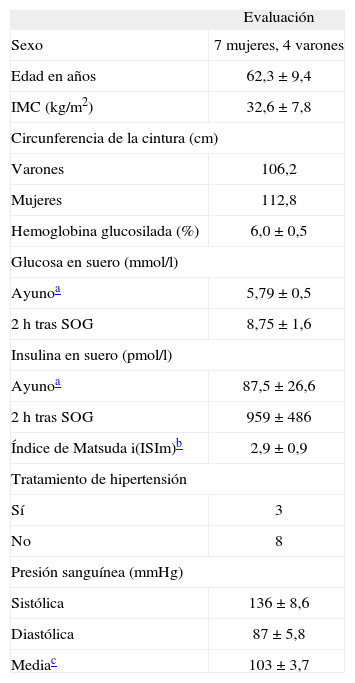
Veintiocho voluntarios no cumplían los criterios de inclusión, o tenían algún motivo de exclusión, y 9 rehusaron participar. Al resto de voluntarios incluidos (n = 22) se les realizó un test de tolerancia oral a la glucosa, y de ellos se seleccionó a 11 voluntarios con resistencia a la insulina, al presentar un índice de sensibilidad a la insulina de Matsuda (ISIm) < 4,019. En la tabla 1 se muestran las características clínicas y bioquímicas de los pacientes incluidos en el estudio. Los voluntarios fueron 4 varones y 7 mujeres de 62 ± 9,4 de edad, con un índice de sensibilidad de Matsuda (ISi) de 2,9 ± 0,9 y con un IMC de 32,6 ± 7,8, y una HbA1c del 6,0 ± 0,5%. En ayunas, presentaban unos valores medios de glucosa e insulina de 5,47 ± 0,5mmol/l y 87,5 ± 26,6 pmol/l, respectivamente y de 8,75 ± 1,6mmol/l y 959 ± 486 pmol/l a las 2h después de la carga de glucosa. Un paciente no pudo concluir la fase alta de HC al presentar un episodio anginoso que precisó de ingreso en unidad coronaria.
Características clínicas basales de los pacientes
| Evaluación | |
| Sexo | 7 mujeres, 4 varones |
| Edad en años | 62,3 ± 9,4 |
| IMC (kg/m2) | 32,6 ± 7,8 |
| Circunferencia de la cintura (cm) | |
| Varones | 106,2 |
| Mujeres | 112,8 |
| Hemoglobina glucosilada (%) | 6,0 ± 0,5 |
| Glucosa en suero (mmol/l) | |
| Ayunoa | 5,79 ± 0,5 |
| 2h tras SOG | 8,75 ± 1,6 |
| Insulina en suero (pmol/l) | |
| Ayunoa | 87,5 ± 26,6 |
| 2h tras SOG | 959 ± 486 |
| Índice de Matsuda i(ISIm)b | 2,9 ± 0,9 |
| Tratamiento de hipertensión | |
| Sí | 3 |
| No | 8 |
| Presión sanguínea (mmHg) | |
| Sistólica | 136 ± 8,6 |
| Diastólica | 87 ± 5,8 |
| Mediac | 103 ± 3,7 |
Los datos se expresan con la media ± desviación estándar.
IMC: índice de masa corporal; SOG: sobrecarga oral a la glucosa.
Media de las determinaciones basales obtenidas en 2 ocasiones separadas. Para convertir glucosa a mg, dividir mmol por 0,0555; para convertir insulina a U/ml dividir por 6,945.
Tras la selección de los 11 voluntarios, y la obtención del consentimiento informado, éstos realizaron 3 fases de dieta isocalórica de 28 días cada una en un diseño aleatorizado y cruzado de cuadrados latinos de Williams. La composición de las dietas fue: una dieta rica en SAT (un 47% HC, un 15% proteínas [PROT] y un 38% de grasas [un 23% SAT, un 9% MUFA, un 6% poliinsaturada –PUFA–), una dieta rica en MUFA (47% HC, 15% PROT y 38% de grasas [un 9% SAT, un 23% MUFA −75% aportado en forma de aceite de oliva virgen extra–, 6% PUFA); y una dieta rica en HC (un 20% de grasas [un 6% SAT, un 8% MUFA, un 6% PUFA]). Para realizar los estudios posprandiales, al final de cada período dietético y tras 12h de ayuno, a los pacientes se les administró un desayuno estandarizado de 443 calorías basado en la composición de la dieta que estaban realizando, el cual se empleó como comida de prueba. El desayuno rico en HC contenía 200ml de leche desnatada, 50g de pan y 75g de mermelada; el desayuno rico en MUFA contenía 200ml de leche desnatada, 50g de pan y 27μl de aceite de oliva, y el desayuno rico en SAT estaba compuesto de 200ml de leche entera, 50g de pan y 25g de mantequilla. Mediante un catéter intravenoso en una vena braquial, se obtuvieron muestras sanguíneas de cada paciente, antes y después de la administración de la comida de prueba, a los tiempos −10, –5, 0, 15, 30, 60, 90, 120, 150 y 180min. A los pacientes se les realizó una evaluación de la reactividad endotelial basal y a los 150min de la ingesta mediante láser Doppler. Se realizó el seguimiento de los voluntarios para mantener su peso corporal y la misma actividad física durante el estudio. La adherencia a las fases de dieta se determinó midiendo el contenido en ácidos grasos de los fosfolípidos plasmáticos al final de cada período de dieta por cromatografía de gases usando un Hewlett Packard 5890 (Avondale, PA, EE.UU.).
Métodos analíticosLas muestras de suero se obtuvieron en tubos estériles con ácido etilendiaminotetraacético (1mg/ml), e inmediatamente se separaron las células por centrifugación a 3.000rpm durante 10min a 4°C. La glucemia se determinó por el método de la glucosa-oxidasa. La concentración de insulina se midió mediante enzimoinmunoanálisis de micropartículas (MEIA; Abbott Diagnostics, Matsudo-shi, Japón; coeficiente de variación (CV): 2,5-6%). El estado de sensibilidad a la insulina se determinó mediante el modelo HOMA (homeostasis model assessment)20. Los ácidos grasos séricos se midieron por triplicado en cada muestra, usando un método colorimétrico (Roche Molecular Biochemical, Mannheim, Alemania; CV: 7,8%). El colesterol total (CT) y los triglicéridos (TG) en suero se midieron por técnicas enzimáticas. El cHDL se determinó por precipitación de las proteínas que contenían apolipoproteína (apo) B con fosfotungstato/magnesio. El colesterol unido a las LDL (cLDL) se calculó utilizando la fórmula de Friedewald21. Las concentraciones de apo AI y apo B100 se determinaron por métodos inmunoturbidimétricos (Boehringer, Mannheim, Alemania). Los valores de nitrotirosina (NT) se determinaron con un sensible ELSA en fase sólida en un sándwich con anticuerpo monoclonal (clone HM.11) (HyCult biotechnology; Uden, Países Bajos). El kit tiene un nivel mínimo de detección 2 nM, con un rango de concentración de 2–1.500 nM y los valores de NT se expresan en μmol/l22. La actividad de alaninatransferasa (ALT), aspartato aminotransferasa (AST) y creatincinasa se determinó por métodos enzimáticos calorimétricos (Biosystem, Barcelona, España; CV intraanálisis < 6%, < 2% y < 2,6%, respectivamente). La evaluación de la reactividad endotelial se realizó mediante la medida de la vasodilatación microvascular postisquemia con un láser Doppler lineal modelo Periflux 5000 (Perimed SA, Stockholm, Suecia) según el protocolo descrito previamente por Ruano et al13. Se colocó a los pacientes en posición supina en una habitación con una temperatura estable (20–22°C), y se les tomó la presión arterial en un punto localizado 5cm por encima del codo (HG Erkameter 300, Erka, Bad Tolz, Alemania), mientras que la prueba de láser Doppler se realizó en la superficie del segundo dedo de la misma mano dominante. Tras un período de descanso de 5min, se midió el flujo capilar basal por 1min (t0). Después, durante 4min, se indujo una isquemia distal, inchando el manguito del tensiómetro a una presión suprasistólica (200 a 220mmHg). Posteriormente, el manguito se desinchó y, después de 30s, se registró el flujo por 1min (td). Los datos obtenidos se registraron y almacenaron usando el software PeriSoft para Windows. Se determinó el área bajo la curva (ABC) entre el t0 y los tiempos del td. Estos datos se emplearon para analizar el incremento del flujo postisquémico por medio de la fórmula siguiente: IRH = (ABCtd – ABCt0) × 100 ABCt0. Estos cálculos se realizaron en las determinaciones basales y a los 150min después del consumo de los desayunos. En un estudio preliminar en 9 individuos sanos tras 3 semanas de diferencia, hemos encontrado una variabilidad interexperimental del 8,85%. En un total de 10 medidas dentro del mismo día en un voluntario, observamos una variabilidad intraanálisis del 8,7%.
Análisis estadísticosLos resultados se expresan como media ± desviación estándar. Los datos se analizaron estadísticamente por el análisis de la variancia (ANOVA) de medidas repetidas. Cuando este análisis reveló diferencias significativas, se realizó una comparación múltiple utilizando el test de Tukey en comparación post hoc. Se consideraron significativos valores de p < 0,05.
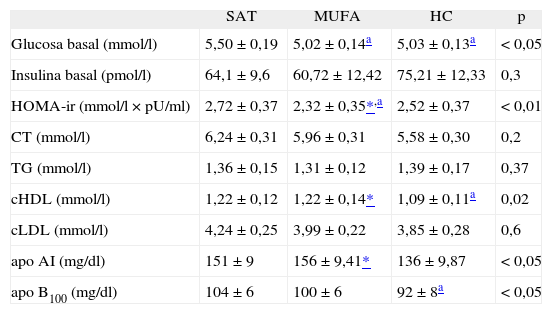
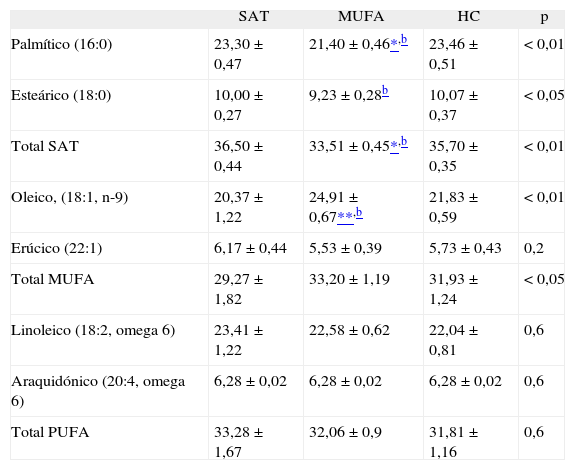
ResultadosEfectos basales en el metabolismo hidrocarbonado y lipídico tras cada una de las fases de dietasLos valores basales de glucosa y de HbA1c fueron menores durante la dieta rica en MUFA y en HC al compararla con la dieta rica en SAT (5,02 ± 0,14; 5,03 ± 0,13; 5,50 ± 0,19; ANOVA p < 0,05; 5,39 ± 0,10; 5,40 ± 0,10; 5,74 ± 0,137; ANOVA p < 0,01, respectivamente) (tabla 2). La resistencia a la insulina estimada por HOMA-insulin resistance (HOMA-ir) disminuyó con la dieta alta en MUFA, comparada con la dieta alta en SAT e HC (2,32 ± 0,35; 2,72 ± 0,37; 2,52 ± 0,37; ANOVA, p < 0,01). Los valores basales de cHDL fueron menores durante la dieta rica en HC al compararla con las dietas MUFA y SAT (1,09 ± 0,1; 1,22 ± 0,1; 1,22 ± 0,1, respectivamente; ANOVA, p < 0,05). Las concentraciones de la apo AI y apo B descendieron con la dieta rica en HC y la relación apo AI/apo B fue mayor con la dieta rica en MUFA. Los valores de AST permanecieron sin cambios con la dieta alta en SAT y rica en HC, comparada con los valores basales; sin embargo, descendieron durante la dieta alta en MUFA comparada con el período rico en SAT (27 ± 2,5 frente a 23,2 ± 2,1; r = 0,89; p = 0,013). Los valores de ALT incrementaron durante el período rico en SAT, comparada con el nivel basal, permanecieron sin cambios tras la dieta rica en HC y descendieron con la dieta alta en MUFA comparada con SAT (27,2 ± 3,0 frente a 21,1 ± 2,2; r = 0,89; p = 0,002). La adherencia a las fases de dieta se confirmó con los cambios en las proporciones de ácidos grasos en los fosfolípidos. Así, las proporciones de ácido palmítico, esteárico y el total de SAT incrementaron tras el consumo de la dieta alta en SAT (ANOVA, p < 0,01, p < 0,05 y p < 0,01, respectivamente), las proporciones de oleico (18:1, n-9) y el total de ácidos grasos MUFA incrementaron tras el consumo de la dieta alta en MUFA (ANOVA, p < 0,01, p < 0,05, respectivamente) y el total de PUFA no cambiaron (tabla 3).
Características bioquímicas tras cada una de las fases de dietas
| SAT | MUFA | HC | p | |
| Glucosa basal (mmol/l) | 5,50 ±0,19 | 5,02 ± 0,14a | 5,03 ± 0,13a | < 0,05 |
| Insulina basal (pmol/l) | 64,1 ±9,6 | 60,72 ± 12,42 | 75,21 ± 12,33 | 0,3 |
| HOMA-ir (mmol/l × pU/ml) | 2,72 ±0,37 | 2,32 ± 0,35*,a | 2,52 ±0,37 | < 0,01 |
| CT (mmol/l) | 6,24 ±0,31 | 5,96 ±0,31 | 5,58 ±0,30 | 0,2 |
| TG (mmol/l) | 1,36 ±0,15 | 1,31 ±0,12 | 1,39 ±0,17 | 0,37 |
| cHDL (mmol/l) | 1,22 ±0,12 | 1,22 ±0,14* | 1,09 ± 0,11a | 0,02 |
| cLDL (mmol/l) | 4,24 ± 0,25 | 3,99 ± 0,22 | 3,85 ± 0,28 | 0,6 |
| apo AI (mg/dl) | 151 ±9 | 156 ±9,41* | 136 ±9,87 | < 0,05 |
| apo B100 (mg/dl) | 104 ±6 | 100 ±6 | 92 ± 8a | < 0,05 |
Los datos son la media ± ESM (error estándar de la media).
Para convertir valores de glucosa, CT y TG a mg/dl, dividir por 0,056, 0,02586 y 0,01129, respectivamente. Para convertir el valor de la insulina a μU/ml dividir por 6,945. HOMA-ir (mmol/l × μU/ml) = glucosa (mmol/l) × insulina (μU/ml)/22,5.
apo: apolipoproteínas; cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; CT: colesterol total; HC: hidratos de carbono; HOMA-ir: homeostasis model assesment-insulin resistance; MUFA: ácidos grasos monoinsaturados; p: análisis de la variancia de variables repetidas; SAT: ácidos grasos saturados; TG: triglicéridos.
Composición de ácidos grasos de los fosfolípidos en plasma tras los 3 períodos de dieta
| SAT | MUFA | HC | p | |
| Palmítico (16:0) | 23,30 ± 0,47 | 21,40 ± 0,46*,b | 23,46 ±0,51 | < 0,01 |
| Esteárico (18:0) | 10,00 ± 0,27 | 9,23 ± 0,28b | 10,07 ± 0,37 | < 0,05 |
| Total SAT | 36,50 ± 0,44 | 33,51 ± 0,45*,b | 35,70 ± 0,35 | < 0,01 |
| Oleico, (18:1, n-9) | 20,37 ± 1,22 | 24,91 ± 0,67**,b | 21,83 ± 0,59 | < 0,01 |
| Erúcico (22:1) | 6,17 ±0,44 | 5,53 ± 0,39 | 5,73 ± 0,43 | 0,2 |
| Total MUFA | 29,27 ± 1,82 | 33,20 ± 1,19 | 31,93 ± 1,24 | < 0,05 |
| Linoleico (18:2, omega 6) | 23,41 ± 1,22 | 22,58 ± 0,62 | 22,04 ±0,81 | 0,6 |
| Araquidónico (20:4, omega 6) | 6,28 ± 0,02 | 6,28 ± 0,02 | 6,28 ± 0,02 | 0,6 |
| Total PUFA | 33,28 ± 1,67 | 32,06 ± 0,9 | 31,81 ± 1,16 | 0,6 |
El total de SAT también incluye el ácido mirístico, el ácido margárico, el ácido araquidónico, el ácido behénico y el ácido lignocérico. El total de MUFA también incluye el ácido palmitoleico y el ácido vaccénico. El total de PUFA también incluye el ácido α-linolénico, el ácido estearidónico, el ácido eicosapentaenoico, el ácido docosapentaenoico y el ácido docosahexaenoico.
Los datos se expresan con la media ± ESM (error estándar de la media) del porcentaje total de ácidos grasos.
a < 0,01
HC: hidratos de carbono; MUFA: ácidos grasos monoiinsaturados; p: análisis de la variancia de variables repetidas; PUFA: ácidos grasos poliinsaturados; SAT: ácidos grasos saturados.
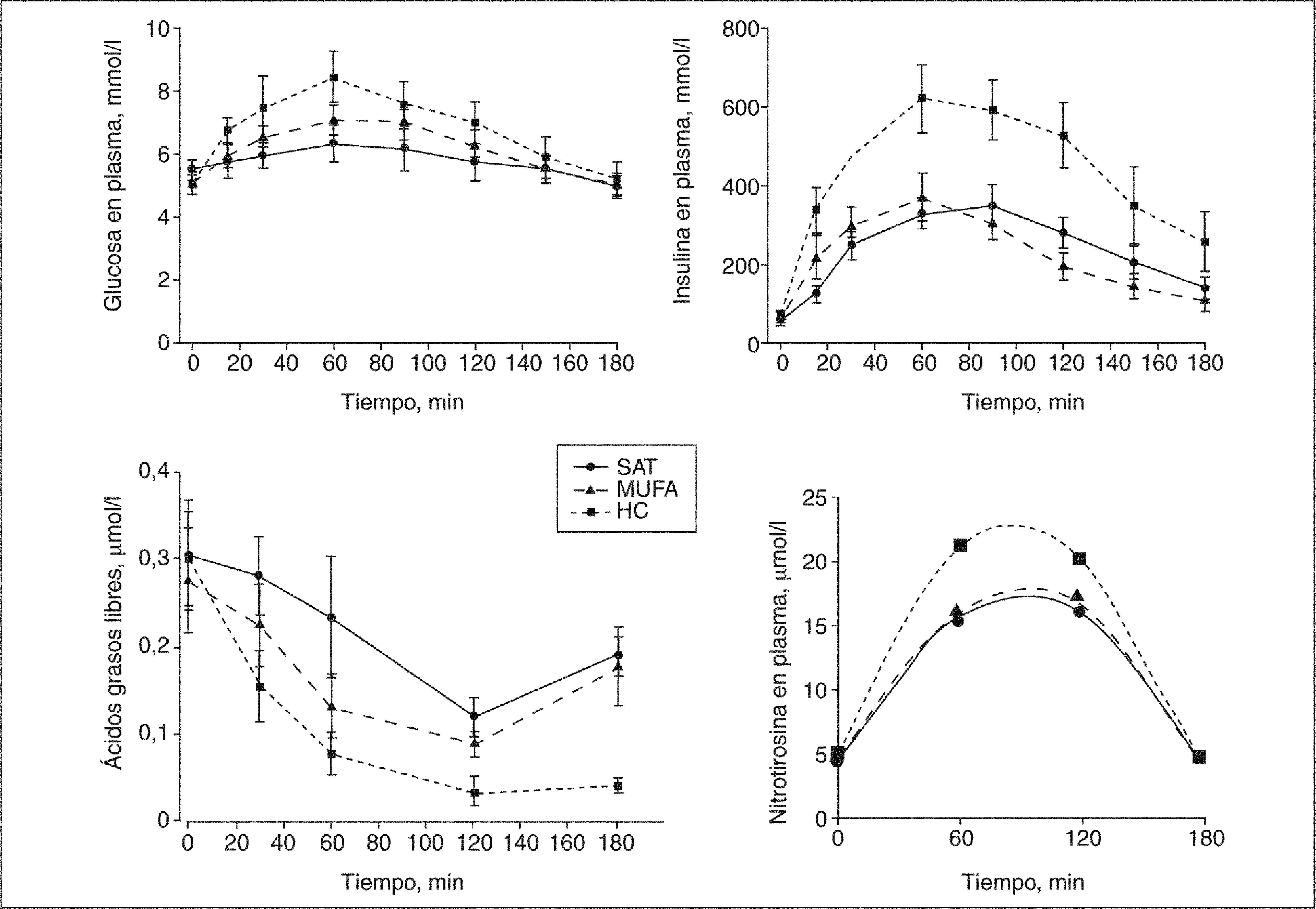
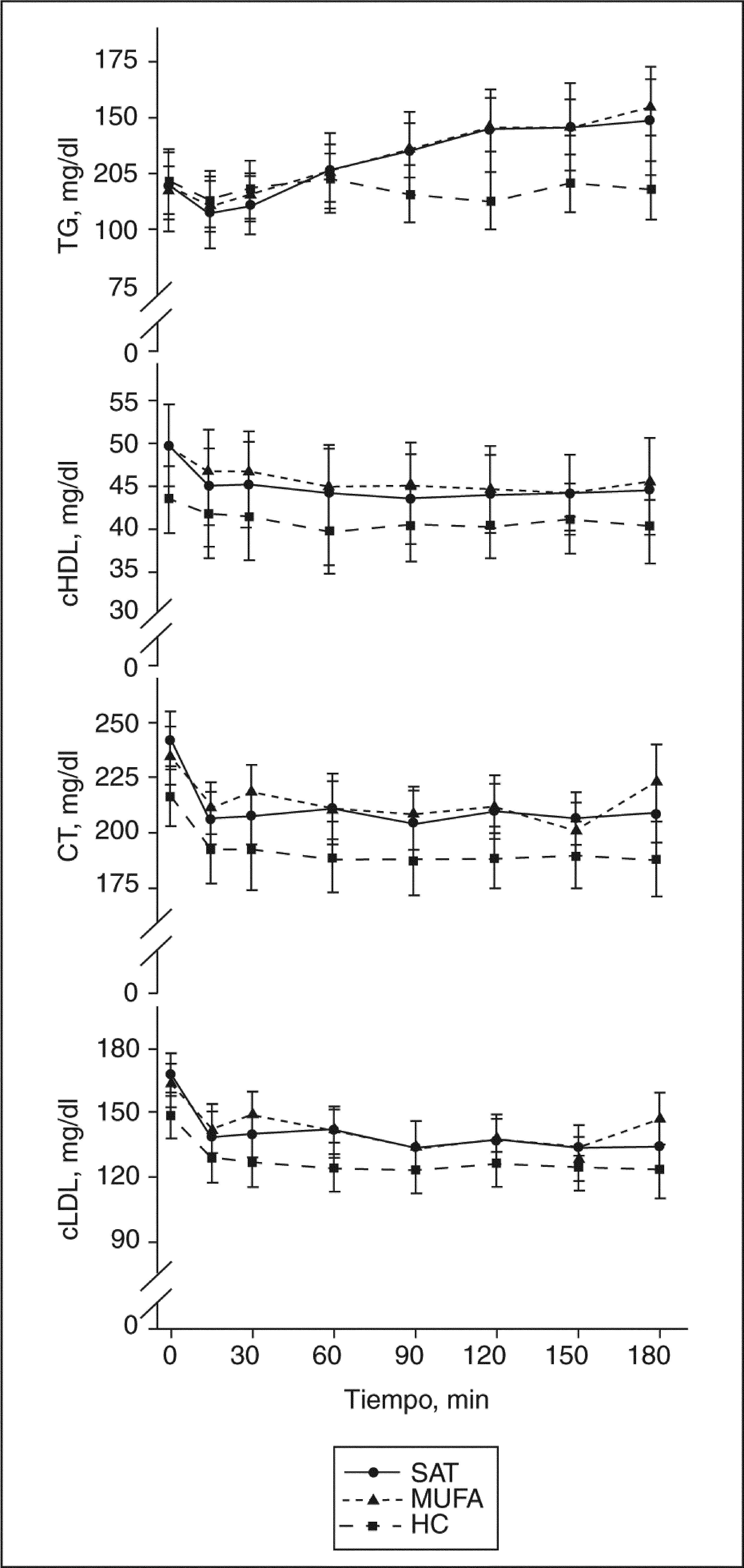
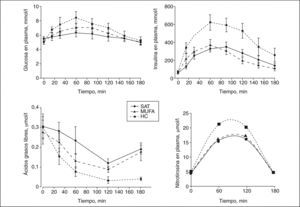
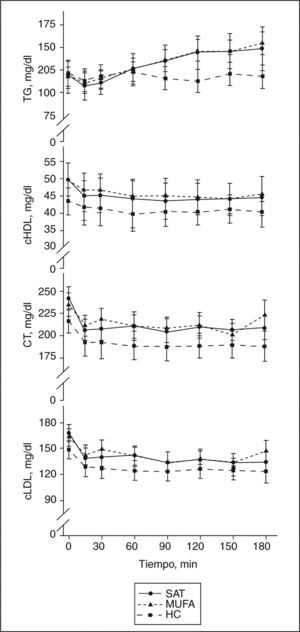
El ABC de la glucosa y la insulina fue significativamente mayor en respuesta al desayuno alto en HC, comparada con la observada tras los desayunos ricos en MUFA y altos en SAT (ANOVA, p < 0,05) (fig. 1). Las concentraciones basales de ácidos grasos libres permanecieron constantes en los 3 períodos de dieta; sin embargo, el ABC de los valores posprandiales de ácidos grasos fueron significativamente menores tras el desayuno alto en HC, comparado con los observados tras el desayuno rico en MUFA y alto en SAT (ANOVA, p < 0,05). Las concentraciones posprandiales de TG incrementaron tras el consumo de las dietas SAT y MUFA, en comparación con los valores observados tras la ingesta de HC (fig. 2). Los valores posprandiales de cHDL permanecieron descendidos tras la dieta alta en HC, al compararla con las dietas MUFA y SAT.
Valores de glucosa, insulina, glucagón y ácidos grasos posprandiales en respuesta a los 3 modelos de dieta. Las concentraciones de glucosa, insulina y nitrotirosina incrementan tras una dieta alta en hidratos de carbono (HC), comparadas con las dietas ricas en grasas. La interacción tiempo frente a dieta fue significativa para la glucemia, la insulinemia y los valores de nitrotirosina (p < 0,05, p < 0,01 y p < 0,05, respectivamente). MUFA: ácidos grasos monoinsaturados; SAT: ácidos grasos saturados.
Perfil lipídico posprandial con las dietas estudiadas. Tras una dieta rica en hidratos de carbono (HC), se observa una concentración menor de triglicérdios (TG), colesterol unido a lipoproteínas de alta densidad (cHDL), colesterol total (CT) y colesterol unido a lipoproteínas de alta densidad (cLDL) calculada, comparada con la observada tras las dietas ricas en grasas. La interacción tiempo frente a dieta fue significativa en los valores de TG (p = 0,000). MUFA: ácidos grasos monoinsaturados; SAT: ácidos grasos saturados.
Las concentraciones basales de NT eran similares después de los 3 períodos de dieta; sin embargo, el ABC de los valores posprandiales de NT incrementaron significativamente después del desayuno alto en HC, comparado con los observados tras el desayuno rico en MUFA y alto en SAT (31,81 ± 1,54; 21,79 ± 3,26; 20,90 ± 2,08, respectivamente; ANOVA; p < 0,05) (fig. 2).
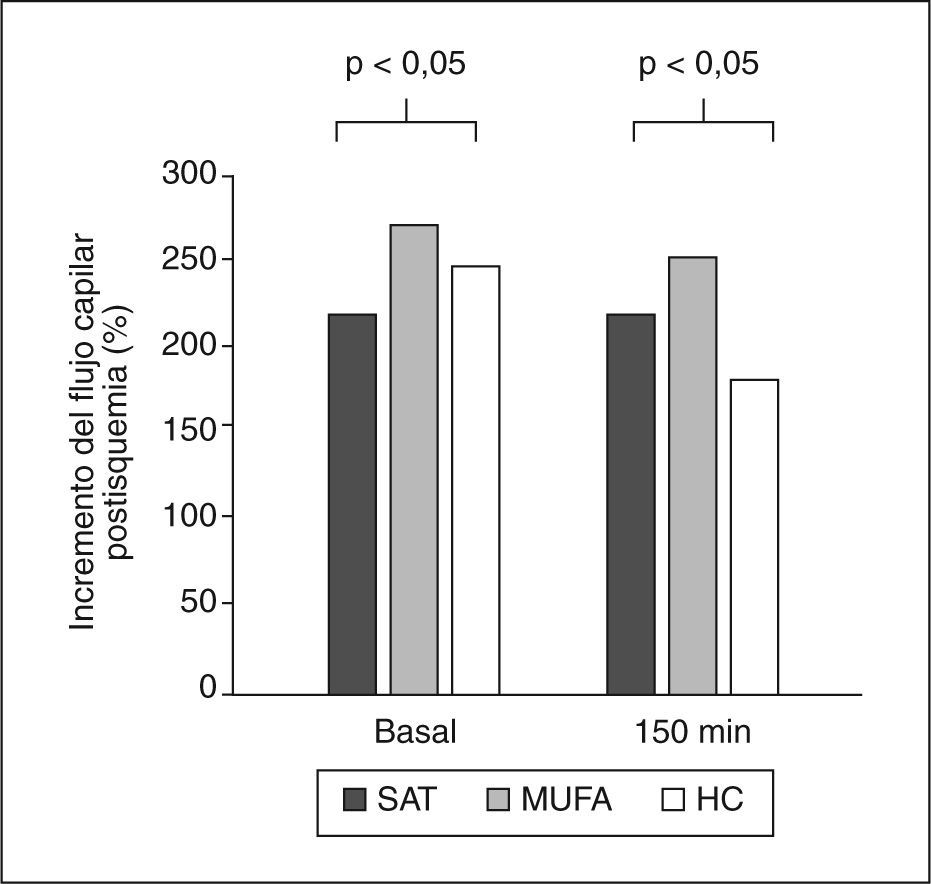
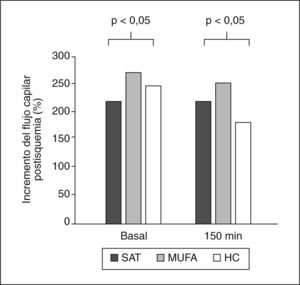
La hiperemia reactiva postisquémica basal y posprandialLa hiperemia reactiva tras isquemia en estado de ayuno (basal) era mayor tras una dieta alta en MUFA, al compararla con las dietas altas en SAT e HC (271,1 ± 16,63; 220,8 ± 13,6; 244,9 ± 37,7, respectivamente; ANOVA; p < 0,05) (fig. 3). En la medida de la función endotelial durante el período posprandial, se observó una reducción de la hiperemia con las 3 dietas ingeridas al compararlas con la respuesta basal. Sin embargo, a los 150min después de la ingesta de la dieta MUFA, la hiperemia reactiva continuaba siendo más elevada que con las dietas SAT e HC (251,9 ± 16,3; 180,1 ± 10,6; 181,4 ± 16, respectivamente; ANOVA, p < 0,05).
Hiperemia reactiva estimada con láser Doppler en las dietas estudiadas. La hiperemia reactiva postisquémica en el estado de ayuno y durante el estado posprandial (a los 150min) tras el consumo de una dieta rica en ácidos grasos monoinsaturados (MUFA) fue mayor comprada con la observada con las dietas ricas en ácidos grasos saturados (SAT) o hidratos de carbono (HC).
Este trabajo es un pequeño ensayo clínico en pacientes con resistencia a la insulina y que evalúa los efectos de 3 modelos de dietas isocalóricas en mantenimiento de peso, que difieren en la composición de ácidos grasos e HC (una dieta rica en SAT; una dieta enriquecida en MUFA o dieta mediterránea, y una dieta rica en HC), en el metabolismo de los HC, la respuesta de glucosa e insulina, el perfil lipídico y la función endotelial. Las características importantes de este estudio son la unicidad del grupo seleccionado de pacientes estudiados (con resistencia a la insulina, sin previo tratamiento antidiabético e hijos de pacientes con DM2 y obesidad) y el diseño del estudio en el que el grupo se expuso de forma secuencial a las 3 dietas. Estos pacientes presentan un riesgo elevado de desarrollar enfermedad cardiovascular y DM2. En este estado (prediabético), se realiza el seguimiento de los pacientes a largo plazo hasta que la “hiperglucemia” basal es evidente. Los tratamientos de primera línea que se aplican a este tipo de pacientes son cambios en el estilo de vida, que incluyen una reducción de peso y un incremento de la actividad física. Sin embargo, la mayoría de los pacientes con sobrepeso y riesgo de DM2 no pueden mantener la pérdida de peso durante largo tiempo, y sigue abierta una discusión respecto a la apropiada composición en macronutrientes de las dietas durante las fases en mantenimiento de peso, por ejemplo, si las dietas deberían enriquecerse con MUFA o con HC.
Nuestros datos indican que el mantenimiento de peso en pacientes con resistencia a la insulina con una dieta mediterránea, alta en grasas y basada en aceite de oliva, mejora el metabolismo de los HC, disminuye los valores basales de glucosa e insulina y mejora su resistencia a la insulina; además, reduce la hiperglucemia y la hiperinsulinemia posprandial. Finalmente, la dieta alta en aceite de oliva mantiene valores basales y posprandiales de cHDL elevados, y se asocia a una mejor respuesta endotelial basal y posprandial.
La hiperglucemia, la hiperinsulinemia y la hiperlipemia son factores de riesgo considerados en el desarrollo de DE, que es una característica temprana de la enfermedad cardiovascular. El síndrome metabólico es el resultado de una interacción entre una predisposición genética y factores medioambientales con la resistencia a la insulina, que resulta en la aparición asociada de varios problemas metabólicos23. La resistencia a la insulina y la hiperinsulinemia se asocian con descensos en los valores de cHDL e incremento en los valores de triglicéridos, y en conjunto incrementa la arteriosclerosis24. Los valores de cHDL se relacionan con un efecto antiaterogénico, representado por el transporte reverso de colesterol de los tejidos periféricos al hígado, acciones antiinflamatorias y antioxidantes del plasma y la pared arterial, y, además, parecen ejercer un efecto protector en la hemostasia25.
Nuestros resultados muestran que la ingesta de una dieta rica en HC incrementa los valores basales y posprandiales de insulina, y se asocian a una disminución de los valores basales de cHDL que permanecen bajos durante toda la fase posprandial, al compararla con las dietas ricas en grasas. Previamente, habíamos demostrado como el control metabólico de la DM2, siguiendo una leve pérdida de peso y acompañado de una disminución de los valores de insulinemia basal, incrementa la actividad de binding periférico de las HDL3, asociado a un aumento de los valores de HDL3 y de apo AI26. Finalmente, en este estudio, hemos observado que la ingesta de una dieta alta en MUFA, comparada con la ingesta de una dieta alta en HC, incrementa los valores de cHDL en estado basal que se mantienen elevados durante toda la fase posprandial, y este hecho se asocia con una elevación menor de los valores de insulina posprandiales y a una mejora de la resistencia a la insulina estimada por HOMA-ir.
Además, nuestro estudio demuestra que el consumo de comidas basadas en aceite de oliva mejora la actividad hiperémica microvascular dependiente de endotelio en estado de ayuno y también la observada durante las primeras 3h del período posprandial en individuos con resistencia a la insulina. Actualmente, evidencias clínicas indican que la hiperglucemia disminuye la función endotelial, tanto en pacientes con diabetes mellitus tipo 1, como en pacientes con DM227. Así, la hiperglucemia durante un infarto de miocardio puede disminuir la perfusión microvascular e incrementar el tamaño del infarto, que asocia al fenómeno de no-reflow28. Asimismo, la hiperglucemia posprandial, tras un test de sobrecarga oral a la glucosa de forma aguda, disminuye la dilatación arterial dependiente de endotelio, mientras se observa una aparición progresiva de los valores de NT29. Durante la hiperglucemia, la interacción de O2- con óxido nítrico es muy rápida y lleva a la producción de NT, considerada un buen marcador de la formación de peroxinitritos, que puede contribuir a la disminución de la función endotelial5,6. Previamente habíamos demostrado que los valores de NT y los de LDL oxidada se cambian de forma rápida a las variaciones agudas de la glucemia, y encontramos los mínimos valores en pacientes con DM2 durante la última fase de pinzamiento euglucémico hiperinsulinémico6. En este estudio, hemos observado que tras la ingesta de una dieta alta en HC, que cursaba con un incremento en los valores posprandiales de glucosa e insulina, se asociaba a un progresivo incremento en los valores de NT posprandial, y finalmente la reactividad dependiente de endotelio era menor que la observada con una dieta alta en MUFA. Por lo tanto, nuestro estudio muestra que la DE observada en individuos con resistencia a la insulina puede prevenirse con la mejora de los cambios agudos posprandiales de ciertas dietas que inducen hiperglucemia.
Por otra parte, la ingesta de dietas con alto contenido de grasas, tradicionalmente, se ha considerado un factor asociado con el desarrollo de DE30. Sin embargo, nuestro grupo ha demostrado previamente que el consumo a largo plazo de una dieta mediterránea, enriquecida con ácido oleico, mejora la función endotelial en pacientes con hipercolesterolemia13,31. Este efecto positivo en la respuesta vasodilatadora dependiente de endotelio de las dietas ricas en aceite de oliva se ha observado directamente correlacionado con los valores de cHDL, e inversamente correlacionado con los valores de triglicéridos plasmáticos13. Pero también se ha postulado que el alto contenido en micronutrientes del aceite de oliva virgen pueden diferenciar el efecto en el endotelio entre las dietas altas en SAT y las altas en MUFA, enriquecidas en aceite de oliva. En ese sentido, el contenido en compuestos fenólicos ha mostrado tener efectos antioxidantes asociados a incrementos en la reactividad vascular de pacientes hipercolesterolémicos; además, los compuestos fenólicos incrementan la resistencia a la oxidación de las partículas de LDL13,32. Finalmente, en este estudio, la dieta rica en MUFA mejoró la resistencia a la insulina que se asoció a un incrementó de la función endotelial basal y posprandial, comparada con las dieta alta en SAT.
Así, nuestros datos apoyan claramente las ventajas de sustituir la SAT e HC por cantidades controladas de aceite de oliva virgen (MUFA) en dietas aplicadas en pacientes con resistencia a la insulina. De una forma más pretenciosa, indica una estrategia de mejorar el pronóstico de pacientes sanos resistentes a la insulina, familiares de pacientes con DM2, tan sólo con un asesoramiento dietético.
En conclusión, en pacientes con resistencia a la insulina, una dieta enriquecida en ácido oleico mejora la hiperemia reactiva basal y posprandial, que se asocia con valores menores de insulina y mayores de cHDL. Por lo tanto, una dieta mediterránea podría aplicarse como un tratamiento alternativo de intervención dietética, mejor que el tratamiento típicamente propuesto rico en HC y bajo en grasas.
Este trabajo ha sido financiado por la Fundación Española de Aterosclerosis, Beca AstraZéneca 2003, la Secretaría General de Calidad y Eficiencia de la Junta de Andalucía 240/04, 462/06, y el CIBER 6/03/0047. Una comunicación referente a esta línea de trabajo se presentó en el XIX congreso Nacional de la Sociedad Española de Arteriosclerosis-Santander, con mención especial. La composición en ácidos grasos de los fosfolípidos se analizó en el Instituto de la Grasa de Sevilla (IGS) que pertenece al Centro Superior de Investigaciones Científicas.