Los países latinoamericanos presentan un crecimiento acelerado de la prevalencia de diabetes mellitus tipo 2 (DM2) asociado al incremento en las tasas de obesidad y sobrepeso, producto de la rápida urbanización experimentada en los últimos años, la cual determina cambios en actividad física y en los hábitos dietéticos. Además, la programación fetal de hijos de madres mal nutridas durante la gestación determina una mayor sensibilidad de estos niños con bajo peso al nacer para desarrollar resistencia a la insulina e inflamación de bajo grado, especialmente cuando se ven sometidos a un medio de excesos alimentarios para los cuales no estuvieron programados, lo que les lleva a presentar obesidad abdominal y mayor riesgo de DM2.
En el presente artículo se revisan algunos de los condicionantes que posiblemente están asociados a la epidemia de DM2 en Latinoamérica, y que básicamente responden a la contradicción entre la necesidad de adaptación del feto a una alimentación materna deficiente o a una insuficiencia placentaria producto de enfermedades como la preeclampsia, y en la etapa adulta, el modo de vida urbano lleno de excesos alimentarios, con alto consumo de grasas saturadas, harinas y bebidas endulzadas, y sedentarismo, condiciones que determinan resistencia a la insulina y DM2. La cabal comprensión de estos condicionantes son fundamentales para combatir la epidemia de DM2 en Latinoamérica, entendiendo que un programa eficaz de prevención de la DM2 demanda un esfuerzo concertado de todos los actores de la sociedad, y no sólo del equipo de salud.
Latin American countries have an accelerated growth in the prevalence of type 2 diabetes mellitus (DM2) associated with increased rates of obesity and overweight. This increase is due to the rapid urbanization experienced in recent years, which has led to changes in physical activity and dietary habits. In addition, the fetal programming of malnourished mothers during pregnancy increases the tendency of children with low birth weight to develop insulin resistance and low-grade inflammation. This is especially so when these children are subjected to an environment of excess food to which they were not programmed, leading them to develop abdominal obesity and an increased risk of DM2.
This article reviews some of the factors that may be associated with the DM2 epidemic in Latin America. These factors are basically caused by the contradiction between the need of the fetus to adapt to poor maternal nutrition or placental insufficiency due to diseases such as preeclampsia, and the need of the adult to adapt to the urban lifestyle full of excess food with a high intake of saturated fats, flours and sweetened beverages, as well as a sedentary lifestyle, which lead to insulin resistance and DM2. A full understanding of these conditions is essential to combat the DM2 epidemic in Latin America, as well as acceptance that effective prevention of DM2 requires a concerted effort by all of the actors in society, not just health teams.
Se estima que alrededor de 250 millones de personas viven actualmente con diabetes mellitus tipo 2 (DM2), y se espera que este número se incremente aproximadamente a 380 millones en el año 2025. La DM2 se ha convertido en la principal causa de enfermedad y muerte temprana en la mayoría de los países del mundo, principalmente por aumentar el riesgo de eventos cardiovasculares. Así, en el año 2005 se estimó que 1,1 millones de personas en todo el mundo murieron directamente por causa de la DM2. Esta cifra puede ser mucho mayor si consideramos que un alto número de fallecimientos fueron registrados como muerte cardiaca o fallo renal, situaciones en las cuales la DM2 contribuye de forma sustancial para el desenlace fatal de estas enfermedades. Se estima que cada año las causas de muerte relacionadas con la DM2 ocasionan 3,8 millones de fallecimientos, lo que equivale a una muerte cada 10 segundos. Desde el punto de vista económico, el tratamiento de la DM2 y de sus complicaciones en el mundo entero costó alrededor de 232 billones de dólares durante el año 2007, y se estima que para el año 2025 subirá a más de 302 billones de dólares. Se ha estimado que el mercado global del tratamiento de la DM2 fue de alrededor de 26,3 billones de dólares para el año 2009 y se espera que aumente a más de 34,5 billones de dólares para el año 20131,2. En verdad, la DM2 es actualmente no sólo un serio problema de salud pública, sino también un enorme problema económico que puede ser especialmente devastador para países de economías débiles como los latinoamericanos. Una cabal comprensión de las causas y de los mecanismos involucrados en esta epidemia de DM2 es fundamental para implementar medidas preventivas y terapéuticas eficientes y eficaces, que soporten un adecuado análisis costo-beneficio. Además, sólo con un adecuado entendimiento de los factores medioambientales que participan del riesgo para desarrollar DM2 podremos demostrar la necesidad de que todos los actores sociales participen en un esfuerzo concertado con el sector salud en programas preventivos, de información, de educación y de comunicación.
En el presente artículo revisamos los diferentes condicionantes que determinan el riesgo para desarrollar DM2 y que ocurren desde la vida intrauterina de un individuo, en muchos de los cuales se da la contradicción de haber sido programados para una realidad diferente a la que les está tocando vivir, dado los acelerados procesos sociales y económicos ocasionados por la globalización de los estilos de vida occidental, los cuales incluyen una desordenada urbanización que concentra en pocas ciudades a millones de individuos que sufren de carencias sanitarias como agua potable y eliminación de excrementos, y sin embargo ya tienen fácil acceso a hábitos y prácticas impuestas por la «vida moderna»: tabaquismo, sedentarismo, alcoholismo, violencia, estrés psicosocial, drogadicción, dieta rica en harinas, grasas saturadas y bebidas azucaradas. Nosotros hemos denominado a esta situación como «patología socioeconómica», la cual propone que el síndrome metabólico (SM), la DM2 y las enfermedades cardiovasculares (ECV) no son sino la respuesta biológica normal del ser humano a un desarrollo socioeconómico anormal3,4.
Prevalencia de DM2 en LatinoaméricaSe estima que en Latinoamérica el número de diabéticos tipo 2 en el año 2000 fue de 35 millones, y que esta cifra subirá a 64 millones en el año 2025, aumento que estará presente en todas las edades, pero principalmente en el grupo de 45 a 64 años de edad, en la cual la prevalencia de DM2 será el doble de la que se observará en los individuos de 20-44 años y en los mayores de 65 años1. La carga económica que estas cifras representarán para el sistema de salud de los países latinoamericanos será enorme en consideración de las mayores tasas de hospitalización y de cuidados médicos que tienen los pacientes con DM2 por la mayor incidencia de ECV, ceguera, insuficiencia renal y amputaciones no traumáticas de miembros inferiores2. A pesar de la gravedad del problema, al momento la mayoría de los países latinoamericanos no han desarrollado sistemas de vigilancia epidemiológica para la DM2 en la población adulta. Aun mas, las cifras anteriores de prevalencia son estimadas, pues en la mayoría de los países de la región no existen datos de prevalencia de DM2 obtenidos de estudios poblacionales bien diseñados. Las informaciones sobre la prevalencia de DM2 derivan de encuestas realizadas en forma esporádica y no con base en programas planificados de detección de la enfermedad. Varias de las encuestas han sido realizadas en regiones o ciudades especificas, pocas tienen carácter nacional y son muy pocos los estudios que se realizaron con una muestra bien calculada y con poder estadístico suficiente.
La prevalencia de DM2 reportada en algunos de los países latinoamericanos varía entre el 5 y el 12%, cifras, insistimos, obtenidas bajo condiciones metodológicas no adecuadas, pero que tienen el valor de dar una aproximación a la magnitud del problema.
En Colombia, la reciente encuesta nacional de salud (ENS) 20075, realizada a nivel nacional en una muestra representativa de la población colombiana, demostró que la prevalencia de diabetes en la población comprendida entre los 18 y los 69 años fue de apenas el 2,6%, siendo mayor en los hombres (3,2%) que en las mujeres (2,1%). Cuando se analizó por grupos etarios, la prevalencia fue incrementándose progresivamente, de 0,9% en el grupo de 18 a 29 años a 6,5% en el grupo de 60 a 69 años. Estas cifras de prevalencia fueron bajas comparadas con las reportadas en una serie de estudios locales en diferentes departamentos del país6–8, situación que llamó a una revisión de las posibles causas de la baja prevalencia encontrada en la ENS 2007. Una de las posibles razones es de tipo metodológico, ya que las determinaciones de glucosa fueron realizadas en sangre capilar (glucometría capilar), cuya utilidad para el diagnóstico de DM2 no está totalmente establecida9–11. Sin embargo, la ENS 2007 demostró que la prevalencia de individuos que presentaron valores de glucemia capilar entre 100 y 125mg/dl y que fueron calificados como pre-diabéticos fue del 9%, cifra cercana a las obtenidas en estudios locales o departamentales, en los cuales se determinó la glucosa en ayunas en sangre venosa6–8. Esta situación llevó que las Sociedades Colombianas de Medicina Interna y de Cardiología, la Federación Colombiana de Diabetes y el Colegio Panamericano del Endotelio propusieran la realización del Estudio Colombiano para la Prevención de la Diabetes Mellitus tipo 2 (ECOPRED2), en el cual se establece la utilización de métodos apropiados para la determinación de glucosa en ayunas, y el uso de los criterios diagnósticos de DM2 aceptados por la Organización Mundial de la Salud (OMS).
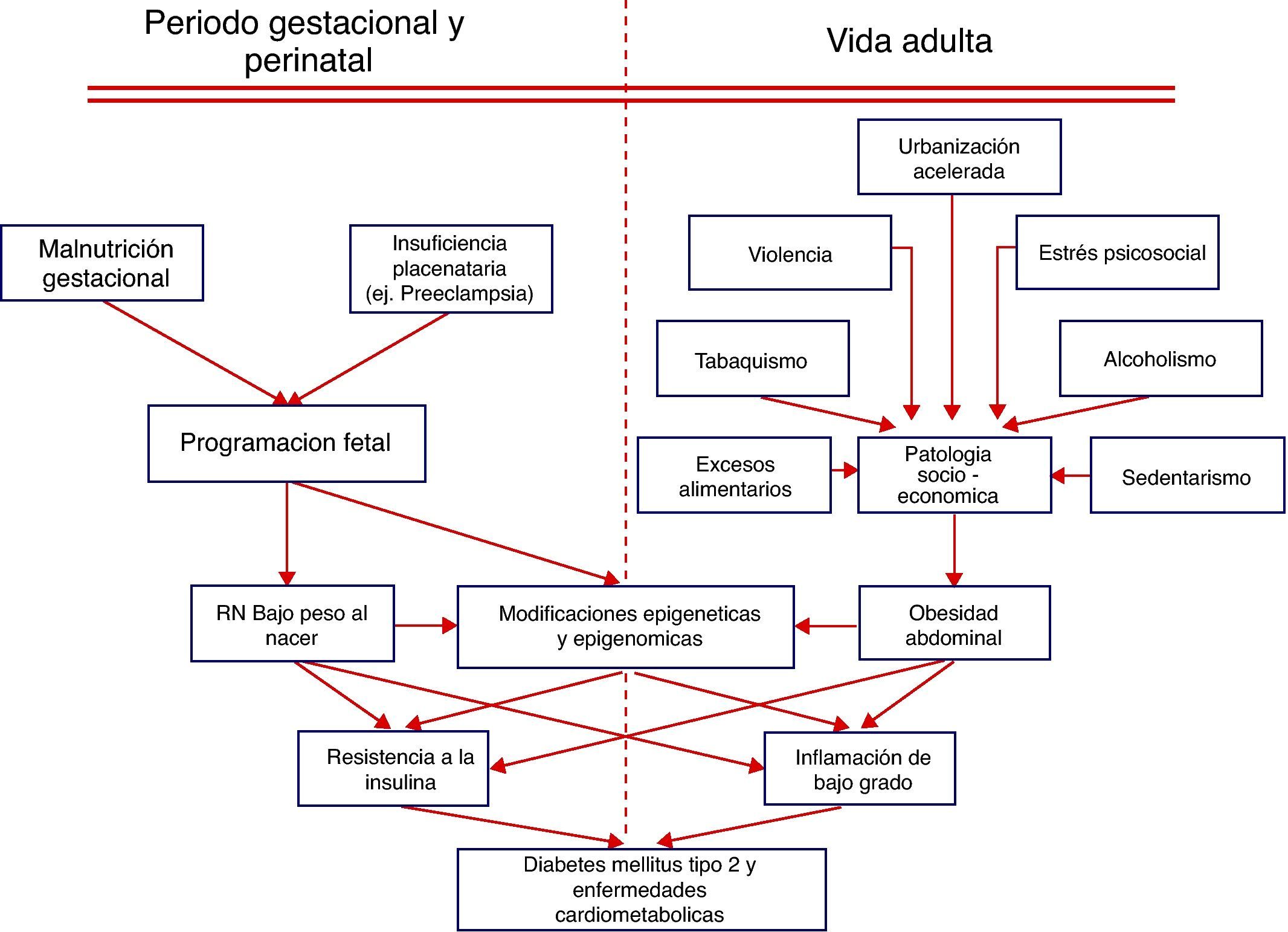
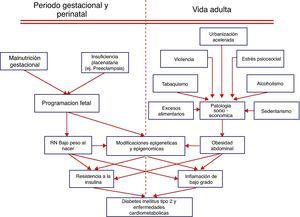
Nutrición materna y riesgo de DM2 en el productoObservaciones realizadas hace algún tiempo12 demostraron la existencia de una relación inversa entre peso al nacer y la mayor susceptibilidad para desarrollar hipertensión arterial, morbilidad cardiovascular, resistencia a la insulina, obesidad y DM2 en la vida adulta. Estas observaciones llevaron a la hipótesis del «fenotipo ahorrador», la cual propone que los ajustes metabólicos que el feto debe realizar de frente a las malas condiciones nutricionales de la madre llevan a limitar su crecimiento somático buscando salvaguardar el desarrollo cerebral, lo que se traduce en bajo peso al nacer y mayor riesgo de enfermedades cardiometabólicas (ECM) en el futuro13. En los países latinoamericanos el bajo peso al nacer para la edad gestacional es un importante problema de salud pública, cuyo origen está asociado principalmente con la malnutrición materna y con alteraciones en la función placentaria debido a infecciones y a preeclampsia14,15. En los sectores sociales empobrecidos de nuestro medio rural o de los suburbios o tugurios de las grandes ciudades latinoamericanas, es común que el recién nacido tenga bajo peso para la edad gestacional14. Estos individuos expuestos posteriormente en su etapa adulta a la «vida moderna» tienen mayor susceptibilidad para presentar DM2 y ECM16. Hace más de dos décadas Hales et al12,13 reportaron que los varones británicos que presentaron pesos al nacer menores de 2.500g tuvieron siete veces más riesgo de ser intolerantes a la glucosa o presentar DM2 en relación a los individuos cuyos pesos al nacer fueron mayores de 4.300g. A esta temprana observación se han sumado una serie de trabajos posteriores realizados en diferentes países en los que se demostró que existe una interrelación entre peso al nacer y la presencia de SM (obesidad abdominal, hipertensión arterial, prediabetes, HDL bajo y triglicéridos altos). Así, en los varones que tuvieron los menores pesos al nacer se incrementó el riesgo de SM hasta en 18 veces, en relación a los que tuvieron mayor peso al nacer16. En nuestra propuesta, la combinación de bajo peso al nacer y obesidad abdominal en la vida adulta es la causa de la mayor sensibilidad que presenta la población latinoamericana para desarrollar resistencia a la insulina e inflamación de bajo grado, eventos que están determinando la epidemia actual de DM2 y ECV en los países subdesarrollados14,15. En la figura 1 se propone un esquema fisiopatológico.
Genética, medio ambiente y plasticidad en el desarrollo fetalExisten tres factores claves involucrados en la sensibilidad que un determinado fenotipo tiene a presentar una enfermedad específica. La relación de estos tres factores clave influye en el fenotipo del adulto, el cual incluye la susceptibilidad para presentar determinadas enfermedades17. Nosotros hemos propuesto que en Latinoamérica son los factores medioambientales y socioeconómicos los principales determinantes del fenotipo a través de la programación de la plasticidad en el desarrollo fetal, y que estos factores epigenéticos se imponen a la carga genética18. Si bien existen varios estudios que demuestran una asociación entre ciertos loci genéticos que influyen en la variabilidad interindividual de la susceptibilidad para presentar ciertas enfermedades, los efectos de la mayoría de alelos son débiles predictores de la presencia de enfermedades específicas19. Sin embargo, existen múltiples estudios que demuestran que diferentes grupos étnicos que viven en las mismas aéreas geográficas y que comparten similares riesgos medioambientales tienen diferentes perfiles de marcadores de enfermedades y diferente prevalencia de las mismas, situación fuertemente sugestiva de una causa genética que explique la diferente susceptibilidad para desarrollar enfermedades específicas20–22. A pesar de estas observaciones, sólo con algunas notables excepciones23, la mayoría de estudios no han podido demostrar la presencia de alelos ancestrales específicos que puedan explicar patologías particulares24,25. De frente a esta contradicción es necesario estudiar otras posibles explicaciones para las diferencias interindividuales, interétnicas y entre clases sociales existentes en el riesgo de desarrollar enfermedades como la DM2. Nosotros proponemos que es el tiempo durante el cual un individuo está expuesto a los excesos del estilo de vida occidental, el factor que determina la mayor o menor susceptibilidad para desarrollar las ECM3,14,15. Así, los emigrantes mexicanos a Estados Unidos y sus hijos estadounidenses de primera generación tienen mayor riesgo para desarrollar obesidad y DM226,27, asociado también a mayores niveles de marcadores inflamatorios a iguales índices de masa corporal y edad28. En soporte a esta propuesta está la bien conocida capacidad que tienen los organismos vivos para responder a las señales externas ajustando su fenotipo durante su desarrollo orgánico para adaptarse a un nuevo medio ambiente, mecanismo denominado «plasticidad en el desarrollo»29. Varios artículos recientes30,31 han profundizado en la revisión de la evidencia que demuestra como los factores medioambientales durante la etapa inicial de la vida de los mamíferos pueden llevar a cambios adaptativos integrados, que se relacionan anticipadamente al medio ambiente que se supone tendrá ese ser en desarrollo en su vida de adulto. Sin embargo, estos mecanismos adaptativos anticipados pueden aumentar el riesgo de que el individuo presente enfermedades, si el medio ambiente en el que teóricamente tenía que vivir el adulto cambia abruptamente, lo que ocasiona una contradicción entre la programación adaptativa y las nuevas circunstancias en las que tiene que vivir el sujeto de adulto. Una población a estudiar es la de los indígenas ecuatorianos (una etnia homogénea) nacidos en precarias condiciones en los páramos andinos (3.000 m sobre el nivel del mar), que crecieron con limitaciones nutricionales durante su infancia y que repentinamente se vieron obligados a migrar a España, en busca de mejores condiciones de vida, y se enfrentan actualmente al sedentarismo y a los excesos nutricionales de la vida moderna, en un medio ambiente diferente.
En el ser humano la plasticidad durante el desarrollo fetal puede ser un factor que determine una mayor susceptibilidad para enfermedades como la DM2, plasticidad que puede explicarse, al menos parcialmente, por alteraciones mediadas en la expresión de los genes (epigenética).
Mecanismos epigenéticos involucrados en la plasticidad durante el desarrollo fetal: posibles efectos en la susceptibilidad a desarrollar DM2El término «epigenética» hace relación a los mecanismos moleculares que establecen y mantienen patrones mitóticamente establecidos de expresión genética, pero que no alteran la secuencia genómica del ADN32. Los mecanismos epigenéticos permiten a los organismos en desarrollo producir fenotipos estables y diferentes a partir del mismo genotipo. Referimos revisiones recientes sobre el tema33,34 para una mayor información sobre las modificaciones epigenéticas en la cromatina, las cuales incluyen:
- •
Metilación del residuo de citosina en los dinucleótidos CpG del ADN.
- •
Modificaciones covalentes (metilación, acetilación, fosforilación, ubiglutinización) de histonas, las proteínas que empacan el ADN dentro de la cromatina.
- •
Las actividades de ARNs no codificados en la regulación de genes y en la organización de la cromatina.
Estas modificaciones epigenéticas cambian la capacidad de unión de los factores de trascripción, ya sean activadores o represores, y de los promotores genéticos específicos; también pueden alterar la conformación de la cromatina a gran escala, y la función de la misma, lo que resulta en modificaciones de la expresión genética, la cual se traduce en último termino en la sobreexpresión o en el silenciamiento de la síntesis de proteínas (epigenómica).
En términos generales se acepta que los mecanismos de metilación del ADN están silenciando la expresión genética a largo plazo, mientras que la modificación en las histonas tienen un efecto de corto alcance y son flexivas en su acción promotora o silenciadora; sin embargo, en la mayoría de los casos existe un entrecruce importante de estos diferentes mecanismos35–40.
Influencia medioambiental en las modificaciones epigenéticasUn creciente cuerpo de evidencias sugiere que cambios en el epigenoma causados por factores medioambientales que se presentan temprano en el desarrollo, se asocian con una aumentada susceptibilidad a la presencia de enfermedades metabólicas en la vida adulta. La mayoría de evidencias se han obtenido de modelos animales y de estudios en células cultivadas34–43. Los modelos animales que estudian los orígenes de las enfermedades en la plasticidad durante el desarrollo orgánico buscan mimetizar las patologías humanas alterando la nutrición materna (ingesta de proteína o energía) durante la gestación y la lactancia, alterando la perfusión placentaria, o por la administración de glucocorticoides a la madre. Se observan como desenlaces los efectos en los diferentes sistemas y órganos de los animales recién nacidos.
En ratas se demostró que si la dieta es insuficiente en proteínas durante la gestación, los productos desarrollan en la vida adulta hipertensión y disfunción endotelial, alteraciones que se acompañan por cambios metabólicos asociados a sobreexpresión genética de los receptores activados por proliferadores peroxisómicos (PPAR) alfa y de los receptores para glucorticoides a nivel hepático, los cuales se relacionan con cambios epigenéticos que facilitan la trascripción de estos receptores y que incluyen modificaciones en la histona, hipometilación del promotor y expresión reducida de Dnmt138. En un modelo similar de rata con desnutrición proteica durante la gestación se demostró una aumentada expresión del receptor 1 de angiotensina II (AT1) en la glándula adrenal de los productos a la semana de vida, alteración que se asoció con hipometilación del promotor proximal del gen que codifica dicho receptor39. Se ha demostrado también que la insuficiencia placentaria causa un aumento de la expresión del factor p53 en los riñones del producto, situación que se asocia a reducida metilación del promotor, la que se manifiesta por aumentada apoptosis renal y menor número de glomérulos40. Una situación similar ha sido descrita a nivel hepático41. El modelo de insuficiencia placentaria también ha sido utilizado experimentalmente en roedores para demostrar que los productos desarrollan disfunción de la célula beta pancreática y DM2 en la vida adulta42,43. La lesión molecular asociada a esta alteración es la baja expresión del factor de transcripción específico del páncreas, el cual es codificado por Pdx142,43. La modificación neonatal de la histona, la cual es reversible, ocasiona reducción de la expresión de Pdx1, lo cual en el animal adulto que desarrolla DM2 se acompaña por alteraciones del CpG en el promotor del Pdx1, lo que ocasiona el silenciamiento permanente del gen42. Además, las modificaciones en la histona pueden ser responsables por una expresión disminuida del transportador de glucosa 4 (GLUT4), alteración que se relaciona con intolerancia a la glucosa en los neonatos de ratas embarazadas que recibieron apenas el 50% de su ingesta diaria normal, cambios que persistieron durante la vida adulta42. Estos cambios fueron interpretados como siendo adaptativos en respuesta a la desnutrición materna. En corderos se demostró que la restricción en el periodo periconcepcional de la ingesta de folato, de vitamina B12 y de metionina lleva a importantes cambios en el epigenoma fetal y en los animales recién nacidos, los cuales, a pesar de presentar pesos similares a los de los animales control, desarrollaron obesidad, resistencia a la insulina e hipertensión arterial cuando alcanzaron la vida adulta43. Es bien conocido que en el ser humano los niveles séricos de folato durante el embarazo se correlacionan positivamente con el contenido de adipocitos del recién nacido y con resistencia a la insulina, tan temprano como a los 6 años de edad, mientras que los niveles séricos de vitamina B12 se correlacionan negativamente con resistencia a la insulina, y se conoce además que el mayor grado de resistencia a la insulina se presenta en los niños cuyas madres tuvieron durante el embarazo un exceso en el consumo de folato pero una deficiente ingesta de vitamina B1244. Se ha demostrado también que en animales diabéticos existe una disminuida metilación de la histona H3, modificación que representa un marcador de represión de trascripción, junto con aumentada expresión de genes proinflamatorios45,46. Los resultados revisados anteriormente en animales de experimentación demuestran la importante influencia que durante el periodo de gestación tiene la nutrición materna sobre la función metabólica de los productos cuando alcanzan la vida adulta.
En humanos, la población más utilizada para estudiar esta relación ha sido la expuesta al denominado «invierno de hambre holandés», época en la que durante la Segunda Guerra Mundial la población holandesa tuvo un periodo de hambruna. Aquellos individuos cuyas madres estuvieron expuestas a la restricción alimentaria durante el periodo periconcepcional, o en el primer trimestre de la gestación, no presentaron pesos al nacer menores que los individuos cuyas madres en ese periodo no tuvieron problemas de alimentos; sin embargo, estos individuos presentaron en la vida adulta una mayor prevalencia de obesidad y enfermedad arterial coronaria. Los individuos cuyas madres estuvieron expuestas a la carencia de alimentos en etapas más tardías del embarazo tuvieron menor peso al nacer y experimentaron mayor prevalencia en la vida adulta de resistencia a la insulina, hipertensión arterial y DM247–49. Y como aspecto interesante, los individuos cuyas madres estuvieron expuestas a la carencia de alimentos al ser estudiados cuando alcanzaron los 60 años de edad, tuvieron una disminuida metilación especifica de los dinucleótidos CpG en el gen impresor para el factor de crecimiento semejante a la insulina tipo 2 (IGF2), resultado que sugiere fuertemente que el estado nutricional en etapas tempranas de la vida puede causar cambios permanentes en el epigenoma humano50.
Herencia de los marcadores epigenéticosCambios en el epigenoma durante el desarrollo orgánico pueden ser heredados por las subsecuentes generaciones. Estudios experimentales han demostrado que intervenciones nutricionales y hormonales en animales gestantes resultan en cambios epigenéticos y fenotípicos que persisten al menos en las próximas dos generaciones51–53. De momento no está claro si esta herencia representa una verdadera transmisión generacional o si es un simple cambio en la célula germinal de la primera generación que fue expuesta a los cambios nutricionales o endocrinos in útero. El concepto de la herencia transgeneracional de las modificaciones epigenéticas ocasionadas por las condiciones medioambientales permanece controvertido. Algunos datos epidemiológicos en humanos demuestran la existencia de una herencia no genómica en el riesgo de presentar una determinada enfermedad, como es el caso del invierno del hambre holandés54. Sin embargo, todavía es limitado el conocimiento sobre el papel que tienen en este proceso los factores epigenéticos, ya que existen serias limitaciones metodológícas para establecer, en un individuo o en una sociedad, cuáles son las contribuciones específicas del genoma y cuáles las de la epigenómica. Pero a pesar de tales limitaciones, ésta es una línea de investigación de gran trascendencia para la salud pública, especialmente de los países como los latinoamericanos, que se encuentran en pleno proceso de transición de su estilos de vida, lo que determina un acelerado proceso de cambio de la desnutrición al sobrepeso y a la obesidad55, por lo que es necesario profundizar el estudio de esta relación para determinar los mecanismos por los cuales la información epigenética sobrevive a la reprogramación que ocurre durante la embriogénesis y la gametogénesis.
¿Es la resistencia a la insulina y la inflamación de bajo grado la respuesta epigenética a la obesidad abdominal?Nosotros proponemos que la obesidad abdominal es clave en el proceso de adaptación a la contradicción entre la programación fetal y los nuevos estilos de vida en Latinoamérica14,15,18. La relación entre obesidad e incidencia de ECM fue establecida por el estudio de Framingham, que demostró que la obesidad es un factor independiente que predice ECM en ambos sexos56. Esta relación fue más evidente en estudios posteriores57, y el estudio IDEA58, realizado en 63 países y que incluyó a 170.000 individuos que asistían a servicios de atención primaria, demostró que por un aumento de 14cm en el perímetro abdominal en los hombres y de 14,9cm en las mujeres, aumenta la posibilidad de presentar ECM en 21-40%. El Panel III de Tratamiento del Adulto del Programa Nacional de Educación en Colesterol (ATP III) reconoció que el sobrepeso y la obesidad figuraban entre los principales factores de riesgo para ECM, destacando que la obesidad abdominal está más fuertemente correlacionada que el índice de masa corporal59. La Federación Internacional de Diabetes (IDF) determinó que la obesidad abdominal es un componente obligatorio para el diagnostico de SM, el cual está estrechamente vinculado al desarrollo de ECM60. Además, la IDF propuso utilizar diferentes puntos de corte de perímetro abdominal de acuerdo a etnias, regiones o países, para establecer el diagnóstico de obesidad abdominal61. En Latinoamérica, nosotros demostramos que el criterio para diagnosticar SM de la IDF utilizando el punto de corte de perímetro abdominal de 90cm para hombres y 80cm para mujeres es mas útil que el del ATP III (102cm en hombres y 88cm en mujeres) para identificar individuos sin eventos cardiovasculares pero en alto riesgo para desarrollar ECM62. Además, en este estudio, que incluyó a más de 500 individuos con antecedentes de infarto agudo de miocardio o de accidente cerebrovascular, se demostró que dos de cada tres de estos sujetos tenían SM, independientemente de cuál de los dos criterios diagnósticos fueron utilizados, lo que destaca la importancia de las diferencias regionales para el diagnóstico de SM en etapas en las que todavía se pueden aplicar medidas preventivas. Es también conocido que las poblaciones de países subdesarrollados —entre estos los latinoamericanos— tienen más riesgo de desarrollar ECM a menores niveles de perímetro abdominal63–65. En hombres jóvenes de Colombia y Ecuador66,67 demostramos que el mejor punto de corte de perímetro abdominal para identificar hombres en riesgo de ECM es el de 90cm.
La circunferencia abdominal es un parámetro fácil y económico para evaluar el contenido de grasa visceral, que es la mayor fuente de citocinas proinflamatorias, las cuales se encuentran elevadas en sujetos con sobrepeso y obesidad68–71. Se ha propuesto que la inflamación sistémica producida por el tejido adiposo visceral participa en todas las etapas del desarrollo de las ECM72,73. Así, al momento sabemos que la proteína C reactiva (PCR), producida en el hígado en respuesta al estímulo del factor de necrosis tumoral alfa (TNF-α) y la interleucina 6 (IL-6), está aumentada en sujetos con eventos coronarios múltiples y que es un fuerte predictor independiente de un nuevo evento isquémico coronario74. En la población latinoamericana demostramos que la PCR es un factor de riesgo independiente para hipertensión arterial esencial75 y para preeclampsia76,77. Además, reportamos que las concentraciones de PCR están aumentadas en sujetos dislipidémicos con SM78. En estos pacientes el perímetro abdominal se asoció a un aumento en los valores de índice de resistencia a la insulina determinado por el HOMA index78. Interesante es la observación de que, y a pesar de las eventuales diferencias que pueden existir en las técnicas para cuantificar la PCR, las concentraciones fueron más altas en la población latinoamericana que las reportadas en las poblaciones caucásicas de los países desarrollados, lo que sugiere que nuestra población, por alguna causa no bien determinada, presenta una mayor sensibilidad para desarrollar inflamación sistémica de bajo grado y resistencia a la insulina a menores niveles de adiposidad visceral79,80. Estas observaciones pueden ser importantes a la luz de los resultados del estudio INTERHEART81,82, que identificó los factores de riego asociados a la presencia de un primer infarto agudo de miocardio y determinó el riesgo poblacional atribuible (RPA) a cada uno de los factores. Los 9 factores de riesgo modificables identificados en este estudio, que incluyó a más de 20.000 individuos reclutados en diferentes regiones del mundo, fueron alteraciones en el perfil lipídico, tabaquismo, hipertensión arterial, obesidad abdominal, estrés psicosocial, diabetes, sedentarismo, insuficiente ingesta de frutas y verduras y consumo de alcohol, el cual fue protector. La presencia de estos factores explicó más del 90% del RPA, tanto en hombres como en mujeres, en todas las regiones del mundo, lo que es alentador, pues significa que el infarto agudo de miocardio puede ser prevenible si se controlan esos 9 factores de riesgo. Destacamos que en este estudio que incluyo a Chile, Colombia, Argentina y Brasil, y a diferencia del resto del mundo, la obesidad abdominal fue el RPA más importante, con el 48,5%, mientras en el resto de países el RPA para obesidad abdominal fue de apenas el 30,2%. Además, en otro estudio poblacional realizado en Costa Rica83, para un infarto agudo de miocardio en 889 pacientes no diabéticos que no recibían ningún medicamento, la obesidad abdominal fue el factor de riesgo más importante, con un valor de RPA de 29,3%, especialmente en mujeres, en quienes alcanzó una cifra de 35%. Estos resultados demuestran la importancia que en nuestra población tiene la obesidad abdominal en el desarrollo de resistencia a la insulina, inflamación de bajo grado y alta incidencias de DM2 y ECV, al punto de ser el factor de riego más importante para la presentación de un infarto agudo de miocardio. Recientemente el Estudio INTERSTROKE84,85 confirmó la importancia de la obesidad abdominal en nuestras poblaciones, al demostrar que es el factor de riesgo con el mayor riesgo poblacional atribuible en la población latinoamericana para la presentación de un accidente cerebrovascular isquémico o hemorrágico, dato que destaca el rol protagónico que en los países sudamericanos participantes (Colombia, Ecuador, Perú, Chile, Argentina y Brasil) tiene la reciente epidemia de obesidad abdominal.
Aportes traslacionales de la epigenética a la prevención de la DM2A diferencia de la poca información útil para la práctica clínica obtenida de los estudios de genómica para predecir e identificar individuos en riesgo de presentar DM286,87, la aparición de marcadores epigenéticos como los patrones de metilación en promotores genéticos específicos sí puede ser útil en la identificación de sujetos y poblaciones con aumentada sensibilidad a presentar DM2 en la vida adulta a causa de factores adversos en la nutrición intrauterina88. La identificación de estas poblaciones o individuos puede ser de gran utilidad para el desarrollo de programas preventivos de DM2, ya sea a través de modificaciones en los estilos de vida o a través de intervenciones nutricionales o farmacológicas activas89–91. Las consecuencias fenotípicas y epigenéticas del retardo de crecimiento intrauterino en el desarrollo pancreático y el riesgo de presentar DM2 en la vida adulta podrían ser revertidas por intervenciones farmacológicas que modifiquen las alteraciones epigenéticas, como, por ejemplo, con medicamentos de uso oncológico como el inhibidor de la deacetilasa de histonas91.
En conclusión, el proceso de transición de individuos nacidos de madres mal nutridas con bajo peso y que en la vida adulta se exponen a hábitos de vida que les conducen a obesidad abdominal, parece ser el determinante de la epidemia de diabetes que se presenta actualmente en los países latinoamericanos. La comprensión de estos procesos a través de investigaciones epidemiológicas, clínicas y básicas, debe ser una prioridad en nuestra región, y de sus resultados dependerá la implementación de programas preventivos eficaces y eficientes que tomen en consideren las diferencias regionales dependientes de mecanismos epigenéticos.