Numerosos estudios prospectivos han mostrado una correlación inversa entre los valores séricos de colesterol unido a lipoproteínas de alta densidad (HDL) y el desarrollo de enfermedad coronaria.
Varias propiedades de las HDL tienen el potencial de proteger contra el desarrollo de aterosclerosis. La propiedad mejor documentada es su habilidad de promover el eflujo de colesterol desde macrófagos en la pared arterial. Sin embargo, las HDL presentan un sinnúmero de propiedades antiaterogénicas adicionales, que pueden no estar relacionadas con su papel de transportador de lípidos en el plasma. Por ejemplo, las HDL modulan la función endotelial, probablemente estimulando la producción de óxido nítrico. Las HDL tienen actividad antioxidante, antiinflamatoria y antitrombótica. Estas actividades las ejercen especialmente apolipoproteínas, enzimas y fosfolípidos asociados a la HDL.
Es todavía incierto el grado, al cual algunas o todas estas funciones no relacionadas con el transporte de lípidos asociado a HDL, contribuye a proteger contra la aterosclerosis, aunque hay evidencias crecientes que al menos alguna de ellas puede ser de gran importancia
An inverse correlation between serum levels of high-density lipoproteins (HDLs) cholesterol and the development of coronary heart disease has been observed in many prospective studies.
There are several properties of HDLs that have the potential to protect against the development of atherosclerosis. The best documented is the ability of HDL to promote the efflux of cholesterol from macrophages in the arterial wall. However, HDLs have a number of additional potentially antiatherogenic properties that may be unrelated to their role in plasma lipid transport. For example, HDLs modulate endothelial function, probably by stimulating endothelial NO production. HDLs also possess anti-oxidative, anti-inflammatory and antithrombotic activities. These activities are exerted by different components of HDL, namely apolipoproteins, enzymes and even specific phospholipids.
The degree to which any or all of these non-lipid transport functions of HDL contribute to protection against atherosclerosis is still uncertain, although evidence is mounting that at least some of them may be of substantial importance.
Hoy día es ampliamente reconocido que el riesgo de aterosclerosis está inversamente relacionado con los valores circulantes de colesterol unido a lipoproteínas de alta densidad (HDL)1,2. Además, el estudio epidemiológico de Frammingham estableció que esta asociación es independiente de los valores de colesterol unido a lipoproteínas de baja densidad (LDL)3,4. Por otra parte, estudios clínicos, como el Veterans Administration HDL Intervention Trial (VA-HIT)5 y el Helsinki Heart Study6, han demostrado en pacientes tratados con fibratos una incidencia baja de episodios coronarios asociada con un aumento en los valores plasmáticos de HDL, aportando así la mejor evidencia del beneficio clínico de la elevación de los valores de HDL de forma farmacológica. En congruencia con los estudios realizados en humanos, hay además numerosos estudios intervencionales en animales que muestran que un aumento en las concentraciones de HDL inhibe el desarrollo de aterosclerosis.
El papel antiaterogénico de la HDL se ha atribuido a menudo a su capacidad de mediar el transporte reverso de colesterol, proceso por el cual el exceso de colesterol es removido desde los tejidos periféricos y entregado al hígado para su excreción biliar7. Sin embargo, las bases de la ateroprotección relacionada con HDL permanecen complejas y aún no del todo claras.
Además del transporte reverso de colesterol, han surgido otros mecanismos potenciales para explicar las propiedades antiaterogénicas de la HDL. Éstos incluyen la modulación de la función endotelial, las acciones antitrombóticas, antioxidantes y antiinflamatorias. El grado al cual estas propiedades de la HDL, no relacionadas con su papel en el transporte de lípidos, contribuyen a la protección contra la aterosclerosis es todavía incierto, aunque hay evidencias crecientes que indican que al menos alguna de ellas puede ser de gran importancia.
Transporte reverso de colesterolLa importancia fisiológica del transporte reverso de colesterol radica en que, como las células periféricas son incapaces de catabolizar el colesterol, ellas requieren eliminarlo para mantener la homeostasis lipídica, a excepción del tejido esteroidogénico, que lo convierte en hormonas esteroidales. Esto es particularmente relevante en el caso de los macrófagos, en que la acumulación de colesterol no está controlada por mecanismos de regulación asociados al receptor de la LDL.
Una vía clave es el eflujo de colesterol hacia aceptores extracelulares y su movilización al hígado para excretarlo.
Como el proceso fisiológico del transporte reverso de colesterol se lleva a cabo a partir de todos los tejidos periféricos, éste ha sido a menudo medido y discutido como un proceso periférico general. Sin embargo, en las lesiones ateroscleróticas, el macrófago es la principal célula que se carga de colesterol y, por tanto, al hacer referencia a la aterosclerosis, es más lógico conceptualizar y medir el transporte reverso de colesterol como un fenómeno específico del macrófago; por lo que se recomienda usar más específicamente el término transporte reverso de colesterol desde macrófagos8.
No todo el eflujo de colesterol desde tejidos, como hígado o intestino, forma parte del modelo clásico de transporte reverso de colesterol o es directamente relevante a la aterosclerosis. Sólo el eflujo de colesterol desde macrófagos de la pared arterial, que tienen la capacidad de transformarse en células de espumas por captación excesiva de LDL modificada, es el más directamente relevante a la aterosclerosis.
El colesterol libre captado por el macrófago es tóxico para la célula. La primera línea de defensa contra la toxicidad en macrófagos es la esterificación del colesterol libre a ésteres de colesterol por la enzima acil-coenzima A: colesterol aciltransferasa-1 (ACAT1)9. El colesterol éster se almacena como gotas de lípidos dentro del citoplasma y esta acumulación de ésteres de colesterol lleva a la formación de la célula de espuma. La regresión de la aterosclerosis podría estar acompañada por una pérdida de la masa de ésteres de colesterol desde la célula de espuma, la cual requeriría previamente la hidrólisis de los ésteres de colesterol a colesterol libre.
Una segunda línea de defensa contra la toxicidad del colesterol en el macrófago la constituye el eflujo de colesterol. Se han llevado a cabo numerosos trabajos que tienden a conocer las características moleculares y la regulación del eflujo de colesterol desde macrófagos.
En este proceso están involucrados 2 transportadores principales: a) ABCA1, el cual promueve el eflujo de colesterol libre y fosfolípidos hacia aceptores extracelulares, como apolipoproteínas A-I (apoA-I) libre de lípidos y preβ HDL, y b) ABCG1, el cual promueve el eflujo de colesterol a partículas de HDL maduras.
El transportador ABCA1 se ha identificado como la molécula defectuosa en la enfermedad de Tangier10–12. Pacientes con enfermedad de Tangier casi no tienen HDL en plasma, debido a su rápido catabolismo; acumulan células de espumas y presentan una aterosclerosis acelerada.
El transportador ABCA1 parece que actúa como una translocasa de lípidos, con el aumento de la disponibilidad de fosfolípidos y colesterol en la superficie celular. La apoA-I pobre en lípidos interactuaría directamente con ABCA1 posiblemente por unión a los 2 grandes dominios extracelulares del transportador. Esta unión parece constituir una etapa esencial en el eflujo de colesterol y fosfolípidos hacia la apoA-I.
Han surgido diferentes modelos para explicar la forma que este transportador media el eflujo de colesterol. Un primer modelo plantea que ABCA1 promueve el eflujo de fosfolípidos y colesterol libre desde un dominio de la membrana en una sola etapa. Otro modelo plantea que ABCA1, localizado en unas vesículas de transporte denominadas rafts, promueve el eflujo de fosfolípidos y colesterol hacia apoA-I. Y un tercer modelo plantea que ABCA1 promueve primero el eflujo de fosfolípidos hacia apoA-I para formar complejos intermediarios, los cuales remueven el colesterol libre desde los rafts13.
La interacción de apoA-I con ABCA1 promueve no sólo el eflujo de colesterol y fosfolípidos desde la célula, sino también la activación de varias proteínas involucradas en señales intracelulares, como las proteínas G, Cdc42 y Rac1; proteínas cinasas PKA, JAK-2 y p54JNK, y proteínas α y β1-sintrofina. Las señales intracelulares generadas por la interacción apoA-I/ABCA1 facilitan el transporte de colesterol intracelular y/o transmembrana y, de este modo, la lipidación de la apoA-I. Además de la remoción de lípidos, la señalización desde fuera hacia dentro, inducida por apoA-I, probablemente cumple otras funciones antiaterogénicas, como la inhibición de la apoptosis o la inflamación12.
Aunque en los macrófagos ABCA1 tiene una función antiaterogénica, no contribuye significativamente al mantenimiento de los valores de HDL en el plasma. Se ha observado en ratones que una deficiencia de ABCA1, específica de macrófagos, tiene un efecto mínimo en la reducción de los valores de colesterol unido a HDL (cHDL). Sin embargo, esto se expresa en un aumento significativo de aterosclerosis. Así, su actividad sería esencial para iniciar la formación de HDL, pero no explicaría fácilmente la relación inversa observada entre los valores de HDL y el riesgo de aterosclerosis14–16.
Actualmente, se sabe que otro transportador de la familia ABC, denominado ABCG1, promueve el eflujo de colesterol desde los macrófagos hacia las principales formas de HDL circulante en el plasma17,18, lo que conduce a un enriquecimiento sucesivo de la HDL en colesterol antes de retornar a la circulación.
Ratones ABCG1-/-mostraron acumulación de lípidos en macrófagos, exhibiendo a su vez un eflujo alterado de colesterol hacia HDL maduras19.
La perfusión de complejos de apoA-I recombinante con fosfolípidos ha demostrado aumentar los valores de HDL, probablemente actuando como aceptores en el eflujo de colesterol mediado por ABCG120.
Además del eflujo mediado por ABCA1 y ABCG1, el colesterol puede excretarse desde el macrófago por un proceso mediado por un receptor scavenger de clase B tipo 1 (SR-B1)21,22. Sin embargo, el eflujo de colesterol facilitado por SR-B1 pareciera no desempeñar un papel más importante en el macrófago8,23,24.
El colesterol que adquiere la HDL naciente y la apoA-I desde la célula se encuentra en la forma no esterificada o libre, y, una vez asociado a estas partículas, éste puede esterificarse por la acción de la enzima lecitina: colesterol aciltransferasa (LCAT) transportada por la HDL25.
Debido a que el colesterol esterificado es más hidrofóbico que el colesterol libre, debe desplazarse hacia el centro de la partícula lipoproteica y conducir a la formación de las HDL maduras.
En el modelo clásico de transporte reverso de colesterol, el cHDL es finalmente transportado y captado por el hígado en un proceso mediado por el receptor SR-B126. Diversos estudios han planteado que SR-B1 media la captación selectiva del colesterol esterificado de la HDL, aunque también se sabe que SR-B1 es capaz de mediar selectivamente la captación del colesterol libre de la partícula27. La sobreexpresión hepática de SR-B1 reduce los valores plasmáticos de cHDL, debido a una captación mayor de la lipoproteína por el hígado28; en cambio, ratones knockout al SR-B1 exhiben valores aumentados de cHDL en plasma, atribuible a una captación hepática reducida29.
Más recientemente se ha informado que la sobreexpresión hepática de SR-B1 en ratones es un regulador positivo del transporte reverso de colesterol en macrófagos30.
El colesterol esterificado de HDL puede también transferirse a lipoproteínas que contienen apoB (LDL, lipoproteínas de densidad intermedia, lipoproteínas de muy baja densidad) por la proteína de transferencia de colesterol esterificado (CETP)31.
El impacto de la CETP en el metabolismo de la HDL se demostró con el descubrimiento de pacientes con deficiencia genética de CETP, los cuales exhibían valores extremadamente elevados de cHDL32, evidencia que generó la posibilidad que la inhibición de CETP pueda ser una nueva estrategia dirigida a elevar los valores de cHDL en el plasma33–35.
Acciones endoteliales de la lipoproteína de alta densidadEl endotelio secreta un número importante de factores que regulan la vasoconstricción y vasodilatación, modulan la activación plaquetaria, la coagulación y la fibrinólisis y afectan a la proliferación y la diferenciación de las células musculares lisas. Uno de los compuestos más importantes sintetizados por las células endoteliales en respuesta a ciertos estímulos fisiológicos lo constituye el óxido nítrico (NO). A través de la acción del NO, el endotelio induce relajación de los vasos sanguíneos, atenúa la adhesión y la agregación de trombocitos y disminuye la adhesión y la migración de leucocitos a la pared del vaso.
Perturbaciones de la función endotelial pueden promover la coagulación intravascular, la disminución de la fibrinólisis, el aumento de la infiltración de macrófagos en la pared del vaso y la interferencia de la vasorrelajación.
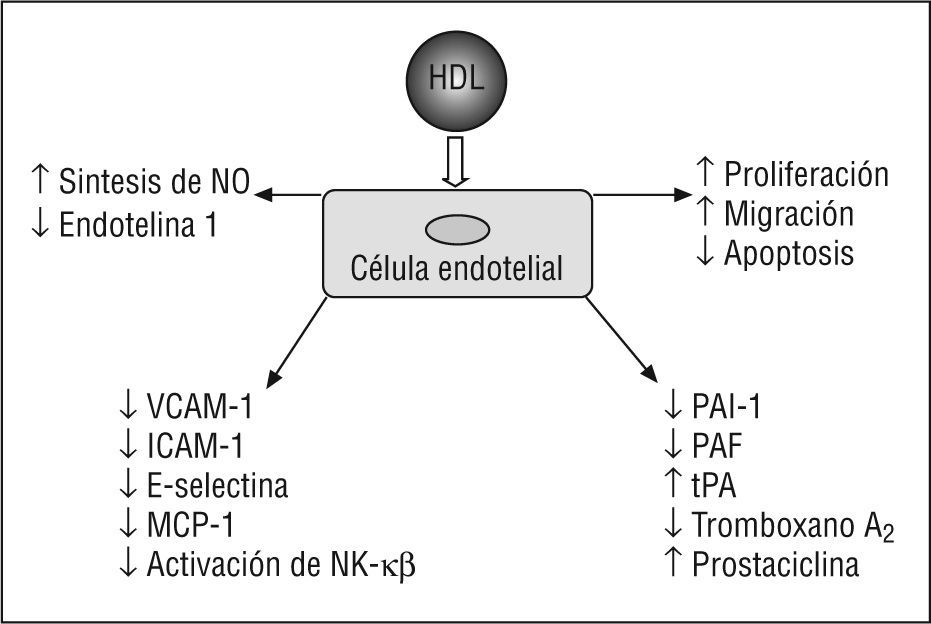
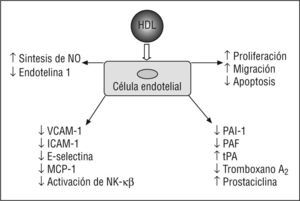
Entre las acciones endoteliales causantes de la ateroprotección de la HDL, deben considerarse su capacidad de modificar la expresión y la actividad de la sintasa de NO endotelial (eNOS), proteger a la célula endotelial de la apoptosis y promover su proliferación y migración.
Durante las primeras etapas de la enfermedad vascular aterosclerótica inducida por hipercolesterolemia, se produce una disminución considerable en la biodisponibilidad de NO derivado del endotelio, el cual es un potente vasodilatador con múltiples efectos adicionales en el endotelio.
La eNOS produce el NO durante la conversión de L-arginina a L-citrulina, y su deficiencia está estrechamente involucrada en la patogenia de la enfermedad vascular inducida por hipercolesterolemia. En el cultivo de células endoteliales, se ha observado que la eNOS se encuentra asociada principalmente a unos microdominios especializados de la membrana plasmática, enriquecidos en colesterol, llamados caveolas36. La LDL oxidada (LDLox) causa depleción del colesterol de las caveolas e induce un desplazamiento de la eNOS desde estos microdominios; proceso que puede desempeñar un papel fundamental en las primeras etapas de la enfermedad vascular inducida por hipercolesterolemia.
La HDL promueve la producción de NO con la regulación de la localización subcelular de la eNOS37. La adición de HDL a células endoteliales en cultivo que contienen LDLox previene el desplazamiento de la eNOS de las caveolas, lo que ayuda a restaurar la actividad de la enzima38. Además, la disminución del contenido de colesterol de las caveolas inducido por LDLox se previene por cotratamiento con HDL.
La habilidad de la HDL por mantener la concentración de colesterol asociado a la caveola no está relacionada con la inhibición de la remoción del colesterol de las caveolas por la LDLox, sino más bien a la provisión de ésteres de colesterol por la HDL. En este proceso, el receptor SR-B1, altamente expresado en las caveolas de las células endoteliales, media la capacidad de la HDL de revertir el impacto de la LDLox en la localización y la función de la eNOS39. Así, en presencia de LDLox, una de las acciones de la HDL es preservar el ambiente lipídico dentro de la caveola, y garantizar la localización subcelular normal y la función de la eNOS.
Además de la capacidad de preservar la localización de la eNOS cuando el ambiente lipídico dentro de las caveolas es perturbado, en cultivos de endotelio se ha demostrado que la HDL es un potente agonista de la eNOS.
La unión de la HDL al receptor SR-B1 induce una serie de señales de transducción a nivel de la membrana plasmática de la célula endotelial, las cuales estimulan la actividad de la eNOS40,41, por lo que la apoA-I de la HDL es necesaria, pero no suficiente, para esta activación.
Además de la regulación de la producción de NO por episodios de señalización que modulan la actividad enzimática de la eNOS, también se ha informado sobre cambios en la cantidad de enzima. En el cultivo de células endoteliales humanas, la expresión de la proteína eNOS aumenta 3 veces por exposición a HDL, aumento que no se asocia con una elevación de los valores de ácido ribonucleico (ARN) mensajero, sino más bien a un aumento en la vida media de la eNOS42.
También se ha investigado el impacto de HDL en la función endotelial en humanos, y se ha observado que los valores elevados de HDL mejoran la vasoconstricción en etapas tempranas de la aterosclerosis43, lo que lleva a plantear un mecanismo para los efectos beneficiosos de HDL que implica aumento de la vasorrelajación, como de la expresión de la eNOS endotelial44–46.
Diversas evidencias han demostrado que la apoptosis de la célula endotelial contribuye a la patogenia de la aterosclerosis. Múltiples factores proaterogénicos promueven la apoptosis en el endotelio, entre los que se incluyen la LDLox47, el factor de necrosis tumoral alfa (TNF-α)48 y la homocisteína49.
La LDLox promueve un aumento sustancial del calcio intracelular en las células endoteliales, lo cual conduce a muerte celular, efecto que la HDL revierte50.
Entre las acciones antiapoptóticas de la HDL, se consideran: a) impedir el aumento del calcio intracelular inducido por agentes proapoptóticos, como la LDLox; b) activar la caspasa 3, y c) antagonizar una variedad de otros mecanismos proapoptóticos51.
La apoptosis de la célula endotelial inducida por el TNF-α se inhibe también mediante la HDL, a través de un mecanismo asociado a una atenuada inducción de la caspasa 3, lo cual se ha descrito como un componente de toda vía apoptótica52.
Los procesos de proliferación y migración de la célula endotelial son cruciales para la neovascularización y el logro de una respuesta exitosa al daño vascular. Las alteraciones de la integridad del endotelio exponen la pared arterial a un alto riesgo de enfermedad vascular. La HDL estimula la migración y la proliferación de la célula endotelial de una manera dependiente del calcio, mediada por múltiples cascadas de cinasas53.
Aunque no se han dilucidado claramente ciertos aspectos de los episodios de señalización causados por la HDL, es probable que la HDL estimule la migración de la célula endotelial mediante la señalización desencadenada por SR-B1, y que estos mecanismos promuevan la integridad del endotelio in vivo54.
Acciones antitrombóticas de la lipoproteína de alta densidadLa HDL presenta múltiples acciones antitrombóticas, como la promoción del flujo sanguíneo y la disminución de la generación de trombina y de la activación endotelial y plaquetaria55–57. La HDL aumenta el flujo sanguíneo e incrementa la producción de NO y prostaciclina. La disminución de la activación endotelial por HDL ocurre a través de la inhibición de la apoptosis de la célula endotelial, la inhibición de la expresión del factor tisular, las moléculas de adhesión E-selectina y P-selectina, y el aumento en la producción de NO.
La disminución de la generación de trombina asociada a HDL es mediada por un aumento en la actividad de la proteína C activada, elemento crucial que regula la coagulación sanguínea mediante la inactivación proteolítica de los factores de la coagulación Va y VIIIa. El antagonismo de la activación plaquetaria mediado por HDL supone la inhibición de la síntesis del factor activador de plaquetas (PAF) y del tromboxano A2 y la activación de la síntesis de NO y prostaciclina.
La HDL aumenta la síntesis de prostaciclina. La prostaciclina actúa de modo sinérgico con el NO, con el objeto de inducir la relajación de la musculatura lisa vascular, inhibir la activación plaquetaria y disminuir la liberación de factores de crecimiento que estimulan la proliferación local de las células musculares lisas58. La prostaciclina se sintetiza a partir de araquidonato derivado de los fosfolípidos de la membrana celular y de los fosfolípidos y ésteres de colesterol de las lipoproteínas circulantes. La enzima limitante en la síntesis de prostaciclina es la ciclooxigenasa (Cox), de la que hay 2 isoformas (Cox-1 y Cox-2), las cuales promueven la síntesis de la prostaciclina en la célula endotelial59. Células endoteliales incubadas con HDL muestran un aumento en la producción de prostaciclina. El impacto de la HDL en la producción de prostaciclina en el endotelio ocurre mediante la provisión de araquidonato y de la up-regulation de la expresión de la Cox-260,61.
La generación de trombina mediante la cascada de coagulación sanguínea induce la activación de plaquetas y la liberación de factores de crecimiento derivado de plaquetas, y causa directamente la formación del coágulo de fibrina por escisión del fibrinógeno. Se ha informado acerca de una correlación positiva entre los valores plasmáticos de apoA-I, componente proteico principal de la HDL, y la respuesta anticoagulante a la proteína C activada62, y una correlación inversa entre HDL y marcadores de activación de trombina plasmática, resultados que indican que la HDL modificaría la generación de trombina63. Además, en estudios de perfusión de HDL en conejos sometidos a dietas ricas en colesterol, se observa que la HDL induce en la célula endotelial la expresión de la trombomodulina, la cual se describe como un factor anticoagulante adicional que suprime la generación de trombina64.
El endotelio libera el activador tisular del plasminógeno (tPA) y el inhibidor del activador del plaminógeno 1 (PAI-1), los cuales juntos controlan la actividad de la plasmina, una enzima que escinde la fibrina del trombo. En células endoteliales en cultivo, la LDL disminuye la generación de t-PA y aumenta la generación de PAI-1. La HDL revierte este efecto mediante la inhibición de la síntesis del PAI-1 y la inducción de la síntesis del t-PA65.
Se ha informado que la agregación plaquetaria se correlaciona inversamente con los valores de HDL66. La administración a humanos de HDL reconstituida, o la perfusión de apoA-I Milano en ratas, inhibe la activación plaquetaria in vivo67. Aunque la HDL puede reducir directamente la activación de las plaquetas, indirectamente puede actuar en la activación plaquetaria mediante efectos en las células endoteliales. Por ejemplo, la HDL puede regular la función plaquetaria con la inhibición de la liberación del PAF, o con la up-regulation de la síntesis y la liberación de NO de las células endoteliales65. La HDL también inhibe la síntesis del tromboxano A2 y éste se encarga de la up-regulation de la producción de prostaciclina67, la cual puede disminuir la agregación plaquetaria.
Propiedades antioxidantes de la lipoproteína de alta densidadLa aterosclerosis es un proceso inflamatorio crónico iniciado por una acumulación, y subsecuente oxidación, de LDL en la íntima arterial68.
La disfunción y la activación de las células endoteliales, como resultado de un intento de adaptación a estímulos anormales69, conduce a un incremento en la expresión de moléculas de adhesión (E y P-selectinas), que hace que los monocitos se deslicen rodando lentamente por la superficie del endotelio. Esto facilita la interacción de los monocitos con las moléculas de adhesión intracelular 1 (ICAM-1) y las moléculas de adhesión celular vascular 1 (VCAM-1) que median la adhesión firme70.
La LDLox estimula a las células endoteliales a expresar la proteína quimiotáctica a monocitos 1 (MPC-1), que atrae monocitos al espacio subendotelial.
Los monocitos que se han seleccionado se diferencian a macrófagos bajo la influencia del factor estimulante de colonias de macrófagos (M-CSF). La diferenciación del monocito a macrófago se caracteriza por el aumento en la expresión de receptores scavenger (SR-A, CD36, LOX-1), no sometidos a regulación por las concentraciones intracelulares de colesterol, y que median la captación de LDLox, y así contribuyen de forma importante a la acumulación de colesterol en macrófagos, a los que convierten en células de espuma71–73. Los macrófagos también expresan citocinas, alguna de las cuales estimula a las células endoteliales a expresar moléculas de adhesión, lo que lleva a la unión de más monocitos circulantes al endotelio, antes de su selección en la pared arterial por la MPC-169.
Las HDL protegen a la LDL de la peroxidación lipídica, y actúan como un reservorio de los peróxidos lipídicos generados en la LDL.
Se ha demostrado que la apoA-I es capaz de remover hidroperóxidos lipídicos de LDL, in vitro e in vivo, después de la perfusión en humanos68. También se ha informado que las células hepáticas remueven rápidamente los hidroperóxidos de éster de colesterol en HDL74, con lo que las HDL se convierten en las principales transportadoras de hidroperóxidos lipídicos en el plasma68,75.
Hay también considerables evidencias que la HDL puede degradar enzimáticamente los fosfolípidos y ésteres de colesterol oxidados presentes en la LDL76.
Las HDL transportan diversas enzimas que destruyen los hidroperóxidos de LDL77. Estas enzimas son la paraoxonasa 1 (PON-1)78,79, la paraoxonasa 3 (PON-3)80, y posiblemente la glutatión fosfolípido peroxidasa77. Las HDL transportan también enzimas, como el PAF acetil hidrolasa (PAF-AH) y la LCAT, que son capaces de remover fosfolípidos oxidados81. A excepción de la PAF-AH, las otras enzimas están asociadas exclusivamente a la HDL.
La actividad antioxidante de la HDL se atribuye, principalmente, a la PON-1. La PON-1 actúa hidrolizando los hidroperóxidos de fosfolípidos y ésteres de colesterol derivados del ácido ariquidónico y linoleico. Este efecto protector de la HDL contra la peroxidación lipídica es más mantenido en el tiempo que el efecto protector de los antioxidantes del tipo vitaminas.
El potencial de la PON-1 de proteger contra el desarrollo de la aterosclerosis se observó en estudios en animales, particularmente en ratones knockout a la PON-182,83. La HDL aislada de ratones knockout a la PON-1 fue incapaz de prevenir la oxidación de la LDL en un modelo de cultivo de células de pared arterial, y tanto HDL, como LDL aislada de los ratones knockout a PON-1, fueron más susceptibles a la oxidación por las células en cultivo.
La PON-1 muestra un polimorfismo de actividad. Las bases moleculares del principal polimorfismo radica en una sustitución de arginina por glutamina en la posición 192 de la enzima. La isoforma A que tiene glutamina en esta posición exhibe una actividad cerca de 8 veces menor que la isoforma B con un residuo de arginina en la posición 192.
Se ha demostrado que los polimorfismos genéticos de PON-1, capaz de proteger la LDL contra la peroxidación lipídica, están sobrerrepresentados en la enfermedad coronaria, particularmente asociada a diabetes mellitus. Sin embargo, estos polimorfismos explican sólo parte de la variación de la actividad de PON-1 en el suero84.
La PON-3, aislada recientemente del suero de conejos, mostró también disminuir la acumulación de peróxidos lipídicos en la LDL85.
Propiedades antiinflamatorias de la lipoproteína de alta densidadEn numerosos estudios se indica que las propiedades antiinflamatorias de la HDL contribuirían a los efectos cardioprotectores atribuidos a esta lipoproteína.
La aterosclerosis es una enfermedad crónica en la que la inflamación participa desde la lesión inicial hasta las complicaciones trombóticas finales, y que se manifiesta generalmente por una elevación en la concentración plasmática de varios marcadores inflamatorios86.
Las células endoteliales activadas expresan diversas moléculas de adhesión, como VCAM-1, ICAM-1 y E-selectina, en respuesta a la activación por citocinas proinflamatorias, mediante el factor de transcripción nuclear kappa beta (NF-κβ). Estas proteínas de adhesión se expresan en arterias y sitios de desarrollo de aterosclerosis, y sus formas solubles se encuentran presentes en el plasma de individuos con enfermedad coronaria87.
Una vez que los monocitos se adhieren al endotelio, migran al espacio subendotelial en un proceso estimulado por la MCP-1, sintetizada por células endoteliales, células musculares lisas y macrófagos de la pared arterial.
El hallazgo que las HDL humanas inhiben la expresión de moléculas de adhesión y de MCP-1ha adquirido gran importancia88. Estudios in vitro han mostrado que las HDL inhiben la transmigración de monocitos en respuesta a LDLox, efecto que parece estar relacionado con la PON-1 y el PAF-AH presentes en la HDL, y disminuyen los procesos inflamatorios agudos como consecuencia de la acumulación de la proteína del amiloide sérico-A (SAA) de HDL89. En otro estudio se observó que la HDL aislada de pacientes con enfermedad coronaria no inhibe la quimiotaxis de monocitos a la misma extensión que la HDL aislada de individuos controles sin enfermedad coronaria90.
En el cultivo de células endoteliales, se ha demostrado que las HDL inhiben la expresión inducida por citocinas de moléculas de adhesión VCAM-1, ICAM-1 y E-selectina, inhibición que se ha asociado a una reducción de los valores de ARN mensajero de estas proteínas91. Sin embargo, en otro estudio no se logró demostrar la habilidad de la HDL de inhibir la expresión de moléculas de adhesión por células endoteliales92.
Las HDL disminuirían la expresión de moléculas de adhesión en células endoteliales, e inhibirían la esfingosina cinasa, enzima que cataliza una etapa clave de la vía, por la cual el TNF-α induce la expresión de estas moléculas93.
La habilidad de la HDL de modificar la expresión de proteínas de adhesión se ha demostrado in vivo. En perfusiones de HDL que contenían apoA-I y fosfatidilcolina, administradas a ratones apoE −/− con enfermedad carotídea, se observó una reducción de un 40% en la expresión de VCAM-194. En otro estudio, en el que se usó un modelo in vivo de inflamación aguda, la perfusión única de HDL inhibe la expresión de E-selectina inducida por interleucina 695.
Un estudio reciente reveló que la HDL transporta una serie de proteínas que podrían conferirle nuevas actividades cardioprotectoras, como por ejemplo proteínas que participan en la activación del complemento, en la regulación de la proteólisis y en la respuesta de fase aguda96, lo que contribuye a sus propiedades antiinflamatorias y antiaterogénicas.
La proteína C reactiva (PCR) es una molécula cuya presencia en concentraciones elevadas en sangre siempre ha sido sinónimo de la existencia de una reacción de fase aguda, es decir, de un proceso inflamatorio.
Actualmente, se considera que la concentración plasmática de PCR ultra sensible (PCR-us) es un predictor de episodios cardiovasculares.
Se ha informado que la PCR aumenta la secreción de MCP-1, reduce la expresión y la biodisponibilidad de NO endotelial, e induce la expresión de las moléculas de adhesión VCAM-1, ICAM-1 y E-selectina en células vasculares incubadas in vitro97,98.
En un estudio reciente, se ha demostrado que las HDL inhiben la expresión de moléculas de adhesión inducida por PCR. El mecanismo por el cual las HDL inhiben los efectos proinflamatorios de la PCR parece que es diferente de la causa que inhibe los efectos inducidos por citocinas. Mientras que la oxidación de la HDL reduce la inhibición mediada por HDL de la expresión de proteínas de adhesión inducida por el TNF-α, ésta aumenta la habilidad de la HDL a inhibir la expresión de proteínas de adhesión inducida por la PCR, lo que indica que los fosfolípidos oxidados de HDL son más efectivos que los no oxidados en neutralizar los efectos de la PCR99 (fig. 1).
Acciones endoteliales de la lipoproteína de alta densidad (HDL). ICAM-1: moléculas de adhesión intracelular 1; MCP-1: proteína quimiotáctica a monocitos 1; NF-κβ factor de transcripción nuclear kappa beta; NO: óxido nítrico; PAF: factor activador de plaquetas; PAI-1: inhibidor del activador del plaminógeno 1; tPA: activador tisular del plasminógeno; VCAM-1: moléculas de adhesión celular vascular 1.
La correlación inversa entre valores séricos de cHDL y el riesgo de enfermedad coronaria, la protección de aterosclerosis en animales mediante manipulación genética del metabolismo de HDL y las evidencias de las propiedades potencialmente antiaterogénicas de la HDL han hecho del metabolismo de esta lipoproteína una diana atractiva para la intervención farmacológica de la aterosclerosis.
Además de promover el eflujo de colesterol a partir de macrófagos, las HDL ejercen numerosas otras acciones potencialmente antiaterogénicas, como acciones endoteliales, antioxidantes, antiinflamatorias y antitrombóticas. Actividades que especialmente ejercen las apolipoproteínas, las enzimas y los lípidos asociados a la HDL.
El principal inconveniente de los estudios, en relación con las acciones antiaterogénicas de las HDL, es que la gran mayoría de ellos se han realizado in vitro, por lo que hay una gran necesidad de llevar a cabo estudios in vivo para validar la relevancia de los diversos efectos de HDL en la prevención de la aterosclerosis, incluso ante las evidencias de algunos resultados contradictorios entre los estudios in vitro e in vivo. Estas discrepancias en los resultados podrían explicarse por la variación en el contenido de partículas de HDL con composición y propiedades completamente diferentes.
Actualmente se están utilizando diversas estrategias terapéuticas para aumentar los valores de HDL, entre las que se incluyen los fármacos como fibratos, estatinas y ácido nicotínico. Por otro lado, los inhibidores de CETP, los complejos de apoAI/fosfolípido y péptidos miméticos de apolipoproteínas de HDL se están considerando entre los futuros agentes terapéuticos para elevar los valores de HDL, promover el transporte reverso de colesterol y disminuir la aterosclerosis.
También, es de gran importancia determinar cuál será el impacto que tienen estos nuevos tratamientos, diseñados para incrementar los valores de HDL, en las propiedades endoteliales, antiinflamatorias y antitrombóticas de esta lipoproteína.