El objetivo del estudio es describir las características clínico-epidemiológicas de nuestros pacientes con lipoproteína(a) (Lp[a]) elevada.
Material y métodosEstudio descriptivo transversal de 316 usuarios con Lp(a) elevada (> 125 nmol/L) en una muestra aleatoria entre enero y agosto de 2022, midiendo variables epidemiológicas, antropométricas, clínicas y analíticas (parámetros del metabolismo lipídico, hidratos de carbono y hormonales).
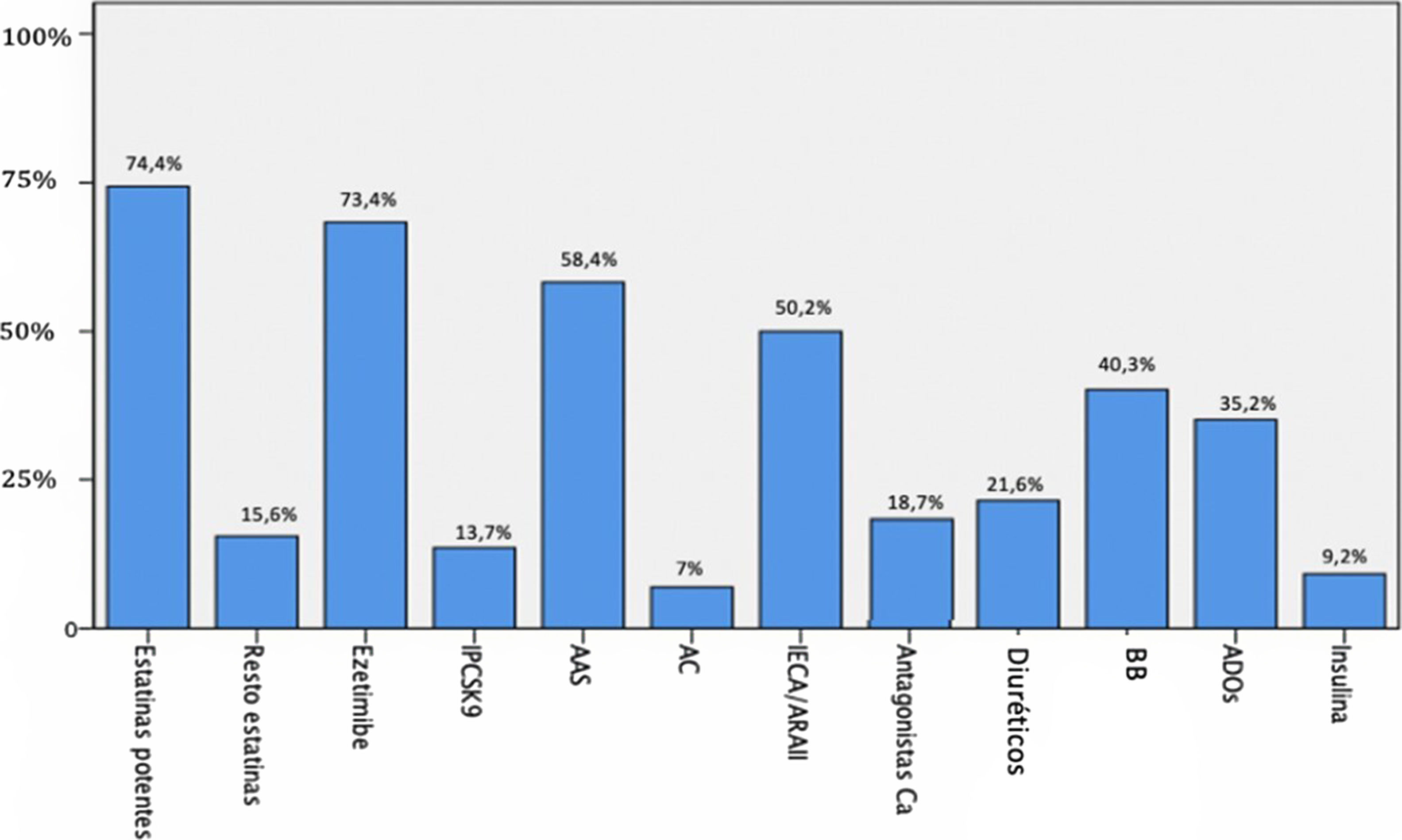
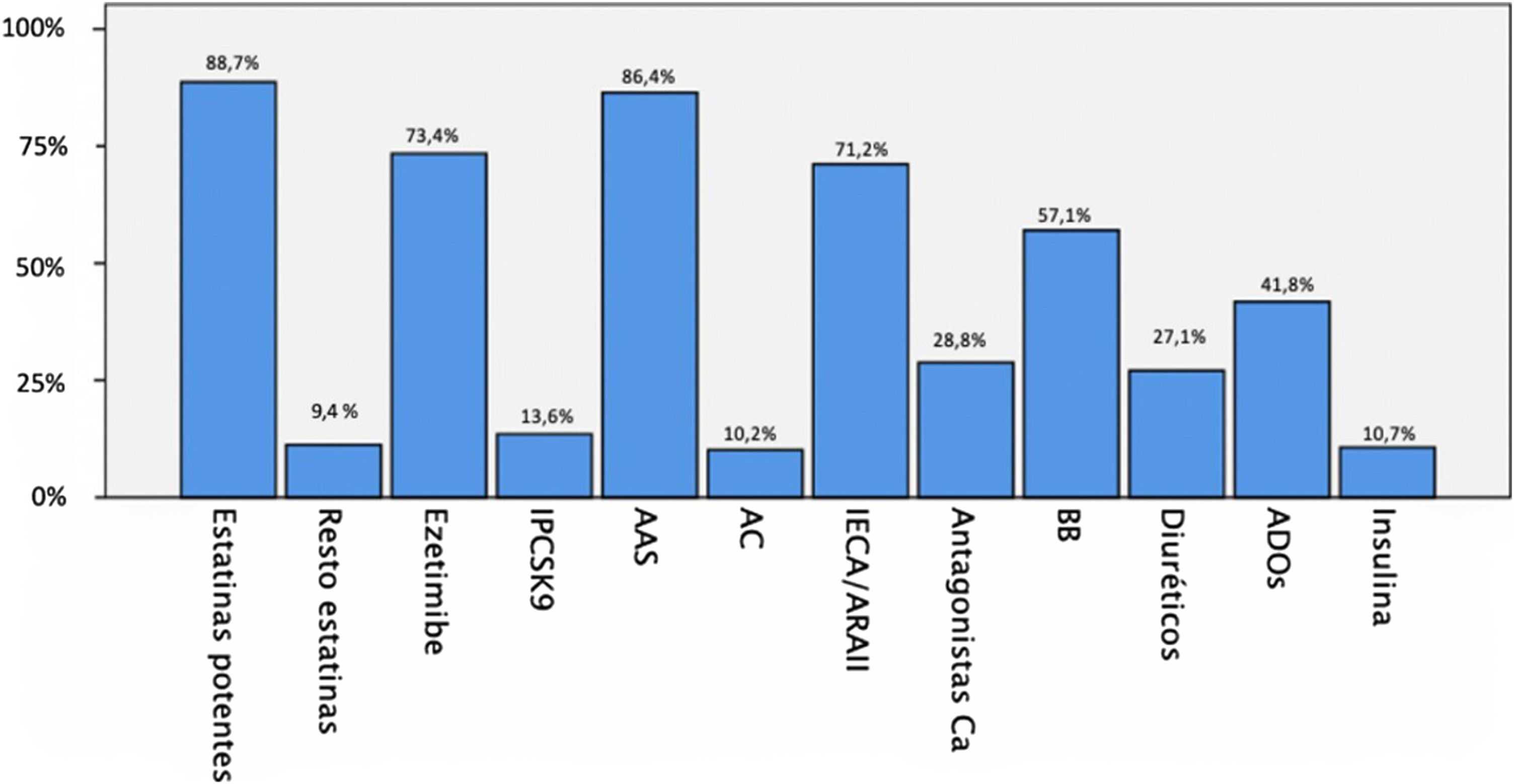
ResultadosLa edad media de los sujetos de la muestra fue de 59 ± 15 años con 56% varones. El índice de masa corporal (IMC) medio fue de 27,6 kg/m2 (71% de IMC elevado). Un perímetro abdominal aumentado en 54,1% de los hombres y 77,8% de mujeres. Un total de 48% con hipertensión arterial (HTA), 30,7% de diabetes mellitus (DM) y 91,5% con dislipemia. Solo 39,7% de los sujetos nunca habían fumado. Los valores medios de colesterol total fueron de 158 ± 45 mg/dL, lipoproteína de baja densidad (LDL) de 81 ± 39 mg/dL, lipoproteína de alta densidad (HDL) de 53 ± 17 mg/dL, triglicéridos (TG) de 127 ± 61 mg/dL y Lp(a) de 260 ± 129 nmol/L. Con respecto al tratamiento hipolipemiante, 89% estaban con estatinas, 68,6% con ezetimiba y 13,7% con los inhibidores de proproteína convertasa subtilisin/kexin tipo 9 (iPCSK9). Un total de177 pacientes (57,7%) padecían enfermedad cardiovascular (ECV) establecida, de ellos 16,3% enfermedad polivascular. Además, había 11,7% usuarios con ECV subclínica y 30,6% sin ECV conocida. Aquellos con ECV establecida, 174 (98,3%), estaban con terapia hipolipemiante (97,2% con estatinas) y 86,4% antiagregados. La edad media de evento cardiovascular fue 55 ± 12 años en varones y 60 ± 11 en mujeres. Presentando 65,1% de ellas y 56,2% de los hombres un evento cardiovascular precoz.
ConclusionesLas personas con Lp(a) elevada son pacientes de muy alto riesgo cardiovascular (RCV) y en especial de ECV precoz.
The objective of the study is to describe the clinical and epidemiological characteristics of our patients with elevated Lp(a).
Materials and methodsA descriptive cross-sectional study was conducted on 316 patients with elevated Lp(a) (>125 nmol/L) in a random sample between January and August 2022. We measured epidemiological, anthropometric, clinical and laboratory variables (lipid metabolism parameters, carbohydrates and hormones).
ResultsMean age of our sample subject's was 59 ± 15 years with 56% males. The average BMI was 27.6 kg/m2 (71% with elevated BMI). Elevated waist circumference was observed in 54.1% of men and 77.8% of women. 48% had hypertension, 30.7% had diabetes mellitus and 91.5% dyslipidemia. Only 39.7% of the patients had never smoked.
The mean values of total cholesterol were 158 ± 45 mg/dl, LDL was 81 ± 39 mg/dl, HDL was 53 ± 17 mg/dl, Triglycerides were 127 ± 61 mg/dl, and Lp(a) was 260 ± 129 nmol/L.
Regarding lipid lowering treatment, 89% were on statins, 68.6% on ezetimibe, and 13.7% on PCSK9 inhibitors. 177 patients (57,7%) had established cardiovascular disease (CVD), 16.3% had polyvascular disease, 11.7% had subclinical CVD, and 30.6% had no known CVD. Among patients with established CVD, 174 (98.3%) were on lipid-lowering treatment (97.2% on statins) and 86.4% were on antiplatelet therapy. The mean age of cardiovascular events was 55 ± 12 years in males and 60 ± 11 years in females. 65,1% of female and 56,2% of male patients suffered an early cardiovascular event.
ConclusionsPatients with elevated Lp(a) are at very high cardiovascular risk, particularly for early cardiovascular disease.
La enfermedad cardiovascular (ECV) es una de las principales causas de mortalidad mundial (17,9 millones de personas anualmente)1. En los últimos años se ha generado un especial interés por el papel que desempeña la lipoproteína(a) (Lp[a]) en la formación de la placa de ateroma que es clave en la ECV.
Aproximadamente un tercio de la población presenta niveles de Lp(a) elevados lo que aumenta hasta 20% el riesgo de morbimortalidad cardiovascular2.
En prevención primaria, valores por encima del percentil 75 se han relacionado con un mayor riesgo de desarrollar estenosis aórtica (EA)3 e infarto de miocardio (IAM)4, mientras que arriba del percentil 90 aumenta el riesgo de insuficiencia cardiaca2,5. Además, niveles por encima del 95 incrementan el riesgo de mortalidad cardiovascular e ictus isquémico2,6.
En prevención secundaria, se asocia a mayor incidencia de eventos cardiovasculares, encontrándose una relación lineal entre niveles de Lp(a) y la ECV, tras ajustar por rangos de lipoproteína de baja densidad (LDL) y tratamiento hipolipemiante7.
Actualmente, no existe ninguna terapia aprobada que reduzca los niveles de Lp(a) de manera relevante, por lo que en estos pacientes debe mantenerse un control estricto del resto de factores de riesgo cardiovascular (FRCV).
Los inhibidores de proproteína convertasa subtilisin/kexin tipo 9 (iPCSK9) han mostrado reducir los niveles de Lp(a) de forma significativa, alrededor de 25-30%8, aunque se desconoce si este decrecimiento de la Lp(a) contribuye a disminuir eventos isquémicos.
Existen también terapias con moléculas denominadas pequeños ARN interferentes que aminorarían la producción hepática de apolipoproteína A (apo A)9. Algunos estudios con estas moléculas son muy prometedores, con reducciones de hasta 80%, que consiguen mantener a prácticamente la totalidad de los sujetos con cifras normales de Lp(a)10.
Los pacientes con niveles elevados de Lp(a) corresponden a un subgrupo de la población de especial riesgo cardiovascular (RCV) y por ello las guías actuales recomiendan medir la Lp(a) al menos una vez en la vida para estratificar adecuadamente el RCV individual2.
El objetivo del estudio es describir nuestra población de pacientes con Lp(a) elevada, con el análisis de parámetros antropométricos, clínicos, analíticos y la relación de estos con los eventos cardiovasculares.
Material y métodosDiseño y sujetos del estudioSe ha diseñado un estudio observacional transversal retrospectivo, seleccionando a los pacientes con Lp(a) elevada (> 125 nmol/L)2 en un análisis solicitado por cualquier motivo entre el primero de enero de 2022 y el 31 de agosto de 2022. Estos usuarios fueron proporcionados por el servicio de Análisis Clínicos del Hospital Universitario 12 de Octubre, independientemente del servicio peticionario.
Se excluyeron aquellos que en el momento de la recogida de datos no tuvieran historia clínica electrónica o estuviera protegida, con lo que se quedó finalmente con una muestra formada por 316 pacientes.
El estudio contó con la aprobación del Instituto de Investigación Hospital 12 de Octubre (anexo 1) y los investigadores se comprometieron a manejar la información de los pacientes de acuerdo con la Ley Orgánica 7/2021 de protección de datos del 26 de mayo de 2021.
Medidas y variablesSe recogieron datos epidemiológicos y antropométricos como edad (años), sexo, altura (m), peso (kg), índice de masa corporal (IMC) (kg/m2) y perímetro abdominal (cm). Las categorías de IMC se establecieron atendiendo a los puntos de corte estandarizados11. Se consideró perímetro abdominal elevado mayor de 102 cm en hombres y mayor de 88 cm en mujeres12.
Además, se analizaron las siguientes comorbilidades: hábito tabáquico y alcohólico, antecedentes familiares (AF) de ECV, ECV establecida clínicamente (ictus, IAM, revascularización cardiaca o arteriopatía periférica), ECV subclínica establecida por técnica de imagen, la edad del primer evento cardiovascular, considerándose como precoz en mujeres menores de 65 años y en hombres de menos de 5513, hipertensión arterial (HTA), diabetes mellitus (DM) y dislipemia, definidas como antecedente médico o toma de medicación para las mismas, enfermedad polivascular (afectación clínica de dos o más territorios vasculares), esteatosis hepática (diagnosticada mediante técnicas de imagen), enfermedades autoinmunes sistémicas (EAS) y EA (clasificada en leve, moderada y grave según criterios ecocardiográficos).
También, se valoró el tratamiento habitual de los pacientes: estatinas de alta potencia (rosuvastatina 10/20/40 mg o atorvastatina 40/80 mg), otras estatinas (el resto que no cumplían el criterio anterior), ezetimiba, iPCSK9, antiagregantes (AAS), anticoagulantes (AC), inhibidores de la enzima convertidora de angiotensina o antagonistas de los receptores de la angiotensina-2 (IECA/ARAII), antagonistas del calcio (Ca), diuréticos, betabloqueadores (BB), antidiabéticos orales (ADO) e insulina.
Con respecto a los parámetros analíticos, se incluyeron valores de hemograma, factores del metabolismo lipídico como el colesterol total, lipoproteína de alta densidad (HDL), LDL, triglicéridos (TG), apo A, apo B-100, colesterol no HDL y el cociente de HDL/TG.
La Lp(a) se analizó mediante prueba inmunoturbidimétrica potenciada por partículas en el autoanalizador (número de material: 05641489001) cobas c701 (8000 cobas c701 module) de Roche Diagnostics.
En relación con el metabolismo de hidratos de carbono se incluyeron la glucemia basal (mg/dL), la hemoglobina glucosilada (%), el índice de resistencia a la insulina (HOMA), péptido C e insulina.
Análisis estadísticoLos resultados del análisis descriptivo de la muestra se presentaron en frecuencias relativas (porcentajes) para variables cualitativas y en medidas de centralidad y dispersión (media ± desviación estándar [DE]) para las cuantitativas.
Para las comparaciones de variables cualitativas se utilizó la prueba de X2 y se aplicó la corrección de Bonferroni en las comparaciones intergrupales. Para las cuantitativas, tras comprobar normalidad se emplearon los estudios no paramétricos U de Mann-Whitney y de Kruskal-Wallis con corrección de Bonferroni para comparaciones intergrupales. La prueba de normalidad usada fue Kolmogorov-Smirnov. Como coeficiente de correlación se aplicó el de Pearson.
Se estableció un nivel de significación estadística α de 0,05 para todas las comparaciones. Para el análisis se usó el programa estadístico Statistical Package for the Social Sciences (SPSS 27.0.0, IBM Corp., Armonk, NY, EE. UU.).
ResultadosEl total de la muestra estudiada fue de 316 pacientes con una edad media de 59,5 ± 14,8 años siendo 56,6% de ellos varones. Los valores antropométricos se recopilaron en 223 usuarios, objetivándose un IMC medio de 27,6 ± 5 kg/m2, con 26% de obesidad, 45% de sobrepeso, 27% en normopeso y 2% con bajo peso.
El perímetro abdominal estaba medido en 153 sujetos, con una media de 95 ± 12 cm en mujeres (70% lo tenían aumentado) y de 102 ± 13 cm en varones (49% con valores elevados). Con respecto a sus hábitos de salud, 87% nunca habían tenido un consumo de alcohol relevante y 39,7% no había fumado.
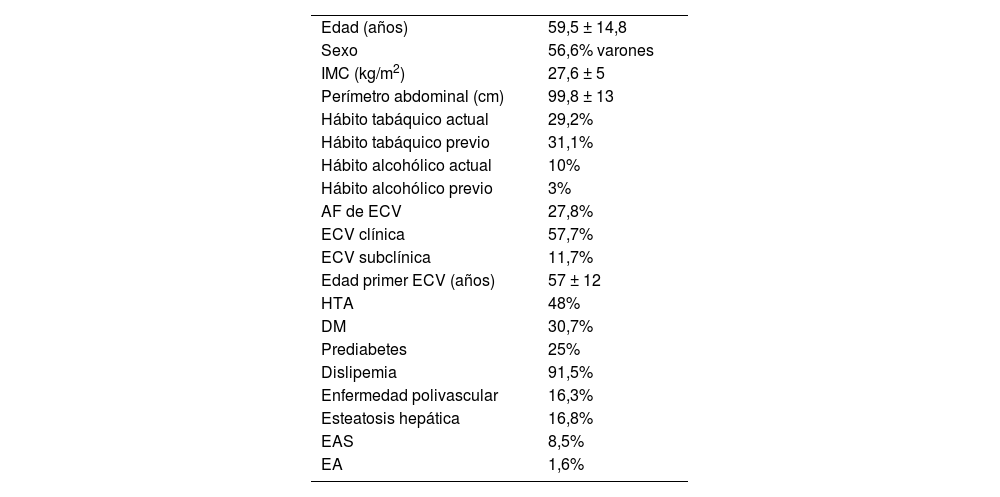
Los datos clínico-epidemiológicos se encuentran resumidos en la tabla 1. En cuanto a la ECV, se excluyeron a los menores de 18 años (nueve sujetos). Un total de 30,6% no tenía ECV previa. De estos, 57,7% (177 pacientes) tenían ECV establecida, de los cuales 16,3% de los casos era enfermedad polivascular y 11,7% ECV subclínica. La edad media de presentación de ECV global fue de 57 ± 12 años, siendo en mujeres de 60 ± 11 y en varones de 56 ± 11, con 39 (65,1%) de estas y 66 (56,2%) de los hombres con ECV precoz.
Parámetros clínicos y epidemiológicos del total de la muestra
| Edad (años) | 59,5 ± 14,8 |
| Sexo | 56,6% varones |
| IMC (kg/m2) | 27,6 ± 5 |
| Perímetro abdominal (cm) | 99,8 ± 13 |
| Hábito tabáquico actual | 29,2% |
| Hábito tabáquico previo | 31,1% |
| Hábito alcohólico actual | 10% |
| Hábito alcohólico previo | 3% |
| AF de ECV | 27,8% |
| ECV clínica | 57,7% |
| ECV subclínica | 11,7% |
| Edad primer ECV (años) | 57 ± 12 |
| HTA | 48% |
| DM | 30,7% |
| Prediabetes | 25% |
| Dislipemia | 91,5% |
| Enfermedad polivascular | 16,3% |
| Esteatosis hepática | 16,8% |
| EAS | 8,5% |
| EA | 1,6% |
AF: antecedentes familiares; DE: desviación estándar; DM: diabetes mellitus; EA: estenosis aórtica; EAS: enfermedad autoinmune sistémica; ECV: enfermedad cardiovascular; HTA: hipertensión arterial; IMC: índice de masa corporal.
Valores expresados en porcentajes y media ± DE
De los 316 participantes de la muestra, tres habían fallecido en el momento del estudio con 48, 64 y 66 años, dos de ellos de causa cardiovascular.
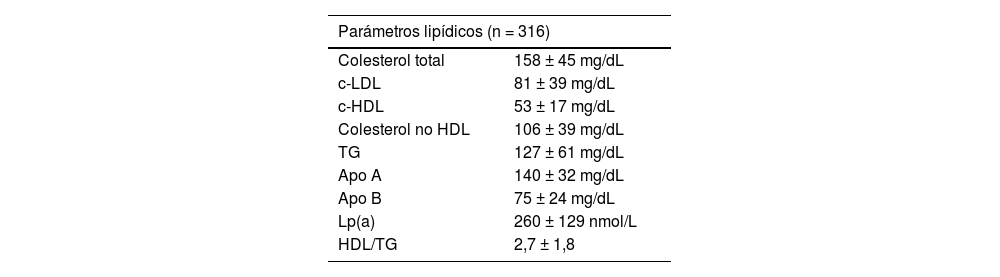
Los parámetros analíticos de metabolismo de lípidos y de hidratos de carbono y resistencia a la insulina se muestran en la tabla 2, y en la figura 1 queda reflejado el tratamiento previo de los pacientes en el momento del análisis.
Parámetros analíticos de la muestra total
| Parámetros lipídicos (n = 316) | |
|---|---|
| Colesterol total | 158 ± 45 mg/dL |
| c-LDL | 81 ± 39 mg/dL |
| c-HDL | 53 ± 17 mg/dL |
| Colesterol no HDL | 106 ± 39 mg/dL |
| TG | 127 ± 61 mg/dL |
| Apo A | 140 ± 32 mg/dL |
| Apo B | 75 ± 24 mg/dL |
| Lp(a) | 260 ± 129 nmol/L |
| HDL/TG | 2,7 ± 1,8 |
| Parámetros de hidratos de carbono y hormonales | |
|---|---|
| Hemoglobina glucosilada (n = 276) | 6,1 ± 1% |
| Glucosa (n = 312) | 107 ± 30 mg/dL |
| Creatinina (n = 312) | 0,91 ± 0,29 mg/dL |
| Insulina (n = 109) | 13,9 ± 10,4 mg/dL |
| Péptido C (n = 83) | 3,3 ± 2 mg/dL |
| HOMA (n = 100) | 3,8 ± 3,9 |
| Ácido úrico (n = 181) | 5,1± 1,9 mg/dL |
Apo A: apolipoproteína A; apo B: apolipoproteína B; c-HDL: colesterol de las lipoproteínas de alta densidad; c-LDL: colesterol de las lipoproteínas de baja densidad; HDL: lipoproteína de alta densidad; HDL/TG: cociente entre lipoproteína de alta densidad y triglicéridos; HOMA: índice de resistencia a la insulina; Lp(a): lipoproteína(a); TG: triglicéridos.
Valores expresados en media ± DE.
Tratamiento de los sujetos en el momento del análisis.
AAS: antiagregantes; AC: anticoagulantes; ADO: antidiabético oral; BB: betabloqueadores; Ca: calcio; IECA/ARAII: inhibidores de la enzima convertidora angiotensina o antagonistas de los receptores de la angiotensina 2; iPCSK9: inhibidores de proproteína convertasa subtilisin/kexin tipo 9.
Se incluyeron 177 personas con ECV clínica, con una media de edad de 63, 9 ± 11 años y una en el inicio de ECV de 56,4 ± 11, siendo 67,2% varones. De los sujetos, 62,7% tenían HTA, 39% DM y 33,9% prediabetes.
Un total de 98,3% usuarios tomaba tratamiento hipolipemiante, (88,7% de estos con estatinas de alta potencia). En la figura 2 se muestra el tratamiento previo de los pacientes con ECV establecida.
Tratamiento de los pacientes que habían sufrido una ECV.
AAS: antiagregantes; AC: anticoagulantes; ADO: antidiabético oral; BB: betabloqueadores; Ca: calcio; ECV: enfermedad cardiovascular; IECA/ARAII: inhibidores de la enzima convertidora angiotensina o antagonistas de los receptores de la angiotensina 2; iPCSK9: inhibidores de proproteína convertasa subtilisin/kexin tipo 9.
De los 177 con ECV clínica, 144 (81,4%) habían tenido cardiopatía isquémica, 45 (25,4%) tenía enfermedad arterial periférica sintomática y 11 (6,2%) afectación cerebrovascular. El total de eventos fue de 190 sufridos por 177 pacientes.
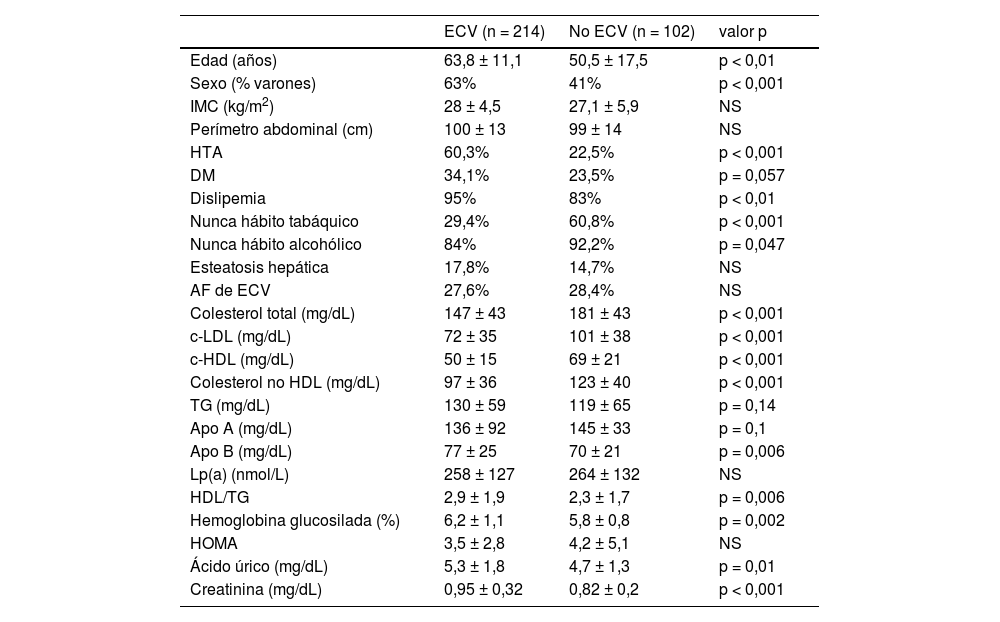
En el análisis comparativo se ha incluido a los sujetos con ECV clínica y subclínica (177 y 37, respectivamente) comparándose sus características clínico-epidemiológicas con las de aquellos sin ECV establecida, con los datos resumidos en la tabla 3.
Comparación de las variables estudiadas entre pacientes con ECV clínica o subclínica vs. los que no tenían ECV
| ECV (n = 214) | No ECV (n = 102) | valor p | |
|---|---|---|---|
| Edad (años) | 63,8 ± 11,1 | 50,5 ± 17,5 | p < 0,01 |
| Sexo (% varones) | 63% | 41% | p < 0,001 |
| IMC (kg/m2) | 28 ± 4,5 | 27,1 ± 5,9 | NS |
| Perímetro abdominal (cm) | 100 ± 13 | 99 ± 14 | NS |
| HTA | 60,3% | 22,5% | p < 0,001 |
| DM | 34,1% | 23,5% | p = 0,057 |
| Dislipemia | 95% | 83% | p < 0,01 |
| Nunca hábito tabáquico | 29,4% | 60,8% | p < 0,001 |
| Nunca hábito alcohólico | 84% | 92,2% | p = 0,047 |
| Esteatosis hepática | 17,8% | 14,7% | NS |
| AF de ECV | 27,6% | 28,4% | NS |
| Colesterol total (mg/dL) | 147 ± 43 | 181 ± 43 | p < 0,001 |
| c-LDL (mg/dL) | 72 ± 35 | 101 ± 38 | p < 0,001 |
| c-HDL (mg/dL) | 50 ± 15 | 69 ± 21 | p < 0,001 |
| Colesterol no HDL (mg/dL) | 97 ± 36 | 123 ± 40 | p < 0,001 |
| TG (mg/dL) | 130 ± 59 | 119 ± 65 | p = 0,14 |
| Apo A (mg/dL) | 136 ± 92 | 145 ± 33 | p = 0,1 |
| Apo B (mg/dL) | 77 ± 25 | 70 ± 21 | p = 0,006 |
| Lp(a) (nmol/L) | 258 ± 127 | 264 ± 132 | NS |
| HDL/TG | 2,9 ± 1,9 | 2,3 ± 1,7 | p = 0,006 |
| Hemoglobina glucosilada (%) | 6,2 ± 1,1 | 5,8 ± 0,8 | p = 0,002 |
| HOMA | 3,5 ± 2,8 | 4,2 ± 5,1 | NS |
| Ácido úrico (mg/dL) | 5,3 ± 1,8 | 4,7 ± 1,3 | p = 0,01 |
| Creatinina (mg/dL) | 0,95 ± 0,32 | 0,82 ± 0,2 | p < 0,001 |
Apo A: apolipoproteína A; apo B: apolipoproteína B; AF: antecedentes familiares; c-HDL: colesterol de las lipoproteínas de alta densidad; c-LDL: colesterol de las lipoproteínas de baja densidad; DM: diabetes mellitus; ECV: enfermedad cardiovascular; HDL: lipoproteína de alta densidad; HDL/TG: cociente entre lipoproteína de alta densidad y triglicéridos; HOMA: índice de resistencia a la insulina; HTA: hipertensión arterial; Lp(a): lipoproteína(a); IMC: índice de masa corporal; NS: no significación estadística; TG: triglicéridos.
Valores expresados como media ± DE y porcentajes.
Hemos descrito de una forma exhaustiva a nuestros pacientes con Lp(a) elevada para poder conocer sus características clínicas, control de FRCV, e identificar diferentes fenotipos y perfiles de usuarios.
En nuestra población los sujetos tenían una edad media en torno a 60 años, destacando la presencia de FRCV previos (casi 50% de HTA, 56% alteraciones del metabolismo de hidratos de carbono y 92 de dislipemia), hábito tabáquico importante y características antropométricas típicas del síndrome metabólico (fundamentalmente sobrepeso y aumentado perímetro abdominal). La prevalencia de ECV clínica o subclínica es de 68%, mucho más que en la población general14,15, y destaca el elevado porcentaje de ECV de aparición precoz. Nuestra población es muy similar a la del estudio SANTORINI, aunque algo más joven y con menor porcentaje de ECV que la de este trabajo observacional prospectivo en el que se describe el uso de terapias hipolipemiantes en pacientes ≥18 años con alto RCV entre 2020 y 2021 en atención primaria y secundaria en 14 países europeos16. A la hora de analizar nuestros resultados debemos tener en cuenta que se trata de una población seleccionada (analíticas pedidas en ámbito hospitalario), lo que dificulta la posibilidad de extrapolar estos hallazgos al ámbito general. Se debería favorecer que desde atención primaria se pudiese solicitar este parámetro en el perfil lipídico, para de esta manera poder estratificar mejor el RCV de los pacientes.
Llama la atención la alta prevalencia de cardiopatía isquémica con respecto a la incidencia de afectación cerebrovascular en nuestra muestra, algo que podría estar en consonancia con la aparente menor relación de la Lp(a) con los eventos cerebrovasculares en relación con la afectación en otros territorios2,17. Sin embargo, en nuestro modelo parece claro un sesgo de selección ya que los cardiólogos piden mucho más el análisis de la Lp(a) que los neurólogos y los cirujanos vasculares nos derivan a casi todos sus pacientes y somos nosotros desde nuestra unidad de RCV los que la pedimos habitualmente.
De nuestra investigación cabe mencionar, por su potencial importancia, la edad de aparición de ECV comparada con otros estudios como el de Jortveit et al.18, donde exponen una incidencia de IAM de 4,4% en menores de 45 años y de 27% en menores de 60, siendo la de ECV clínica de 15,8 y 47,3% en nuestra muestra para esos grupos etarios con unas características basales muy similares a las nuestras, pero desconociendo los valores de Lp(a) en el estudio mencionado.
Por ello, se debería plantear la medición precoz de Lp(a) en estimaciones globales de salud, ya que sus valores están determinados genéticamente19 y, por tanto, se encuentran elevados desde la juventud20. Esto supone un incremento notable del RCV muchas veces no conocido, pero que influye en la precocidad de los ECV.
Sujetos con enfermedad cardiovascular vs. sujetos sin enfermedad cardiovascularComo se muestra en la tabla 3 existe más prevalencia de FRCV en los pacientes con ECV. Destaca una mayor proporción de varones, predominio de HTA, dislipemia y alteración de parámetros del metabolismo de hidratos de carbono (mayor tasa de DM 34,1 vs. 23,5%, p = 0,057), aunque sin llegar a la significación estadística en probable relación con el tamaño muestral en algunos de ellos.
No se encontraron diferencias en los niveles de Lp(a) entre grupos, siendo elevada en ambos por el diseño del estudio, aunque en la estratificación de riesgo asociado a Lp(a) se prefiere hablar en términos de umbrales más que en una asociación lineal21. Cabe destacar que los pacientes sin ECV eran más jóvenes (14 años menos de media) y dado que la ECV se asocia fuertemente a la edad, niveles de colesterol de las LDL (c-LDL) y otros FRCV alterados en el tiempo y no en un momento puntual, es posible que estos desarrollen un ECV en un futuro con mayor probabilidad que aquellos con cifras normales de Lp(a). Este supuesto apoya la teoría de que sería recomendable disponer de valores de Lp(a) de forma precoz para así poder estratificar el RCV de nuestros usuarios y realizar intervenciones tempranas si fuese necesario.
Los parámetros del perfil lipídico controlables con mediación (colesterol total, LDL y no HDL) eran menores en los sujetos con ECV, sin embargo, otros factores aterogénicos como HDL, TG y cociente HDL/TG eran peores en estos sujetos, lo que traduce que el tratamiento de ellos estaba mejor ajustado a su RCV, en la medida de lo posible, manteniendo el riesgo residual no tratable. Si comparamos además con los datos del estudio SANTORINI14, nuestros sujetos estaban tratados de forma más conveniente ya que solo 8,5% no tenían terapia hipolipemiante (21,8% en el SANTORINI). Además, en aquellos con ECV previa la diferencia se incrementa siendo de 21,2% sin método hipolipemiante en el SANTORINI vs. 1,7% de nuestros pacientes. Probablemente, el conocer el valor de Lp(a) ha jugado también su papel en un tratamiento más ajustado a nivel cardiovascular. Además, en cuanto a los objetivos del perfil lipídico en usuarios con ECV establecida11, en nuestra muestra 35,3% se encontraban con LDL < 55 mg/dL vs. 20,7% de los sujetos del estudio SANTORINI, destacando que varios de nuestros participantes fueron recogidos en el momento del evento cardiovascular, por lo tanto, es necesario más tiempo de seguimiento para apreciar el efecto de la terapia hipolipemiante instaurada en ese momento.
A pesar de ser un trabajo observacional retrospectivo, la principal fortaleza de nuestro estudio es su elevado tamaño muestral. Por el contrario, su principal limitación puede ser un sesgo de selección al tratarse de pacientes con RCV previo ya elevado. Si bien, podría plantearse la realización de un seguimiento prospectivo a los sujetos sin ECV para valorar si la edad de aparición de ECV en estos es menor que en los que tienen cifras normales de Lp(a) y alto RCV previo.
ConclusionesNuestros pacientes con Lp(a) son un grupo de muy alto RCV, pudiendo constituir un subgrupo de riesgo de ECV precoz. La medición de Lp(a) en nuestro medio se realiza únicamente en el ámbito de la atención especializada y, generalmente, en el contexto de prevención secundaria, pero sería razonable plantear la identificación de este factor de riesgo de forma precoz (antes de la aparición de ECV) incorporándolo a la práctica clínica habitual, para de esta manera poder llevar a cabo intervenciones en prevención primaria y mejorar el control de otros FRCV.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.