La disfunción endotelial es un importante mediador de la mayor morbimortalidad cardiovascular de los pacientes diabéticos. Las células progenitoras endoteliales (EPC) parecen poseer defectos funcionales en estos pacientes. La pioglitazona aumenta el número y función de las EPC y disminuye la mortalidad cardiovascular en la población diabética.
ObjetivosDeterminar la capacidad de adhesión de EPC cultivadas sobre arterias de pacientes diabéticos y no diabéticos, así como evaluar los efectos de la glucosa y la pioglitazona sobre estos parámetros.
Material y métodosLas EPC se aislaron de células mononucleares a partir de la capa leucoplaquetaria de sangre de donantes y se cultivaron sobre fibronectina en medio microvascular. La adhesión se midió marcando las células con 111In-oxina y pasándolas ex vivo sobre una cámara de flujo con arterias mamarias internas remanentes de cirugía cardiaca. La expresión de la proteína CXCR-4 se determinó por citometría de flujo.
ResultadosSe observó una mayor adhesión de las EPC sobre las arterias de pacientes diabéticos. Esta adhesión disminuyó al incubar las células con glucosa a 15mM. La co-incubación con pioglitazona 1μM restauró la capacidad adhesiva de las EPC. La glucosa a 15mM disminuyó la expresión de CXCR-4 en las EPC cultivadas, en cambio, la pioglitazona a 1μM fue capaz de aumentarla.
ConclusiónPese a que las arterias de pacientes diabéticos tienen una mayor capacidad de reclutar EPC, la hiperglucemia disminuye las propiedades adhesivas de estas células.
Endothelial dysfunction underlies the increased cardiovascular disease burden in diabetic patients. Endothelial progenitor cell (EPC) function seems to be defective in these patients. Pioglitazone has been shown to improve the number and function of EPCs and to decrease cardiovascular mortality in the diabetic population.
ObjectiveTo determine the adhesive capacity of cultured EPCs on arteries from diabetic and non-diabetic patients and evaluate the effects of high glucose and pioglitazone on this parameter.
Material and methodsEPCs were isolated from mononuclear cells from buffy coats, obtained from healthy blood donors. The cells were plated on fibronectin and were cultured in a microvascular medium. EPCs were labelled with 111In-oxine and adhesion was assessed using a flow chamber in which internal mammary arteries obtained from cardiac surgery were set. CXCR-4 expression was measured by flow cytometry.
ResultsEPC adhesion was higher on internal mammary arteries obtained from diabetic patients. Adhesion was decreased after incubation of the EPCs with glucose at 15mM and was restored by co-incubation with pioglitazone 1μM. Glucose at 15mM decreased CXCR-4 expression and pioglitazone 1μM was able to restore it.
ConclusionsAlthough arteries from diabetic patients possess a higher capacity to adhere EPCs, hyperglycemia decreases the adhesive properties of these cells. This deficiency could be corrected by drugs such as pioglitazone, which are able to modulate CXCR-4 expression and EPC adhesiveness.
El infarto de miocardio es la primera causa de muerte en pacientes diabéticos, que tienen un riesgo cardiovascular considerablemente elevado1,2. Uno de los factores causantes de una mayor morbimortalidad cardiovascular en la diabetes es la disfunción endotelial, que se traduce en un deterioro de la función vascular y en una mayor progresión de la aterosclerosis3.
En los últimos años se viene reconociendo la existencia y la importancia fisiológica de las células progenitoras endoteliales (EPC) en el mantenimiento de una adecuada función endotelial. Las EPC se originan de la médula ósea y se dirigen a los lugares de isquemia a través de la sangre periférica, donde se diferencian hacia las propias células endoteliales de los vasos, o bien colaboran con las células endoteliales residentes en el proceso de la angiogénesis. La evidencia científica reconoce la importancia de las EPC en la reparación vascular, y su disfunción en las enfermedades cardiovasculares4–7. El número de EPC en la sangre de pacientes diabéticos es menor que en los pacientes no diabéticos. Más aún, en los pacientes diabéticos parece existir una disfunción fisiológica cualitativa en el funcionamiento de las EPC5. De este modo, se considera que un correcto funcionamiento de las EPC es esencial para la conservación de una adecuada función vascular, y su alteración numérica y funcional podría mediar, al menos en parte, las alteraciones del endotelio de los vasos diabéticos.
La pioglitazona es un fármaco utilizado en el tratamiento de la diabetes que parece poseer efectos vasculares directos, más allá de su mera acción hipoglucemiante8. Se ha comprobado que posee efectos antiateroscleróticos en modelos animales9 y en ensayos clínicos10. También es capaz de aumentar la neoangiogénesis y de prevenir las apoptosis de las EPC mediante la vía del fosfoinositol-3-quinasa (PI3K). Las EPC se movilizan en respuesta a la isquemia, y se dirigen a los tejidos isquémicos, ricos en la proteína SDF-1, merced a su receptor celular CXCR-4, que se une a SDF-111. Sin embargo, esta adecuada movilización y adhesión a los lugares de isquemia se encuentra alterada en la enfermedad cardiovascular diabética. No obstante, no se conoce todavía si esta adhesión defectuosa se debe a factores atribuibles a las propias EPC (la «semilla»), a los vasos enfermos (el «suelo»), o a ambas estructuras. El objetivo del trabajo es estudiar la adhesión de EPC cultivadas sobre arterias de pacientes diabéticos y no diabéticos, y determinar si la pioglitazona es capaz de modular esta interacción.
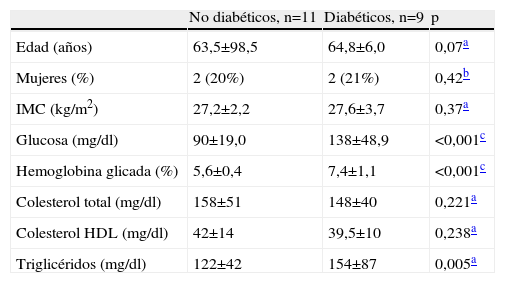
Material y métodosPacientesSe reclutó a un grupo de pacientes sometidos a cirugía de revascularización miocárdica en el Servicio de Cirugía Cardíaca, Hospital Clínico San Carlos, Madrid. La diabetes mellitus se definió, según criterios de la Asociación Americana de Diabetes, como glucosa en suero en ayunas ≥126mg/dl, o uso de medicación antidiabética (antidiabéticos orales o insulina). Todos nuestros pacientes diabéticos fueron diabéticos de tipo 2. Los criterios de exclusión fueron: pacientes mayores de 80 años, enfermedad hepática, renal, autoinmune u oncológica, e infarto de miocardio o cirugía cardiovascular reciente (menos de 7 días). Las arterias mamarias se extrajeron en el quirófano y se congelaron a −70°. Previamente, el endotelio de las arterias fue denudado mecánicamente. El estudio se realizó según la Declaración de Helsinki, y en todos los pacientes se obtuvo consentimiento informado. Las características clínicas y bioquímicas de los pacientes participantes en este estudio se muestran en la tabla 1.
Características clínicas y bioquímicas de los sujetos estudiados
| No diabéticos, n=11 | Diabéticos, n=9 | p | |
| Edad (años) | 63,5±98,5 | 64,8±6,0 | 0,07a |
| Mujeres (%) | 2 (20%) | 2 (21%) | 0,42b |
| IMC (kg/m2) | 27,2±2,2 | 27,6±3,7 | 0,37a |
| Glucosa (mg/dl) | 90±19,0 | 138±48,9 | <0,001c |
| Hemoglobina glicada (%) | 5,6±0,4 | 7,4±1,1 | <0,001c |
| Colesterol total (mg/dl) | 158±51 | 148±40 | 0,221a |
| Colesterol HDL (mg/dl) | 42±14 | 39,5±10 | 0,238a |
| Triglicéridos (mg/dl) | 122±42 | 154±87 | 0,005a |
IMC: índice de masa corporal.
Las EPC se obtuvieron a partir de la fracción leucoplaquetaria de sangre periférica obtenida como subproducto de la donación de sangre de voluntarios sanos (Centro Regional de Transfusiones de la Comunidad de Madrid), según hemos descrito previamente12. Las células mononucleares se separaron mediante un gradiente de densidad de Ficcoll (Amersham, Barcelona, España), y se sembraron a una densidad de 4×106/cm2 en placas de cultivo (Nunc, Roskilde, Dinamarca), recubiertas de fibronectina a 10μg/ml durante 1h a temperatura ambiente (Tebu-Bio, Madrid, España). Se mantuvieron en un medio de microvasculatura con 5% de suero y 5mM de glucosa (MV-2 Microvascular Medium PromoCell, Heidelberg, Alemania). El medio se cambió al día 4 y los experimentos se realizaron en el día 7. Este modelo de cultivo celular ha sido relacionado con la EPC precoces, que se relacionan con la fase más incipiente de la reparación vascular.
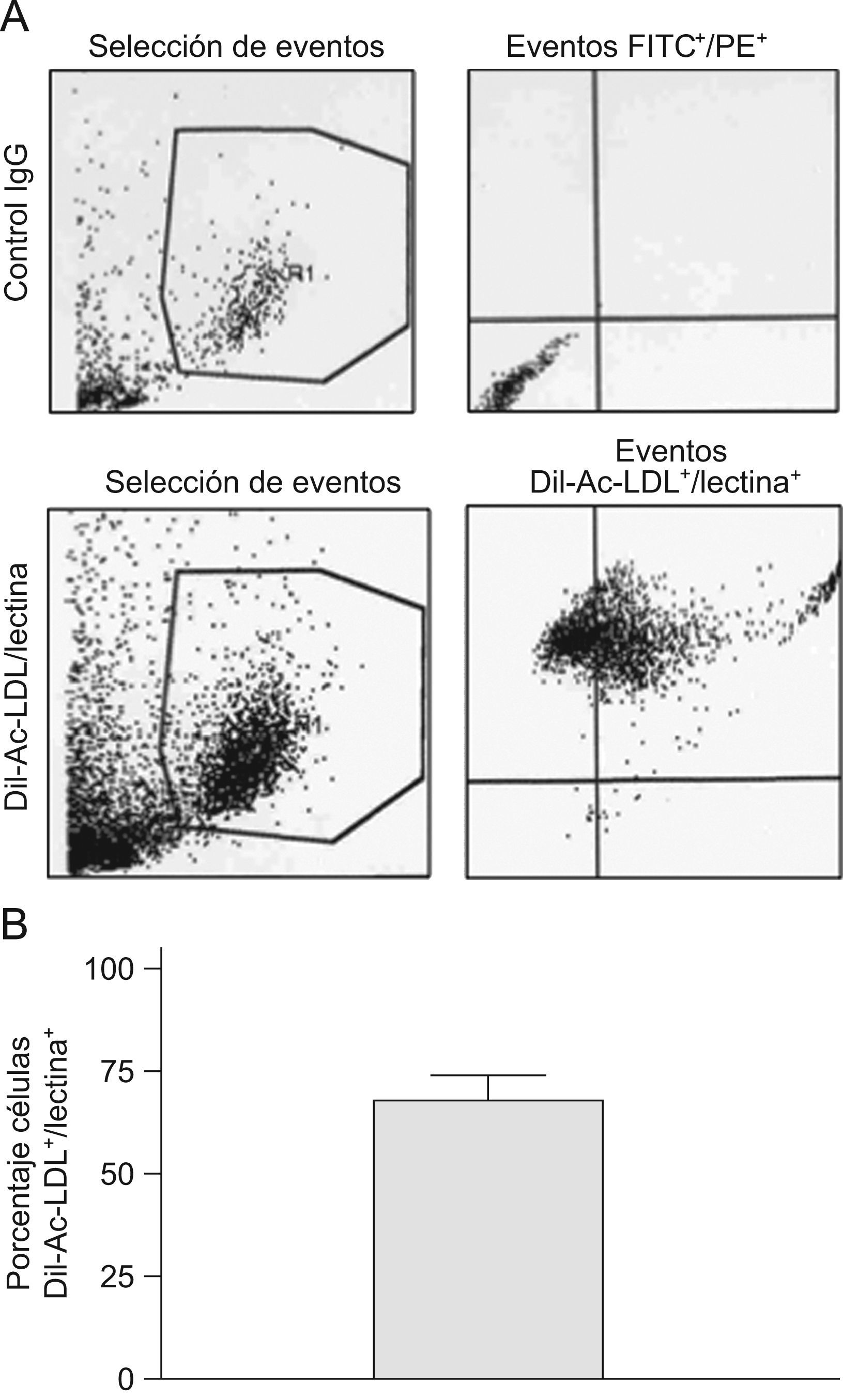
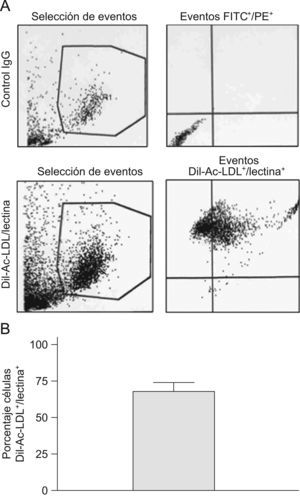
Caracterización de las EPC por citometría de flujoLas EPC se caracterizaron por citometría de flujo mediante la doble positividad de Dil-Ac-LDL (LDL acetilada marcada con 1,1′-dioctadecil-3,3,3′,3′-tetrametilindocarbocianina) y de la lectina del erizo Ulex Europaeus, según un protocolo ya publicado12. Las EPC en cultivo se incubaron durante 2h a 37°C con Dil-Ac-LDL a 4μg/ml. Después, se despegaron con tripsina y fijaron en paraformaldehído al 2% en tampón fosfato salino (PBS) durante 15min. Después, las células se lavaron con PBS y se incubaron con la lectina durante 1h, en frío, y protegidas de la luz. La detección de células doblemente positivas para ambos marcadores se realizó mediante citometría de flujo (FACScalibur™, Becton-Dickinson, San José, Estados Unidos), en el Centro de Microscopía y Citometría de la Universidad Complutense. La positividad de Dil-Ac-LDL/lectina se muestra en la figura 1.
Caracterización de las EPC mediante doble positividad de Dil-Ac-LDL/lectina. Las EPC fueron cultivadas según lo expuesto en Material y métodos. En el panel A se muestran 4 figuras representativas de citometría de flujo. La población seleccionada es separada por el aparato poniendo en ordenadas la complejidad y en abscisa el tamaño, en los dos perfiles de la izquierda. La población seleccionada, de mayor tamaño y complejidad que los restos celulares, es la contenida en el polígono. En las figuras de la derecha se analiza, en esta población seleccionada, la doble positividad de isotiocianato de fluoresceína (FITC), y de ficoeritrina (PE) (es decir, las células doblemente positivas para ambos marcadores, que no se ven en el control negativo de arriba y sí en el positivo de abajo). El panel B muestra el porcentaje medio de células Dil-Ac-LDL+/lectina+ en el cultivo celular. Esta deficiencia podría ser corregida con fármacos como la pioglitazona capaz de modular la expresión de CXCR-4 y la función de las EPC.
Para analizar la adhesión de las EPC a las arterias de pacientes, se utilizaron arterias mamarias internas remanentes de cirugía de revascularización coronaria. Las EPC se marcaron radiactivamente con 111In-oxina según una técnica estándar13 y su capacidad adhesiva se analizó mediante una cámara de flujo utilizando fragmentos de arteria mamaria interna, con el endotelio previamente denudado por la cirugía y por el ciclo de congelado y descongelado. Para ello las EPC se levantaron de la placa de cultivo al día 7, usando Accutase® (Laboratorios PAA, Linz, Austria), se resuspendieron en PBS y se incubaron durante 20min a temperatura ambiente con 111In-oxina (148mBq/1,0×105 células), y se midió la eficacia del radiomarcaje. La adhesión en flujo de las EPC a la arteria mamaria interna se midió mediante una cámara de flujo descrita previamente14. Esta cámara consiste en un canal cilíndrico de flujo, de 1mm de diámetro y 2,5cm de longitud. Las secciones de arteria (0,8cm2) se cortaron longitudinalmente y se acoplaron, permitiendo el flujo de la suspensión celular radiomarcada sobre el sustrato vascular. Las EPC marcadas se resuspendieron en medio HHMC (medio HBSS tamponado con HEPES, Mg2+/Ca2+ a 1mM, BSA al 0,5%), y se hicieron pasar sobre los vasos sanguíneos con un flujo de 0,3ml/min, durante 15min.
Determinación de CXCR-4 en EPC en cultivoLa positividad de CXCR-4 sobre EPC cultivadas se determinó mediante citrometría de flujo. Para ello las células se levantaron con Actuase®, se resuspendieron en 100μl de PBS con 0,5% de albúmina sérica bovina (BSA), y se incubaron durante 30min, en frío y protegidas de la luz, con 10μl anticuerpo anti-CXCR-4 marcado con ficoeritrina (E-Bioscience). Las células se fijaron con paraformaldehído al 2% en PBS. Dentro de las 48h siguientes, se analizaron por citometría de flujo (FACScalibur™, Becton-Dickinson, San José, Estados Unidos), en el Centro de Microscopía y Citometría de la Universidad Complutense de Madrid.
EstadísticaLos resultados se muestran como media±desviación estándar, acompañado por el número de observaciones. Se realizó un análisis estadístico mediante una t de Student, una ANOVA de una vía, chi cuadrado o test de Welch. Se asumió como significativa una p menor de 0,05.
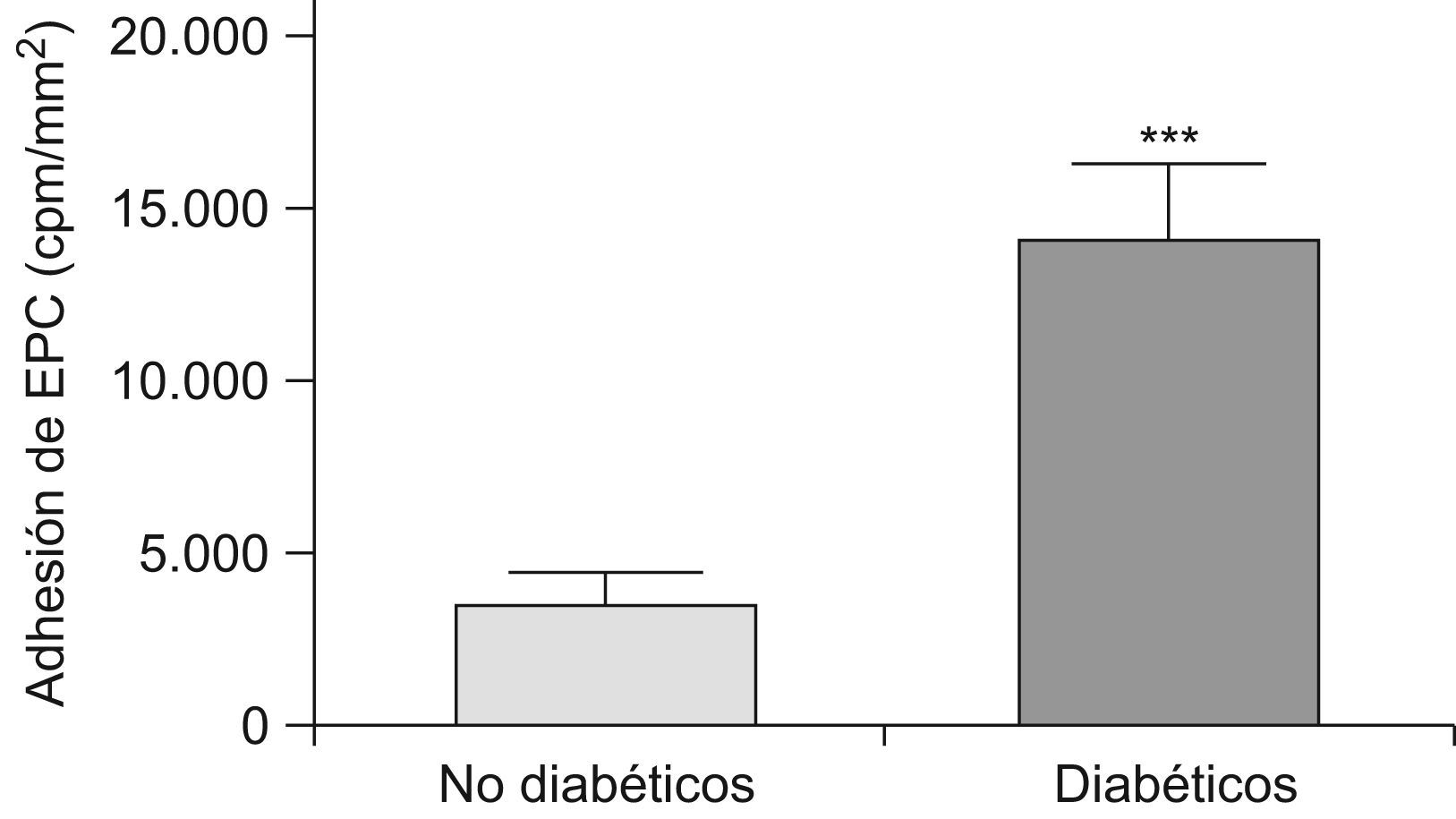
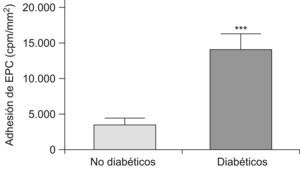
ResultadosAdhesión de las EPC a arterias mamarias internasSe observó que la adhesión de las EPC era mayor sobre las arterias de pacientes diabéticos, respecto a los pacientes revascularizados no diabéticos (fig. 2). Por tanto, en condiciones de flujo las arterias de pacientes diabéticos son un mejor sustrato para la adhesión de EPC cultivadas. Este aumento de la adhesión de las EPC en vasos diabéticos, en los que normalmente el remodelado vascular es defectuoso, podría deberse a una mayor expresión de factores de adhesión, secundaria a una mayor inflamación.
Adhesión de EPC a arterias mamarias internas de pacientes revascularizados no diabéticos y diabéticos. Las EPC se radiomarcaron con 111In-oxina y se hicieron pasar sobre arterias mamarias internas montadas en una cámara de flujo. Se observa una mayor adhesión, medida como cuentas por minuto por mm2, sobre arterias mamarias internas de pacientes diabéticos. **p<0,001.
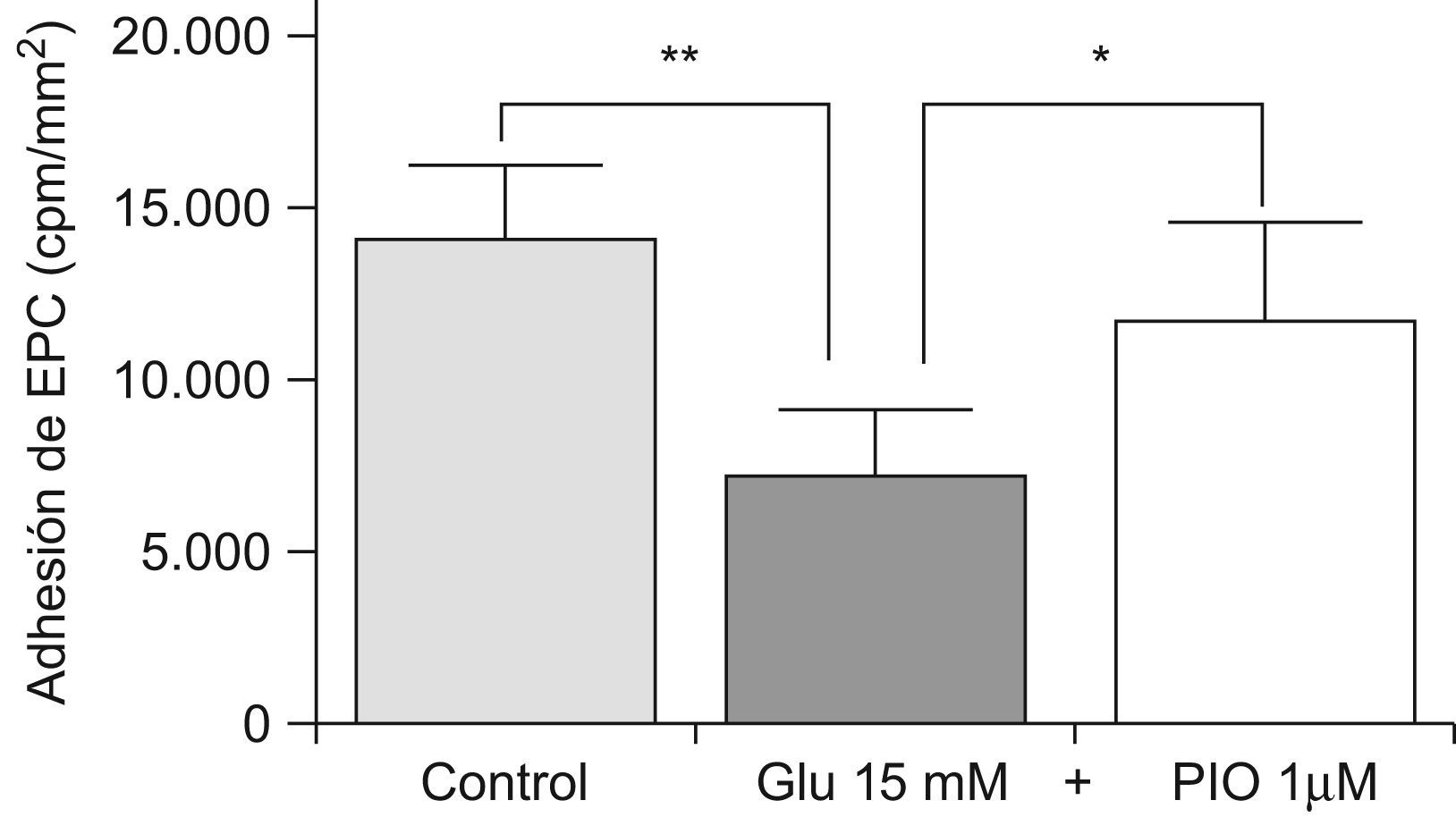
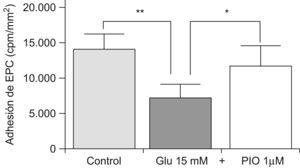
Al observar que la adhesión de las EPC era superior en las arterias de pacientes diabéticos, quienes como es bien sabido tienen menor capacidad de reparación vascular, nos planteamos analizar si además del estado de la arteria (el «suelo») también influía la calidad de las EPC (la «semilla»). De este modo, las EPC se incubaron con una concentración de elevada de glucosa (15mM), y se sometieron a ensayos de adhesión en condiciones flujo. Encontramos que, tras una incubación de 72h con glucosa, la adhesión de las EPC a los vasos de pacientes diabéticos era peor, siendo este efecto revertido si simultáneamente se co-incubaban con pioglitazona 1μM durante 72h (fig. 3). Por tanto, pioglitazona es capaz de contrarrestar in vitro los efectos inhibitorios de la hiperglucemia sobre la capacidad adhesiva de las EPC a los vasos de pacientes diabéticos, y por consiguiente de aumentar el reclutamiento de EPC.
Efecto de la glucosa y la pioglitazona en la adhesión de las EPC a arterias mamarias internas. Las EPC se cultivaron durante 72h con glucosa a 15mM, o con pioglitazona a 1μM. La adhesión a arterias mamarias internas se midió como se describe en material y métodos. Glu: glucosa. PIO: pioglitazona. *p<0,05, **p<0,01.
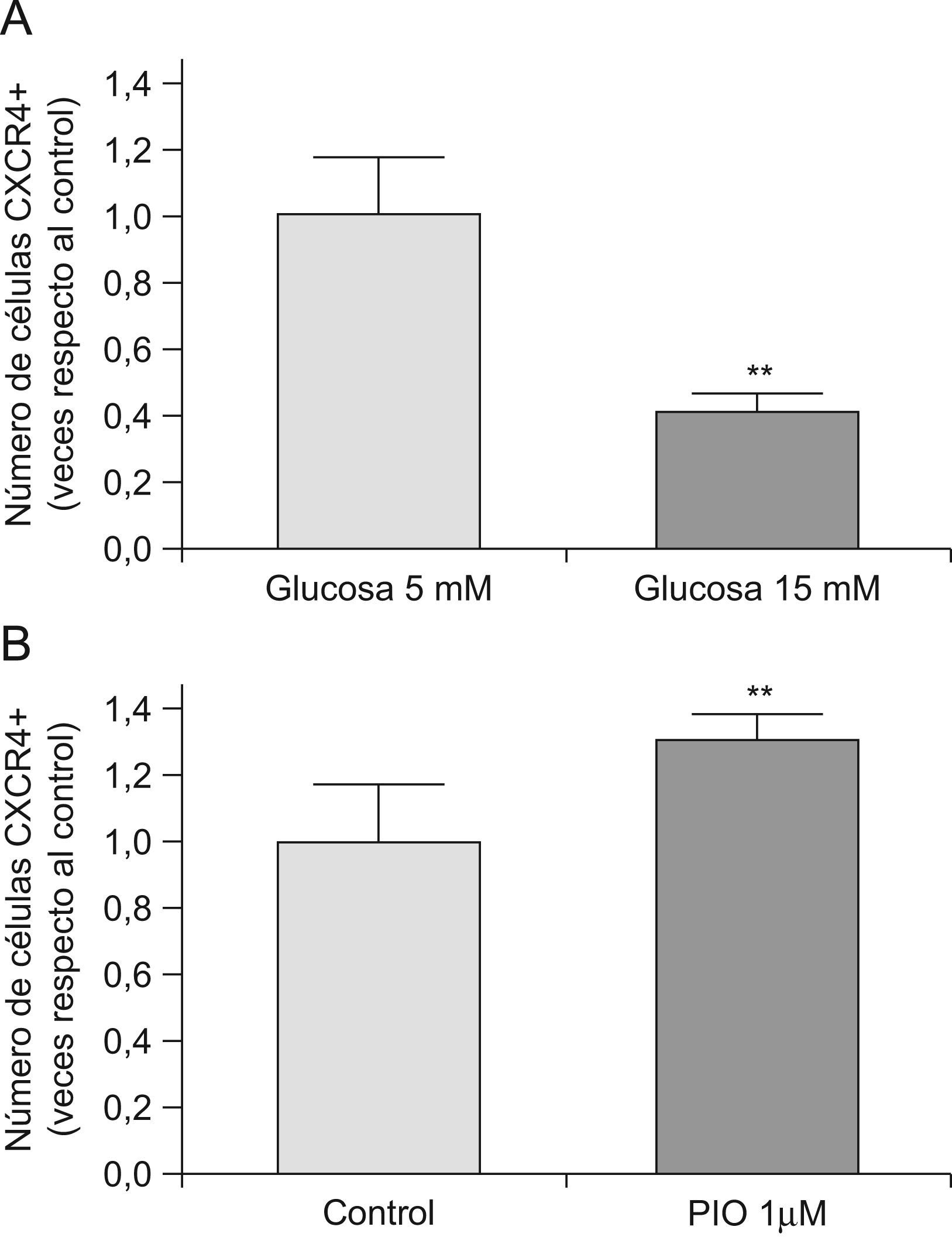
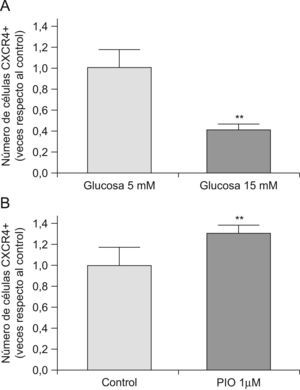
Debido a los efectos observados en la adhesión, y a la importancia del receptor de quimiocinas CXCR-4 en la regulación de la adhesión de las EPC, nos propusimos estudiar la expresión de CXCR-4 mediante citrometría de flujo. Como se muestra en la figura 4, los niveles de CXRC-4 se correlacionan con la capacidad de adhesión, que disminuye al incubar las EPC con glucosa a 15mM (fig. 4, panel A). En cambio, la capacidad adhesiva de las EPC, medida como expresión de CXCR-4, aumenta al co-incubar las células con pioglitazona 1μM (fig. 4, panel B). Por lo tanto, la expresión de CXCR-4 podría mediar la adhesión de las EPC a las arterias, y su modulación negativa o positiva por la hiperglucemia o la pioglitazona, respectivamente.
Efectos sobre la expresión de CXCR-4. La expresión de CXCR-4 se midió por citometría de flujo como se explica en Material y métodos. El panel A muestra el efecto de la incubación de glucosa a 15mM durante 72h. El panel B muestra el efecto de la incubación con pioglitazona a 1μM durante 72h. PIO: pioglitazona. *p<0,05, **p<0,01.
Los hallazgos más relevantes de este estudio se resumen en que hemos encontrado un aumento de adhesión de las EPC a vasos sanguíneos de pacientes diabéticos. Esta capacidad de adhesión se encuentra disminuida cuando las EPC se cultivan in vitro con una concentración elevada de glucosa («hiperglucemia»). Sin embargo, este defecto se corrige al co-incubar las EPC con pioglitazona a 1μM. Finalmente, nuestros resultados sugieren que el receptor de quimiocinas CXCR-4 puede ser el responsable de la menor adhesión de las EPC en la hiperglucemia, y en el papel corrector de la pioglitazona.
Uno de los hallazgos más notables de nuestro estudio es la mayor adhesión de EPC sobre arterias mamarias internas de pacientes diabéticos, en comparación con los de pacientes revascularizados no diabéticos (fig. 2). Este resultado se contrapone con el hallazgo de una menor capacidad de adhesión de las EPC aisladas de ratas diabéticas5. Puede postularse que en la enfermedad cardiovascular diabética existe un adecuado estímulo de los vasos dañados e inflamados para reclutar a las EPC, siendo estas sin embargo, defectivas en número y calidad. En otras palabras, es adecuado el «suelo», pero no las «semillas». Una importante molécula, producida en tejidos isquémicos y que se comporta como reclutadora de EPC, es el SDF-111. Las EPC poseen receptores CXCR-4, que se unen al SDF-1 expresado en los tejidos isquémicos. De este modo, se asegura una correcta movilización de las EPC desde la médula ósea hasta los tejidos isquémicos, lo que permite una adecuada reparación vascular a partir de estos progenitores hemáticos, cuya función fisiológica no se produce solo por diferenciación hacia células endoteliales, sino también mediante la secreción de factores endocrinos estimuladores de las células endoteliales residentes4–7.
De acuerdo con nuestros resultados, uno de los factores más importantes en la disminución de la expresión de CXCR-4 y la subsiguiente adhesión de las EPC en la diabetes es la hiperglucemia. Estudios recientes demuestran que la hiperglucemia es capaz de disminuir la reparación vascular mediada por EPC13,15. Más aún, los productos avanzados de glicación (AGE), afectan a la adhesión de las EPC16. La hiperglucemia puede también afectar la capacidad metabólica de las EPC17 y acelerar su senescencia a través de la MAP kinasa p3818.
Debido a que la hiperglucemia es capaz de disminuir la capacidad adhesiva de la EPC, a unos vasos sanguíneos cuya capacidad movilizadora de EPC no está disminuida, nos propusimos estudiar la posible reversión farmacológica. La pioglitazona es un fármaco antidiabético que parece poseer un efecto vascular directo más allá de su efecto hipoglucemiante8. La capacidad de retención de sales y líquidos y el aumento del riesgo de insuficiencia cardiaca, observados con otros fármacos de la clase de las tiazolidinodionas, no se ha observado con este fármaco19. Además, el estudio PROactive demostró una menor mortalidad cardiovascular en pacientes tratados con pioglitazona10. La pioglitazona ha demostrado aumentar el número y la capacidad funcional de las EPC en pacientes diabéticos20, y en pacientes con enfermedad coronaria21. Pioglitazona también previene la apoptosis y aumenta la capacidad angiogénica de las EPC in vivo22. Por tanto, la pioglitazona podría aumentar la capacidad de adhesión de las EPC sobre vasos sanguíneos, ya que se ha demostrado que puede aumentar la adhesión de las EPC sobre una matriz de fibronectina in vitro12.
Nuestros resultados muestran que pioglitazona es capaz de revertir el defecto de adhesión de las EPC inducido por la hiperglucemia. Este efecto está mediado por el receptor CXCR-4. De este modo, el presente estudio remarca la importancia del defecto de adhesión de las EPC en la diabetes a través de una menor expresión de CXCR-4, siendo estos efectos revertidos con la incubación con pioglitazona a 1μM. De modo que en la enfermedad cardiovascular diabética, a pesar de un adecuado estímulo de llamada de las EPC por parte de los vasos inflamados (el «suelo»), existe una disfunción de las EPC (las «semillas»), mediada por la hiperglucemia, que puede ser revertida mediante la incubación con la pioglitazona. Esta disfunción de la adhesión, y la corrección por el fármaco, está mediada por la expresión del receptor de quimiocinas CXCR-4 en las propias EPC.
FinanciaciónEste trabajo se ha realizado con el apoyo financiero del Instituto de Salud Carlos III (ISCIII) a través del proyecto FISS-PI080920 y de la Red Temática de Investigación Cardiovascular RECAVA (RD06/0014/1007 y RD06/0014/0027), y de laboratorios Lilly.
Contribución de los autoresTodos los autores cumplen los requisitos exigidos por la revista para ser coautores en el artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos el apoyo técnico del Centro de Microscopía y Citometría de la Universidad Complutense, y del Centro Regional de Transfusiones de la Comunidad de Madrid.
Agradecemos a la Prof. Lina Badimón su apoyo en el uso de la cámara de perfusión. Agradecemos su asistencia a Fernando Ortego y a todo el personal médico y de enfermería del Servicio de Cirugía Cardiaca, Hospital Clínico San Carlos, Madrid.