El colangiocarcinoma hiliar es el colangiocarcinoma más frecuente, representando hasta un 10% de todos los tumores hepatobiliares. Es un tumor agresivo con una resecabilidad al diagnóstico del 47% y una supervivencia sin cirugía inferior a 12 meses. Las pruebas de imagen más utilizadas para valorar estadificación y resecabilidad son la tomografía computarizada y la colangiorresonancia magnética. La mayoría de los pacientes presentan prurito e ictericia al diagnóstico, por lo que el drenaje biliar preoperatorio está indicado, pudiendo realizarse por colangiopancreatografía retrógrada endoscópica o colangiografía transparietohepática. En la actualidad, el único tratamiento curativo consiste en la resección quirúrgica, siendo la resección amplia con resección en bloque y reconstrucción vascular la técnica que ha conseguido una supervivencia mayor a largo plazo. La resección R0, la afectación ganglionar y las metástasis a distancia siguen siendo los factores pronóstico más importantes.
Hiliar cholangiocarcinoma is the most common type of cholangiocarcinoma, an represent around 10% of all hepatobiliary tumors. It is an aggressive malignancy, resectable in around 47% of the patients at diagnosis. Complete resection is the most effective and only potentially curative therapy, with a survival rate of less than 12 months in unresectable cases. Axial computerized tomography and magnetic resonance are the most useful image techniques to determine the surgical resectability. Clinically, jaundice and pruritus are the most common symptoms at diagnosis;preoperative biliary drainage is recommended using endoscopic retrograde cholangiography or percutaneous transhepatic cholangiography. Surgery using extended liver resections with an en bloc resection of the liver with vascular reconstruction is the technique with the highest survival. Complete resection with histologically negative resection margins (R0), nodal involvement and metastases are the most important prognostic factors.
La neoplasia originada en el epitelio de los conductos biliares o colangiocarcinoma (CC), representa el 10% de los tumores hepatobiliares y el 2% de los tumores malignos1,2. Los CC pueden dividirse en 3 subtipos, en función de su origen anatómico dentro de la vía biliar: CC intrahepático o periférico (ICC), CC perihiliar o tumor de Klatskin (PHC) y CC distal.
El PHC, objeto de la presente revisión, es el más frecuente, representando entre el 40-60% de todos los CC2,3. Es un tumor agresivo, silente, con una sintomatología inespecífica hasta estadios avanzados, lo que motiva un diagnóstico tardío y una supervivencia sin tratamiento quirúrgico baja, de entre 6 y 12 meses4. La cirugía, única opción curativa disponible, solo es posible en alrededor del 47% de los pacientes en el momento del diagnóstico5–8. Los factores pronósticos más importantes de este tumor suelen asociarse a las opciones quirúrgicas y al estadio tumoral, siendo el tamaño, la afectación ganglionar y vascular, las metástasis intrahepáticas y el tipo histológico los más importantes9–11.
Espacio anatómicoEl espació anatómico de los PHC sería el delimitado entre la entrada del conducto cístico a nivel distal, y la bifurcación de los conductos hepáticos derecho e izquierdo a nivel proximal1,12. En las clasificaciones más utilizadas se incluyen todos los CC originados en el confluente biliar o en sus proximidades. Algunos grupos han sugerido también la inclusión de los CC originados en el parénquima hepático pero que invaden el confluente biliar y su origen se encuentra en el espacio anatómico delimitado entre el origen de la rama venosa portal posterior derecha y el ligamento falciforme13–15. Estos ICC con afectación del confluente biliar tendrían el mismo tratamiento que los tumores de origen extrahepático, y una supervivencia similar a los PHC con el mismo estadio, siendo habitualmente tumores muy avanzados con invasión vascular y ganglionar locorregional. Las dudas sobre el comportamiento biológico diferente de estos tumores han hecho que muchos grupos los excluyan de los tumores perihiliares. En un estudio publicado por Ebata et al.13,15 con 250 pacientes resecados por CC con afectación del confluente, analizaron el estadio y supervivencia en función de si el tumor era intrahepático con afectación del confluente (ICC), o si el origen del tumor estaba en la vía biliar extrahepática (PHC). Un total de 83 pacientes presentaban ICC y 167 PHC. Al comparar los estadios, los pacientes con ICC mostraban con mayor frecuencia afectación vascular y ganglionar, con un TNM superior al grupo de PHC, presentando estadio iii y iv en el 59% de los casos respecto al 38% en el grupo PHC. Pero si se dividía la supervivencia por estadios en ambos grupos, no había diferencias estadísticamente significativas a los 5 años, con una supervivencia global mínimamente superior en el PHC (20 vs. 29% respectivamente; p=0,057), por lo que se concluía que eran comparables en cuanto a tratamiento y supervivencia. Con la mejoría de las pruebas diagnósticas y conocimientos histopatológicos, en el futuro quizás podamos definir mejor si son 2 entidades distintas o clínica y biológicamente iguales.
Características histopatológicasEl 90% de los PHC son adenocarcinomas. El 10% son carcinomas adenoescamosos o escamosos, que en algunos casos se han podido relacionar con el antecedente de litiasis, quistes o anomalías de los conductos biliares. En función del aspecto tumoral, el tipo de crecimiento y el comportamiento biológico y clínico de los PHC, estos se dividen en16,17:
- -
CC tumoral o «mass-forming»: Es la forma de presentación más frecuente en el ICC, aunque también se puede encontrar en un gran número de PHC. Se caracteriza por formar una masa tumoral de márgenes bien definidos, con importante reacción fibrótica y es frecuente la necrosis central. Este tumor se origina en la luz del conducto biliar, invade la pared y se disemina creciendo tridimensionalmente, formando una masa nodular que condiciona un cuadro obstructivo16–19.
- -
CC periductal infiltrante. Este tipo de tumor crece a lo largo de un conducto biliar en forma de un engrosamiento concéntrico y longitudinal a través del tejido conectivo periductal, provocando estenosis u obstrucción completa de la vía biliar afectada19. La mayoría de los PHC son de este tipo, y son difíciles de identificar mediante las pruebas de imagen17.
- -
CC de crecimiento intraductal o papilar intraductal. Esta variedad se caracteriza por la presencia de tumores papilares superficiales e intraluminales en la vía biliar, que producen mucina y ocasionan obstrucción parcial y dilatación de los conductos16. Este tumor presenta un bajo grado de malignidad y habitualmente es de pequeño tamaño, aunque puede diseminarse por la mucosa biliar dando lugar a múltiples tumores (papilomatosis o carcinomatosis papilar)20.
La importancia de esta diferenciación radica en las variaciones de supervivencia en función del subtipo. Diversos estudios han demostrado el mejor pronóstico de los pacientes con la variedad papilar intraductal respecto a las variedades escleronodulares21, con una mediana de supervivencia de 55 y 33 meses respectivamente22, y siendo menos frecuente la afectación vascular y ganglionar en el subtipo papilar intraductal.
En resumen, la mayoría de los PHC son adenocarcinomas con patrón de crecimiento periductal que les confiere un peor pronóstico, siendo la variante de crecimiento intraductal la menos frecuente pero la que presenta un mejor pronóstico.
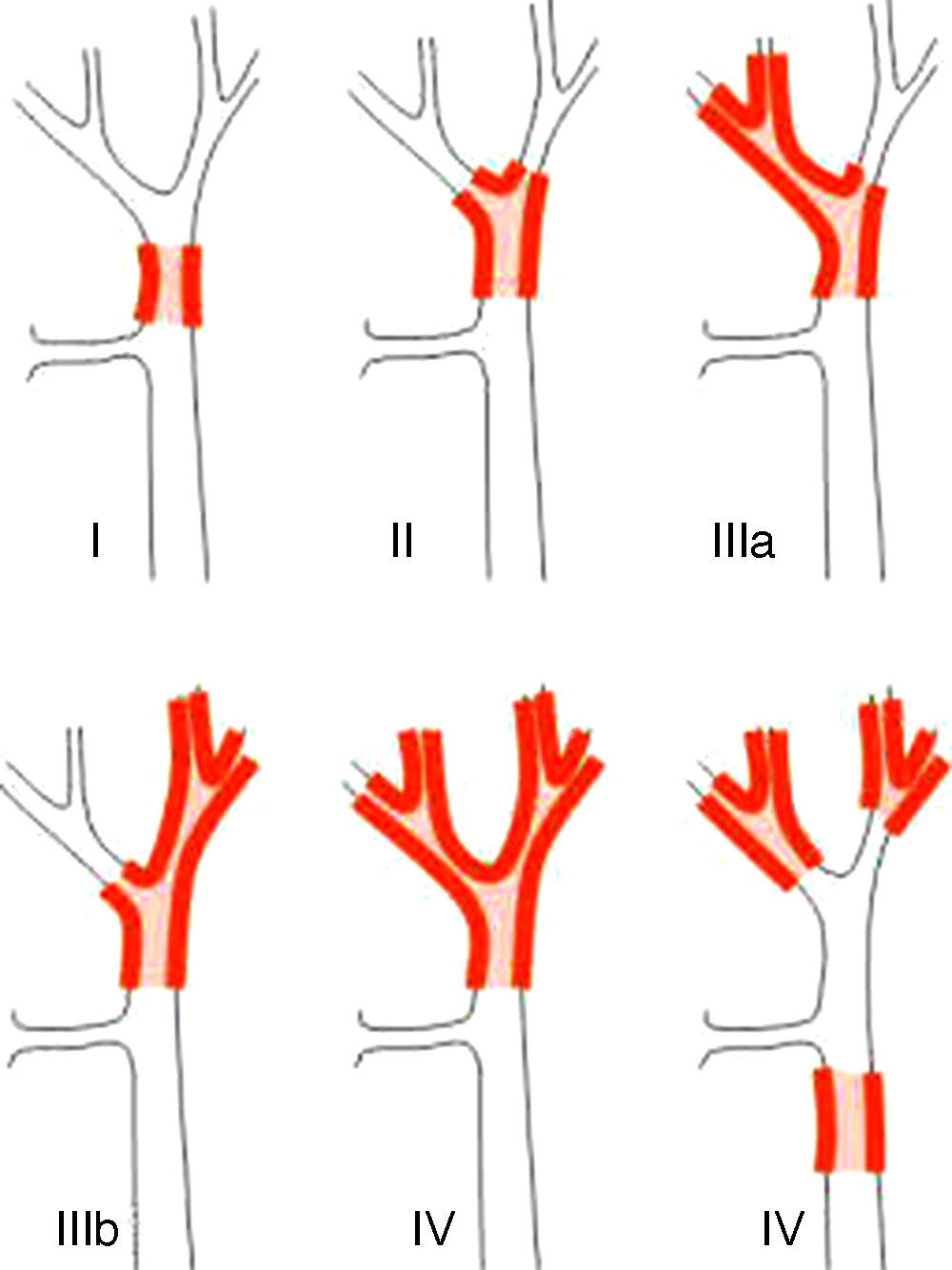
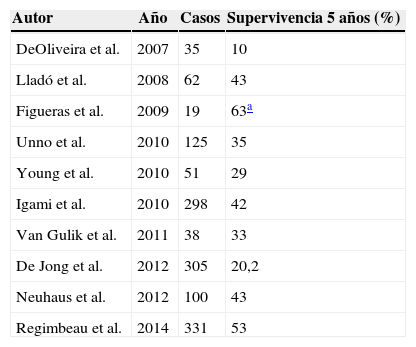
Sistemas de estadificaciónLos sistemas de clasificación de los PHC pueden diferenciarse en clasificaciones prequirúrgicas y las posquirúrgicas. Dentro de las primeras, que utilizaríamos para planificar la cirugía, la más importante es la clasificación de Bismuth-Corlette, que nos indica cuál de los lóbulos está afectado preferentemente y por lo tanto nos marca el tipo de hepatectomía a realizar (fig. 1)23. Esta clasificación ideada en los años 70 no tiene en cuenta la afectación ganglionar ni metastásica, no teniendo por lo tanto actualmente valor pronóstico.
Clasificación de Bismuth-Corlette23.
Otra clasificación prequirúrgica utilizada en EE. UU. es la publicada por Jarnagin et al.10 del «Memorial Sloan-Ketteing» de Nueva York. Está clasificación pretende predecir la resecabilidad del tumor teniendo en cuenta 3 factores de extensión local, que son la extensión biliar, la afectación vascular y la atrofia lobar. Esta clasificación no tiene en cuenta la afectación ganglionar ni metastásica por lo que pierde valor pronóstico. Como la resecabilidad difiere según los grupos y cada vez se tiende a ser más agresivo, su valor dependerá de los criterios de irresecabilidad del centro. La afectación local hoy en día no debería ser un criterio de irresecabilidad siempre y cuando podamos conseguir un R0 con la resección quirúrgica.
En cuanto a las clasificaciones posquirúrgicas, la más usada es la clasificación TNM de la «Union for International Cancer Control» (UICC) séptima edición12. Esta clasificación tiene en cuenta los datos de la anatomía patológica, como la extensión local, afectación vascular, ganglionar y metástasis, para establecer una clasificación que contempla la extensión tumoral, y tienen un carácter pronóstico.
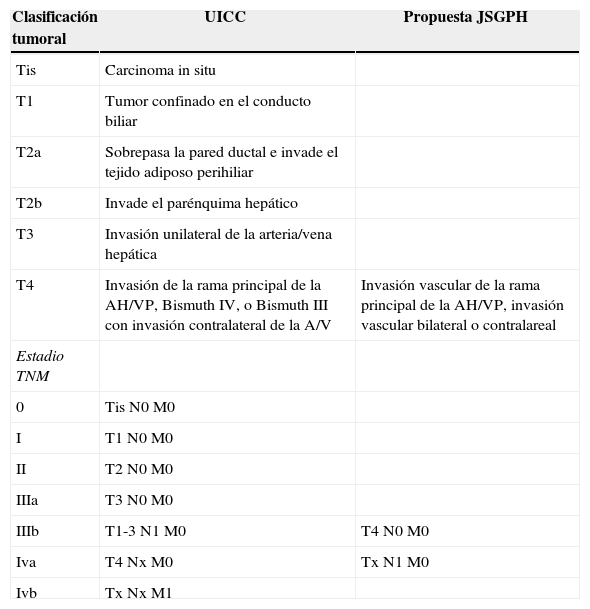
Recientemente el «Japanese Study Group on Perihilar Cholangiocarcinoma» (JSGPH) ha publicado un estudio en el que proponen una modificación de esta clasificación de la «Union for International Cancer Control». Las diferencias básicas están resumidas en la tabla 1 y consisten principalmente en13:
- 1.
En la no consideración del Bismuth IV como T4. La clasificación del JSGPH por lo tanto no tiene en cuenta la extensión biliar bilateral como mal pronóstico si se consigue una resección R0.
- 2.
En cuanto a los estadios, priorizan la afectación ganglionar como peor pronóstico. De esta manera, consideran la afectación ganglionar como estadio iva y no iiib (TNM7).
Comparación entre las diferencias básicas de la clasificación del UICC TNM 7 y la propuesta del JSGPH
| Clasificación tumoral | UICC | Propuesta JSGPH |
|---|---|---|
| Tis | Carcinoma in situ | |
| T1 | Tumor confinado en el conducto biliar | |
| T2a | Sobrepasa la pared ductal e invade el tejido adiposo perihiliar | |
| T2b | Invade el parénquima hepático | |
| T3 | Invasión unilateral de la arteria/vena hepática | |
| T4 | Invasión de la rama principal de la AH/VP, Bismuth IV, o Bismuth III con invasión contralateral de la A/V | Invasión vascular de la rama principal de la AH/VP, invasión vascular bilateral o contralareal |
| Estadio TNM | ||
| 0 | Tis N0 M0 | |
| I | T1 N0 M0 | |
| II | T2 N0 M0 | |
| IIIa | T3 N0 M0 | |
| IIIb | T1-3 N1 M0 | T4 N0 M0 |
| Iva | T4 Nx M0 | Tx N1 M0 |
| Ivb | Tx Nx M1 |
AH: arteria hepática; JSGPH: «Japanese Study Group on Perihilar Cholangiocarcinoma»; TNM: tumor ganglios metástasis; UICC: «Union for International Cancer Control»; VP: vena porta.
Fuente: Ebata et al.13.
A nivel europeo se ha creado un registro internacional de tumores perihiliares tratados quirúrgicamente, liderado por el «International Cholangiocarcinoma Group for the Staging of PHC». Este grupo, ha publicado una nueva clasificación1 que tiene en cuenta el tamaño del tumor, la afectación biliar, venosa, arterial, ganglionar y metastásica, tanto preoperatorias como postoperatorias. Las limitaciones de esta clasificación, sin embargo, están en que es meramente descriptiva de las características del tumor y la cirugía a realizar, pero no divide luego a los pacientes en grupos o estadios en función de estas variables. En consecuencia no se pueden extraer conclusiones pronósticas y es imposible comparar resultados entre grupos.
Las publicaciones previas muestran que la clasificación prequirúrgica más usada hoy para decidir el tipo se resección es la clasificación de Bismuth-Corlette y la clasificación TNM 7 para definir el pronóstico a largo plazo.
Estrategias diagnósticasLos síntomas más frecuentes asociados al PHC son: la ictericia (90%), pérdida de peso y dolor abdominal (35%), prurito (26%) y colangitis aguda (10%)17. Debido a estos síntomas el diagnóstico inicial suele hacerse con ecografía abdominal, siendo esta una buena prueba de despistaje. Otras pruebas diagnósticas en este tipo de tumor serían:
- •
Ecografía Doppler abdominal: Permite evaluar la permeabilidad arterial y portal (trombosis), que pueden condicionar la resecabilidad del tumor y la estrategia terapéutica, aunque no es la prueba de elección para valorar la afectación vascular.
- •
Tomografía axial computarizada abdominal: Útil para el diagnóstico del tumor primario y para la extensión de la enfermedad, teniendo una sensibilidad del 80% para valorar la extensión biliar. Es la técnica de elección para la valoración prequirúrgica de la anatomía vascular y tiene una sensibilidad del 93% y 87% para valorar la afectación arterial y portal respectivamente. La sensibilidad para evaluar la afectación ganglionar prequirúrgica es baja (50%)14,24. Es útil también para realizar la volumetría y calcular el volumen hepático remanente tras la resección quirúrgica, y es la prueba más económica para la estadificación prequirúrgica.
- •
Resonancia magnética y colangiorresonancia magnética (colangio-RM): La mejor prueba para el diagnóstico del tumor primario y valorar la extensión biliar. Tiene una sensibilidad entre el 86-100%, siendo superior a la colangiografía directa y siendo una prueba no invasiva25. Por el contrario, tiene una sensibilidad baja para valorar la afectación vascular (73%) y una sensibilidad del 80% para la invasión del parénquima hepático.
- •
Colangiografía directa: colangiopancreatografía retrógrada endoscópica(CPRE) y colangiografía transparietohepática (CTPH): Nos informa del nivel de obstrucción biliar y permite realizar una toma de muestras de la lesión por citología, con una sensibilidad del 20%. Actualmente sustituidas en el diagnóstico por la colangio-RM. Muy útiles para el drenaje biliar preoperatorio y en el tratamiento paliativo del PHC, con la colocación de stents metálicos recubiertos preferiblemente26–28.
- •
Ecografía endoscópica: Útil para la evaluación de la afectación ganglionar del territorio del tronco celíaco y región peripancreática y establecer la estadificación preoperatoria, pudiendo tomar biopsias con la punción aspiración con aguja fina.
- •
Tomografía por emisión de positrones: Útil en el estudio de pacientes con sospecha de afectación metastásica y en la afectación de adenopatías en el tronco celíaco. Hay controversia en cuanto a la sensibilidad, que puede ir del 38-90% según la series publicadas14,24,29.
- •
Marcadores tumorales: Su utilidad es limitada, siendo el CA 19.9 el que con mayor frecuencia se emplea. La mayoría de los estudios lo han evaluado en neoplasias pancreáticas y en menor medida en CC, sin especificar su localización o características. Los niveles séricos de este marcador están muy influidos por la obstrucción biliar e ictericia debido a su eliminación biliar. Se han propuesto distintos valores normales en función de la presencia de hepatopatía (300U/ml) o ictericia (1.000U/ml), obteniendo en cáncer de páncreas sensibilidades superiores al 70% con especificidades de más del 95%. Su concentración en estos pacientes es muy variable y no se correlaciona con el tamaño tumoral, pero sí con la afectación metastásica. Se puede aumentar su sensibilidad y especificidad combinándolo con el CEA, sobre todo en los casos con Lewis A negativo (no productores de CA 19.9)30.
Los datos anteriormente indicados muestran que para el diagnóstico del PHC iniciaremos habitualmente el estudio con una ecografía, en el contexto de un paciente con ictericia, siendo la tomografía computarizada y la colangio-RM las mejores pruebas de estadificación y las más recomendadas para realizar antes de la cirugía. La volumetría se podrá realizar por tomografía computarizada o RM en función del tipo de aparatos y programas informáticos de cada centro. Ante la duda sobre la extensión ganglionar que pueda contraindicar la cirugía la prueba recomendada es la tomografía por emisión de positrones o la ecoendoscopia con punción aspiración con aguja fina.
Criterios de irresecabilidadLa cirugía es el único tratamiento curativo en el PHC y el que ofrece mejor supervivencia a largo plazo. Los criterios adoptados para indicar la resección quirúrgica se han expandido en los últimos años, desde los descritos inicialmente por el equipo del «Memorial Sloan Kettering Cancer Center» por Burke et al.31 en 1998 hasta la introducción reciente de abordajes con resección vascular y hepatectomías extendidas3,5,32–34. Los criterios de irresecabilidad varían en función de cada centro, siendo los más extendidos: afectación vascular de un lado con afectación biliar contralateral hasta la división de los radicales de segundo orden, las metástasis hepáticas a distancia, la afectación vascular de ambos lóbulos hepáticos, la afectación extrahepática o peritoneal y la afectación adenopática del tronco celíaco, arteria mesentérica superior o región paraaortica3,5,8,31.
En un estudio multicéntrico publicado por De Jong et al.34 en el que se analizaba a 305 pacientes intervenidos por PHC en 7 centros diferentes de EE. UU. y Europa, y en el que se incluía a pacientes con afectación portal, en el análisis multivariado los 2 únicos factores pronóstico estadísticamente significativos fueron la afectación del margen de resección y la afectación ganglionar(p=0,02). En el estudio publicado por Ebata et al.15 analizando a 1.352 pacientes intervenidos en 8 hospitales japoneses por PHC con intención curativa, en el análisis multivariado los factores pronóstico estadísticamente significativos fueron: la invasión vascular, la invasión pancreática, la afectación ganglionar, las presencia de metástasis y la afectación del margen de resección, siendo la afectación ganglionar y metastásica las que condicionaban peor supervivencia a los 5 años respecto al resto (10, 20 y 63% respectivamente). Estos resultados apoyan el abordaje quirúrgico de estos tumores a pesar de la extensión local si es factible realizar una resección R0, ya que se puede conseguir aumentar la supervivencia a los 5años independientemente de la extensión local.
Por todo ello se recomienda evaluar de forma individual cada caso, y la cirugía se lleva a cabo si se puede conseguir una resección R0 en ausencia de metástasis a distancia o afectación peritoneal. La afectación biliar bilateral y vascular local, por lo tanto, no deberían ser criterio de irresecabilidad, si se puede realizar la cirugía preservando más del 30% del volumen hepático y conseguir una resección oncológica.
Estrategias terapéuticasDrenaje biliarDado que la mayoría de los pacientes afectados de PHC comienzan con ictericia, uno de los dilemas más importantes es la utilidad del drenaje biliar preoperatorio. Sin embargo, este no está exento de complicaciones, las asociadas a la CPRE con colocación de prótesis son: pancreatitis, perforación duodenal, migración duodenal, obstrucción del catéter y, la más importante, la colangitis. El drenaje por CTPH presenta una incidencia inferior de colangitis preoperatoria, pero se asocia a hemorragia, migración del catéter, diseminación tumoral en el trayecto del catéter de hasta el 5% y molestias y dolor en la zona de entrada. En global, según los estudios publicados, la CPRE asocia una morbilidad del 60% y la CTPH de un 31%14,35.
Por todo ello, el drenaje biliar preoperatorio en cirugía hepatobiliopancreática ha sido puesto en duda36,37. Estos estudios que incluyen cualquier tipo de cirugía hepatobiliar han demostrado que el drenaje biliar preoperatorio en pacientes con ictericia aumenta las morbilidad asociada sin mejorar la supervivencia, incrementando principalmente las complicaciones infecciosas. Sin embargo, en el estudio multicéntrico europeo publicado en 2013 por Farges et al.38, se analizó retrospectivamente a 366 pacientes sometidos a hepatectomía o hepatectomía extendida y resección biliar por PHC. Se dividieron en función de si se había realizado drenaje biliar preoperatorio. El grupo sin drenaje biliar preoperatorio (no PBD) estaba compuesto de 186 pacientes y el grupo con drenaje biliar (PBD) de 180 pacientes. Los grupos eran homogéneos en cuanto a edad, estadio tumoral y resección portal. El grupo de PBD presentaba mayor número de hepatectomías derechas (56 vs. 44%). Cuando compararon ambos grupos en función del tipo de cirugía realizada, los pacientes sometidos a hepatectomía derecha mostraban mayor número de fallo hepático postoperatorio si pertenecían al grupo no PBD, con una incidencia del 16 vs. 4% en el grupo PBD (p=0,009). En el análisis multivariado de los factores asociados a mayor mortalidad en el grupo de hepatectomía derecha, tener unos niveles de bilirrubina por debajo de 3mg/dl antes de la cirugía era un factor estadísticamente significativo. En cambio si se comparaban ambos grupos en los pacientes sometidos a hepatectomía izquierda, el grupo PBD presentaba mayor número de sepsis postoperatorias con una incidencia del 6% respecto al 0% del grupo no PBD (p=0,014). Este trabajo demuestra que aunque si bien es cierto que el drenaje biliar aumenta la incidencia de sepsis postoperatoria, en aquellos pacientes que van a ser sometidos a una hepatectomía derecha se debería realizar el drenaje de la vía biliar para disminuir la morbimortalidad asociada a la insuficiencia hepática postoperatoria, habiendo otros trabajos que apoyan esta teoría39. Dado que en el tratamiento del PHC los únicos estudios que han demostrado una mayor supervivencia son aquellos que apuestan por resecciones amplias consiguiendo una resección R0, se recomienda el drenaje biliar cuando se indica la cirugía y esta puede acabar requiriendo una hepatectomía extendida de más del 50% del volumen hepático o trisegmentectomía, o ante la presencia de colangitis. Existe controversia sobre cuál debe ser el punto de corte en los niveles de bilirrubina para indicar el drenaje, siendo>10mg/dL uno de los más usados5,37. Se recomienda realizar drenaje biliar por CTPH con colocación de drenaje externo, que evita la manipulación del tumor, tiene una incidencia de infecciones inferior a la CPRE y permite, en aquellos pacientes que con el drenaje unilateral no normalizan niveles de bilirrubina, realizar un drenaje biliar bilateral35,40.
Se ha descrito la diseminación tumoral en el lugar de punción de hasta el 5-10% con la utilización de la CTPH14,24, aunque estos estudios no especifican si se han usado drenajes externos o interno-externo, y no tienen en cuenta el tiempo transcurrido hasta la cirugía. Algunos autores recomiendan el uso del drenaje nasobiliar colocado por endoscopia para evitar la diseminación producida en el lugar de punción, con una incidencia de colangitis y obstrucción de la prótesis menor que la CPRE41, aunque los mismos estudios reconocen la dificultad del drenaje biliar preoperatorio bilateral por este sistema, lo que dificulta la normalización de los niveles de bilirrubina antes de la cirugía en los pacientes en los que el drenaje unilateral ha fallado42.
Para disminuir la morbilidad asociada a las infecciones tras el drenaje biliar preoperatorio, se ha sugerido el cultivo sistemático de la bilis tras el drenaje y durante la intervención quirúrgica. Diversos estudios han demostrado la positividad de los cultivos con una incidencia del 78-94% en los pacientes drenados respecto a un 20-30% en los no drenados43–45, siendo el enterococo el organismo aislado con mayor frecuencia. Estos grupos defienden el uso de antibióticos de forma profiláctica, que aunque aumenta la resistencia a los antibióticos de las especies aisladas, en los estudios publicados consigue una morbilidad infecciosa postoperatoria similar a la de los grupos no drenados. El antibiótico de elección dependerá de los cultivos y el antibiograma, eligiendo según la mayoría de los grupos al menos una cefalosporina de tercera generación o fluoroquinolonas+metronidazol, en los que no dispongamos de cultivo o este sea negativo43,44,46.
En los pacientes irresecables realizamos un drenaje biliar paliativo. El drenaje se puede realizar por CPRE dejando prótesis metálica recubierta, o también por CTPH en los casos en los que es imposible un correcto drenaje de ambas vías biliares por CPRE.
En definitiva, se debería realizar el drenaje biliar preoperatorio en todos los pacientes con una bilirrubina superior o igual a 10mg/dL y en los que se tenga que llevar a cabo una resección hepática mayor al 50% del volumen hepático. El tipo de abordaje dependerá del centro, aunque es recomendable la CTPH con colocación de drenaje externo para no manipular el tumor y por la menor incidencia de colangitis. En los pacientes drenados, algunos autores recomiendan el uso de antibióticos de forma profiláctica en función de los cultivos biliares.
Embolización portal preoperatoriaLa embolización portal preoperatoria fue descrita en los años ochenta, inicialmente por Makuuchi et al.47 y luego por Kinoshita et al.48. El objetivo de la embolización portal es aumentar el volumen hepático remanente en aquellos casos en los que se considera insuficiente en la volumetría preoperatoria, disminuyendo la probabilidad de sufrir una insuficiencia hepática en el postoperatorio. En un metaanálisis publicado recientemente por Higuchi y Yamamoto49 que incluía a 836 pacientes con PHC en los que se realizó la embolización portal preoperatoria, la morbilidad fue del 1% y la mortalidad del 0,09%. La progresión del tumor durante el procedimiento que impidió la cirugía fue del 19,4%. Estos resultados apoyan la idea de que su uso en el PHC está justificado en aquellos pacientes con un volumen hepático remanente preoperatorio inferior al 30%.
Laparoscopia de estadificaciónCon los avances en la sensibilidad y especificidad de las pruebas de imagen no invasivas en los últimos años, la laparoscopia de estadificación está cayendo en desuso. Los criterios más importantes de irresecabilidad como la afectación ganglionar, extensión biliar e invasión vascular, son de difícil valoración durante la laparoscopia, con una precisión y eficacia que ha ido disminuyendo durante los años, como demuestra la reciente revisión de Rotellar y Pardo50, con una precisión y eficacia del 41 y 72% respectivamente en 2002, a un 14 y 32% en estudios publicados en 2011. Este descenso es debido principalmente a la mejoría de las pruebas no invasivas como la colangio-RM. Su eficacia aumenta si se seleccionan pacientes de alto riesgo de presentar diseminación peritoneal o metástasis hepáticas, evitando así laparotomías innecesarias50–52. Se recomienda en estadios avanzados por pruebas de imagen no invasivas (T2/3/4) que presentan posible afectación peritoneal o ganglionar avanzada, no puncionable por ecoendoscopia y antes de realizar el drenaje biliar preoperatorio. Siempre realizamos la laparoscopia de estadificación con ecografía intraoperatoria para mejorar la sensibilidad de la afectación locorregional y ganglionar53.
Tratamiento quirúrgicoLa cirugía en el PHC sigue siendo el único tratamiento curativo3,14 consiguiendo supervivencias del 20-40% a los 5 años (tabla 2)10,11. La resección quirúrgica debe realizarse siempre que se pueda conseguir una resección R0. Los principales factores que afectan a la supervivencia tras la cirugía son la afectación de los márgenes de resección, ya sea de forma microscópica (R1) o macroscópica (R2) y la afectación ganglionar (N1 y N2)14,17,44,54. Diversos estudios han demostrado el aumento de la supervivencia incrementando la amplitud de la resección para conseguir márgenes negativos3,5,33,45. Las técnicas propuestas incluyen la realización de hepatectomías extendidas con resección del segmento caudado, resección biliar, linfadenectomía hiliar hasta el tronco celíaco y reconstrucción con hepatoyeyunostomía.
Supervivencia tras la resección del PHC según las series publicadas
| Autor | Año | Casos | Supervivencia 5 años (%) |
|---|---|---|---|
| DeOliveira et al. | 2007 | 35 | 10 |
| Lladó et al. | 2008 | 62 | 43 |
| Figueras et al. | 2009 | 19 | 63a |
| Unno et al. | 2010 | 125 | 35 |
| Young et al. | 2010 | 51 | 29 |
| Igami et al. | 2010 | 298 | 42 |
| Van Gulik et al. | 2011 | 38 | 33 |
| De Jong et al. | 2012 | 305 | 20,2 |
| Neuhaus et al. | 2012 | 100 | 43 |
| Regimbeau et al. | 2014 | 331 | 53 |
Supervivencia después de la resección hepática por colangiocarcinoma perihiliar.
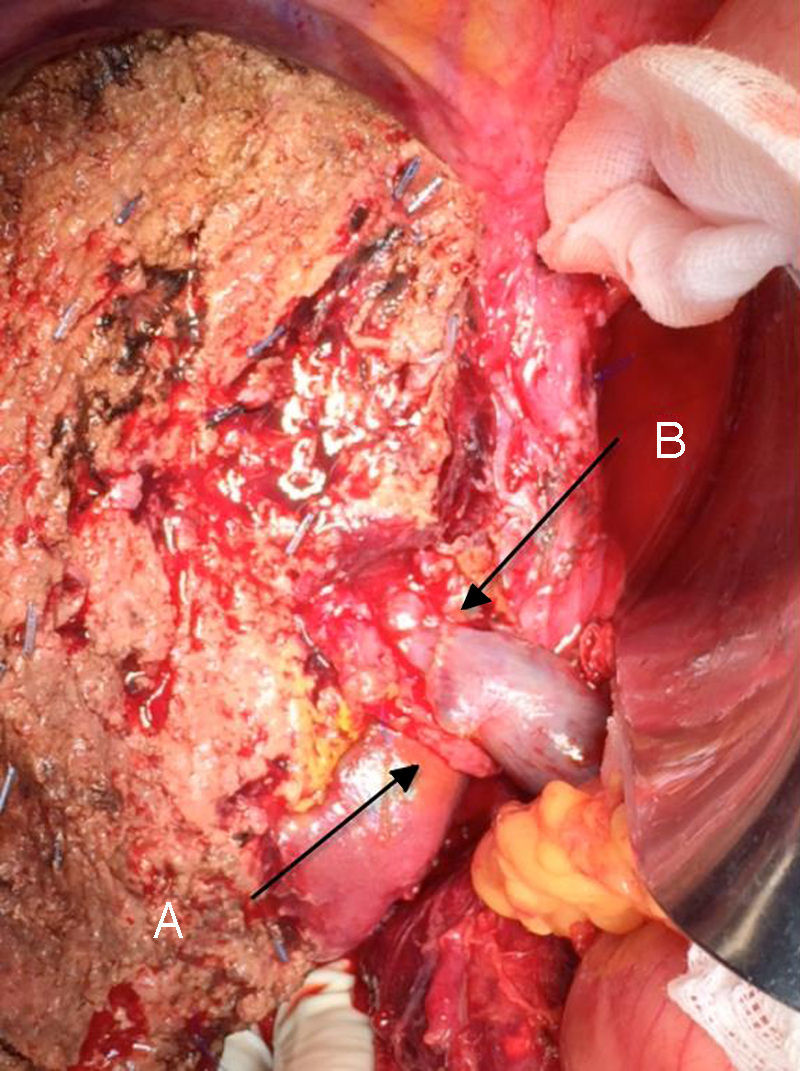
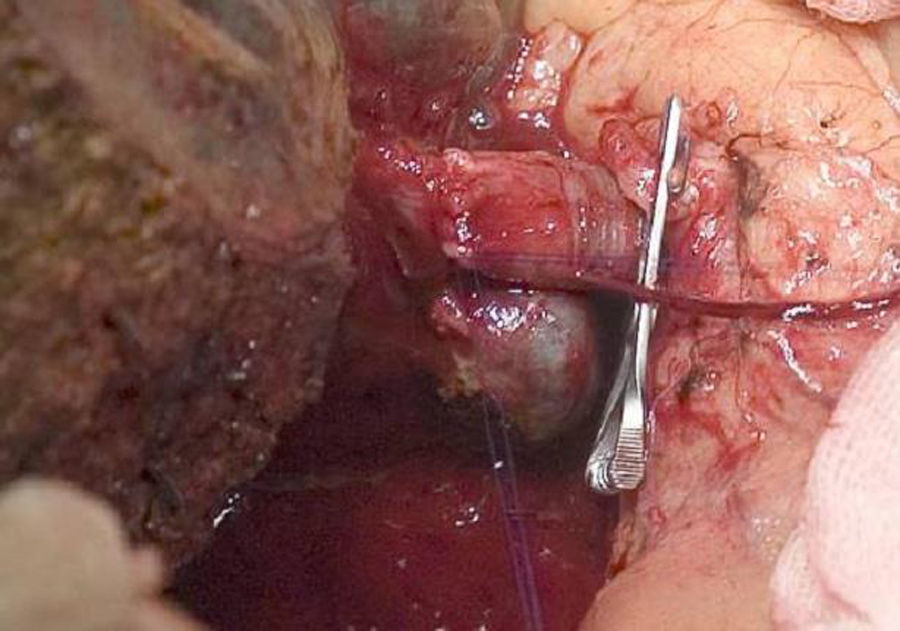
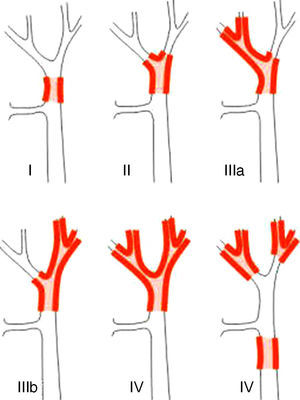
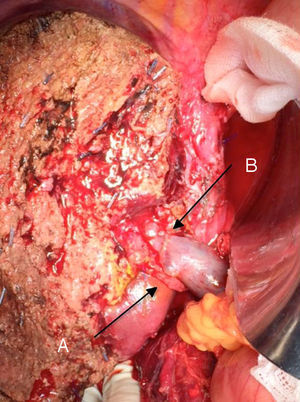
La técnica «non-touche técnique» descrita inicialmente por Neuhaus et al.32 conlleva la resección en bloque del hilio hepático sin la manipulación del tumor, aumentando la supervivencia de los pacientes a los 5 años en más del 15%3,33,34,55. Básicamente consiste en la resección de vena porta y arteria hepática derecha cuando se encuentran próximas al tumor, evitando así su disección si esto conlleva la manipulación tumoral y la resección de la vía biliar completa con una linfadenectomía amplia hasta la raíz del tronco celíaco y reconstrucción con hepaticoyeyunostomía. La elección del lóbulo hepático derecho será preferible («non-touch técnique» propiamente, según Neuhaus33, siempre que la extensión del tumor lo permita para poder incluir la arteria hepática derecha, que es la que se encuentra más próxima al tumor. Este tipo de cirugía amplia conlleva una morbilidad postoperatoria aceptable, de entre el 50-70% según las series con una mortalidad de entre el 10-20%3,5. La supervivencia de los pacientes con PHC a los 5 años está entre el 20% y el 40%, llegando en estudios publicados con resección portal y en series utilizando la «non-touch technique» al 58% a los 5 años3,5,33 (figs. 2 y 3).
Es importante también resaltar estudios recientes que demuestran el aumento de la supervivencia de los pacientes con afectación vascular preoperatoria tras la resección portal, llegando incluso a tener una supervivencia igual o superior a los que no presentaban afectación vascular preoperatoria y no se realizó por tanto la resección portal33,56,57. En estos estudios la incidencia de complicaciones hepáticas y vasculares son similares a la del grupo sin resección portal, excepto en los pacientes sometidos a resección arterial, que presentan una morbimortalidad superior al resto. Por todo ello se recomienda la cirugía en los pacientes con afectación portal unilateral o del confluente en las pruebas preoperatorias, realizando una resección en bloque y reconstrucción vascular. No se aconseja la resección arterial y reconstrucción a no ser que la arteria esté claramente afectada, ya que se asocia a peores resultados postoperatorios, siendo preferible en estos casos la hepatectomía derecha.
En resumen, los principios quirúrgicos a seguir serán: cirugías amplias con resección biliar, del caudado y linfadenectomía, con márgenes R0 y sin manipular el tumor, aunque ello comporte la resección y reconstrucción vascular de la vena porta y arteria hepática.
ConclusionesEn la actualidad, el único tratamiento curativo consiste en la resección quirúrgica, siendo la resección amplia con resección en bloque y reconstrucción vascular la técnica que ha conseguido una supervivencia mayor a largo plazo. Para disminuir la morbimortalidad postoperatoria, es recomendable realizar el drenaje biliar para evitar la insuficiencia hepática, la utilización de profilaxis antibiótica tras el drenaje y la embolización portal siempre que el futuro volumen hepático remanente sea inferior al 30%. La resección R0, la afectación ganglionar y las metástasis a distancia siguen siendo los factores pronóstico más importantes.
Conflicto de interesesEsta revisión no ha sido presentada o publicada parcial o totalmente en ninguna revista o congreso.