El 25-35% de los pacientes politraumatizados presentan profundas alteraciones de la coagulación a su llegada al hospital (coagulopatía aguda traumática [CAT]). Los test viscoelásticos (ROTEM®) valoran rápidamente la capacidad hemostática y detectan precozmente la CAT. Los objetivos de este estudio son describir el tromboelastograma inicial de estos enfermos y determinar la prevalencia de CAT según unos perfiles tromboelastográficos predefinidos.
MétodosEstudio unicéntrico, observacional y prospectivo en pacientes politraumatizados. Se realizó analítica, prueba tromboelastográfica (ROTEM®) y se registraron datos prehospitalarios y hospitalarios, transfusiones, intervenciones quirúrgicas/arteriografía iniciales, paradas cardiorrespiratorias y fallecimientos. Los pacientes fueron clasificados en grupos según su ROTEM® inicial: «normal», «hipercoagulabilidad», «hipocoagulabilidad», «hipocoagulabilidad +hiperfibrinólisis» e «hiperfibrinólisis aislada».
ResultadosSe analizaron 123 pacientes. En 32 casos (26%) se objetivó CAT: 15 pacientes presentaron hipocoagulabilidad, 9 hiperfibrinólisis aislada y 8 hipocoagulabilidad +hiperfibrinólisis. El grupo con CAT, respecto al grupo «normal», presentó mayor ISS (23 vs. 16; p<0,01), mayor transfusión de hemoderivados (2,5 vs. 0; p=0,001), más episodios de PCR (19 vs. 1%, p<0,01) y mayor mortalidad (34 vs. 5%, p<0,01). El subgrupo con hipocoagulabilidad +hiperfibrinólisis, respecto a los grupos con hipocoagulabilidad o hiperfibrinólisis aislada, presentó mayor ISS (41 vs. 25 vs. 15, p<0,01), mayor necesidad de arteriografía (62% vs. 13% vs. 0%, p<0,01) y mortalidad superior (75% vs. 33% vs. 0%, p=0,05).
ConclusionesEl 26% de los enfermos politraumatizados presenta coagulopatía precoz evaluada mediante tromboelastografía, asociada a mayor consumo de hemoderivados y menor supervivencia. El perfil combinado de «hipocoagulabilidad +hiperfibrinólisis» se asocia a mayor gravedad y necesidades superiores de hemoderivados y arteriografía.
About 25-35% of polytraumatized patients have a profound alteration of hemostasis on arrival at the hospital (acute traumatic coagulopathy [CAT]). Viscoelastic tests (ROTEM®) measure the hemostatic capacity and provide an early detection of CAT. The objectives of this study are to describe the initial thromboelastogram of these patients and to determine the prevalence of CAT according to predefined thromboelastographic profiles.
MethodsSingle-center, observational, prospective study in polytraumatic patients. Initial blood and thromboelastographic test (ROTEM®) were made, and pre-hospital, hospital, transfusion, initial surgical/angiographic interventions, cardiac arrest and mortality data were collected. ROTEM®-based, patients were classified as: normal, hypercoagulable, hypocoagulable, hipocoagulable +hyperfibrinolytic and isolated hyperfibrinolysis.
ResultsOne hundred and twenty-three patients were analyzed. 32 cases (26%) with CAT: 15 patients with hypocoagulability, 9 with hyperfibrinolysis alone and 8 with hypocoagulability +hyperfibrinolysis. The CAT group, related to the normal group, presented higher ISS (23 vs. 16, P<.01), higher blood products transfusion (2.5 vs. 0; P=.001), more cardiac arrest (19 vs. 1%, P<.01), and higher mortality (34 vs. 5%, P<.01). The subgroup with hypocoagulability/hyperfibrinolysis, related to the groups with hypocoagulability or hyperfibrinolysis alone, presented a higher ISS (41 vs. 25 vs. 15, P<.01), higher angiographic procedures (62% vs. 13% vs. 0%, P<.01) and higher mortality (75% vs. 33% vs. 0%, P=.05).
ConclusionsTwenty-six percent of the polytrauma patients presented early coagulopathy assessed by thromboelastography. It is associated with higher consumption of blood products and lower survival. The presence of hypocoagulability +hyperfibrinolysis is associated with greater severity and a higher requirement of blood products.
La hemorragia traumática representa la principal causa de mortalidad prevenible en los pacientes politraumatizados (PLT)1. Múltiples estudios han objetivado que el 25-35% de los PLT presentan profundas alteraciones de la coagulación a su llegada al centro de admisión2; este fenómeno, intrínsecamente asociado al trauma grave y con decisivo valor pronóstico, ha sido denominado «coagulopatía aguda del paciente traumático» o «coagulopatía aguda traumática» (CAT)3. Se debe considerar esta entidad como un factor independiente —pero con efecto sinérgico— de la alteración de la hemostasia derivada de la hemodilución (fluidoterapia excesiva) y de la conocida «tríada letal» (hipotermia, acidosis metabólica y coagulopatía)3.
Clásicamente, el grado de coagulopatía se monitoriza mediante pruebas de coagulación convencionales basadas en reacciones plasmáticas (plasma-based tests: TP, INR, TTPa) y en la concentración de plaquetas y fibrinógeno. Estos parámetros solo reflejan la cantidad de trombina generada durante la fase inicial de la coagulación, sin aportar información sobre la interacción de las plaquetas con los factores de la coagulación, la formación-estabilidad-lisis de los coágulos, ni evaluar el estado global de hiperfibrinólisis (característico de pacientes PLT graves). Es por ello que, recientemente, las «pruebas viscoelásticas» (TEG® y ROTEM®) han adquirido un creciente papel en la valoración de la capacidad hemostática del paciente PLT y en la detección precoz de CAT4,5. La tromboelastometría rotacional (ROTEM®) y la tromboelastografía convencional (TEG®) proporcionan información cualitativa y cuantitativa del equilibrio global entre formación y destrucción del coágulo, pudiendo discriminar el mecanismo fisiopatológico de la hemorragia grave y guiar de forma más precisa e individualizada la resucitación hemostática del enfermo PLT6,7. Sin embargo, el patrón de tromboelastograma prototípico de los pacientes PLT graves atendidos en los hospitales de referencia españoles no ha sido aún definido.
El objetivo principal de nuestro estudio consiste en describir el tromboelastograma inicial de los pacientes PLT atendidos en nuestro centro y determinar la prevalencia de CAT en base a unos perfiles tromboelastométricos predefinidos de normocoagulación, hipocoagulabilidad y/o hiperfibrinólisis. Como objetivos secundarios, analizamos las diferencias clínicas, analíticas, transfusionales, terapéuticas y pronósticas entre los grupos que presentan un patrón ROTEM® normal vs. coagulopático (CAT). Finalmente, describimos la asociación entre los distintos perfiles tromboelastométricos y la gravedad del trauma (características hemodinámicas, Glasgow e Injury Severity Score [ISS]), las necesidades transfusionales y terapéuticas (cirugía, arteriografía) y la mortalidad.
MétodosEstudio unicéntrico, observacional y prospectivo realizado entre octubre de 2012 y octubre de 2013. El estudio fue aprobado por el Comité Ético de Investigación Clínica del Hospital Universitario de Bellvitge, Barcelona (referencia PR205/12).
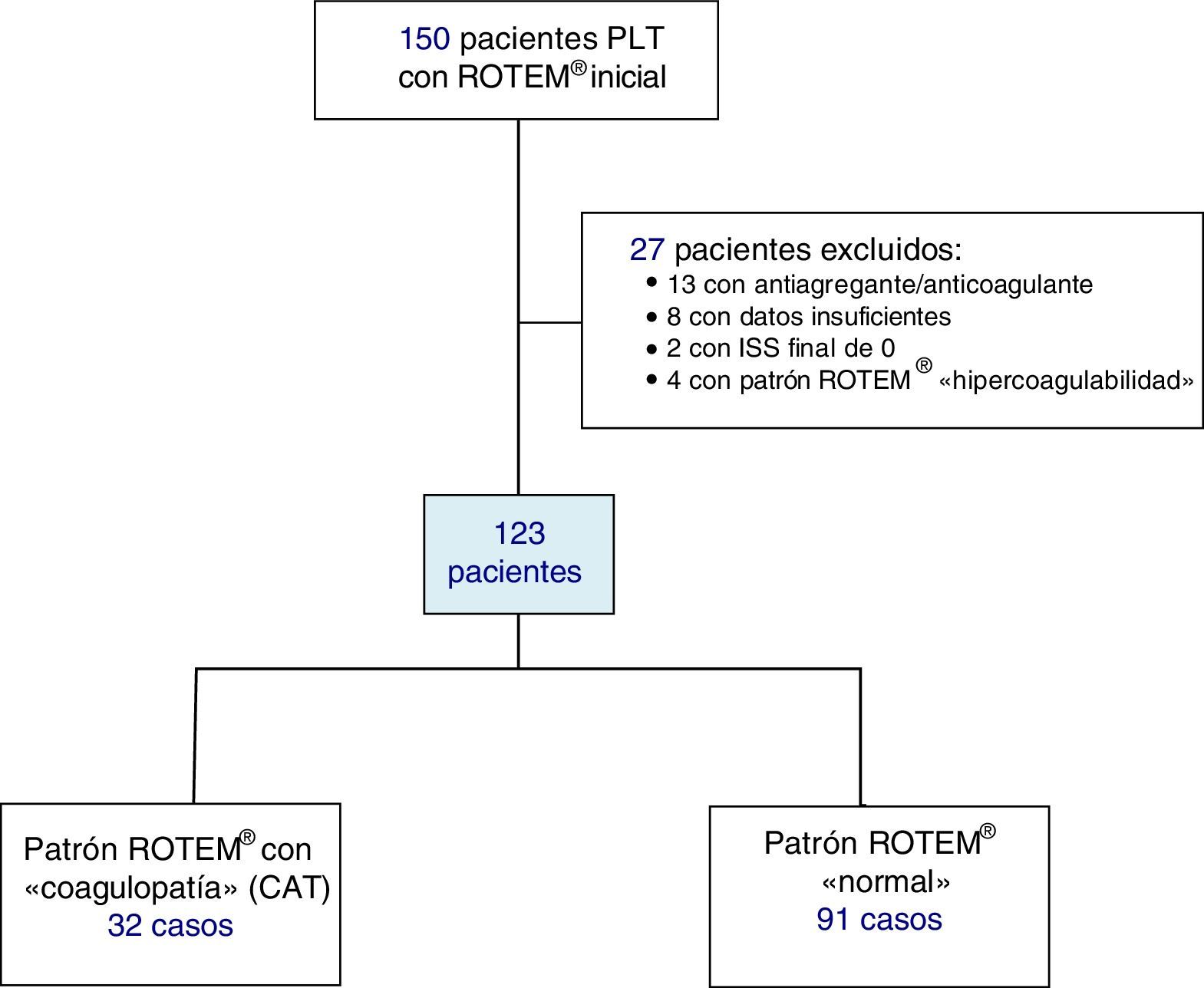
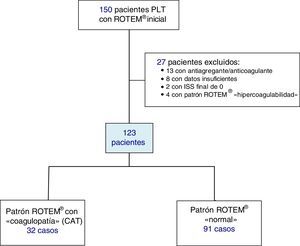
Se incluyeron pacientes PLT atendidos en el box de emergencias tras la activación prehospitalaria del código «paciente politraumatizado» (código PPT) y traslado primario; se excluyó a los enfermos que recibían tratamiento antiagregante y/o anticoagulante, a los pacientes con datos prehospitalarios insuficientes y a aquellos con ISS de 0 (fig. 1).
Todos los pacientes fueron atendidos inicialmente según las directrices habituales de manejo del enfermo PLT (ATLS®).
Se valoró la gravedad de las lesiones mediante una estimación inicial del Injury Severity Score (ISS) para diferenciar los pacientes con traumatismo leve (ISS<15) o grave (ISS≥15).
A todos los pacientes se les realizó una analítica inmediata completa (equilibrio ácido-base, lactato, hemograma, bioquímica y coagulación) y valoración de la coagulación mediante tromboelastometría ROTEM® (test EXTEM: valoración de la vía extrínseca); en función del resultado (A10-EXTEM≤35) y del ISS (ISS≥15), se incluía valoración del fibrinógeno (sub-test FIBTEM).
Inicialmente, a los PLT graves (ISS≥15) se les administró 1g de ácido tranexámico (bolus i.v.) junto con 1g en perfusión continua durante 8h (protocolo CRASH-2)8; a los pacientes menos graves (ISS<15) se les administró únicamente bolo i.v. Se administraron 2g de fibrinógeno i.v. si el valor A10-FIBTEM era ≤7mm (indicativo de un papel insuficiente del fibrinógeno en la formación de coágulos; rango normal: 7-23mm). Si el ROTEM® registraba un efecto plaquetario insuficiente (parámetros A10-FIBTEM >7mm y A10-EXTEM ≤35mm; rango normal: 43-65mm) se administró un pool de plaquetas.
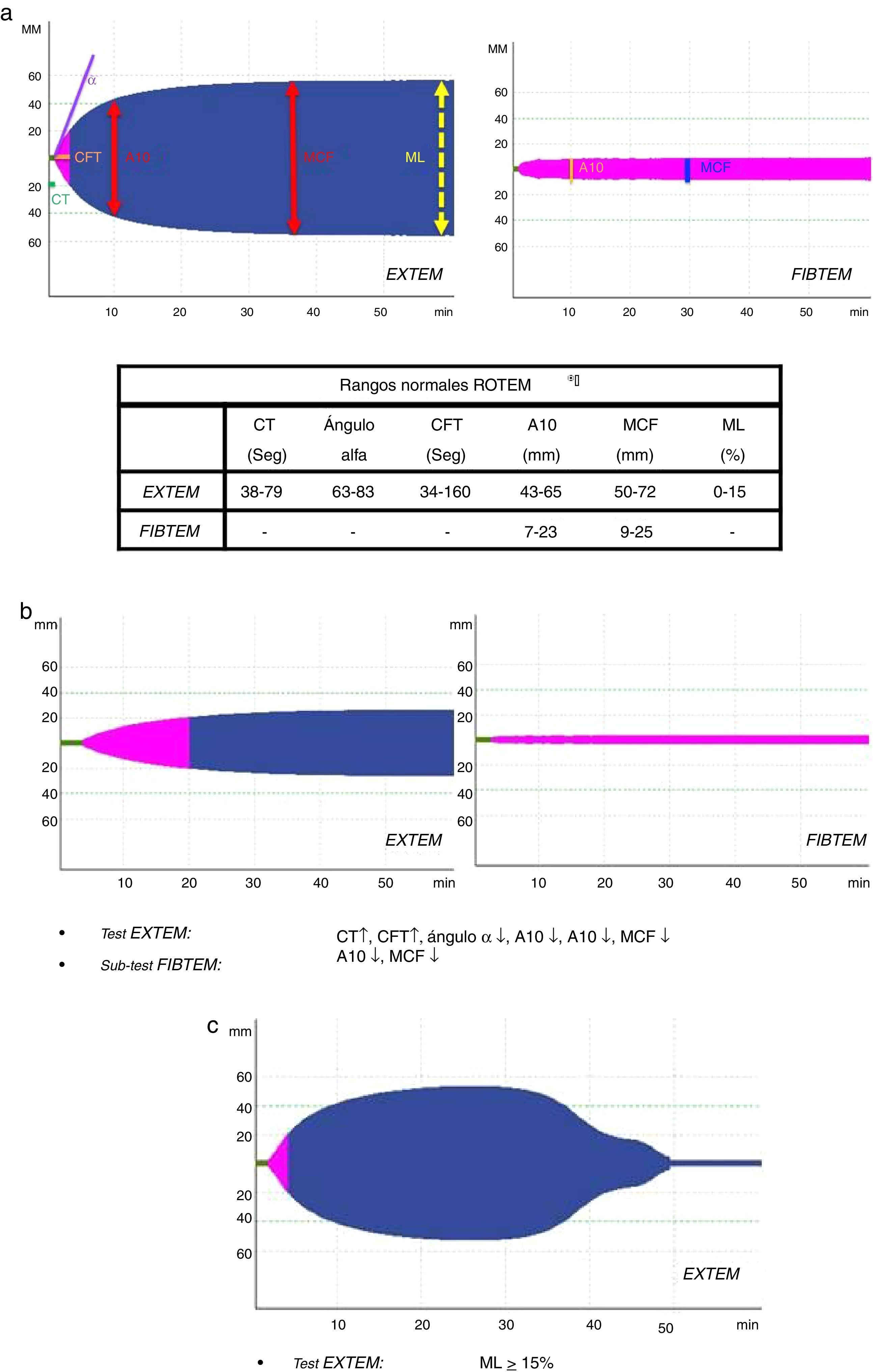
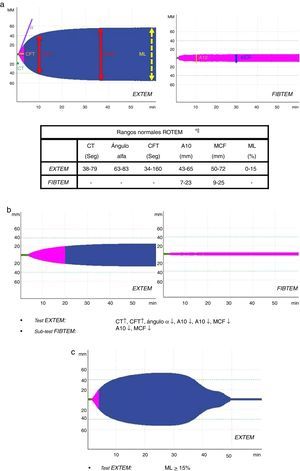
Se recogieron variables demográficas (edad, sexo), puntuación ISS, tipo de traumatismo (cerrado vs. abierto), variables clínicas prehospitalarias y hospitalarias: presión arterial sistólica (PAS), frecuencia cardiaca (FC), frecuencia respiratoria (FR), saturación de oxígeno (SatO2) y puntuación Glasgow (GCS); datos analíticos: hemoglobina, hematocrito, plaquetas, tiempo de tromboplastina parcial activada (TTPa), tiempo de protrombina (TP/INR), fibrinógeno, lactato, pH, exceso de bases; parámetros de los distintos tests ROTEM®: tiempo de coagulación (CT-EXTEM), tiempo de formación del coágulo (CFT-EXTEM), máxima firmeza del coágulo (MCF-EXTEM y MCF-FIBTEM), amplitud del coágulo a los 10min (A10-EXTEM y A10-FIBTEM), «ángulo alfa» (ángulo α-EXTEM) y máxima lisis del coágulo en 1h (ML-EXTEM) (fig. 2a-c).
Esquema de perfiles y parámetros ROTEM®.
a) Patrón y valores ROTEM® «normales» (test EXTEM y sub-test FIBTEM). b) Patrón ROTEM® con «hipocoagulabilidad» (test EXTEM y sub-test FIBTEM). c) Patrón ROTEM® con «hiperfibrinólisis» (test EXTEM). A10: amplitud del coágulo; CFT: tiempo de formación del coágulo; CT: tiempo de coagulación; EXTEM: test de la vía extrínseca; FIBTEM: sub-test del fibrinógeno; MCF: máxima amplitud/firmeza del coágulo; ML: máxima lisis del coágulo.
Según la valoración del tromboelastograma inicial, los pacientes se clasificaron en cinco «perfiles ROTEM®»: «normal», «hipocoagulabilidad», «hipocoagulabilidad e hiperfibrinólisis», «hiperfibrinólisis aislada» e «hipercoagulabilidad». Siguiendo los criterios descritos previamente por Kaufmann et al.9, se definió como ROTEM® con «hipocoagulabilidad» la presencia de dos o más de los siguientes factores: alargamiento de CT o CFT, disminución del «ángulo alfa» o reducción de MCF/A10; se consideró ROTEM® «normal» cuando todos estos parámetros se hallaron dentro del rango de la normalidad; se consideró ROTEM® con «hiperfibrinólisis» si el parámetro ML era ≥15% (valor normal ML-EXTEM <15%); se definió ROTEM® con «hipercoagulabilidad» la presencia de dos o más de los siguientes factores: aumento del «ángulo alfa», disminución de CT o CFT o incremento de MCF/A104.
Se consideró la presencia de CAT en todos los pacientes que presentaron cualquier patrón ROTEM® distinto al definido como «normal» (grupo ROTEM® con «coagulopatía» vs. grupo ROTEM® «normal»).
Se registró la transfusión precoz (≤24h) de concentrados de hematíes, plaquetas, plasma fresco congelado y fibrinógeno; la necesidad de laparotomía, toracotomía, cirugía craneal, cirugía traumatológica de extremidades/pelvis e intervencionismo angiorradiológico en las primeras 24h; los casos que sufrieron una parada cardiorrespiratoria (PCR) y los fallecimientos durante el ingreso.
Los datos fueron analizados mediante el programa estadístico SPSS® 15.0 (SPSS Inc, Chicago, EE.UU.). Las variables categóricas se describieron mediante frecuencia absoluta y porcentaje, y las variables continuas mediante media y desviación estándar (o mediana y rango). Se utilizó el test chi cuadrado o el de Fisher para el análisis de variables categóricas, y la prueba t de Student para variables continuas. Se comprobó la homogeneidad de las variables continuas mediante el test de Kolmogorov, y se aplicó la U de Mann-Whitney si la distribución no era normal. Se aceptó como significación estadística una p<0,05.
ResultadosDurante el estudio se registraron 150 pacientes PLT. Se excluyeron un total de 23 casos: 13 con tratamiento antiagregante/anticoagulante, 8 con datos incompletos y 2 con ISS con valor 0. Los 127 enfermos restantes se categorizaron según su perfil ROTEM® inicial: 91 pacientes con patrón tromboelastométrico «normal», 32 con «hipocoagulabilidad y/o hiperfibrinólisis» (CAT) y 4 con «hipercoagulabilidad». Los enfermos con «hipercoagulabilidad» se excluyeron del análisis por representar una muestra muy pequeña, de forma que la población a estudio quedó definida por 123 pacientes.
En 32 casos (26%) se objetivó alguna forma de CAT según los datos del ROTEM®: en 8 pacientes se registró hipocoagulabilidad asociada a hiperfibrinólisis; en 15 hipocoagulabilidad aislada (sin hiperfibrinólisis) y en 9, hiperfibrinólisis aislada (sin hipocoagulabilidad).
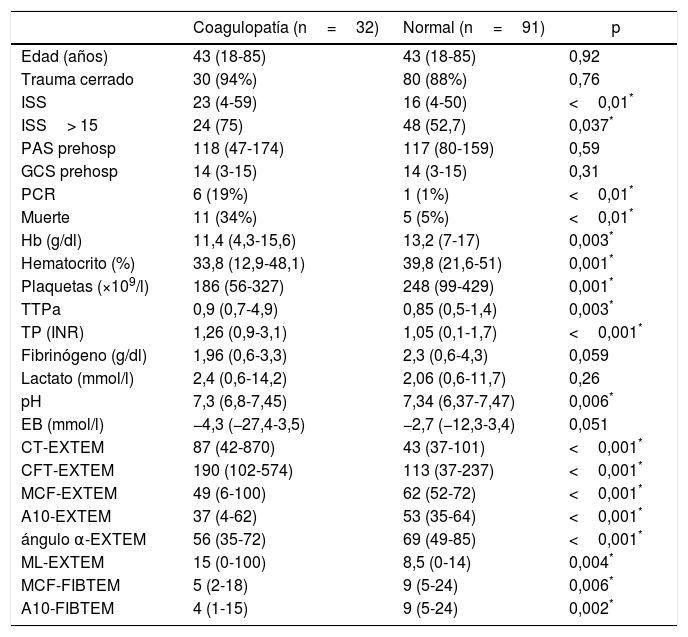
Los dos grupos de pacientes —con y sin alteraciones tromboelastométricas— resultaron comparables en términos de edad, sexo y mecanismo lesional. Se observaron diferencias significativas en relación con la gravedad del traumatismo, con mayor ISS (23 vs. 16) y mayor porcentaje de traumatismos graves (ISS≥15) en el grupo con CAT (75 vs. 52,7%) (tabla 1).
Variables demográficas y clínicas, datos de laboratorio y prueba ROTEM® (test EXTEM y sub-test FIBTEM) en los grupos ROTEM® «con coagulopatía» y ROTEM® «normal»
| Coagulopatía (n=32) | Normal (n=91) | p | |
|---|---|---|---|
| Edad (años) | 43 (18-85) | 43 (18-85) | 0,92 |
| Trauma cerrado | 30 (94%) | 80 (88%) | 0,76 |
| ISS | 23 (4-59) | 16 (4-50) | <0,01* |
| ISS> 15 | 24 (75) | 48 (52,7) | 0,037* |
| PAS prehosp | 118 (47-174) | 117 (80-159) | 0,59 |
| GCS prehosp | 14 (3-15) | 14 (3-15) | 0,31 |
| PCR | 6 (19%) | 1 (1%) | <0,01* |
| Muerte | 11 (34%) | 5 (5%) | <0,01* |
| Hb (g/dl) | 11,4 (4,3-15,6) | 13,2 (7-17) | 0,003* |
| Hematocrito (%) | 33,8 (12,9-48,1) | 39,8 (21,6-51) | 0,001* |
| Plaquetas (×109/l) | 186 (56-327) | 248 (99-429) | 0,001* |
| TTPa | 0,9 (0,7-4,9) | 0,85 (0,5-1,4) | 0,003* |
| TP (INR) | 1,26 (0,9-3,1) | 1,05 (0,1-1,7) | <0,001* |
| Fibrinógeno (g/dl) | 1,96 (0,6-3,3) | 2,3 (0,6-4,3) | 0,059 |
| Lactato (mmol/l) | 2,4 (0,6-14,2) | 2,06 (0,6-11,7) | 0,26 |
| pH | 7,3 (6,8-7,45) | 7,34 (6,37-7,47) | 0,006* |
| EB (mmol/l) | −4,3 (−27,4-3,5) | −2,7 (−12,3-3,4) | 0,051 |
| CT-EXTEM | 87 (42-870) | 43 (37-101) | <0,001* |
| CFT-EXTEM | 190 (102-574) | 113 (37-237) | <0,001* |
| MCF-EXTEM | 49 (6-100) | 62 (52-72) | <0,001* |
| A10-EXTEM | 37 (4-62) | 53 (35-64) | <0,001* |
| ángulo α-EXTEM | 56 (35-72) | 69 (49-85) | <0,001* |
| ML-EXTEM | 15 (0-100) | 8,5 (0-14) | 0,004* |
| MCF-FIBTEM | 5 (2-18) | 9 (5-24) | 0,006* |
| A10-FIBTEM | 4 (1-15) | 9 (5-24) | 0,002* |
A10-EXTEM: amplitud del coágulo a los 10min (mm, rango 43-65); A10-FIBTEM: firmeza del coágulo a los 10min en test FIBTEM (mm, rango 7-23); ángulo α-EXTEM: ángulo alfa (grados, rango 63-83); CFT-EXTEM: tiempo de formación del coágulo (segundos, rango 34-160); CT-EXTEM: tiempo de coagulación (segundos, rango 38-79); EB: exceso de bases; GCS prehosp: puntuación escala Glasgow prehospitalaria; Hb: hemoglobina; ISS: puntuación Injury Severity Score; MCF-EXTEM: máxima firmeza del coágulo (mm, rango 50-72); MCF-FIBTEM: máxima firmeza del coágulo en test FIBTEM (mm, rango 9-25); ML-EXTEM: máxima lisis del coágulo (%, rango 0-15); PAS prehosp: presión arterial sistólica prehospitalaria (mmHg); PCR: parada cardiorrespiratoria; TP: tiempo de protrombina (INR); TTPa: tiempo de tromboplastina parcial activada.
Datos expresados como mediana y rango (o porcentaje) entre paréntesis.
Las pruebas analíticas mostraron diferencias significativas entre ambos grupos. El grupo con coagulopatía registrada por ROTEM® presentaba cifras inferiores de hemoglobina, hematocrito, plaquetas y pH, y valores superiores de TTPa y TP/INR, sin diferencias significativas en las concentraciones de fibrinógeno, lactato o exceso de bases (tabla 1).
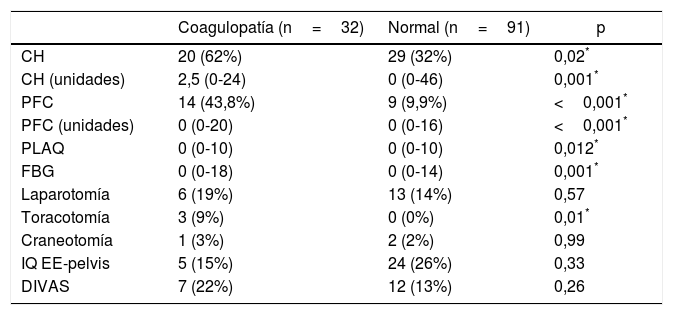
La transfusión de hemoderivados resultó significativamente mayor en el grupo «con coagulopatía», tanto en el porcentaje de pacientes transfundidos como en el número de hemoderivados administrados (tabla 2). En relación con el intervencionismo inicial, solo se observó una mayor necesidad de toracotomía exploradora en el grupo con alteraciones de la coagulación (tabla 2).
Datos de transfusión de hemoderivados e intervencionismo inicial (24h) en los grupos ROTEM® «con coagulopatía» y ROTEM® «normal»
| Coagulopatía (n=32) | Normal (n=91) | p | |
|---|---|---|---|
| CH | 20 (62%) | 29 (32%) | 0,02* |
| CH (unidades) | 2,5 (0-24) | 0 (0-46) | 0,001* |
| PFC | 14 (43,8%) | 9 (9,9%) | <0,001* |
| PFC (unidades) | 0 (0-20) | 0 (0-16) | <0,001* |
| PLAQ | 0 (0-10) | 0 (0-10) | 0,012* |
| FBG | 0 (0-18) | 0 (0-14) | 0,001* |
| Laparotomía | 6 (19%) | 13 (14%) | 0,57 |
| Toracotomía | 3 (9%) | 0 (0%) | 0,01* |
| Craneotomía | 1 (3%) | 2 (2%) | 0,99 |
| IQ EE-pelvis | 5 (15%) | 24 (26%) | 0,33 |
| DIVAS | 7 (22%) | 12 (13%) | 0,26 |
CH: pacientes transfundidos (concentrados de hematíes); CH (unidades): concentrados de hematíes/paciente (solo en enfermos transfundidos); DIVAS: angiografía por sustracción digital; FBG: gramos de fibrinógeno administrados; IQ EE-pelvis: intervención quirúrgica sobre extremidades y/o pelvis; PFC: pacientes transfundidos (plasma fresco congelado); PFC (unidades): unidades de plasma/paciente (solo en enfermos transfundidos); PLAQ: aféresis de plaquetas.
Datos expresados como mediana y rango (o porcentaje) entre paréntesis.
El desarrollo de PCR (19% vs. 1%) y la mortalidad (34% vs. 5%) resultaron significativamente mayores en el grupo con perfil ROTEM® alterado (CAT) (tabla 1).
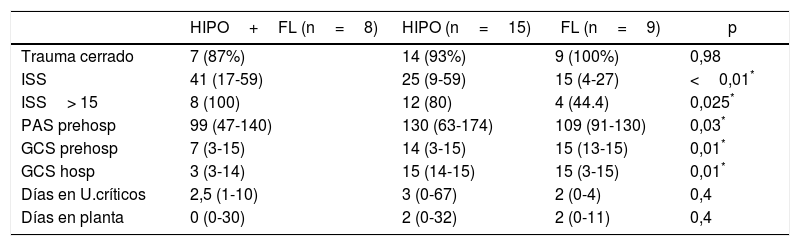
En el grupo «con coagulopatía» (CAT, 32 casos), el análisis por subgrupos mostró que los pacientes con patrón «combinado» de hipocoagulabilidad asociada a hiperfibrinólisis (8 casos) presentaban un ISS más grave que el resto, así como una puntuación Glasgow inferior (prehospitalaria y hospitalaria) (tabla 3). El porcentaje de enfermos con traumatismo grave también resultó significativamente superior en este subgrupo (100% de los casos), comparado con un 80% en el grupo de «hipocoagulabilidad aislada» y un 44% en el de «hiperfibrinólisis». La presión arterial resultó también inferior en este subgrupo, pero solo a nivel prehospitalario. Asimismo, este subgrupo con patrón combinado presentó valores iniciales inferiores de hemoglobina, fibrinógeno y pH, y cifras superiores de TTPa y déficit de bases; registró mayor necesidad de todos los tipos de hemoderivados y de arteriografía precoz que los otros subgrupos de CAT (tabla 4). La estancia mediana en unidades de críticos o en planta convencional no mostró diferencias significativas entre los distintos subgrupos.
Variables demográficas y clínicas entre los diferentes subgrupos con coagulopatía (patrones ROTEM®)
| HIPO+FL (n=8) | HIPO (n=15) | FL (n=9) | p | |
|---|---|---|---|---|
| Trauma cerrado | 7 (87%) | 14 (93%) | 9 (100%) | 0,98 |
| ISS | 41 (17-59) | 25 (9-59) | 15 (4-27) | <0,01* |
| ISS> 15 | 8 (100) | 12 (80) | 4 (44.4) | 0,025* |
| PAS prehosp | 99 (47-140) | 130 (63-174) | 109 (91-130) | 0,03* |
| GCS prehosp | 7 (3-15) | 14 (3-15) | 15 (13-15) | 0,01* |
| GCS hosp | 3 (3-14) | 15 (14-15) | 15 (3-15) | 0,01* |
| Días en U.críticos | 2,5 (1-10) | 3 (0-67) | 2 (0-4) | 0,4 |
| Días en planta | 0 (0-30) | 2 (0-32) | 2 (0-11) | 0,4 |
FL: patrón ROTEM® con hiperfibrinólisis; GCS hosp: puntuación escala Glasgow hospitalaria; GCS prehosp: puntuación escala Glasgow prehospitalaria; HIPO: patrón ROTEM® con hipocoagulabilidad; HIPO+FL: patrón ROTEM® con hipocoagulabilidad e hiperfibrinólisis; ISS: puntuación Injury Severity Score; PAS prehosp: presión arterial sistólica prehospitalaria (mmHg); U.críticos: unidad de críticos.
Datos expresados como mediana y rango (o porcentaje) entre paréntesis.
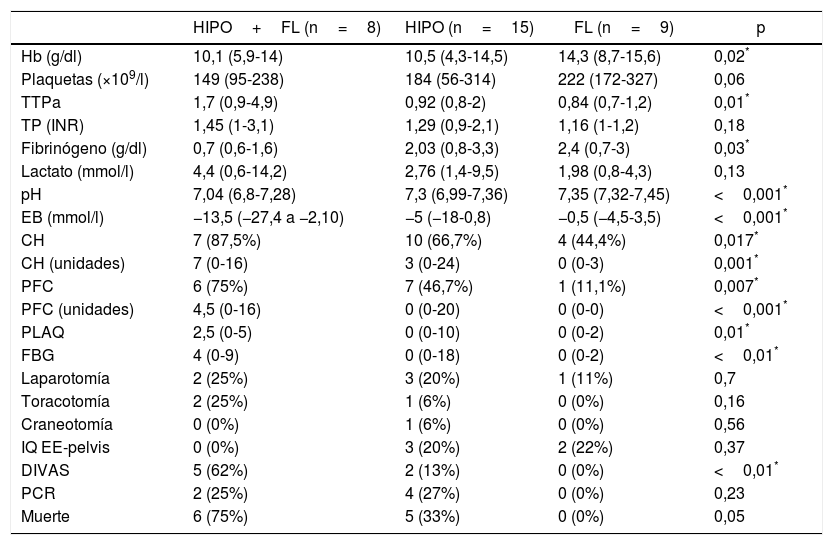
Datos de laboratorio, transfusión de hemoderivados (24h), intervencionismo inicial (24h) y evolución entre los diferentes subgrupos con coagulopatía (patrones ROTEM®)
| HIPO+FL (n=8) | HIPO (n=15) | FL (n=9) | p | |
|---|---|---|---|---|
| Hb (g/dl) | 10,1 (5,9-14) | 10,5 (4,3-14,5) | 14,3 (8,7-15,6) | 0,02* |
| Plaquetas (×109/l) | 149 (95-238) | 184 (56-314) | 222 (172-327) | 0,06 |
| TTPa | 1,7 (0,9-4,9) | 0,92 (0,8-2) | 0,84 (0,7-1,2) | 0,01* |
| TP (INR) | 1,45 (1-3,1) | 1,29 (0,9-2,1) | 1,16 (1-1,2) | 0,18 |
| Fibrinógeno (g/dl) | 0,7 (0,6-1,6) | 2,03 (0,8-3,3) | 2,4 (0,7-3) | 0,03* |
| Lactato (mmol/l) | 4,4 (0,6-14,2) | 2,76 (1,4-9,5) | 1,98 (0,8-4,3) | 0,13 |
| pH | 7,04 (6,8-7,28) | 7,3 (6,99-7,36) | 7,35 (7,32-7,45) | <0,001* |
| EB (mmol/l) | −13,5 (−27,4 a −2,10) | −5 (−18-0,8) | −0,5 (−4,5-3,5) | <0,001* |
| CH | 7 (87,5%) | 10 (66,7%) | 4 (44,4%) | 0,017* |
| CH (unidades) | 7 (0-16) | 3 (0-24) | 0 (0-3) | 0,001* |
| PFC | 6 (75%) | 7 (46,7%) | 1 (11,1%) | 0,007* |
| PFC (unidades) | 4,5 (0-16) | 0 (0-20) | 0 (0-0) | <0,001* |
| PLAQ | 2,5 (0-5) | 0 (0-10) | 0 (0-2) | 0,01* |
| FBG | 4 (0-9) | 0 (0-18) | 0 (0-2) | <0,01* |
| Laparotomía | 2 (25%) | 3 (20%) | 1 (11%) | 0,7 |
| Toracotomía | 2 (25%) | 1 (6%) | 0 (0%) | 0,16 |
| Craneotomía | 0 (0%) | 1 (6%) | 0 (0%) | 0,56 |
| IQ EE-pelvis | 0 (0%) | 3 (20%) | 2 (22%) | 0,37 |
| DIVAS | 5 (62%) | 2 (13%) | 0 (0%) | <0,01* |
| PCR | 2 (25%) | 4 (27%) | 0 (0%) | 0,23 |
| Muerte | 6 (75%) | 5 (33%) | 0 (0%) | 0,05 |
CH: pacientes transfundidos (concentrados de hematíes); CH (unidades): concentrados de hematíes/paciente (solo en enfermos transfundidos); DIVAS: angiografía por sustracción digital; EB: exceso de bases; FBG: gramos de fibrinógeno administrados; FL: patrón ROTEM® con hiperfibrinólisis; Hb: hemoglobina; HIPO: patrón ROTEM® con hipocoagulabilidad; HIPO+FL: patrón ROTEM® con hipocoagulabilidad e hiperfibrinólisis; IQ EE-pelvis: intervención quirúrgica sobre extremidades y pelvis; PCR: parada cardiorrespiratoria; PFC: pacientes transfundidos (plasma fresco congelado); PFC (unidades): unidades de plasma/paciente (solo en enfermos transfundidos); PLAQ: aféresis de plaquetas; TP: tiempo de protrombina (INR); TTPa: tiempo de tromboplastina parcial activada.
Datos expresados como mediana y rango (o porcentaje) entre paréntesis.
Analizando las causas y la distribución temporal de la mortalidad de toda la muestra, de los 5 fallecimientos registrados en el grupo con patrón ROTEM® normal, ninguno ocurrió durante las primeras 24h, mientras que 7 de los 11 fallecimientos en el grupo de pacientes con coagulopatía inicial se produjeron durante las primeras 24h (2 por causa neurológica y 5 por shock hemorrágico). En el análisis por subgrupos con CAT, la mortalidad resultó superior (aunque sin alcanzar significación estadística) en el subgrupo con patrón combinado («hipocoagulabilidad e hiperfibrinólisis») (75%, 6 de los 8 casos), en comparación con el subgrupo con «hipocoagulabilidad aislada» (33%, 5 de los 15 casos) o el de «hiperfibrinólisis aislada» (ningún fallecimiento de los 9 casos) (tabla 4).
DiscusiónEl perfil ROTEM® inicial y la prevalencia de CAT en los pacientes PLT atendidos en nuestros hospitales no han sido aún completamente definidos. El presente trabajo describe distintos patrones tromboelastométricos y estima la prevalencia de CAT —según criterios ROTEM®— en población politraumatizada atendida en un centro de tercer nivel; secundariamente, hemos definido y comparado tres perfiles tromboelastométricos de CAT en virtud a parámetros clínicos, necesidades transfusionales y terapéuticas y supervivencia.
En nuestra serie, el 26% de pacientes PLT presentan coagulopatía identificable por tromboelastometría (ROTEM®) en el momento del ingreso. Este dato coincide con la prevalencia (25-35%) de CAT registrada por otras series desde su descripción original3,6,10. La mortalidad global de la muestra (13%, 16casos) resulta similar a otros registros2,6.
Las pruebas viscoelásticas (tromboelastografía TEG® y tromboelastometría rotacional ROTEM®) valoran la capacidad hemostática del paciente de forma más rápida y completa que los test de coagulación convencionales (TP, INR, TTPa), ofreciendo información dinámica —«en tiempo real» y «a pie de cama»— sobre la interacción plaquetas-factores de coagulación y sobre la formación, estabilidad y lisis del coágulo. Múltiples estudios han confirmado la utilidad de protocolos transfusionales basados en técnicas viscoelásticas (en comparación con los tests de coagulación habituales), y las ventajas obtenidas tras su introducción en cirugía electiva (detección precoz de coagulopatía, reducción de hemoderivados y de reintervenciones por sangrado, aumento de la supervivencia) han impulsado su aplicación en el contexto del paciente PLT, con resultados iniciales prometedores4,10-12. Estas técnicas permitirían efectuar un diagnóstico más preciso de coagulopatía y una corrección «dirigida» según el tipo e intensidad de las alteraciones específicas detectadas, optimizando recursos y hemoderivados; esto posibilitaría una aproximación terapéutica más individualizada (resucitación hemostática), con el potencial incremento de su supervivencia, tal como sugieren algunas guías recientes de manejo del paciente PLT1,5,7,13,14.
En nuestra serie, los pacientes que presentaron un patrón ROTEM® inicial con «coagulopatía» se asociaban a un perfil general de traumatismo más grave, con mayor ISS (ISS 23 vs. 16). Muchos estudios en este campo relacionan el estado de coagulación y/o el desarrollo de CAT con la gravedad del traumatismo. Así, por ejemplo, Johansson et al.4 registran asociaciones entre hipercoagulabilidad y trauma «moderado», hipocoagulabilidad y trauma «grave», e hiperfibrinólisis y trauma «masivo».
El grupo de enfermos con CAT precisó —en comparación con el grupo sin coagulopatía— mayores requerimientos transfusionales, se asoció a un mayor porcentaje de PCR y a una mortalidad significativamente superior (34% vs. 5%). Estos datos coinciden con otros estudios publicados sobre CAT3,10. Respecto a la distribución temporal de la mortalidad, la mayor parte de los fallecimientos en el grupo con coagulopatía se produjeron de forma precoz en las primeras 24h de ingreso (7 de los 11 fallecimientos), en contraposición con el grupo sin coagulopatía (5 muertes, todas ellas transcurridas >24h).
Nuestros resultados confirman la presencia de tres perfiles tromboelastométricos distintos que reflejan un estado precoz de CAT y determinan, en gran medida, el pronóstico: hipocoagulabilidad aislada (15casos), hiperfibrinólisis aislada (9casos) e hipocoagulabilidad asociada a hiperfibrinólisis (8casos)6,9.
Los pacientes con patrón ROTEM® combinado de «hipocoagulabilidad e hiperfibrinólisis» se asociaron a mayor ISS, menor puntuación Glasgow y mayor necesidad de hemoderivados y arteriografía precoz. La mortalidad de este subgrupo resultó, asimismo, superior a la de los otros (aunque sin alcanzar significación estadística). Podemos inferir que el patrón tromboelastométrico combinado de «hipocoagulabilidad e hiperfibrinólisis» representa una expresión de máxima gravedad del traumatismo, señalando a los pacientes en los que puede ser necesaria una corrección sustitutiva masiva de hemoderivados y un empleo superior de recursos (logísticos y terapéuticos).
Cabe destacar que 9 pacientes (7%) presentaron un perfil de hiperfibrinólisis aislada, sin consecuencias respecto a la transfusión de hemoderivados o la mortalidad; nuestros resultados contrastan con los obtenidos por otros grupos, donde la presencia de hiperfibrinólisis se asocia a mayores necesidades transfusionales y peor pronóstico13,15.
Recientemente se ha descrito (mediante pruebas viscoelásticas) un espectro variable de respuestas del sistema fibrinolítico al trauma grave16; en un extremo del espectro se situaría la hiperfibrinólisis, menos prevalente (7-18%) pero más grave (mortalidad 34-70%), e intrínsecamente asociada al shock hemorrágico; en el otro polo se registra una resistencia o inhibición de la fibrinólisis (fibrinolysis shutdown), más frecuente (46-64%), con menor mortalidad asociada (17-23%) y probablemente relacionada con la lesión tisular17,18. En nuestra serie hemos excluido el patrón de hipercoagulabilidad por ser minoritario (3%), aunque otros estudios lo registran como el patrón más frecuente, asociado a traumatismos leves6. Aunque no ha sido considerado en nuestro estudio, la existencia de un perfil fibrinolítico inhibido (shutdown) plantea la posibilidad de una administración «selectiva» de antifibrinolíticos, al tiempo que sugiere una posible relación con el posterior desarrollo de fracaso multiorgánico y/o fenómenos tromboembólicos17,18.
Como limitaciones del estudio podemos citar el reducido tamaño muestral, la falta de uniformidad de criterios en la literatura para definir los diferentes patrones tromboelastográficos, el hecho de no valorar la evolución temporal de la coagulopatía ni realizar determinaciones ROTEM® seriadas y la ausencia de registros sugestivos de hipofibrinólisis.
En conclusión, el 26% de los enfermos PLT presentan coagulopatía precoz evaluada mediante tromboelastografía ROTEM®, asociada a un mayor consumo de hemoderivados y menor supervivencia. El perfil combinado de «hipocoagulabilidad +hiperfibrinólisis» se asocia a mayor gravedad y necesidades superiores de hemoderivados y arteriografía.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.