El adenoma hepático (AH) es un tumor benigno que puede presentar graves complicaciones por lo que, clásicamente, todos eran resecados. Actualmente se ha demostrado que los menores de 3cm, y si no expresan β-catenina, solo se complican excepcionalmente, lo que ha cambiado la estrategia terapéutica.
Material y métodosEstudio retrospectivo en 14 unidades HPB. Criterio de inclusión: pacientes con AH resecado y confirmado histológicamente. Periodo de estudio: 1995-2011.
ResultadosFueron intervenidos 81 pacientes. Edad: 39,5 años (rango: 14-75). Sexo: mujeres (75%). Consumo de estrógenos en mujeres: 33%. Tamaño: 8,8cm (rango: 1-20cm). Solo 6 AH (7,4%) eran menores de 3cm. La mediana de AH fue 1 (rango: 1-12). Nueve pacientes presentaban adenomatosis (> 10 AH). El 51% de los pacientes presentaban síntomas; el más frecuente (77%) era dolor abdominal. Ocho pacientes (10%) comenzaron con abdomen agudo por rotura o hemorragia. El 67% de los diagnósticos preoperatorios fueron correctos. La cirugía fue programada en el 90% de los pacientes. Las técnicas fueron: hepatectomías mayores (22%), menores (77%) y un trasplante hepático. Un 20% fueron realizadas por laparoscopia. La morbilidad fue 28%. No hubo mortalidad. Tres pacientes presentaron malignización (3,7%). El seguimiento fue 43 meses (rango: 1-192). Se detectaron 2 recidivas que fueron resecadas.
DiscusiónLos pacientes con AH resecados son habitualmente mujeres con lesiones grandes, con un consumo de estrógenos inferior al esperado. Su diagnóstico preoperatorio correcto es aceptable (70%). La tasa de hepatectomías mayores es 25% y la de laparoscopia, 20%. Hemos obtenido una baja morbilidad y nula mortalidad.
Hepatic adenomas (HA) are benign tumours which can present serious complications, and as such, in the past all were resected. It has now been shown that those smaller than 3cm not expressing β-catenin only result in complications in exceptional cases and therefore the therapeutic strategy has been changed.
Material and methodRetrospective study in 14 HPB units. Inclusion criteria: patients with resected and histologically confirmed HA. Study period: 1995-2011.
Results81 patients underwent surgery. Age: 39.5 years (range: 14-75). Sex: female (75%). Consumption of oestrogen in women: 33%. Size: 8.8cm (range, 1-20cm). Only 6 HA (7.4%) were smaller than 3cm. The HA median was 1 (range: 1-12). Nine patients had adenomatosis (>10HA). A total of 51% of patients displayed symptoms, the most frequent (77%) being abdominal pain. Eight patients (10%) began with acute abdomen due to rupture and/or haemorrhage. A total of 67% of the preoperative diagnoses were correct. Surgery was scheduled for 90% of patients. The techniques employed were: major hepatectomy (22%), minor hepatectomy (77%) and one liver transplantation. A total of 20% were performed laparoscopically. The morbidity rate was 28%. There were no cases of mortality. Three patients had malignisation (3.7%). The follow-up period was 43 months (range 1-192). Two recurrences were detected and resected.
DiscussionPatients with resected HA are normally women with large lesions and oestrogen consumption was lower than expected. Its correct preoperative diagnosis is acceptable (70%). The major hepatectomy rate is 25% and the laparoscopy rate is 20%. There was a low morbidity rate and no mortality.
El adenoma hepático (AH) es un tumor benigno hepático que puede presentar graves complicaciones (rotura, hemorragia, malignización…). Debido a ello, clásicamente se resecaban casi todos los AH diagnosticados1–6. Ciertas series han demostrado que los AH de menos de 5cm y que no expresan ciertos marcadores (ß-catenina) solo se complican excepcionalmente1,7. Por ello, en la actualidad se postula el tratamiento conservador de ciertos AH1,7. Ante este cambio terapéutico, la sección hepatobiliopancreática (HPB) de la AEC ha planteado un estudio retrospectivo de AH resecados como paso previo a realizar posteriormente un estudio prospectivo del tratamiento actual del adenoma hepático.
Material y métodosEstudio retrospectivo llevado a cabo en 14 unidades de cirugía HPB en el periodo de enero 1995 a diciembre 2011. Los criterios de inclusión fueron pacientes con AH resecado y confirmado histológicamente. No hemos podido determinar cuántos pacientes con AH fueron valorados y no resecados.
Se efectuó una recogida de datos mediante cuestionario que incluía las siguientes variables: edad, sexo, consumo de estrógenos, presencia de enfermedades relacionadas con el AH (glucogenosis, poliposis, tirosinemia...), tamaño y número de AH, síntomas causados por el AH, diagnóstico preoperatorio radiológico y embolización preoperatoria, tipo de intervención (programada o urgente), técnica quirúrgica realizada y tipo de abordaje (laparotómico vs. laparoscópico), morbilidad medida mediante la clasificación de Dindo-Clavien8, estudio histológico y seguimiento para cuantificar recidivas. Se definió adenomatosis como más de 10 AH.
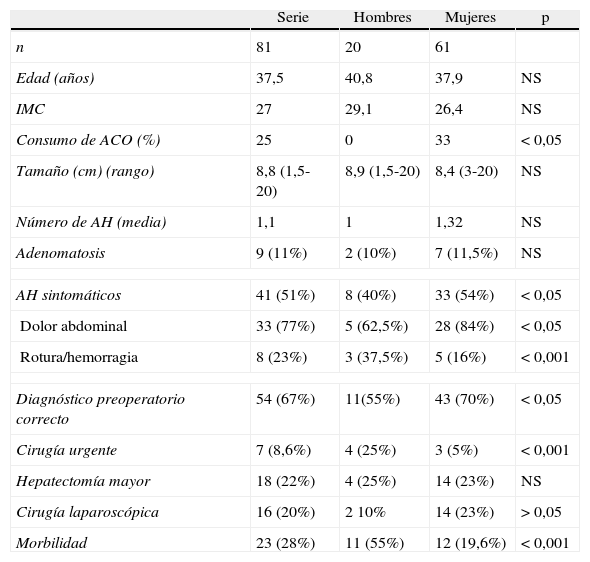
ResultadosFueron intervenidos 81 pacientes con AH (tabla 1). La edad media fue 39,5 años (rango: 14-75). El 75% de los pacientes fueron mujeres. El índice de masa corporal fue: 27kg/m2 (rango: 21-41) Solo un 33% de las mujeres habían consumido anticonceptivos orales (ACO). Ningún paciente reconoció haber consumido andrógenos u otros anabolizantes. Un paciente varón presentaba glucogenosis. El tamaño medio del AH fue 8,8cm (rango: 1-20cm). El diagnóstico radiológico fue efectuado mediante ecografía y tomografía axial (TAC) en el 100% de los casos, y complementado con resonancia magnética (RM) en el 67% de los pacientes. Solo 6 AH (7,4%) eran menores de 3cm. La mediana de nódulos en los pacientes sin adenomatosis fue 1 (rango: 1-6). Nueve pacientes presentaban adenomatosis (>10 AH) (11%): 8 de forma multifocal y uno, masiva9. El 51% de los pacientes presentaban algún síntoma, el más habitual fue el dolor abdominal. El diagnóstico preoperatorio de AH fue correcto en el 67% de los pacientes (n=54). Los diagnósticos incorrectos preoperatorios más frecuentes fueron: hepatocarcinoma (n=5), hiperplasia nodular focal (HNF)(n=4), angiomiolipoma (n=1) y metástasis (n=1). En el resto (n=16) se dudaba entre HNF y AH.
Intervención de 81 pacientes con AH
| Serie | Hombres | Mujeres | p | |
| n | 81 | 20 | 61 | |
| Edad (años) | 37,5 | 40,8 | 37,9 | NS |
| IMC | 27 | 29,1 | 26,4 | NS |
| Consumo de ACO (%) | 25 | 0 | 33 | <0,05 |
| Tamaño (cm) (rango) | 8,8 (1,5-20) | 8,9 (1,5-20) | 8,4 (3-20) | NS |
| Número de AH (media) | 1,1 | 1 | 1,32 | NS |
| Adenomatosis | 9 (11%) | 2 (10%) | 7 (11,5%) | NS |
| AH sintomáticos | 41 (51%) | 8 (40%) | 33 (54%) | <0,05 |
| Dolor abdominal | 33 (77%) | 5 (62,5%) | 28 (84%) | <0,05 |
| Rotura/hemorragia | 8 (23%) | 3 (37,5%) | 5 (16%) | <0,001 |
| Diagnóstico preoperatorio correcto | 54 (67%) | 11(55%) | 43 (70%) | <0,05 |
| Cirugía urgente | 7 (8,6%) | 4 (25%) | 3 (5%) | <0,001 |
| Hepatectomía mayor | 18 (22%) | 4 (25%) | 14 (23%) | NS |
| Cirugía laparoscópica | 16 (20%) | 2 10% | 14 (23%) | >0,05 |
| Morbilidad | 23 (28%) | 11 (55%) | 12 (19,6%) | <0,001 |
ACO: anticonceptivos orales; AH: adenoma hepático; IMC: índice de masa corporal.
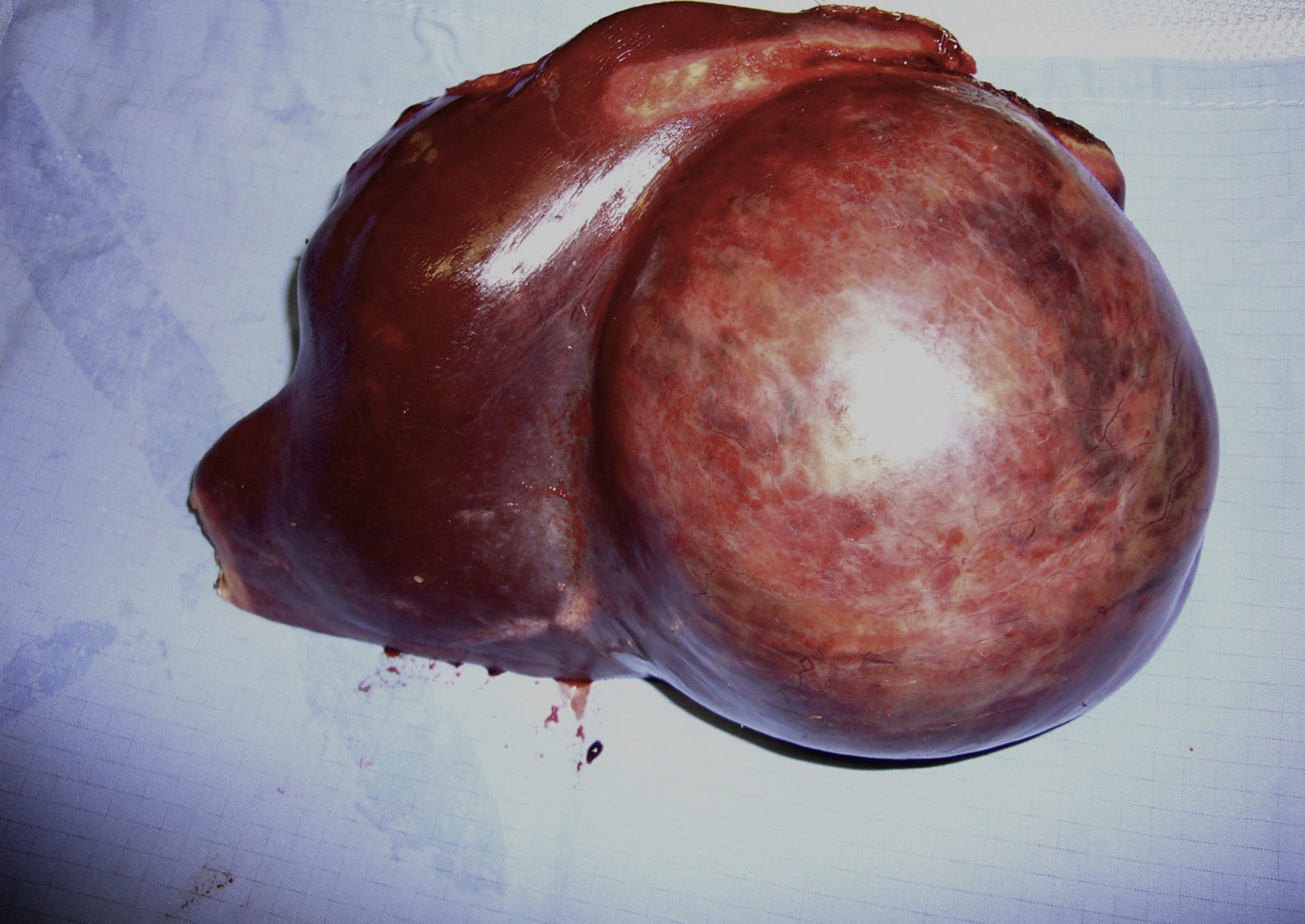
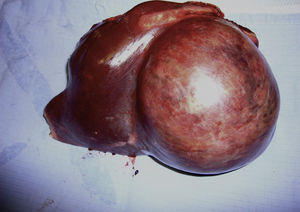
La intervención quirúrgica fue programada en el 90% (73/81). Las 7 intervenciones urgentes fueron realizadas en AH complicados (rotura/hemorragia); el octavo paciente con hemorragia fue embolizado y operado de forma programada. Las técnicas realizadas fueron: hepatectomías mayores (22%), menores (77%) y un trasplante hepático tras resección previa por aparición de nuevas lesiones (hepatectomía derecha). Un 20% de las intervenciones fueron realizadas por abordaje laparoscópico. La morbilidad fue del 28% (n=23). La morbilidad fue dividida según gravedad en 2 grupos: Clavien I-II: 82% (n=19) y mayor Clavien: III-IV: 18% (n=4). No hubo mortalidad. En el estudio histológico, 2 pacientes presentaron malignización del AH a hepatocarcinoma y en otro paciente se apreció la existencia de focos de displasia grave, lo que representa un 3,7% del total de enfermos. De estos pacientes, uno era un varón que presentaba un tumor único de 11cm (fig. 1) y 2 eran mujeres: una con un tumor de 6cm y otra afecta de adenomatosis hepática. El número tan reducido de pacientes con malignización no permite extraer conclusiones estadísticas sobre algún parámetro que se asocie a malignización. La mediana de seguimiento fue 43 meses (rango: 1-192). Se detectaron 2 recidivas que fueron resecadas nuevamente.
Se realizó una comparación de los parámetros estudiados en varones y mujeres (tabla 1). La diferencia fundamental es un mayor número de varones que se presentan con rotura y hemorragia, lo que implica más cirugía urgente, mayor morbilidad y menor índice de cirugía laparoscópica. Las mujeres presentan más frecuentemente dolor abdominal.
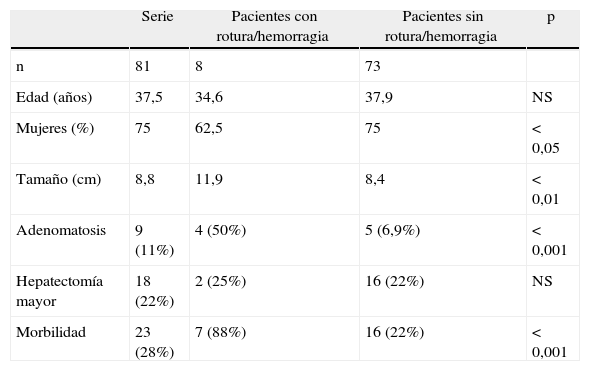
Efectuamos una comparación entre los pacientes que presentaron abdomen agudo (rotura/hemorragia) y los no complicados (tabla 2). El tamaño, la presencia de adenomatosis y la morbilidad postoperatoria fueron superiores en el grupo de pacientes complicados (p<0,05).
Comparación entre los pacientes que comenzaron con abdomen agudo (rotura/hemorragia) y los no complicados
| Serie | Pacientes con rotura/hemorragia | Pacientes sin rotura/hemorragia | p | |
| n | 81 | 8 | 73 | |
| Edad (años) | 37,5 | 34,6 | 37,9 | NS |
| Mujeres (%) | 75 | 62,5 | 75 | <0,05 |
| Tamaño (cm) | 8,8 | 11,9 | 8,4 | <0,01 |
| Adenomatosis | 9 (11%) | 4 (50%) | 5 (6,9%) | <0,001 |
| Hepatectomía mayor | 18 (22%) | 2 (25%) | 16 (22%) | NS |
| Morbilidad | 23 (28%) | 7 (88%) | 16 (22%) | <0,001 |
El AH es un tumor hepático benigno infrecuente, descrito por primera vez por Frerichs en 18611–5,10–14. Suelen aparecer sobre hígado sano, ser únicos, y de tamaño variable1,2,13,15–18. Su incidencia es aproximadamente de 1,3-5 casos por millón de habitantes2,4,6,10,12,19. Ocurren predominantemente, pero no exclusivamente, en mujeres jóvenes (15-45 años) que han recibido tratamiento con ACO1,2,5,10,16,18–20, y solo en un 4,3% en varones que suelen haber consumido anabolizantes1,13,21. Otros factores de riesgo para la aparición de AH en varones son: alcoholismo, tabaquismo e índice de masa corporal elevado19. En nuestro estudio multicéntrico destacan 2 datos epidemiológicos: el alto porcentaje de varones que compone la serie (25%), y el muy bajo consumo de ACO en mujeres (33%). Este dato está probablemente sesgado por la recogida retrospectiva de información, porque la tasa de consumo de ACO en las pacientes europeas con AH suele ser del 85-95%16. Curiosamente ambos datos, tasa alta de varones y bajo consumo de ACO, se han observado en otro estudio realizado sobre los AH en China10.
La etiopatogenia del AH no está totalmente aclarada aunque la relación entre consumo de ACO o esteroides anabolizantes que contengan andrógenos y la formación de AH es evidente, y además es dosis-dependiente1,2,4,5,13,14,21. El AH es más frecuente en pacientes con glucogenosis tipo ia, iiiyvi, los cuales presentan mayor riesgo de malignización de sus AH, tirosinemias, galactosemia, β-talasemias, estetaohepatitis, hemocromatosis, poliposis familiares y anemia de Fanconi por el uso de andrógenos como tratamiento1,5,6,11,13,16,19,22,23. Uno de nuestros pacientes presentaba glucogenosis como enfermedad asociada al AH.
Según el genotipo, los AH se clasifican en: AH con mutaciones en el gen HNF1α, AH con mutaciones del gen β-catenina y sin marcadores16,19,20,23,24. Esta clasificación tiene importancia pronóstica, ya que el grupo de AH con mutación del gen β-catenina tiene mayor riesgo de malignización6,19,20. Debido a su coste económico, los marcadores de genotipo no suelen realizarse rutinariamente en España. Desde el punto de vista histológico, se subdividen en esteatósicos (cuando presentan más del 60% de esteatosis macronodular), inflamatorios o telangiectásicos y no clasificables1. Esta clasificación es importante para tomar decisiones terapéuticas, ya que, por ejemplo, los AH telangiectásicos tienen mayor tendencia a la rotura1.
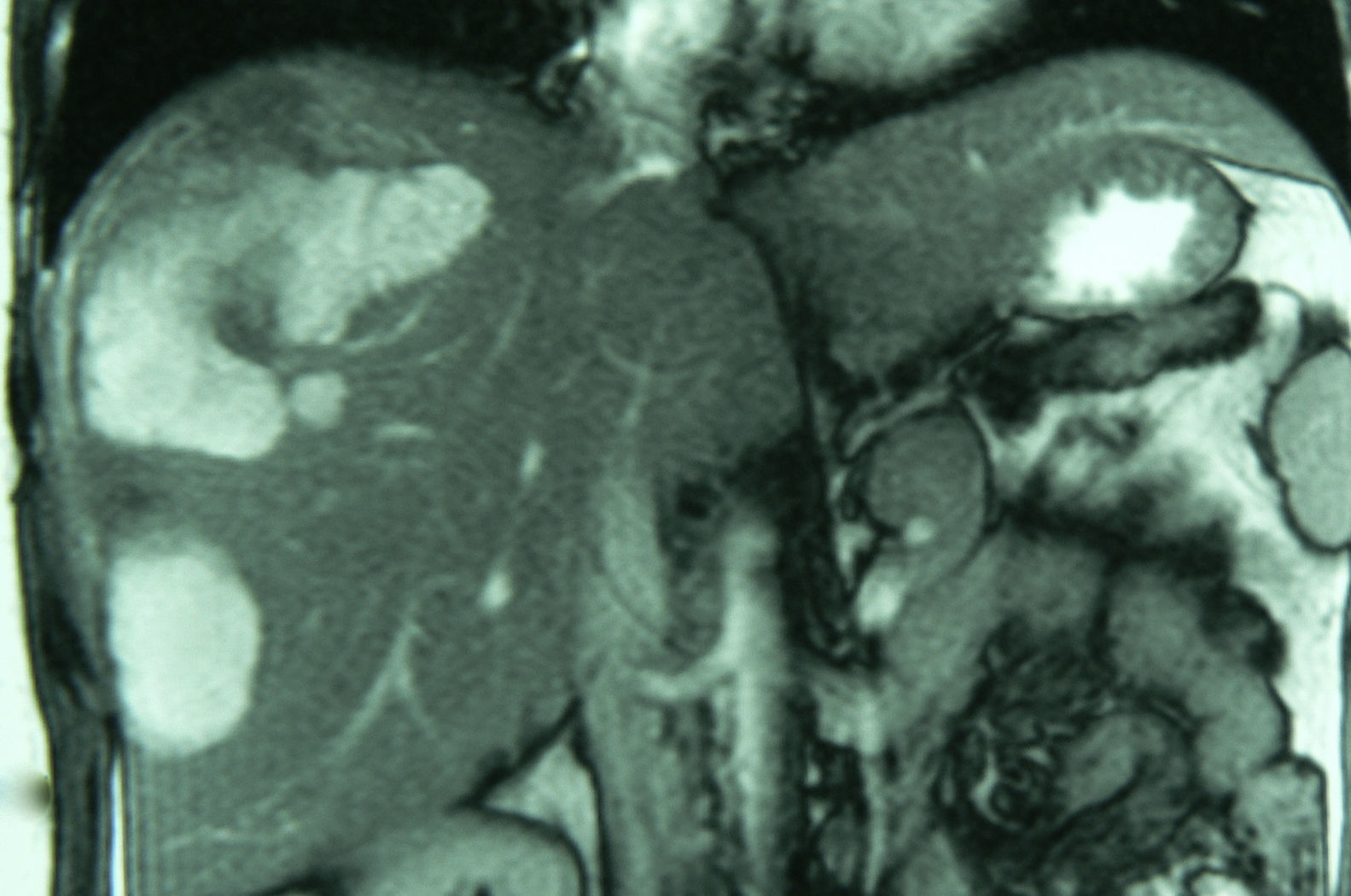
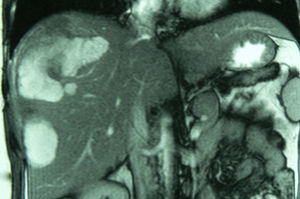
El diagnóstico radiológico del AH no es sencillo10,25. La sensibilidad diagnóstica conjunta de las técnicas radiológicas alcanza el 80%12,17. En nuestra serie, que incluye un largo período de tiempo, es del 54%. Los métodos diagnósticos más empleados son la ecografía tradicional, la eco-doppler y la ecografía con contraste, la TAC multifase y especialmente la RM6,24,26–28 (fig. 2). La RM con contrastes hepato-específicos puede llegar a alcanzar una sensibilidad del 97% y además permite clasificar los AH según los fenotipos (esteatósicos vs. inflamatorios) lo cual tiene implicaciones terapéuticas24,27. La PET-TAC ha sido empleada para diferenciar AH e HNF, obteniendo prometedores resultados en una corta serie6,26,27.
Tras el diagnóstico de un AH, la primera medida es que el paciente debe dejar de tomar ACO o anabolizantes, si se consumían, y realizar medidas dietéticas en los pacientes con glucogenosis, y tras ello se debe efectuar una reevaluación radiológica a los 3-6 meses4,6,7,10,16,28. Se han observado disminuciones de tamaño e incluso desaparición completa de la lesiones2,4–6,16,28. Entonces se debe decidir si el AH debe ser resecado.
La estrategia terapéutica ha cambiado en los últimos años. Clásicamente, casi todos los AH eran resecados por las posibles complicaciones1,5,7, pero actualmente se acepta una estrategia más conservadora, y solo se admite que hay que resecar los AH mayores de 5cm6,11,16,22,29. Este corte se basa en que el riesgo de malignización o hemorragia de los AH de tamaño inferior a 5cm es extremadamente bajo2,13,22,29. Otra indicación admitida de resección es un AH que crezca más de 1cm entre 2 controles sucesivos2,13, y otra, más discutible, es resecar todo AH diagnosticado en varones o en pacientes con glucogenosis por el mayor riesgo de complicaciones16,19,23.
Hay diversas opiniones sobre cómo actuar en los tumores inferiores a 5cm. El debate está especialmente centrado en los que miden entre 3 y 5cm, ya que existe un cierto consenso en que los AH de menos de 3cm deben ser inicialmente observados1,2,13. No hay protocolos establecidos sobre el seguimiento a efectuar en AH no resecados, aunque una revisión anual con RM es el más aceptado4,16. Ciertos autores recomiendan realizar, casi sistemáticamente, punción del AH y realización de marcadores inmunohistoquímicos en el material obtenido. Si es positivo para β-catenina, recomiendan la resección, por el mayor riesgo de transformación maligna. Pero no todos los autores están de acuerdo con este planteamiento, ya que obliga a puncionar todo AH, lo que puede acarrear complicaciones, y los resultados con la β-catenina no son tan fiables1,7,13,16,23.
La cirugía se puede realizar tanto por vía laparatómica como por el cada vez más frecuente abordaje laparoscópico, cuando es factible4,7. El porcentaje de hepatectomías mayores de nuestra serie es similar al de la literatura (25%)10. En la cirugía efectuada de forma programada, la mortalidad no suele sobrepasar el 1% (nula en nuestro estudio) y la morbilidad oscila entre el 5 y el 30% (28% en nuestra serie). Estas cifras se elevan considerablemente en la cirugía urgente29. La tasa de recidiva tras resección en pacientes con tumores únicos es excepcional16.
La complicación más grave a largo plazo de un AH, aunque infrecuente, es su malignización2,13,19,22,25. Los mecanismos exactos de transformación maligna son desconocidos23. Se ha postulado una evolución adenoma-carcinoma por la presencia de carcinoma en el interior del tejido adenomatoso, pero no ha podido ser confirmada. La diferenciación preoperatoria mediante pruebas de imagen de los casos de AH malignizados y no malignizados es muy difícil7. La α-feto-proteína sérica carece de utilidad ya que habitualmente es normal10,22.
La incidencia real de malignización del AH no estaba claramente definida y se cifraba entre el 5 y el 18%1,6,7,22. La revisión sistemática de la literatura efectuada en 2010 por Stoot et al. sobre AH y malignización obtuvo una incidencia de transformación maligna de 4,2% del total de AH estudiados, y un 4,5% de los AH resecados13. Ese porcentaje de malignización es muy similar al de nuestra serie (3,7%). El tamaño medio de los AH malignizados publicados es grande (10,5cm), pero la relación entre el tamaño tumoral y la transformación maligna clásicamente admitida no ha podido confirmarse estadísticamente13,28. El tumor más pequeño malignizado publicado mide únicamente 4cm, pero solo el 4,4% de los AH malignizados miden menos de 5cm1,13.
El punto de mayor interés sería poder definir qué AH tienen un mayor riesgo de malignización para proceder a su exéresis inmediata2,7. Entre los posibles factores se han citado: el consumo de andrógenos o esteroides anabolizantes, el sexo varón, los pacientes con glucogenosis, pacientes con poliposis, la presencia de displasia en la biopsia percutánea, la expresión de altos niveles de β-catenina, los AH no esteatósicos y los mayores de 5cm1,2,6,13,23,24.
La rotura o la hemorragia es otra grave complicación del AH3,4,6. Una revisión sistemática de la literatura efectuada en 2012 fijó la incidencia de hemorragia en 27% y la de rotura intraperitoneal en 17,5%3. Nuestra serie presenta una incidencia del 10%. La ingesta previa de ACO y un tamaño mayor de 7cm se han asociado a la rotura, aunque se ha descrito la rotura de un AH de 1cm2. No se ha observado relación entre el número de AH y la aparición de esta complicación3. En nuestro estudio, los pacientes con rotura y hemorragia presentaron tumores más grandes (8,4 vs. 11,9cm) y mayor porcentaje de adenomatosis (44 vs. 7%). La rotura es más frecuente en los AH inflamatorios o telangiectásicos.
Cuando un AH se rompe, es una situación grave que requiere una actuación urgente. El paciente habitualmente (70% de los casos) desconoce que tiene un AH, y sufre bruscamente dolor abdominal e inestabilidad hemodinámica4,6. Tras la estabilización inicial, la embolización transarterial del AH se ha mostrado como una arma terapéutica muy útil, ya que evita una cirugía urgente que presenta una morbilidad muy incrementada, 81% en nuestra serie, y la embolización puede incluso en ciertos casos (tumores pequeños, pacientes con comorbilidades...) hacer innecesaria la resección4,5,25,28,29. Pero el gran inconveniente es que la embolización no siempre está disponible o, en algunos pocos casos, es ineficaz. En esos casos, la cirugía urgente laparatómica es el tratamiento de elección, que incluye la resección o el packing y exéresis en un segundo tiempo7,25,28,29. De nuestros 8 casos que comenzaron con hemorragia o rotura, 7 fueron intervenidos, y solo uno se embolizó y operó de forma programada. Creemos que esto se debe a una combinación de hechos: baja disponibilidad de embolización urgente en los centros españoles y que, en los casos más antiguos, aún no se contempló.
La adenomatosis hepática es una entidad de etiología desconocida muy infrecuente: el número de casos publicados no llega al centenar. Fue descrita por Flejou en 1985 y definida como la presencia de más de 10 adenomas en un parénquima hepático sano; es más frecuente en mujeres3–6,12,16–18,30. Se ha postulado que alteraciones del metabolismo de la glucosa, obesidad, mutaciones del HNF1-α y la esteatohepatitis pueden ser factores etiológicos4,5,18. Existen 2 formas: la multifocal y la masiva6,9. Ocho de nuestros pacientes presentaban la forma multifocal y uno la masiva. La aparición de complicaciones (sangrado, malignización...) o síntomas (dolor abdominal) en la adenomatosis parece ser más frecuente que en los adenomas únicos5,6,16–18,30. Su tratamiento es controvertido, aunque en la actualidad, cada vez se es más conservador en los pacientes con adenomatosis18: se oscila entre la observación y el trasplante hepático, aunque la resección de las lesiones mayores de 5cm, sobre todo si la β-catenina es positiva, y la observación del resto de las lesiones es la más empleada actualmente ya que la eliminación completa de todas las lesiones es difícil por la frecuente afectación bilobar6,12,17,18,30. Nuestra serie incluye 9 pacientes con adenomatosis que fueron tratados mediante resección de las lesiones predominantes. Uno de los pacientes primero fue tratado con una hepatectomía mayor y luego fue trasplantado. El trasplante hepático, hoy en día, prácticamente no se utiliza en esta entidad1.
La ablación por radiofrecuencia y la embolización transarterial son nuevas estrategias terapéuticas empleadas pero aún no validadas en el tratamiento del AH1,4,6,10,13,21,31. Las indicaciones más admitidas para esta técnica son lesiones centrales o múltiples que requieren complejas hepatectomías, hígados esteatósicos, pacientes no aptos para cirugía o mujeres que quieren quedarse embarazadas6,31. La ablación por radiofrecuencia es especialmente útil en lesiones de menos de 4cm que inicialmente no deben ser tratadas, solo observadas6,31.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.