El uso de la fluorescencia en cirugía se ha ampliado y difundido en los últimos años, lo que ha constituido un auténtico fenómeno tecnológico ligado a la aparición de dispositivos adaptados a su utilización en los abordajes laparoscópicos y robóticos. La cirugía guiada por fluorescencia en el campo de la cirugía endocrina está igualmente en auge. Cada vez son más los artículos que describen su uso en la cirugía de las glándulas tiroides, paratiroides y suprarrenal, aunque con series aun modestas y con protocolos diversos no estandarizados. Existen actualmente diversas áreas de desarrollo de la aplicación de la fluorescencia en cirugía endocrina. Cabe destacar el uso de la fluorescencia con verde de indocianina en cirugía suprarrenal, la identificación y predicción de la perfusión paratiroidea con verde de indocianina, y la autofluorescencia de las glándulas paratiroides. El objetivo de este artículo es revisar las actuales aplicaciones de la fluorescencia en cirugía endocrina.
The use of fluorescence in surgery has expanded and become widespread in recent years, which has led to a real technological phenomenon with the emergence of devices adapted for use in laparoscopic and robotic approaches. Fluorescence-guided surgery in the field of endocrine surgery is also on the rise. More and more articles describe its use in surgery of the thyroid, parathyroid and adrenal glands, although the series are still modest in size and protocols have not been standardized. There are currently several developing areas for the application of fluorescence in endocrine surgery, including the use of fluorescence with indocyanine green in adrenal gland surgery, the identification and prediction of parathyroid perfusion with indocyanine green, and autofluorescence of the parathyroid glands. The objective of this article is to review the current applications of fluorescence in endocrine surgery.
La fluorescencia es la propiedad óptica de aquellos materiales que presentan luminiscencia a la excitación por radiaciones de determinado espectro electromagnético. La aplicación de la fluorescencia en cirugía permite visualizar estructuras invisibles a simple vista, evaluar procesos metabólicos o la perfusión de un tejido, tras la administración de un fluoróforo, usando luz del espectro adecuado y cámaras con filtros espectrales determinados, sin requerir un gran aumento en el tiempo quirúrgico ni grandes aparatajes.
La sustancia cuyo estudio presenta mayor difusión en cirugía guiada por fluorescencia es el verde de indocianina (ICG, del inglés «indocyanine green»). Es un trazador hidrosoluble estéril de 775 daltons desarrollado por Kodak en 1955 y aprobado para uso clínico por la FDA desde 1959. Es capaz de excitarse al absorber la luz del espectro infrarrojo cercano (NIR, del inglés «near-infrared light») y emitir fluorescencia en torno a los 820nm de longitud de onda. Tras su inyección intravenosa, viaja unido a proteínas plasmáticas, es rápidamente depurado por el hígado sin metabolizarse y sin apenas absorción tisular, y es eliminado por vía biliar en aproximadamente 8min, según vascularización y función hepáticas. Si se inyecta fuera del torrente sanguíneo, es drenado vía linfática unido igualmente a proteínas. Su dosis tóxica es de>5mg/kg, mucho mayor a las dosis utilizadas. Los efectos adversos son escasos (1,5/1.000 pacientes) y están relacionados con reacciones de hipersensibilidad. Su uso está contraindicado en pacientes alérgicos al yodo por presentar yoduro de sodio en su composición.
El ICG ha sido usado en medicina desde mediados del siglo pasado para medir el gasto cardíaco, estudiar los vasos retinianos o medir la reserva funcional hepática. Su uso en cirugía se ha ampliado y difundido en los últimos años, lo que ha constituido un auténtico fenómeno tecnológico ligado a la aparición de dispositivos adaptados a su utilización en los abordajes laparoscópicos y robóticos1–4.
La cirugía endocrina guiada por fluorescencia está igualmente en auge. Cada vez hay más artículos que describen su uso en cirugía de las glándulas tiroides, paratiroides y suprarrenal, aunque con series aún modestas y con protocolos diversos no estandarizados.
El objetivo de este artículo es revisar y describir las actuales aplicaciones de la fluorescencia en cirugía endocrina.
Material y métodosSe ha realizado una revisión sistemática mediante el buscador PubMed de todos los artículos publicados que contienen las palabras clave «fluorescence», «indocyanine green», «near-infrared» o «autofluorescence», además de alguna de las siguientes: «adrenalectomy», «adrenal», «parathyroid» o «thyroidectomy». Al tratarse de técnicas novedosas con aún escaso nivel de evidencia, se han valorado todos los artículos encontrados, y comentado aquellos que aportan mayor evidencia científica o más novedosos avances.
ResultadosUso del verde de indocianina en la cirugía de la glándula suprarrenalDesde que Gagner et al.5 describieron la primera adrenalectomía laparoscópica en 1992, dicha técnica se ha convertido en el abordaje estándar y múltiples publicaciones lo avalan6.
La cirugía de glándula suprarrenal guiada por ICG fue descrita en 2013 por Manny et al.7 con una serie de 3 casos en los que se realizó resección parcial de la glándula mediante abordaje robótico y el dispositivo Firefly® (Intuitive Surgical, Inc., Sunnyvale, CA, EE. UU.) tras la administración de 2,5mg de ICG intravenosos. Describieron una menor fluorescencia en las masas adrenales respecto al tejido glandular sano, probablemente por una diferente expresión de la enzima biliotranslocasa. El análisis anatomopatológico demostró unos márgenes de resección libres de enfermedad (un feocromocitoma, un lipoadenoma y una hiperplasia folicular linfoide). Concluyeron que se trata de una técnica factible y segura y que la fluorescencia con ICG podría ser útil para asegurar los márgenes de resección en suprarrenalectomías parciales.
El primer artículo sobre suprarrenalectomía-ICG en modelo animal lo presentaron Dip et al.8 en 2014. Describieron la perfecta delimitación del contorno de la glándula suprarrenal en 5 cerdos tras la administración de ICG a dosis de 0,5mg/kg usando el dispositivo laparoscópico de Karl Storz® (Karl Storz Endoskope, Tuttlingen, Alemania). Las glándulas suprarrenales se mostraron claramente más hiperfluorescentes que el tejido graso circundante, mejorando la diferenciación entre ambas estructuras respecto a la visión bajo luz blanca, con diferencias estadísticamente significativas.
En 2015, Sound et al.9 del grupo del Dr. Berber de la Cleveland Clinic, Ohio, describieron el uso de ICG en una serie con 10 suprarrenalectomías totales usando el dispositivo Firefly® para abordaje robótico. Se registró la dosis de ICG infundida y la medición de la fluorescencia a diferentes tiempos desde la infusión. Se determinó que la distinción entre la fluorescencia glandular y la del tejido graso periglandular aparece en el primer minuto tras la infusión de ICG, es máxima a los 5min, y aun perdura a los 20min tras la misma.
DeLong et al.10 aplicaron esta técnica al abordaje laparoscópico convencional, también en 2015 en una serie de 4 adrenalectomías guiadas por ICG con el dispositivo Pinpoint® (Novadaq Technologies, Inc., Mississauga, ON, Canadá). Describieron la técnica como factible y segura, y definieron la secuencia de visualización de la fluorescencia. Las arterias suprarrenales son las que primero emiten fluorescencia, seguidas del parénquima adrenal, y finalmente, de la vena suprarrenal. Así pues, la visualización de la vascularización mediante fluorescencia podría mejorar el control de la misma en las maniobras previas a la suprarrenalectomía, de especial interés para evitar crisis noradrenérgicas en el abordaje del feocromocitoma o para ayudar a evitar hemorragias intraoperatorias.
El mayor estudio publicado hasta la fecha sobre el uso de fluorescencia con ICG en cirugía suprarrenal lo presentó el grupo del Dr. Berber. En él, Colvin et al.11 presentan una serie de 43 adrenalectomías por abordaje robótico transabdominal lateral o retroperitoneal. Tras la administración de una media de 3 inyecciones de 5mg de ICG por paciente, compararon la fluorescencia glandular con el tejido graso circundante, estratificando por tipo de tumoración. Evidenciaron mayor utilidad de la técnica en las tumoraciones corticales, que se mostraban hiperfluorescentes, en comparación con las de origen medular como el feocromocitoma, hipofluorescentes respecto al resto de la glándula, probablemente por déficit de expresión de la enzima biliotranslocasa. Este hallazgo pudiera tener especial interés ante dobles adrenalectomías con preservación cortical en feocromocitomas bilaterales.
Uso del verde de indocianina para la identificación de las glándulas paratiroidesMúltiples estrategias se han estudiado para mejorar la identificación de las glándulas paratiroides. En 1971 Dudley12 describió el uso del azul de metileno aunque la aparición de encefalopatía tóxica en ciertos pacientes hizo disminuir su uso13. De igual forma, el ácido aminolevulínico también ha sido usado, pero la necesidad de fotosensibilizar al paciente previamente y de protegerlo de la luz durante 48h tras la cirugía también ha limitado su uso14. Las técnicas de imagen para visualizar las paratiroides, como la ecografía y la gammagrafía intraoperatorias, son objeto de múltiples estudios que han descrito sensibilidades del 70-85% para cada técnica15.
En este contexto, en 2014 Suh et al.16 presentaron un estudio en modelo canino en el que midieron de forma objetiva y postoperatoria la intensidad de fluorescencia emitida por las glándulas paratiroides en 3 perros a diferentes dosis crecientes de ICG intravenoso, y que fueron claramente mayores comparadas con las emitidas por las glándulas tiroides.
En 2015, de nuevo Sound et al.17, de la Cleveland Clinic de Ohio, describieron por primera vez el uso de la fluorescencia con ICG para la identificación de las glándulas paratiroides en humanos, usando el dispositivo Pinpoint®. Presentaron una serie de 3 pacientes sometidos a reintervención quirúrgica por hiperparatiroidismo primario persistente. Describieron detalladamente la técnica y la dosis ideal de ICG a administrar (5mg) y evidenciaron una clara hiperfluorescencia de las paratiroides desde los 2 a los 20min postinfusión, lo que facilitó su identificación. Definieron la técnica como fácil, rápida, reproducible y segura.
El mismo grupo presentó en 2016 un estudio con 33 pacientes intervenidos por hiperparatiroidismo primario en los que se identificaron 112 glándulas paratiroides15. De estas, el 93% (104) presentaron hiperfluorescencia tras la administración de 5mg de ICG. La emisión de fluorescencia aparecía a los 30-60seg de la infusión y duraba hasta 20min. Por primera vez, describieron una graduación subjetiva de la fluorescencia basada en la medición postoperatoria del área de la glándula que se mostraba hiperfluorescente según la escala siguiente: 0 (no captación), 1 (<30% del volumen de la glándula), 2 (30-70%) y 3 (>70%). De entre múltiples variables analizadas, la edad<60 años, los niveles de calcio sérico preoperatorio>11mg/dl y el diámetro máximo de la glándula paratiroides>10mm, se correlacionaron con mayores puntuaciones en la escala de hiperfluorescencia paratiroidea.
En 2016, Vidal Fortuny et al.,18 en Ginebra, Suiza, infundieron ICG en pacientes programados para paratiroidectomía subtotal una vez colocados clips quirúrgicos que dividían en 2 zonas diferenciadas cada una de las 4 glándulas paratiroides localizadas. De esta manera, conservaban la media glándula paratiroides que más fluorescencia emitía, resecando las 3 glándulas y media restantes. Así, intentaban garantizar la perfusión del remanente glandular para poder evitar el hipoparatiroidismo postoperatorio. La misma hipótesis y metodología fueron usadas por el mismo grupo poco después19 y también con el dispositivo Pinpoint®, en el que 13 pacientes fueron sometidos a paratiroidectomía subtotal. Según los autores, sus resultados mostraron que un remanente glandular bien vascularizado pudiera evitar el hipoparatiroidismo persistente. Estos fueron los primeros estudios que hallaron una correlación entre la perfusión o fluorescencia de las glándulas paratiroides y su posterior función, sin basarse simplemente en la identificación de las glándulas, lo que ha constituido un cambio sustancial para estudios posteriores.
Con esta nueva hipótesis de trabajo, el mismo año, Vidal Fortuny et al.20 publicaron una serie de 36 pacientes sometidos a tiroidectomía total con medición de fluorescencia paratiroidea mediante el dispositivo Pinpoint®. Para ello, crearon una escala de medición subjetiva que clasifica a cada glándula con los valores 2 (hiperfluorescencia, glándula bien vascularizada), 1 (paratiroides levemente fluorescente o de forma heterogénea, glándula parcialmente vascularizada) o 0 (paratiroides no fluorescente, no vascularizada). Todos los pacientes fueron tratados con calcio oral y vitamina D en el postoperatorio, según protocolo del centro. Treinta pacientes tuvieron al menos una glándula paratiroides con una puntuación de 2 (bien vascularizada) y ninguno de ellos presentó hipoparatiroidismo postoperatorio. Dos de los 6 pacientes sin ninguna glándula con puntuación de 2 en la escala de fluorescencia presentaron hipoparatiroidismo transitorio. Los autores mostraron la existencia de una excelente correlación perfusión-función paratiroidea de manera que una sola glándula bien vascularizada podría evitar el hipoparatiroidismo posquirúrgico.
De manera similar, Zaidi et al.21, de nuevo de la Cleveland Clinic, usaron la escala de fluorescencia de las paratiroides descrita anteriormente por su grupo15 en la que también contemplaban el tamaño del área hiperfluorescente medida de forma postoperatoria. Así contemplaban las 4 posibilidades descritas: 0 (paratiroides no fluorescente), 1 (<30% del volumen de la glándula es hiperfluorescente), 2 (30-70%) y 3 (>70%). Usando el mismo dispositivo Pinpoint® se realizaron 27 tiroidectomías totales con visualización de 85 paratiroides. Se encontraron diferencias aunque no estadísticamente significativas en los valores de PTH postoperatorios en aquellos pacientes con menos de 2 glándulas puntuadas con el valor 1 según la escala descrita.
El abordaje robótico axilomamario bilateral con fluorescencia ICG mediante el dispositivo Firefly® fue descrito en 2016. Yu et al.22 compararon una serie de 22 pacientes intervenidos con esta técnica con un grupo control de 44 pacientes operados sin fluorescencia, usando técnicas estadísticas de pareamiento por puntaje de propensión («propensity score matching»). Los autores describieron una menor tasa de paratiroidectomías incidenteles en el grupo ICG aunque no encontraron diferencias significativas en la tasa de hipoparatiroidismo postoperatorio.
En 2017, Lang et al.23 presentaron el primer estudio descrito con valoración objetiva e intraoperatoria de la intensidad de fluorescencia en cirugía de tiroides. Describieron una serie de 70 pacientes intervenidos de tiroidectomía total con identificación de las 4 glándulas paratiroides mediante el dispositivo SPY® Fluorescent Imaging System (Novadaq Technologies, Inc., Mississauga, ON, Canadá). En cada paciente se objetivó la intensidad de fluorescencia traqueal, otorgándole un valor del 100%, y sobre el cual se valoró la fluorescencia relativa de cada paratiroides. Una intensidad de fluorescencia glandular>150% para al menos una glándula paratiroides se definió como el mejor valor predictor con una tasa de hipocalcemia postoperatoria del 0%, frente al 81,8% en los pacientes con intensidad de fluorescencia glandular≤150%.
De nuevo, el grupo de Vidal Fortuny et al.24 han publicado en 2018 el artículo más reciente sobre fluorescencia paratiroidea con ICG. Comparan la tasa de hipoparatiroidismo postoperatorio en 196 pacientes sometidos a tiroidectomía total distribuidos en 3 grupos. Ciento cuarenta y seis pacientes presentaron al menos una glándula paratiroides con índice de fluorescencia de 2 según la escala descrita por el mismo autor ya comentada20. Este grupo se aleatorizó en 2 subgrupos de 73 pacientes cada uno. En uno de ellos, se administró la dosis de calcio y vitamina D postoperatorios estandarizada según el protocolo del centro y se midieron los niveles séricos de calcio y PTH el día+1 postoperatorio (grupo control). En el otro subgrupo, no se realizó ningún control analítico ni se administró tratamiento preventivo postoperatorio (grupo intervención). Los 50 pacientes restantes no aleatorizados presentaron un índice de fluorescencia<2 en todas sus paratiroides y recibieron tratamiento para prevenir hipocalcemia (grupo no aleatorizado). Los resultados demostraron una no inferioridad del grupo intervención en cuanto a hipocalcemias respecto al grupo control (p=0,012), mientras que el grupo no aleatorizado presentó una mayor tasa de hipoparatiroidismo postoperatorio respecto al grupo aleatorizado (p=0,007). El estudio concluye que la fluorescencia con ICG predice la vascularización y función paratiroidea postoperatoria y que la presencia de al menos una glándula bien vascularizada evita la necesidad de controles analíticos de PTH y calcio postoperatorios, y de tratamiento preventivo protocolizado con calcio y vitamina D.
Uso de la autofluorescencia en la identificación de las glándulas paratiroidesEn 2011 Paras et al.25 describieron la autofluorescencia que presentan las glándulas paratiroides cuando son iluminadas con luz del NIR, con una emisión en torno a los 820nm, y claramente superior a la que presenta el tiroides. Aunque la naturaleza del fluoróforo endógeno es desconocida, los receptores de calcio o de vitamina D se han postulado como posibles responsables.
El mismo grupo realizó en 2015 un estudio con 264 glándulas paratiroides de 137 pacientes en las que se midió la autofluorescencia26. Cerca del 100% de las glándulas fueron identificadas en cada paciente con esta técnica, independientemente de la enfermedad tiroidea o paratiroidea que motivó la cirugía, con la excepción de aquellos pacientes con hiperparatiroidismo secundario en los que la tasa de detección fue claramente inferior (53,8%; p=0,008). Además, un IMC>25kg/m2, niveles de calcio séricos>10,5mg/dl y de vitamina D preoperatorios<30ng/ml se asociaron también con menor intensidad de autofluorescencia paratiroidea (p=0,0018; p=0,012; p=0,026, respectivamente). No se evidenciaron diferencias según edad, sexo, etnia o niveles de PTH preoperatorios.
En 2016, Falco et al.27,28 presentaron el primer estudio con un dispositivo comercial, el Fluobeam 800® (Fluoptics, Grenoble, Francia). Compararon la fluorescencia de las glándulas paratiroides con el tiroides y con el tejido graso circundante en 74 pacientes, hallando una mayor intensidad de fluorescencia en las paratiroides (p<0,0001). Además compararon el número de glándulas visibles con luz infrarroja y con luz blanca, evidenciando un mayor número de pacientes en los que se hallaron 4 glándulas paratiroides con luz infrarroja (μ=3,7 glándulas/paciente) que con luz blanca (μ=2,5) con diferencias estadísticamente significativas (p<0,001).
El mismo dispositivo fue usado por De Leeuw et al.29 en 2016 al analizar la sensibilidad de la prueba en 28 piezas de paratiroidectomía ex vivo con un resultado del 94,1%, siendo las paratiroides aún autofluorescentes incluso una hora tras la exéresis y fijadas en formol. Así pues, la autofluorescencia es independiente de la vascularización y función glandular. De la misma manera, analizaron el uso del dispositivo en 81 paratiroides in vivo de 35 pacientes con una sensibilidad del 98,8% en la detección de las glándulas. Según los autores, el tejido adiposo pardo y los nódulos coloides tiroideos podrían dar resultado de falso positivo.
Similares resultados se han obtenido en recientes estudios en los que se han usado otros dispositivos para medir la autofluorescencia. Kim et al.30 describieron el uso de una lámpara de infrarrojos (INFRALUX-300®, Daekyung Electro Medical Co, Pocheon City, Gyeonggi-Do, Corea) añadida al sistema de imagen NIR para mejorar la visualización del tejido periparatiroideo en 8 pacientes. El mismo año, Shinden et al.31 usaron el dispositivo comercial Photodynamic Eye® (PDE) (Hamamatsu Photonics, Hamamatsu, Japón), ideado para la cirugía con ICG, en 17 pacientes intervenidos hallando una mayor fluorescencia intrínseca en las glándulas paratiroides que en tiroides, ganglios linfáticos y grasa circundante, tanto in vivo como ex vivo. Ladurner et al.32, en 2017, usaron el dispositivo de Karl Storz® en 30 pacientes en los que evidenciaron mediante autofluorescencia 34 de las 42 glándulas paratiroides, mientras que 8 paratiroides englobadas en tejido adiposo no pudieron localizarse con luz infrarroja solamente.
Llegados a este punto, Kahramangil y Berber33 compararon en 2017 la visualización de las paratiroides tras infusión intravenosa de ICG con la autofluorescencia paratiroidea, en 44 pacientes intervenidos de tiroidectomía (22 pacientes con cada técnica). Los porcentajes de glándulas paratiroides identificadas fueron del 95% en el grupo ICG y del 98% en el grupo autofluorescencia, sin diferencias significativas. Por el contrario, el porcentaje de glándulas visualizadas antes de ser identificadas con luz blanca a simple vista fue del 6% en el grupo ICG y del 52% en el grupo autofluorescencia, con diferencias estadísticamente significativas (p<0,001). Los autores concluyeron que ambas técnicas tienen una similar tasa de detección de paratiroides pero que la autofluorescencia aporta mayor rapidez que el ICG.
En 2018 Benmiloud et al.34 han publicado un estudio de cohortes realizado por 2 cirujanos en 2 periodos de tiempo consecutivos en el que uno de los cirujanos (cirujano 1) usó la autofluorescencia para identificar las glándulas paratiroides en el periodo de tiempo número 2 (grupo NIR+). Comparando sus resultados con el resto se obtuvo que el grupo NIR+ presentó una menor tasa de hipocalcemia postoperatoria (p<0,01), una mayor tasa de identificación de paratiroides (p<0,05) y precisó una menor tasa de autotransplante de paratiroides (p<0,05).
El estudio más reciente publicado sobre autofluorescencia paratiroidea es el de Kahramangil et al.35, un estudio multicéntrico que analiza su uso en 210 pacientes. La autofluorescencia detectó el 98% de las glándulas, y el 46% de las mismas (una glándula por paciente, de media) no eran visibles a simple vista antes de su completa disección del tejido graso que las englobaba.
DiscusiónEl uso del ICG en cirugía endocrina es una técnica segura y eficaz, cuya dosis ideal a administrar recomendada es de 5mg, tanto en cirugía suprarrenal como tiroidea, pudiéndose repetir la administración en diversas ocasiones si se precisa.
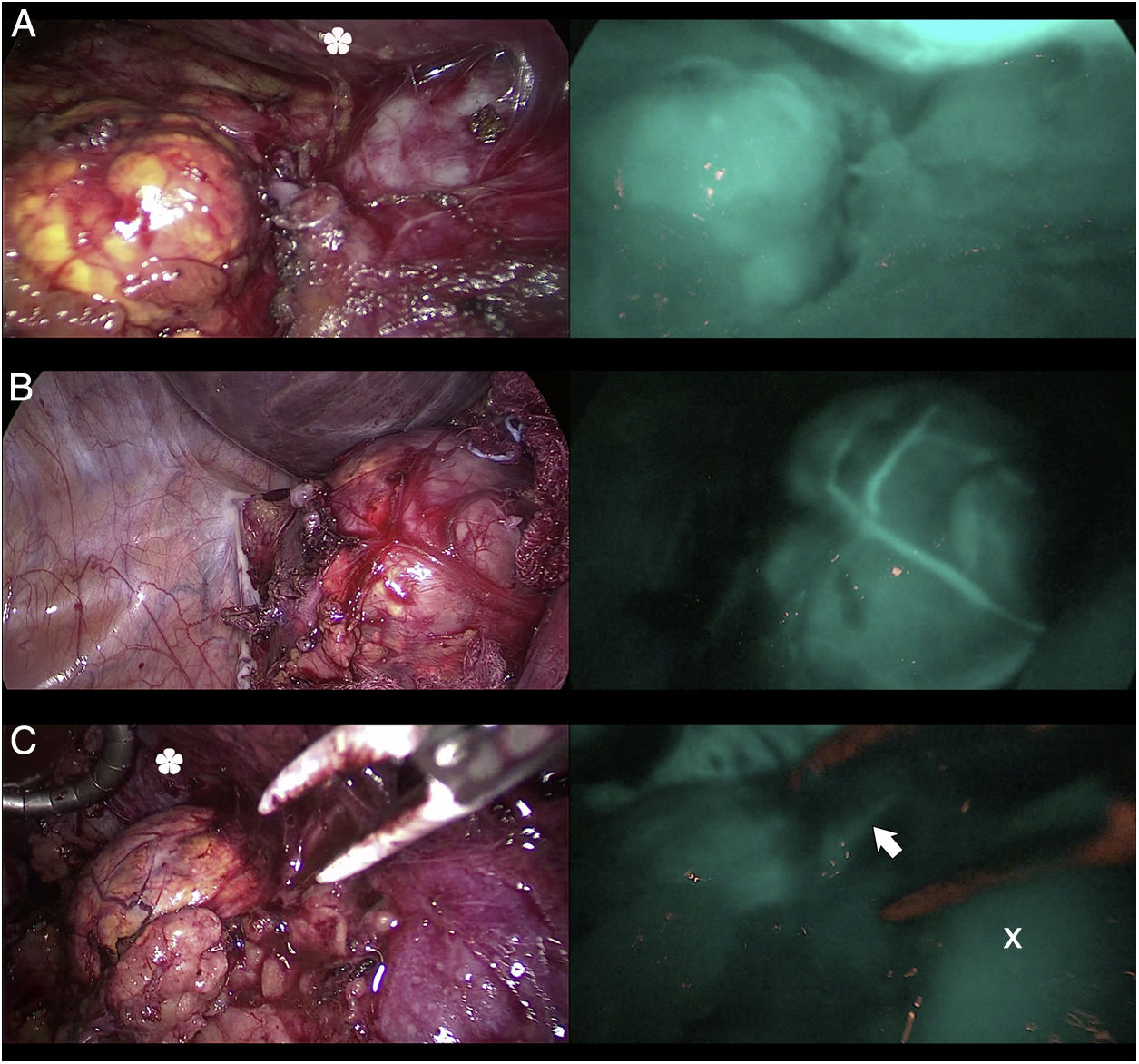
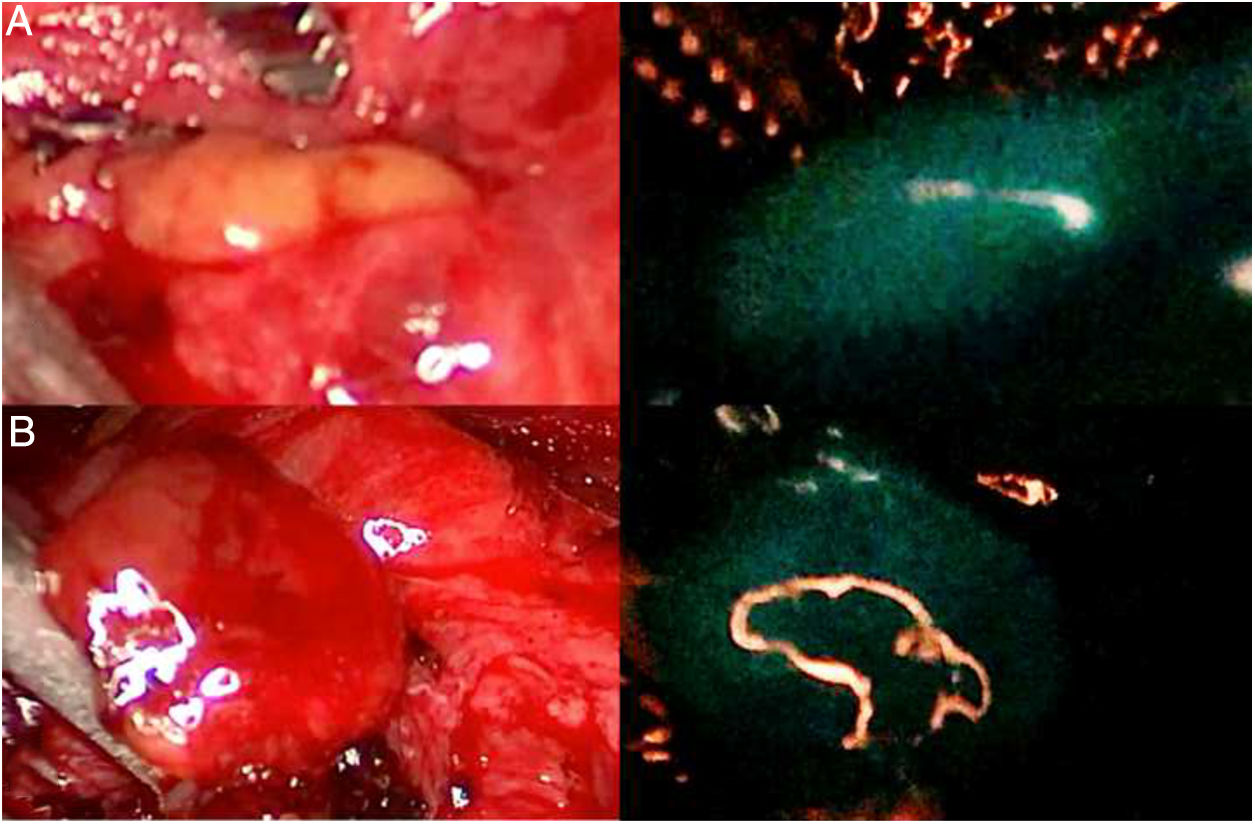
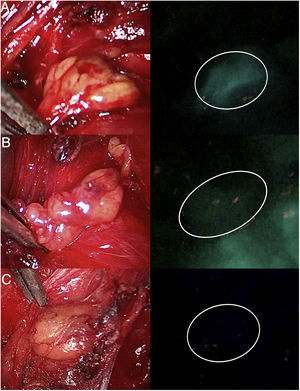
En el campo de la cirugía suprarrenal (fig. 1) el ICG muestra una hiperfluorescencia adrenal clara al primer minuto, máxima a los 5min y visible hasta 20min tras la infusión, lo que permite diferenciarla perfectamente del tejido graso circundante y asegurar su disección y resección completa. Además, la visualización de la vascularización adrenal con ICG, aunque inconstante, puede aportar un mayor control de la misma durante las maniobras de disección y así disminuir las tasas de complicaciones hemorrágicas, así como las derivadas de la manipulación glandular. Cabe mencionar que los tumores de corteza adrenal parecen ser hiperfluorescentes, mientras que los medulares y las tumoraciones malignas serían hipofluorescentes respecto al resto de la glándula, de especial interés ante resecciones parciales.
Tres casos (A, B y C) de adrenalectomía laparoscópica por vía anterior con dispositivo Image 1HD de Karl Storz®. En la columna de la izquierda aparecen las glándulas suprarrenales iluminadas con luz blanca y en la de la derecha bajo luz NIR tras infusión de 5mg de ICG intravenosos. Se aprecia la hiperfluorescencia suprarrenal en los 3 casos, claramente mayor a la del tejido graso circundante. La flecha blanca indica la vena suprarrenal derecha. Marcado con * la hiperfluorescencia hepática. Marcado con X la vena cava inferior.
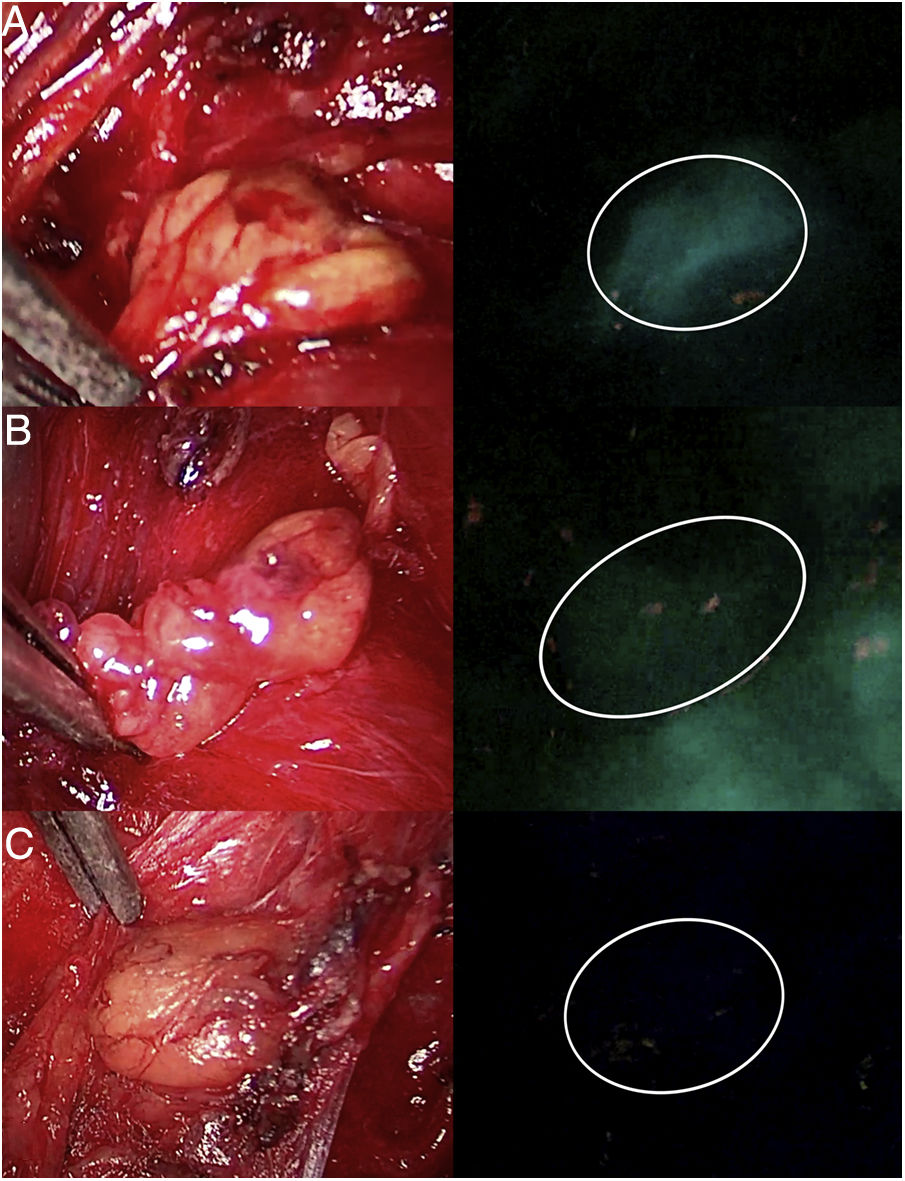
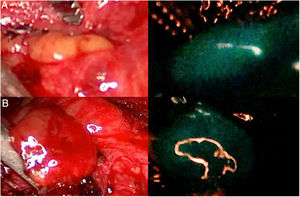
De igual forma, el uso de ICG en cirugía endocrina cervical (fig. 2) muestra una fluorescencia paratiroidea claramente superior a la tiroidea y visible desde los 30-60seg hasta los 20min tras la infusión. La edad joven, los niveles elevados de calcemia preoperatoria y un elevado tamaño glandular se podrían correlacionar con mayor hiperfluorescencia paratiroidea. Además existe una interesante correlación entre hiperfluorescencia y función paratiroidea postoperatoria. La presencia de al menos una glándula paratiroidea bien vascularizada podría evitar la hipofunción postoperatoria pudiendo ser innecesarios los controles analíticos postoperatorios y el tratamiento profiláctico. Se han elaborado diversas escalas subjetivas de medición de la fluorescencia paratiroidea con resultados prometedores, pero aún escasos métodos de graduación objetiva e intraoperatoria.
Tres glándulas paratiroides (A, B y C) visualizadas bajo luz blanca (columna de la izquierda) y bajo luz NIR (columna de la derecha) con el dispositivo Image 1HD de Karl Storz®, tras infusión de 5mg de ICG intravenosos. La glándula paratiroides A presenta una hiperfluorescencia homogénea. La glándula marcada como B muestra una fluorescencia parcheada o heterogénea por una probable vascularización insuficiente. La paratiroides C no muestra fluorescencia, por lo que su vascularización y función se prevén claramente alteradas.
El descubrimiento de la autofluorescencia paratiroidea (fig. 3) sin necesidad de la administración de ningún trazador exógeno, y claramente superior a la tiroidea, presenta un importante cambio en el campo de la cirugía endocrina guiada por fluorescencia. La autofluorescencia paratiroidea no está relacionada con la función, vascularización, ni enfermedad glandulares. Sí se ha asociado a una menor autofluorescencia el hiperparatiroidismo secundario, un IMC elevado, niveles de calcio séricos altos y de vitamina D preoperatorios bajos, sin diferencias según edad, sexo, etnia o niveles de PTH preoperatorios. Esta técnica parece tener una similar tasa de identificación de paratiroides que el ICG, pero aporta una mayor rapidez en la detección glandular que este, y puede ayudar a disminuir la tasa de hipocalcemia postoperatoria.
ConclusionesLa cirugía guiada por fluorescencia está aportando importantes avances que pueden modificar la concepción de la cirugía endocrina del futuro. Aunque se precisan más estudios para aportar mayor evidencia estadística a estos nuevos avances, los resultados actuales son prometedores.
Conflicto de interesesNinguno de los autores tiene conflicto de intereses ni ha recibido apoyo financiero a declarar.