La cirugía de los sarcomas retroperitoneales debe ser compartimental «en bloque», lo que implica la resección de órganos adyacentes al tumor. Su empleo «de entrada» permite un elevado porcentaje de resecciones con márgenes negativos, lo que supone un mejor control local y mayor supervivencia en muchos pacientes. La preservación de órganos debe hacerse de forma personalizada, especialmente en la pelvis, y adaptarla a la agresividad histológica del tumor. La biopsia preoperatoria permite establecer el subtipo de sarcoma y una adecuada estrategia perioperatoria. Estos pacientes deben ser manejados por cirujanos expertos en centros de referencia, con unidades multidisciplinarias y comités oncológicos. El uso de quimioterapia y radioterapia aún no está bien definido, por lo que solo se recomienda en centros de referencia con ensayos clínicos. En la actualidad esta es la única opción para ofrecer las mejores tasas de morbimortalidad, y las posibles mejoras en la supervivencia de estos pacientes.
Surgery for retroperitoneal sarcomas should be “en bloc” compartmental, which involves resection of unaffected organs. Its upfront use is key, providing a high percentage of resections with negative margins, resulting in a better local control and increased survival in many patients. Preservation of organs should be done in an individualized manner, especially in the pelvic location, and adapted to the histological aggressiveness of the tumor. Preoperative biopsy is able to establish the diagnosis of sarcoma subtype and consequently an adequate perioperative strategy. These patients should be managed by expert surgeons at referral centers with multidisciplinary units and oncology committees. The use of chemotherapy and radiotherapy is not yet well defined, so it is only recommended at referral centers with clinical trials. Currently, this is the only option to offer the best morbidity and mortality rates, as well as possible improvements in the survival of these patients.
Los sarcomas de partes blandas retroperitoneales y pélvicos (SRP) son un raro y heterogéneo grupo de neoplasias cuyo diagnóstico y tratamiento requieren un abordaje multidisciplinar en centros de referencia1–4. Casi siempre precisan de un tratamiento quirúrgico inicial agresivo y excepcionalmente las recidivas curan con cirugía2,4. El uso de la quimioterapia (QMT) y/o la radioterapia (RT) aún no está bien definido, por lo que solo se recomiendan dentro de ensayos clínicos1,2.
El grupo de sarcomas de la Asociación Española de Cirujanos (AEC) ha creído importante crear, en colaboración con oncólogos médicos y radioterapeutas, las líneas de actuación en los SRP y hacer especial énfasis en las estrategias quirúrgicas para estos pacientes.
Diagnóstico de los sarcomas de partes blandas retroperitoneales y pélvicosLos sarcomas de partes blandas tienen una incidencia de 3-4 casos por 100.000 habitantes/año. El 15% asientan en el retroperitoneo (SRP) y constituyen la segunda localización más frecuente tras las extremidades. Si bien en esta localización existe una gran variedad de subtipos histológicos (>70); los más frecuentes son el liposarcoma bien diferenciado (LPS-WD), el liposarcoma desdiferenciado (LPS-DD) y el leiomiosarcoma (LMS). Son más raros el fibrosarcoma y el sarcoma pleomórfico indiferenciado, el rabdomiosarcoma, el linfangiosarcoma, el schwanoma maligno o el hemangioepitelioma3,5,6.
La presencia de una masa abdominal palpable, con o sin sintomatología, es el dato clínico más frecuente en los SRP. Los sarcomas pelvianos pueden producir síntomas por compresión vesical, rectal o del plexo nervioso sacro. La pérdida de peso, la obstrucción gastrointestinal o la presencia de edema en las extremidades inferiores suelen darse en estadios localmente muy avanzados7.
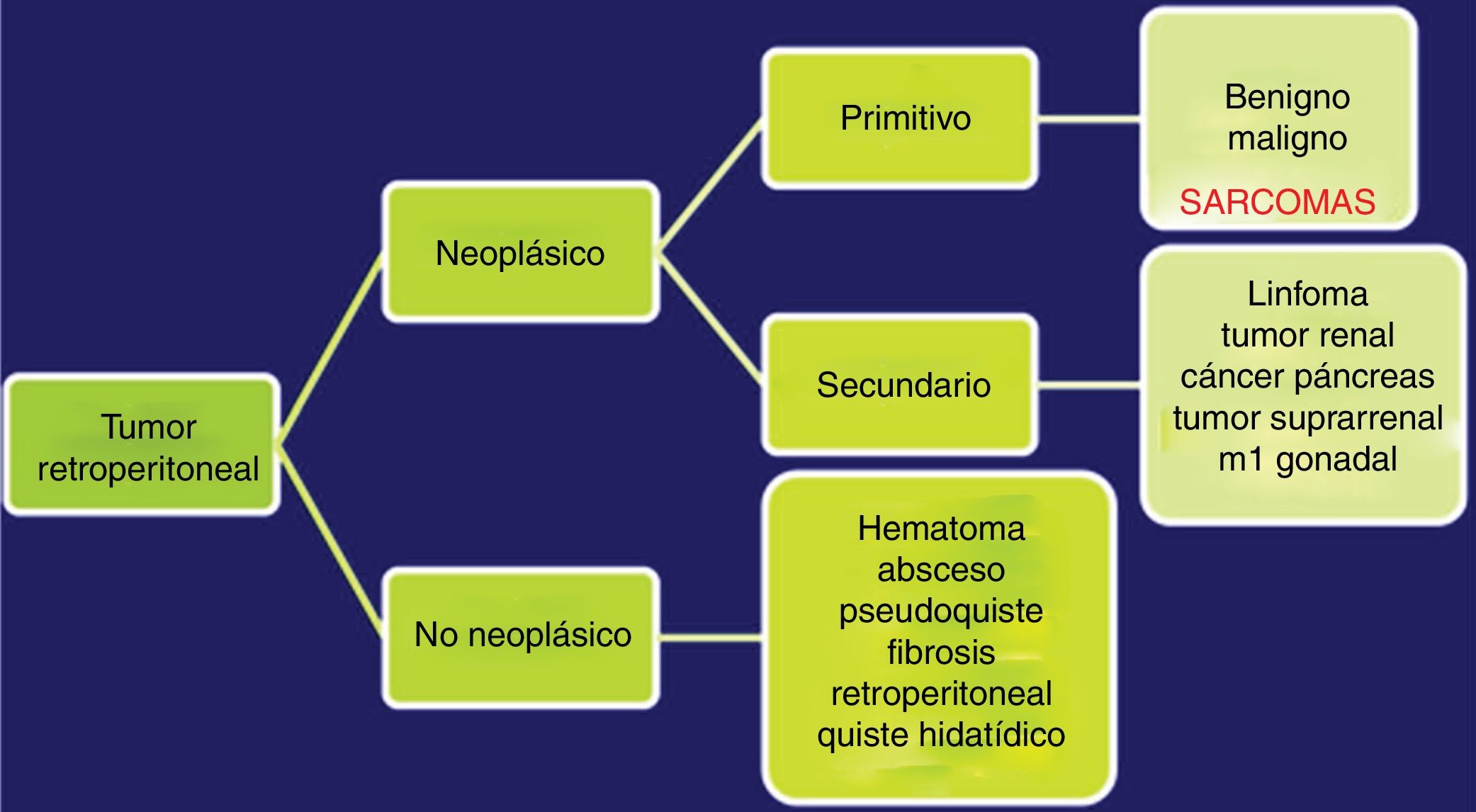
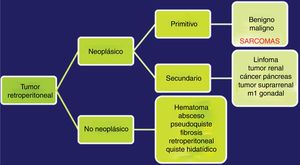
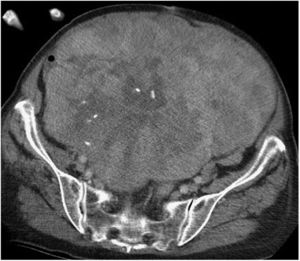
Las TAC abdominopélvica y torácica, asociadas a la RMN pélvica y a la PET, permiten definir el aspecto y tamaño, la localización y la relación del tumor con los órganos vecinos, así como la presencia de infiltración de las estructura adyacentes o la extensión metastásica pulmonar8,9. El diagnóstico diferencial de los SRP incluye otras lesiones malignas en la misma localización: linfomas, los tumores de células germinales, los tumores intraabdominales, tumores desmoides y las lesiones benignas retroperitoneales (fig. 1).
La biopsia tumoral preoperatoria (tru-cut) es necesaria en la mayoría de los casos. Debe ser siempre indicada ante un diagnóstico incierto y ante la necesidad de subclasificarlo histológicamente, o antes de abordar una quimioterapia o radioterapia preoperatoria. Al realizarse la biopsia guiada por eco/TAC debe evitarse el abordaje transabdominal por el riesgo de diseminación. Cuando la TAC es muy sugestiva de LPS-WD puede prescindirse de la biopsia y ser intervenidos de entrada7,8.
Tratamiento quirúrgico de los sarcomas de partes blandas retroperitoneales y pélvicosLa resección quirúrgica completa R0 de los SRP es el único tratamiento potencialmente curativo, siendo la cirugía inicial la que determina el pronóstico9–11. La íntima relación del tumor con estructuras anatómicas vitales hace que esta cirugía solo sea posible en el 70% de pacientes, siendo en los sarcomas pélvicos donde existe una mayor dificultad para la obtención de márgenes amplios.
La recurrencia local y/o peritoneal, tras una cirugía radical R0, se produce en más del 50% de los casos. El intervalo de tiempo libre de recidiva marca la evolución de la enfermedad y es más prolongado cuanto más radical sea la cirugía primaria. Si bien la agresividad biológica del SRP (bajo/alto grado) determina el pronóstico del paciente, los márgenes de la resección tumoral influyen tanto en la tasa de recurrencia local como en la mortalidad12. Actualmente, la tasa de recidiva locorregional a 5 años es del 41-58%. Lo más habitual es que las recidivas sean irresecables y que asocien una elevada mortalidad. Los actuales datos disponibles comunican tasas de recidivas locorregionales a 5 años del 41-58%, con tasas de supervivencia global a 10 años del 30%13. Parece claro que la resección R0 es la clave para el control local de la enfermedad y para lograr una mejor supervivencia. Sin embargo, en el 18-23% de los SRP se observa una multifocalidad tumoral y elevadas tasas de infiltración microscópica de órganos vecinos sin afectación macroscópica (48% en LPS-WD, 75% LPS-DD y 71% en LMS). Ello hace que muchos grupos consideren que la resección quirúrgica estándar de los SRP ha de ser siempre considerada como marginal, y asociada a una alta morbimortalidad14.
Bases teóricas de la cirugía compartimental en los sarcomas de partes blandas retroperitoneales y pélvicosUna cirugía radical «en bloque» en los SRP obliga a incluir, a modo de barrera anatómica, las vísceras próximas al tumor15. En el espacio retroperitoneal superior esta resección incluye colon, intestino delgado, riñón, páncreas y/o bazo. Excepcionalmente, puede ser necesaria la extirpación de la vena cava inferior, la arteria aorta, los órganos pélvicos (exenteraciones parciales o totales) o segmentos de pared abdominal o pélvica (hemipelvectomía).
Desde hace una década existe un debate, entre las escuelas europeas y americanas, respecto a lo que debe ser una cirugía óptima en los SRP, y si esta debe ser una cirugía compartimental «en bloque»16–23. El debate se establece en términos de equilibrio entre coste/beneficio oncológico entre una cirugía agresiva y su morbimortalidad asociada. A su vez, la propia agresividad biológica del SRP tiene un claro impacto sobre la supervivencia global de estos pacientes, diferenciando claramente los tumores menos agresivos, pero con mayor índice de recidiva local (LPS-WD de grado 1 y 2) de los más agresivos (LPS-DD y LMS). Esto implicaría, tal como están manifestando actualmente los grupos de expertos, una estrategia quirúrgica más personalizada basada en la propia agresividad biológica de estos tumores y una resección más liberal de los órganos adyacentes al tumor y aparentemente no afectados16,24.
Aspectos técnicos de la cirugía compartimental en los sarcomas de partes blandas retroperitoneales y pélvicosEn la cirugía de los SRP se deben evitar las resecciones incompletas, la rotura tumoral intraoperatoria y los sangrados con alto requerimiento transfusional, pues tienen un alto riesgo de recidiva. Debe valorarse si existen criterios de irresecabilidad, aunque finalmente esta valoración se concrete en el intraoperatorio. La invasión de los vasos mesentéricos o de las venas suprahepáticas y la imposibilidad de mantener la función renal tras la nefrectomía ipsilateral contraindican una cirugía agresiva. Los LMS vasculares retroperitoneales pueden exigir la resección del propio vaso25,26.
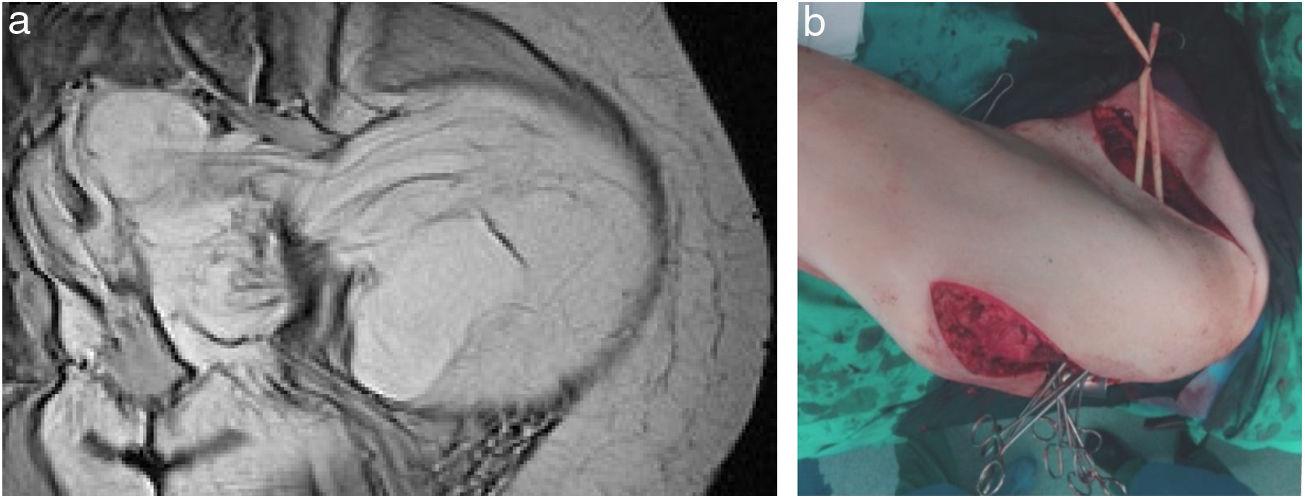
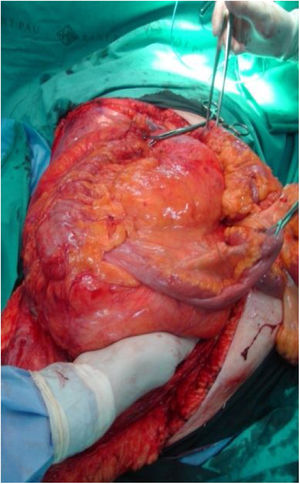
La incisión habitual para el abordaje de los SRP es una amplia laparotomía media, ocasionalmente extendida lateralmente hacia el lado afecto para ofrecer una mejor exposición y control vascular (fig. 2). En los casos con afectación tumoral retrohepática o extensión hacia el tórax puede ser necesaria una toracotomía, y el control de la vena cava inferior hasta la aurícula derecha. Cuando el tumor se extiende hacia la raíz del mesenterio deben abordarse inicialmente los vasos mesentéricos. La apertura del ligamento gastro-cólico y la sección del colon transverso en la línea media facilitan su control. Los vasos iliacos deben abordarse, siempre que sea posible, desde su zona más proximal y progresar distalmente ligando todas las ramas vasculares que van hacia el tumor. En una resección óptima la inclusión del riñón, con la ligadura de la arteria renal previa a la vena renal, es necesaria25.
La resección del músculo psoas exige la conservación de los nervios femoral y obturador, a fin de evitar las secuelas. La extirpación de todo el peritoneo en contacto con el tumor es obligada. El diafragma debe ser resecado cuando esté infiltrado por el tumor. Existen diferencias según el lado donde se origina el tumor27:
- -
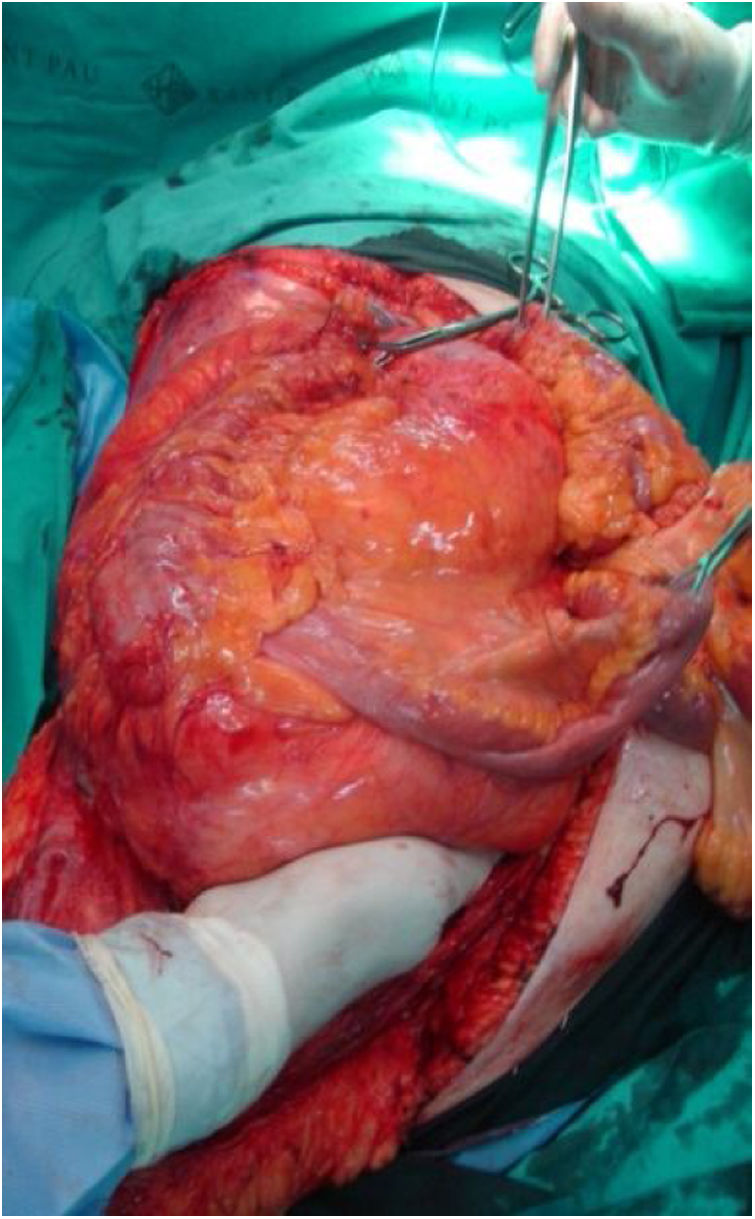
Lado derecho: suele incluir el tumor, el colon y el riñón derechos (fig. 3). La liberación del duodeno-páncreas permite acceder a la vena cava infrahepática. Cuando el duodeno o la cabeza pancreática esté afectada por compresión tumoral pueden producirse graves lesiones. En estas circunstancias no es aconsejable una duodenopancreatectomía, pues no mejora la supervivencia global.
- -
Lado izquierdo: suele incluir el tumor, el colon y el riñón izquierdos. Es importante liberar ampliamente el duodeno a nivel del ángulo de Treitz. Cuando existe infiltración del mismo su resección exige una posterior duodeno-yeyunostomía. En los tumores del cuadrante superior izquierdo generalmente debe añadirse una espleno-pancreatectomía distal de necesidad27.
Finalmente, es oportuno comentar que existen situaciones específicas a tener en cuenta: a) la herniación del tumor hacia el tórax puede obligar a una toracotomía; y b) la resección de las estructuras del conducto inguinal son necesarias en tumores que progresan por el mismo.
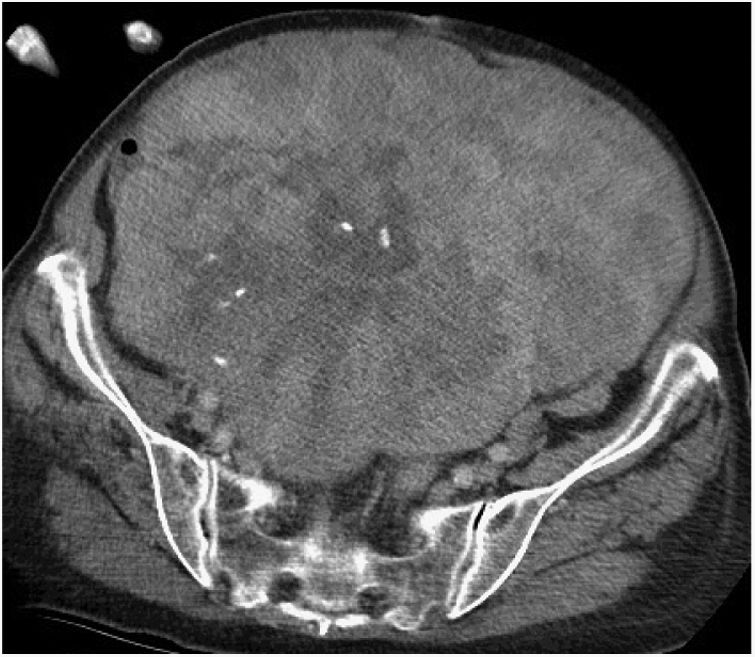
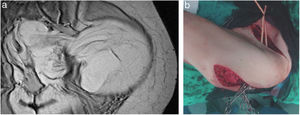
Cirugía en los sarcomas pélvicosLos SRP de localización pélvica extraperitoneal representan el 18% de todos ellos9. En esta localización se han de valorar las características del tumor y su relación con las múltiples estructuras anatómicas de la pelvis. Los tipos histológicos más frecuentes son el LPS-WD y LPS-DD, el LMS y el tumor fibroso solitario28 (fig. 4).
En esta localización la planificación quirúrgica exige una estadificación correcta mediante una TAC abdominopélvica y/o una RMN pélvica. Hay que diseñar una cirugía individualizada con la intención de preservar la anatomía y función de los órganos pélvicos28.
Los límites anatómicos de la cavidad pélvica extraperitoneal son el peritoneo parietal en la parte superior, el suelo de la pelvis inferiormente, por delante el pubis y los ligamentos inguinales y detrás el sacro. Debido a la íntima relación del tumor con las estructuras vasculares, óseas o viscerales de la pelvis, es difícil conseguir unos márgenes quirúrgicos amplios. La resección en la pelvis exige una extirpación completa del tumor, junto a las estructuras directamente invadidas por el mismo.
Los sarcomas pélvicos frecuentemente comprimen la vejiga, la próstata, las glándulas seminales o los uréteres, pero es raro que estos órganos sean invadidos y necesiten ser extirpados junto al tumor (<2%). La vejiga, si está invadida, puede ser resecada parcialmente sin afectar su función28. Cuando el tumor se localiza en el mesorrecto la resección debe incluir el recto, llegando incluso a la amputación abdominoperineal en casos extremos.
Las recidivas pélvicas precisan de una cirugía más compleja y exigen resecciones viscerales más frecuentemente. La identificación intraoperatoria de los uréteres suele ser difícil y obliga a la colocación preoperatoria de catéteres ureterales o nefrostomías por hidronefrosis obstructiva, y a la resección de la parte distal del uréter y su reimplantación en la vejiga. La fragmentación del tumor se relaciona con mayor riesgo de recurrencia local y con menor supervivencia16. Cuando los tumores son grandes, recidivantes o están adheridos a las paredes óseas de la pelvis pueden beneficiarse de una QMT/RT neoadjuvante y/o intraoperatoria.
En los casos en que la radicalidad quirúrgica exija la resección de los vasos ilíacos y/o femorales será necesaria una posterior restitución protésica vascular, lo que implica una mayor morbimortalidad postoperatoria. Si la afectación de los troncos venosos pélvicos provoca una oclusión y el desarrollo de una intensa circulación venosa complementaria, la resección sin reconstrucción es bien tolerada, siendo excepcional la utilización de una prótesis venosa. En general, al no existir diseminación linfática, es innecesario una linfadenectomía.
La resección nerviosa (n. femoral/n. obturador) puede ser necesaria bien porque el tumor se origine en los nervios (swanoma maligno), bien para conseguir una cirugía radical. Cuando ello sucede existen secuelas debidas a los déficits motores provocados por dicha sección28.
Un escenario complejo son los tumores pélvicos o extrapélvicos (glúteo/inguinocrural) «en reloj de arena» que progresan en uno u otro sentido a través de orificios anatómicos naturales pélvicos (obturador, inguinal-crural o escotadura isquiática). En estos casos el abordaje quirúrgico ha de ser mediante una incisión sobre la cresta ilíaca con prolongación hacia la región glútea y/o hacia la región inguinal, o bien mediante una doble incisión sobre ambas regiones (figs. 5 A y B). En los LPS-WD de gran tamaño puede ser útil dividir el tumor en 2 partes a su paso por el orificio anatómico.
Tratamiento quimioterápico en los sarcomas de partes blandas retroperitoneales y pélvicosTratamiento sistémico en el SRP localizado resecable.La QMT en esta situación aún no está bien establecida y no se recomienda fuera de ensayos clínicos1-33. Valoramos su utilidad antes y después de la cirugía:
- -
Quimioterapia neoadjuvante en el SRP. No disponemos de estudios que valoren su beneficio previo a la cirugía. Sí se ha observado que los pacientes con respuesta histopatológica a la QMT neoadyuvante tienen una mejor supervivencia específica por enfermedad. Además, esta respuesta es un factor que se considera en el nomograma de estimación de supervivencia para SPB MSKCC29.
- -
La quimioterapia intraperitoneal con hipertermia regional en combinación con quimioterapia sistémica EIA (etopósido, ifosfamida, doxorrubicina) se asocia en algunos casos a un beneficio en la SLR local y a distancia, sin aumento de las complicaciones30.
- -
La QMT/RT concomitantes han sido estudiadas en ensayos fase i. Un estudio fase i-ii del Grupo Italiano de Sarcomas incluyó SRP resecables tratados con dosis altas de ifosfamida concurrente con RT (50,4Gy), alcanzando un 8% de respuestas parciales y un 79% de estabilizaciones, mejorando la SLR a 3 años. No obstante, ante la toxicidad observada se optó por un ensayo fase iii exclusivamente con RT neoadyuvante (FIII-EORTC 31)31.
- -
Por tanto, a pesar de no existir ensayos comparativos F-III sobre el papel de la QMT neoayuvante, su uso es capaz de inducir respuestas, y por tanto puede facilitar la cirugía en algunos casos32. Esto es particularmente relevante en el caso de cirugía de rescate en SRP inicialmente inoperables o en el límite de resecabilidad y en tumores con histologías quimiosensibles.
- -
Quimioterapia adjuvante en SRP. Su papel no está establecido, ya que no existen estudios específicos para esta localización33. En la actualidad disponemos de nomogramas que pueden ayudarnos a individualizar la indicación de la QMT adyuvante en esta localización34.
TratamientoQMT en la enfermedad avanzada irresecable y/o metastásica. En la enfermedad localizada irresecable las estrategias son limitadas. Solo en aquellos casos con una buena respuesta a la RT o la QMT, se abriría la posibilidad de una resección quirúrgica, por lo que serían en realidad tratamientos neoadyuvantes35. En SRP definitivamente irresecables y/o metastásicos, la QMT se plantea con carácter paliativo. La actitud expectante es una opción válida para tumores de bajo grado con lenta evolución, en pacientes ancianos o asintomáticos36.
El tratamiento es similar al realizado en los SPB metastásicos de otras localizaciones y la selección del régimen depende de la histología, el estado del paciente y el uso de QMT previa37. En general, debe considerarse a la doxorrubicina como el tratamiento estándar de primera línea, con una tasa de respuestas del 25%2. Recientemente se ha aprobado en primera línea la combinación de doxorrubicina y olaratumab37. Finalmente, otras opciones han sido utilizadas en función del tipo histológico, de la QMT administrada previamente y del estado del paciente38–40.
Radioterapia en los sarcomas de partes blandas retroperitoneales y pélvicosLa RT utilizada en un 25-30% de los SRP podría mejorar la supervivencia y el control local de la enfermedad, pero hasta la actualidad este concepto adolece de una baja evidencia científica41,42. En los últimos años se han publicado resultados contradictorios generando confusión sobre su papel en SRP43,44. No existen ensayos prospectivos que demuestren su beneficio, y la cuestión de cómo situarla antes (RTPP), durante (RIO) o posterior (RTPO) a la cirugía es controvertida. En cualquier caso, los SRP de bajo grado, como LPS-WD, no se benefician de la RT45. En un recién estudio sobre 9.068 pacientes con SRP se comparan 2 cohortes, una RTPP vs. cirugía sola y otra RTPO vs. cirugía sola. Ambos esquemas mostraron beneficio en cuanto a la SG, siendo superior la supervivencia con RTPP (110 meses) frente a la RTPO (89 meses)43.
RTPP. Estudios retrospectivos recientes han demostrado que la RTPP mejora el control local de la enfermedad y la supervivencia41, incrementa la resecabilidad tumoral y permite un mayor porcentaje de extracciones en bloque42. No obstante, el valor de la RTPP tendrá que esperar los resultados del ensayo fase iii de la EORTC, entre cirugía versus RTPP y posteriormente cirugía.
Otros esquemas como la cirugía con RTPP/RTPO asociadas a una RIO, ofrecen unos esperanzadores resultados, con un control local de la enfermedad a los 5 años del 40-60%, pero se ha descrito un mayor índice de toxicidad crónica neurológica43. La asociación de doxorrubicina y RIO tras la resección (ensayo fase i) consiguió R0 en el 90% de los pacientes operados. No obstante, este estudio no permite definir la dosis óptima de RT en esta combinación43. Finalmente, la radioterapia de intensidad modulada (IMRT) posibilita escalar la dosis de RT, con una disminución de la toxicidad crónica42. Dada la ausencia de una clara evidencia científica, el uso de la RTPP en SRP se recomienda solo en ensayos clínicos44.
RTPO. En la actualidad se desestima la RTPO por varias razones: a) dificultad de planificación debido a la desestructuración anatómica que conlleva; b) su toxicidad es poco predecible por el movimiento del intestino y otros órganos de riesgo; y c) exige una mayor dosis de RTP. Con técnicas más conformadas como la IMRT es posible disminuir la dosis en órganos de riesgo, pero sin embargo en el caso del abdomen resulta difícil evitar dosis altas en el intestino47,48.
Se puede afirmar que si bien no existe una evidencia científica, la RTPP es eficaz, factible y con menos toxicidad que la RTPO. Las técnicas actuales, como la IMRT, posibilitan aumentar la dosis de radiación en las zonas de alto riesgo de recidiva. No obstante, a pesar de todas estas consideraciones, debemos esperar los resultados del ensayo fase iii STRASS trial NCT01344018 de la ESMO, para definir el beneficio de la RT en los SRP.
Pronóstico de los sarcomas de partes blandas retroperitoneales y pélvicos y conclusiones finalesEl pronóstico de los SRP (SLR y SG) varía entre las diferentes formas histológicas. La ausencia de diseminación ganglionar en la mayoría de los SRP hace que la supervivencia en estos pacientes sea superior a la de otros tumores49. La primera cirugía debe ser siempre lo más radical posible, pues de ello depende la SLR y SG, así como la necesidad de cirugías de rescate50. Cada reiteración quirúrgica se asocia a mayor dificultad técnica y a un porcentaje superior de complicaciones y mortalidad postoperatoria, siendo su indicación solo aceptada cuando esta puede conseguir una resección completa de la recidiva9,51.
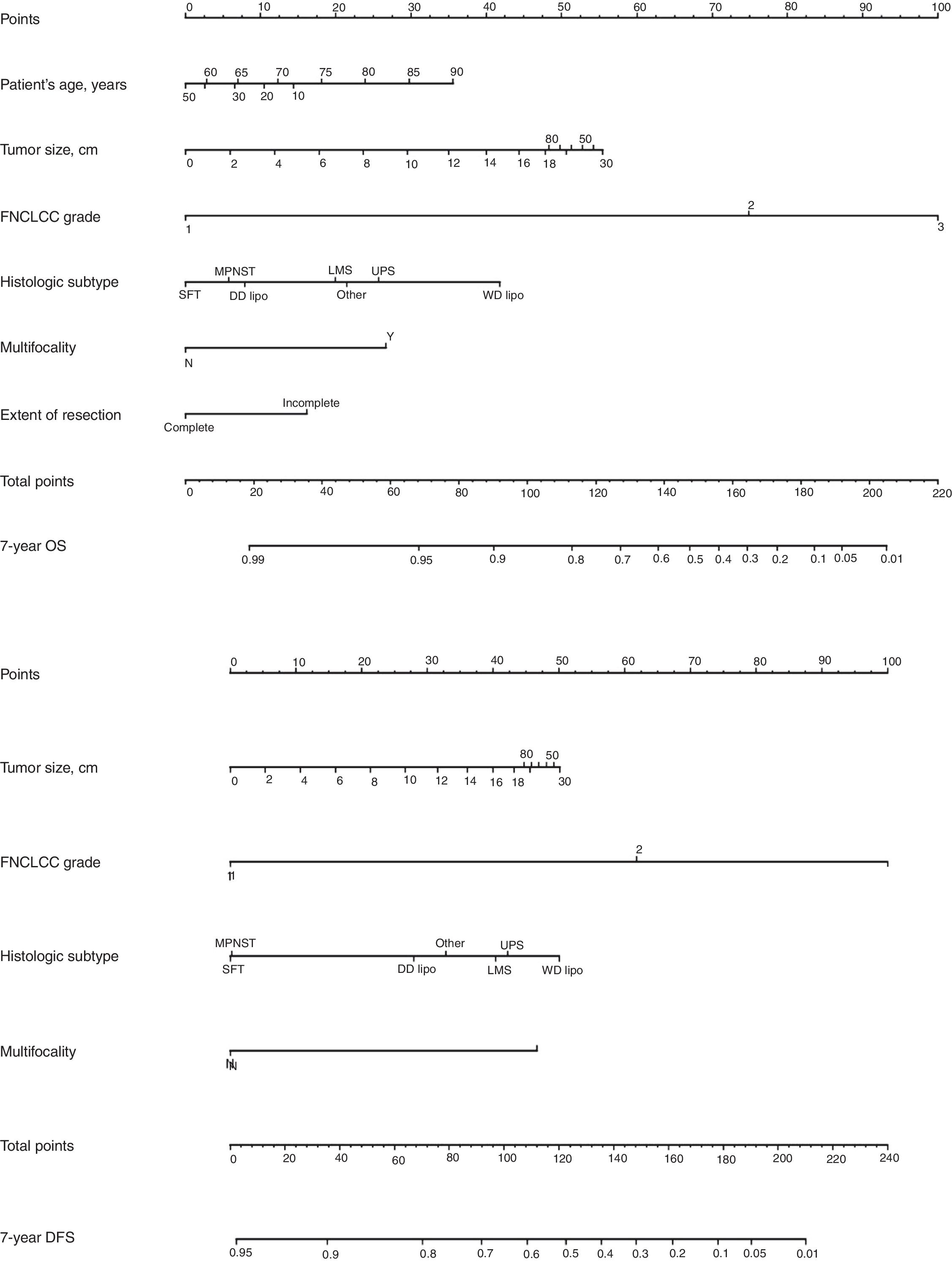
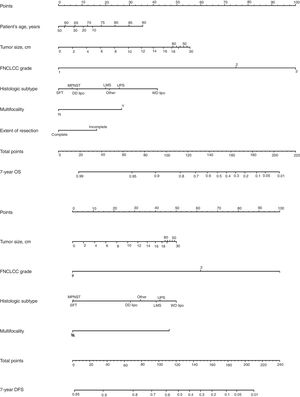
Clásicamente, el tipo y grado histológico y la calidad de la cirugía han sido los factores predictivos más importantes. Desde un punto de vista quirúrgico, se ha de considerar que una cirugía óptima en los SRP consiste en una exéresis macroscópica completa (R0 y R1). Existen 4 nomogramas pronósticos específicos de SRP, en los que, el grado tumoral y el subtipo histológico parecen ser los predictores de pronóstico más importante. De ellos, solo el de Gronchi et al.34 ha sido validado y respaldado por la AJCC. En este nomograma la predicción de que un paciente esté vivo o libre de enfermedad a los 7 años de la cirugía se ajusta en función de una puntuación sobre el tamaño tumoral, el grado y subtipo histológico, la edad del paciente y la extensión de la resección35 (fig. 6).
Finalmente es importante resaltar que la cirugía sigue siendo el tratamiento de elección en los SRP, siempre y cuando se cumplan los criterios de radicalidad quirúrgica. Esta cirugía debe ser realizada por expertos, con el soporte de los diferentes especialistas quirúrgicos, en un contexto mutidisciplinar, en centros referentes con un alto volumen de casos2. La combinación de esta cirugía con QMT y/o RT puede ser efectiva cuando los casos son bien seleccionados. En situaciones complejas, como los tumores pélvicos, la asociación de la cirugía con RT preoperatoria±RIO ayuda en el control local de la enfermedad.
Conflicto de interesesNo existe ningún conflicto de intereses por parte de los autores.