Las vías clínicas son planes detallados de asistencia aplicables al tratamiento de pacientes con variaciones en la práctica y un curso clínico predecible. Sin pretender sustituir el juicio clínico de los profesionales, buscan una mejora en la efectividad y la eficiencia. La vía clínica que presentamos es el resultado del trabajo colaborativo de las Secciones de Cirugía Endocrina y Gestión de Calidad de la Asociación Española de Cirujanos, que intenta aportar un marco para normalizar la realización de la tiroidectomía. Junto con documentos habituales de toda vía clínica (matriz temporal, hoja de variaciones e información, indicadores de evaluación, encuesta de satisfacción), incluye una revisión de la evidencia científica en torno a diferentes aspectos del pre, intra y posoperatorio de esta intervención, la más frecuentemente realizada en cirugía endocrina. Entre otros, analiza la profilaxis antibiótica y antitrombótica, la preparación preoperatoria en hipertiroidismo, la neuromonitorización intraoperatoria, los sistemas para hemostasia intraoperatoria y el tratamiento de la hipocalcemia posoperatoria.
Clinical pathways are care plans applicable to patient care procedures that present variations in practice and a predictable clinical course. They are designed not as a substitute for clinical judgment, but rather as a means to improve the effectiveness and efficiency of the procedures. This clinical pathway is the result of a collaborative work of the Sections of Endocrine Surgery and Quality Management of the Spanish Association of Surgeons. It attempts to provide a framework for standardizing the performance of thyroidectomy, the most frequently performed operation in endocrine surgery. Along with the usual documents of clinical pathways (temporary matrix, variance tracking and information sheets, assessment indicators and a satisfaction questionnaire) it includes a review of the scientific evidence around different aspects of pre, intra and postoperative management. Among others, antibiotic and antithrombotic prophylaxis, preoperative preparation in hyperthyroidism, intraoperative neuromonitoring and systems for obtaining hemostasis are included, along with management of postoperative hypocalcemia.
Todo proceso asistencial precisa un planteamiento integral y multidisciplinar. Para ello, una de las herramientas a disposición de los profesionales sanitarios son las vías y guías de práctica clínica. Las vías clínicas son planes asistenciales aplicables a pacientes con una determinada enfermedad que coordinan todas las dimensiones de la calidad asistencial: las estimadas por los profesionales (calidad científico-técnica, optimización de la atención y coordinación interprofesionales), por los enfermos (información, participación y ajuste de expectativas) y por los gestores (eficiencia y evaluación continua)1. Son herramientas para facilitar la atención sistematizada y multidisciplinar del paciente, que no reemplazan el juicio clínico del profesional2. Los objetivos fundamentales son: estandarizar las actuaciones profesionales de acuerdo con la mejor evidencia científica disponible para disminuir la variabilidad injustificada de la práctica clínica y reducir los costes innecesarios asociados al procedimiento.
El proceso de la tiroidectomía, intervención más frecuentemente realizada en cirugía endocrina, ha evolucionado en los últimos años, con un mejor conocimiento de la fisiopatología de sus complicaciones y la incorporación de nuevas técnicas de ayuda en el pre, intra y posoperatorio. Con el objetivo de ayudar a los profesionales a incorporar las mejores prácticas y proporcionar la mejor atención a los pacientes, las secciones de Cirugía Endocrina y de Gestión de Calidad de la Asociación Española de Cirujanos decidieron elaborar una vía clínica de tiroidectomía (VCT). Las juntas de ambas secciones encomendaron su realización a un grupo de trabajo conjunto y paritario. Esta vía clínica pretende ser una herramienta útil para la toma de decisiones clínicas, mediante una serie de directrices basadas en la evidencia con las que solventar los problemas que surgen en la atención de pacientes concretos.
Límites del proceso. Criterios de inclusión y exclusiónLa vía clínica se inicia cuando el cirujano confirma la indicación quirúrgica y propone al paciente la realización de una tiroidectomía. Aunque conceptualmente el límite de salida es el alta hospitalaria, dada la variabilidad existente en la práctica, se ha incorporado una revisión sistemática de determinados aspectos novedosos o controvertidos de la monitorización, el seguimiento y el eventual tratamiento de complicaciones posoperatorias, una vez el paciente ha sido dado de alta hospitalaria. De forma general, las recomendaciones propuestas en la VCT son aplicables a todos los pacientes sometidos a resección tiroidea. Se han definido unos criterios de exclusión: contraindicación para la anestesia general o regional, intervenciones urgentes y realización de procedimientos quirúrgicos mayores concomitantes. La VCT se ha dividido en 2 documentos básicos: recomendaciones sobre los puntos clave del proceso y documentos propios de la VCT.
Recomendaciones sobre los puntos clave en el procesoConsideraciones generalesHan sido elaboradas sistemáticamente sobre los aspectos de alta variabilidad o que requerían una actualización. Se ha seguido la metodología de la medicina basada en la evidencia, estandarizando la búsqueda y haciendo una evaluación crítica de la literatura. Basándose en un nivel de evidencia (NE) determinado, se han ponderado las diversas recomendaciones para minimizar los sesgos. Nos hemos basado en trabajos originales y guías de práctica clínica evaluadas según las directrices del documento Appraisal of Guidelines for Research and Evaluation –AGREE– II (http://www.agreetrust.org)3.
La clasificación del NE utilizada es la del Centro de Medicina Basada en la Evidencia de Oxford de 2009 (http://www.cemb.net/?o=1025)4. Valora procedimientos diagnósticos, intervenciones terapéuticas y preventivas, factores pronósticos y de riesgo. Para ellos define un NE (tabla 1) y un grado de recomendación (GR) establecido en:
- -
Grado A: derivado de estudios consistentes nivel 1.
- -
Grado B: derivado de estudios consistentes nivel 2-3, o extrapolaciones (uso de datos para situaciones clínicas con diferencias potencialmente importantes) de estudios nivel 1.
- -
Grado C: derivado de estudios nivel 4, o extrapolaciones de estudios nivel 2-3.
- -
Grado D: derivado de evidencia nivel 5 o de estudios inconsistentes o no concluyentes de cualquier nivel.
Niveles de evidencia y grados de recomendación del Centro para la Medicina Basada en la Evidencia de Oxford (marzo de 2009)
| Nivel | Etiología/tratamiento/efectos adversos/prevención | Diagnóstico |
|---|---|---|
| 1a | RS homogéneasa de ensayos clínicos | RS homogéneasa de estudios diagnósticos de nivel 1, o algoritmos de decisión o escalas de puntuación derivados de estudios 1b de diferentes centros |
| 1b | Ensayo clínico con intervalo de confianza estrecho | Estudios de cohortes para validación de test diagnósticosb con buenos estándares de referenciac, o algoritmos de decisión o escalas de puntuación testados en un único centro |
| 1c | Series de casos de «todos o ninguno»c | Test diagnósticos de muy alta sensibilidad y especificidad |
| 2a | RS homogéneasa de estudios de cohortes | RS homogéneasa de estudios diagnósticos de nivel 2 o superior |
| 2b | Estudios de cohortes individuales o ensayos clínicos de baja calidad (seguimiento menor del 80%) | Estudio de cohortes de validaciónb con buenos estándares de referenciac. Estudios derivados de algoritmos de decisión o escalas de puntuación, o validados solo sobre muestras divididasd o bases de datos |
| 2c | Investigación de resultados o estudios ecológicos | |
| 3a | RS homogéneasa de estudios casos-control | RS homogéneasa de estudios nivel 3b o superiores |
| 3b | Estudios casos-control individuales | Estudios sobre pacientes no consecutivos, o sin un estándar de referencia consistentemente aplicado |
| 4 | Series de casos, o estudios de casos-control de baja calidade | Estudios de casos-control con estándares de referencia no independientes o escasamente independientes |
| 5 | Opinión de expertos sin evaluación crítica explícita, o basados sobre fisiología, investigación ex vivo o principios generales | Opinión de expertos sin evaluación crítica explícita, o basados sobre fisiología, investigación ex vivo o principios generales |
RS: revisiones sistemáticas.
Se ha de recoger información en torno a historia familiar de enfermedad endocrina o cáncer, irradiación o cirugía cervical previa, ritmo de crecimiento del nódulo, presencia de síntomas compresivos (disnea, disfagia, disfonía) y de hiper o hipotiroidismo5 (NE 2b, GR B). La ausencia de síntomas no excluye malignidad6 (NE 3b, GR C). La exploración física debe incluir la tiroides y los ganglios linfáticos cervicales (NE 3b, GR B), describiendo sus características y localización5–7 (NE 3b, GR C).
Estudios de laboratorioSe debe determinar el nivel sérico de la hormona tirotropa, pues indica el estado hormonal6 (NE 1b, GR A). Su descenso indica hipertiroidismo, aleja el riesgo de neoplasia y evidencia la pertinencia de una gammagrafía (NE 2b, GR B). Una TSH aumentada hace aconsejable determinar anticuerpos anti-TPO. Los anticuerpos antitiroglobulina se deben determinar ante la sospecha de tiroiditis linfocitaria, con concentraciones normales de TPO (NE 3b, GR C). La determinación de tiroglobulina no está justificada preoperatoriamente5,6.
Además de las determinaciones estándar, incluiríamos pruebas de función hepática8 (NE 5, GR D), calcio y fósforo9. La determinación de hormona paratiroidea (PTH) permite descartar un hiperparatiroidismo y poder disponer del gradiente de su descenso posoperatorio como predictor de hipocalcemia, por lo que se recomienda su determinación sistemática. También en este contexto resulta útil la determinación de 25-OH vitamina D, por lo que también se propone su determinación en todos los pacientes.
No hay consenso respecto a la determinación rutinaria de calcitonina basal para descartar carcinoma medular10,11. Sería coste-efectiva en los síndromes hereditarios, en nódulos sólidos únicos, cuando existan antecedentes familiares de cáncer tiroideo, o sospecha de malignidad o carcinoma medular en la punción con aguja fina5,7,12, por lo que se recomienda solicitarla de forma restringida en estos escenarios clínicos (NE 3b, GR B). Cifras elevadas deben confirmarse mediante test de estimulación con pentagastrina (contraindicada en embarazadas) o calcio13.
Debe preverse reserva de sangre con pruebas cruzadas en intervenciones por cánceres anaplásicos o tumores avanzados que requieran vaciamientos cervicales extensos, aunque, dado el bajo NE disponible en este punto, la implementación siempre debe estar supeditada a la valoración de la Comisión de Transfusión o el organismo competente en cada centro específico (NE 5, GR D).
Pruebas de imagenLa ecografía cervical es la primera exploración a realizar: es inocua, barata y se puede llevar a cabo en la consulta (NE 1c, GR A). Aporta mucha información respecto al tamaño y ecogenicidad glandulares. Describirá la presencia o no de nódulos, su número, tamaño, posición, forma, márgenes, contenido, patrón ecográfico, vascularización y presencia de calcificaciones5,6 (NE 2b, GR C). Explora la presencia de adenopatías, anomalías vasculares, quistes y otras malformaciones5,14,15. La elastografía y la ecografía con contraste pueden ser útiles en la discriminación de benignidad o malignidad del nódulo tiroideo, pero no forman parte en la actualidad de su protocolo de estudio5,6 (NE 2b, GR C).
Ni la resonancia magnética ni la tomografía computarizada están indicadas de rutina al ser menos coste-efectivas e informativas que la ecografía5 (NE 5, GR D). Hay que solicitarlas ante síntomas compresivos, sospecha de prolongación endotorácica o localización retrovisceral. En caso de malignidad permiten detectar adenopatías, infiltración local o metástasis a distancia. Para este último propósito la resonancia magnética (o la tomografía computarizada sin contraste intravenoso) es de elección porque el contraste yodado usado para la tomografía computarizada interfiere con la posible utilización posoperatoria de radioyodo9 (NE 5, GR D).
La mayor utilidad de la tomografía por emisión de positrones sería la sospecha de recidiva de un cáncer tiroideo, no detectada por técnicas convencionales. En el estudio preoperatorio, una captación focal tiroidea incidental corresponde a carcinomas en más de un tercio de los casos. En nódulos con citología de neoplasia folicular ha mostrado capacidad discriminativa por su alta sensibilidad, aunque con baja especificidad5,16. No obstante, no puede recomendarse su uso sistemático (NE 2b, GR B).
La gammagrafía tiroidea no está indicada rutinariamente. Su utilidad principal es el estudio del hipertiroidismo5,6,9 (NE 2b, GR B). En el nódulo sólido con citología indeterminada, la hiperfunción hace más improbable que se trate de un carcinoma. Nunca debe utilizarse en embarazadas.
Punción-aspiración con aguja finaEl estudio citológico es la prueba de elección en el diagnóstico de los nódulos tiroideos no hiperfuncionantes5,6,10,17. La realización de la punción-aspiración con aguja fina (PAAF) bajo control ecográfico, la obtención de muestra suficiente y el estudio por citólogos expertos mejoran su rendimiento (NE 2b, GR B). En los nódulos infracentimétricos, la PAAF no está indicada, salvo hallazgos ecográficos indicativos de malignidad. En caso de lesiones solidoquísticas debe puncionarse el componente sólido, y en glándulas multinodulares, el nódulo más sospechoso de malignidad, independientemente del tamaño (NE 5, GR D)17.
Globalmente, un 72% de las PAAF resultan benignas, un 5% malignas, un 17% indeterminadas y un 6% pruebas fallidas, por muestra insuficiente o inadecuada18. La clasificación citológica de Bethesda es la más utilizada actualmente (tabla 2 del anexo 1, material suplementario disponible en la edición electrónica)19. Como podemos ver, establece 6 categorías diagnósticas, para las que constituye un riesgo de malignidad (con porcentajes avalados por amplios estudios posteriores20,21) y una recomendación clínica (NE 2b, GR B).
La PAAF permite el diagnóstico de los carcinomas papilares, medulares y anaplásicos, del linfoma tiroideo y las metástasis, pero no de los carcinomas foliculares17,18 (NE 5, GR D). La biopsia con aguja gruesa puede ofrecer información adicional sobre el tiroides o masas cervicales que presenten resultados no concluyentes en la PAAF22 (NE 2b, GR B).
LaringoscopiaLa constatación preoperatoria de la movilidad de las cuerdas vocales, bien por fibrolaringoscopia, bien por laringoscopia indirecta, puede ayudar a decidir la estrategia quirúrgica7 (NE 5, GR D). Aunque todos los autores reconocen su utilidad, suelen admitir que no la realizan rutinariamente. Por el bajo NE disponible y la escasa rentabilidad de la técnica en pacientes asintomáticos desde el punto de vista vocal y sin antecedentes que pudieran estar en relación con un trastorno de la motilidad laríngea, no podemos recomendarla rutinariamente. Debe solicitarse siempre en las siguientes circunstancias:
- 1.
Ante antecedentes de cirugía tiroidea o cervical.
- 2.
Si el paciente presenta disfonía o cambios en el tono de voz.
- 3.
Que vaya a realizarse neuromonitorización intraoperatoria.
- 4.
En casos de afección maligna o probablemente maligna. Ante cánceres avanzados o anaplásicos se debe complementar con broncoscopia y esofagoscopia23.
- 5.
En enfermedad benigna, cuando se prevea un mayor riesgo recurrencial, como en grandes bocios endotorácicos con compresión o desplazamiento traqueal (NE 4, GR C).
Los pacientes deben llegar eutiroideos a la cirugía, por lo que la medicación antitiroidea no debe suspenderse preoperatoriamente24 (NE 5, GR D). Ocasionalmente, pueden ser necesarios betabloqueantes (propranolol) para un mejor control sintomático25. La medicación antitiroidea actual puede haber convertido en innecesario el uso preoperatorio de la solución de Lugol en la enfermedad de Graves-Basedow26–29 (NE 5, GR D).
Estudio genético y de biología molecularSe realiza sobre muestras de tejido tiroideo. Puede ser útil en nódulos tiroideos con citología indeterminada. Las mutaciones somáticas más estudiadas vinculadas al cáncer diferenciado de tiroides incluyen las de los genes BRAF y RAS (N-RAS, H-RAS y K-RAS), y reordenaciones anómalas tipo RET/PTC. También se analiza la expresión génica para determinación de ARN mensajero o micro-ARN17,30. Son determinaciones caras, de resultados no validados, utilidad no definida y utilización selectiva, aunque se prevé su incorporación a los algoritmos de decisión a medio plazo (NE 2b GR B). Por otra parte, los estudios mutacionales resultan imprescindibles en sospecha de síndromes multiglandulares (MEN2), en relación con el protooncogén RET31.
Aspectos intraoperatoriosProfilaxis antibióticaPretende disminuir la carga bacteriana local durante el procedimiento32. La incidencia de infección del sitio quirúrgico varía dependiendo de la localización y el tipo de cirugía. Si no existe inflamación tisular previa, y se mantiene la integridad de la vía aerodigestiva, la tiroidectomía debe considerarse cirugía limpia que no precisa profilaxis antibiótica33–38. Algunos factores de riesgo justificarían su uso en un paciente concreto, cuando se presente al menos uno de ellos: cáncer, linfadenectomía asociada, apertura de la vía aérea, cirugía prolongada o presencia de al menos un factor de riesgo clínico: radiación cervical previa, quimioterapia reciente, edad avanzada, desnutrición, diabetes mellitus, obesidad, tabaquismo, anemia, enfermedad vascular periférica, inmunosupresión34 (NE 3a, GR C). Se administrará en dosis única antes de la incisión cutánea, y debe cubrir los patógenos más comunes en esta zona (cocos grampositivos, incluyendo especies de estreptococos, estafilococos coagulasa negativos y Staphylococcus aureus)39,40.
Profilaxis antitrombóticaExisten factores de riesgo bien conocidos de la enfermedad tromboembólica venosa41,42.
Diversos modelos estratifican dicho riesgo43–45, como el de Caprini (material suplementario, tabla 3 del anexo 1)45. Este y la valoración del riesgo de hemorragia46 son recomendables para decidir la prescripción de la profilaxis tromboembólica. La guía en terapia antitrombótica del American College of Chest Physicians incluye la tiroidectomía en el mismo grupo de riesgo que la cirugía intestinal, urológica y de mama, y establece unas recomendaciones terapéuticas aplicables (material suplementario, tabla 4 del anexo 1)47.
La mayor parte de los pacientes sometidos a tiroidectomía son de riesgo al menos moderado. Por otra parte, la profilaxis farmacológica puede incrementar el riesgo de hemorragia en cirugía tiroidea hasta en un 0,5%48. Evaluaciones recientes de la ratio riesgo/beneficio recomiendan reservar la profilaxis tromboembólica farmacológica para pacientes de alto riesgo, con c5 u más puntos según el modelo de estratificación de riesgo de enfermedad tromboembólica venosa de Caprini45,49 (NE 2a, GR B).
Profilaxis antieméticaLas náuseas y vómitos posoperatorios aparecen hasta en un 71% de los casos tras una tiroidectomía50,51. Provocan malestar en el paciente, y un aumento de la presión venosa que compromete zonas de sellado o ligaduras vasculares, favoreciendo hemorragias. La dexametasona preoperatoria reduce su incidencia, el dolor y la necesidad de analgésicos, y mejora la función vocal52–54. Se recomienda el uso rutinario de profilaxis antiemética con una dosis preoperatoria única de 8mg de dexametasona55 (NE 1a, GR A).
HemostasiaEs imperativo comprobar la hemostasia tras acabar la resección tiroidea. Las hemorragias venosas pueden evidenciarse con maniobras de Valsalva, aplicando presión espiratoria positiva en el circuito de ventilación. La posición de Trendelenburg a 30° ayuda a identificar puntos sangrantes adicionales56 (NE 2b, GR B). Los vendajes compresivos cervicales no son útiles y dificultan la visualización de un posible hematoma, por lo que no están justificados57 (NE 1b, GR A).
Además de los sistemas clásicos de hemostasia, contamos con nuevos dispositivos, como el sistema de energía ultrasónica y el sistema de sellado vascular electrotérmico bipolar. En varios metaanálisis, su uso es ventajoso respecto a los sistemas convencionales en cuanto a tiempo operatorio, hemorragia intra y posoperatoria y estancia hospitalaria (NE 1a, GR A)58–61. La limitada evidencia actual no permite extraer recomendaciones respecto a las ventajas del uso de uno de los dispositivos sobre el otro62–68.
Se ha propuesto la aplicación de hemostáticos locales y sellantes (principalmente a base de fibrina). Pueden ser útiles para mejorar la hemostasia y prevenir seromas posquirúrgicos. En algunos estudios reducen el débito medido en los drenajes68, permiten obviar su uso y reducen la estancia hospitalaria69–73. Sin embargo, los productos utilizados son dispares, y los estudios, escasos y de reducida casuística, por lo que no se puede justificar su aplicación sistemática73 (NE 2b, GR B).
Biopsia intraoperatoriaNo es útil para descartar malignidad en lesiones con resultado citológico de neoplasia folicular, pues se precisa un análisis detallado para la determinación de invasión capsular o vascular74,75. Tampoco sería coste-efectiva en pacientes con una PAAF diagnóstica de carcinoma papilar76–78. Algunos trabajos alertan del posible efecto producido por los cortes por congelación de la pieza quirúrgica, que podría alterar la identificación de la invasión capsular y vascular, los cambios nucleares y la detección de microcarcinomas74,75. Por tanto, no se recomienda su uso sistemático en la cirugía del nódulo tiroideo. Debería quedar reservada para casos de sospecha citológica de malignidad, hallazgos intraoperatorios inesperados indicativos de cáncer, o confirmación diagnóstica de lesiones poco frecuentes (NE 2C, GR D).
Neuromonitorización intraoperatoriaDesde principios del siglo xx se ha recomendado la identificación rutinaria del nervio recurrente laríngeo durante la tiroidectomía para disminuir sus lesiones79. Asimismo, es deseable la preservación de la rama externa del nervio laríngeo superior, relacionado anatómicamente con la arteria tiroidea superior80.
La introducción de la neuromonitorización intraoperatoria en cirugía tiroidea es reciente. En el método más usado, un tubo endotraqueal con electrodos en su parte externa recoge el efecto de la estimulación del nervio recurrente a través de la contracción de las cuerdas vocales. Su utilización exige una laringoscopia pre y otra posoperatoria81. Entre sus ventajas, podemos incluir:
- 1.
Puede evitar la lesión recurrencial bilateral, si el cirujano no actúa en el segundo lado tras constatar una pérdida de señal electromiográfica en el primero82,83.
- 2.
Puede ser especialmente útil en reintervenciones, para cirujanos con bajo volumen de actividad, y desde el punto de vista docente y medicolegal84,85.
También se han descrito inconvenientes:
- 1.
Su uso no impide la parálisis recurrencial, pues la predice solo cuando ya ha ocurrido la lesión85,86. La estimulación continua del vago podría detectar cambios electromiográficos reversibles, pero sus resultados no están testados de forma fiable87.
- 2.
Tiene un bajo valor predictivo positivo88. Ante una pérdida de señal, las posibilidades de una parálisis son del 30-75%. Causas de falsos positivos son el desplazamiento del tubo endotraqueal, problemas de equipamiento, un campo quirúrgico cubierto de sangre y persistencia del bloqueo neuromuscular.
- 3.
Su uso puede demorar a una segunda cirugía la totalización de la tiroidectomía. Hasta en un 90% de los pacientes sin sección nerviosa, la actuación en el segundo lado no añadiría riesgo, por recuperación intraoperatoria de la función nerviosa89.
- 4.
Es dudosamente coste-efectiva. No reduce el tiempo quirúrgico, y añade costes directos y tiempo de quirófano88.
Dos metaanálisis analizan su utilidad84,85. Uno no mostró reducción en las tasas de lesión nerviosa con su uso84. En el otro85,86,90–94 solo redujo significativamente el riesgo de lesión transitoria de la rama externa del laríngeo superior. Con estos datos no se puede recomendar su uso rutinario (NE 5, GR D).
Autotrasplante de paratiroidesEl autotrasplante de paratiroides en el músculo esternocleidomastoideo es una maniobra muy extendida, aunque existen dudas sobre su grado real de utilidad95. En principio solo está indicada cuando alguna glándula ha quedado totalmente desvascularizada o ha sido extirpada inadvertidamente. La mejor prevención es mantener in situ las glándulas y su vascularización con una técnica meticulosa, ya que la tasa de hipoparatiroidismo permanente aumenta de forma significativa tras el autotrasplante de más de 2 glándulas95 (NE 4, GR C).
Uso de drenajesPuede obviarse prácticamente en el 90% de las tiroidectomías96, ya que:
- -
No previenen la hemorragia ni hacen más rápida la posible reintervención.
- -
Su débito escaso no descarta el hematoma, pues pueden estar obstruidos por coágulos.
- -
No evitan las colecciones y seromas posoperatorios.
- -
Pueden aumentar la tasa de infección de la herida quirúrgica.
- -
Causan molestias a los pacientes y alargan la estancia hospitalaria.
En resumen, tal como recoge una revisión de la Colaboración Cochrane (válida para pacientes sin extensión endotorácica del tiroides, coagulopatía o disecciones ganglionares), no ofrecen beneficios y son innecesarios97–99. Por tanto, se recomienda utilizarlos de forma selectiva (NE 1a, GR A).
Aspectos posoperatoriosEstancia en la Unidad de ReanimaciónEl tiempo de estancia mínimo recomendado es de 6h100,101 (NE 5, GR D). Allí se atienden posibles complicaciones, como náuseas y vómitos, dolor, alteraciones respiratorias (dificultad respiratoria, estridor laríngeo) y cardiovasculares, hemorragia causante de un hematoma asfíctico y otras101,102. En ausencia de complicaciones, se puede iniciar la ingesta oral de 4 a 6h tras la cirugía, preferentemente a demanda103–106 (GR 2b, NE B).
Monitorización de la función paratiroidea y tratamiento de la hipocalcemiaLa hipocalcemia es la complicación más frecuente después de una tiroidectomía bilateral. Ocurre transitoriamente en un 30% de los pacientes y queda como secuela permanente (después de la cirugía) en un 2%. Sus síntomas pueden iniciarse hasta 72h después de la tiroidectomía. Se precisan controles analíticos para descartarla precozmente (NE 2a, GR B)107–110, que por su mínima incidencia no serían coste-efectivos tras la hemitiroidectomía111.
La tendencia a realizar cirugía ambulatoria112,113 ha estimulado el desarrollo de diferentes modalidades para su detección precoz114–117. La determinación aislada de calcemia tendría una máxima fiabilidad a las 72h, incrementando la estancia hospitalaria. Puede medirse el calcio total corregido con albúmina o proteínas totales (más económico y extendido) o el ionizado117,118. La medición de cifras de PTH, tomadas en las primeras 24h después de la tiroidectomía, es útil como predictor de hipocalcemia119 (NE 2a, GR B). Asociada a la calcemia, aporta la máxima fiabilidad119–125. Dado que sus valores de referencia y unidades de medición varían125, es más generalizable su nivel de descenso relativo desde los valores pre a posoperatorios126, estando el gradiente más predictivo situado en un 40-75%110,119,120,126–128.
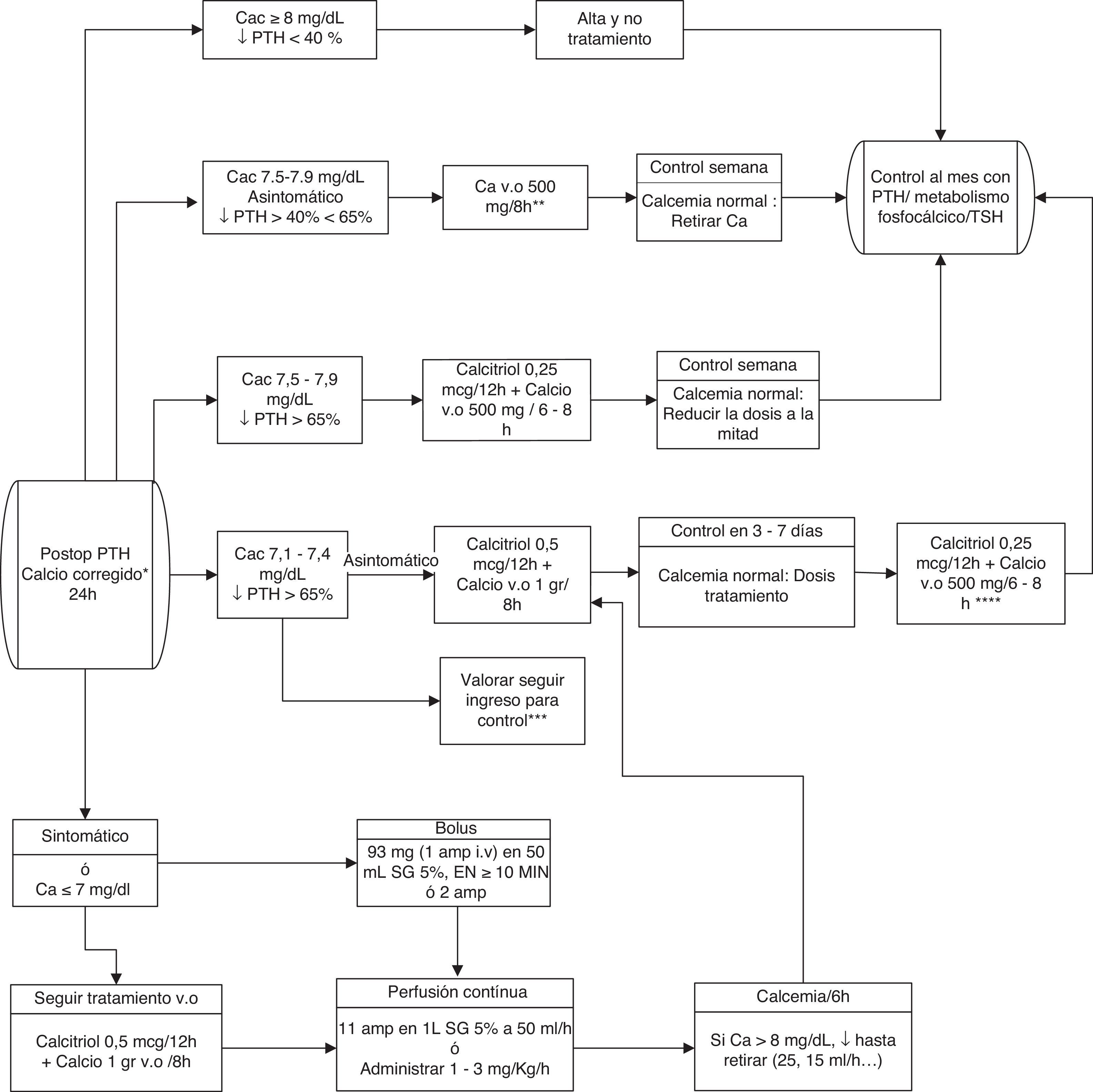
Si no disponemos de cifras de PTH se puede establecer un punto de corte de 15pg/mL. Pacientes con valores superiores no necesitarán calcio si presentan calcemias mayores o iguales a 8mg/dL, y se tratarán con calcio a dosis bajas si presentan calcemias menores a 8mg/dL.
La reposición debe ser más agresiva, incluyendo calcitriol, ante cifras de PTH inferiores a 15pg/mL.
Las estrategias terapéuticas ante la hipocalcemia incluyen la reposición rutinaria o selectiva (según necesidades objetivadas) de calcio oral, asociada o no a calcitriol, forma activa de la vitamina D. Esta asociación es más efectiva, pero exige una monitorización más estrecha para evitar hipercalcemias129–132 (NE 2b, GR B). El calcio intravenoso se reserva para pacientes muy sintomáticos o con calcio menor de 7-7,5mg/dL133–136. Debe asociarse al tratamiento oral para normalizar más rápidamente la calcemia (NE 2b, GR B). Para la reposición oral, los compuestos más recomendados son el carbonato o el citrato cálcico. Para el tratamiento intravenoso (en perfusión lenta) es preferible el gluconato cálcico, en ampollas de 10mL al 10% conteniendo 93mg de calcio elemental. Otra opción es el cloruro cálcico en ampollas de 10ml, al 10% conteniendo 270mg de calcio elemental, aunque con más efectos adversos.
Ante hipocalcemias graves o resistentes se debería descartar una hipomagnesemia concomitante (niveles de Mg<0,7mEq/L o 1,4mg/dL). Para una reposición rápida se precisa tratamiento intravenoso137–139, aunque siempre es preferible la reposición oral. El tratamiento urgente (vía intravenosa) se realiza administrando 6-12mmol/L de sulfato de magnesio (Sulmetin®) inmediatamente, y 40mmol en las siguientes 5h. Una ampolla contiene 150mg, 12mEq o 6mmol de Mg++. Se deben pasar estas 1-2 ampollas en 10-20min (nunca una ampolla en menos de 10min). Por vía oral se deben administrar 15mmol/día (unos 400 mg de óxido de magnesio). La suplementación debe mantenerse hasta que mejore la ingesta oral y la magnesemia sea superior a 2mg/dL. Hay más hipocalcemia en pacientes con déficit preoperatorio de vitamina D, por lo que sería aconsejable mantener sus niveles preoperatorios en rangos adecuados135,136,140.
En conclusión, para minimizar el riesgo de hipocalcemia y favorecer estancias posoperatorias de un día proponemos la determinación conjunta de calcemia (al día siguiente de la intervención) y PTH posoperatoria (extraída entre 4 y 24h tras el final de la cirugía, en función de la disponibilidad de los centros). Para esta última se considerará un gradiente de descenso del 65% de su valor preoperatorio para indicar tratamiento sustitutivo127. Si hubiese mayor probabilidad de hipocalcemia por incidencias intraoperatorias, se podría instaurar tratamiento «profiláctico» oral precozmente. Las pautas recomendadas de reposición se presentan en la figura 1.
Algoritmo terapéutico de reposición de calcio.
Amp: ampollas; Ca: calcio; Cac: calcio corregido. i.v.: intravenoso; SG: suero glucosado; v.o.: vía oral; PTH: hormona paratiroidea; TSH: hormona tirotropa.
*La calcemia puede ser medida con calcio total corregido (con proteínas o albúmina) o bien con calcio iónico. Los valores aquí propuestos son para calcio corregido.
**Las dosis reflejadas son de calcio elemental.
***Valorar el ingreso en pacientes muy sintomáticos o con signos severos de hipocalcemia, lejanía o difícil acceso a centro sanitario, o previsión de dificultad en su manejo ambulatorio.
****Valorar peso y cifras de calcemia.
El estándar actual es la hospitalización posoperatoria al menos una noche (NE 5, GR D), y el período mínimo de observación hospitalaria, de 6-8h. La cirugía ambulatoria es posible para pacientes seleccionados112,140–145. La American Thyroid Association ha propuesto unas contraindicaciones relativas (material suplementario, tabla 5 del anexo 1)146 y unas condiciones que el paciente debe cumplir para el alta hospitalaria ambulatoria:
- 1.
Capacidad para tomar líquidos y medicación oral.
- 2.
Adecuado control del dolor con analgésicos orales.
- 3.
Recuperación completa de la capacidad de deambulación preoperatoria, y de la realización de las actividades básicas de la vida diaria.
- 4.
Adecuado estado clínico tras revisión de la herida, descartando inflamación o hematoma cervical, disfonía, disfagia o disnea.
- 5.
Adecuada oxigenación, signos vitales y presión arterial.
- 6.
Adecuado apoyo social y comprensión de las instrucciones.
Las recomendaciones para la suplementación con hormona tiroidea varían según la enfermedad intervenida. Tras tiroidectomía total en dolencia benigna no hiperfuncionante, se recomienda iniciar en la primera semana dosis diarias de levotiroxina de 1,6mcg/kg. Para mayores de 65 años o cardiópatas es recomendable iniciar una dosis menor. El objetivo será mantener cifras de TSH normales a las 4-6 semanas. La suplementación hormonal a largo plazo debería ser realizada por el endocrinólogo, y una vez ajustada la dosis sería suficiente una determinación anual deTSH9,147. Tras una lobectomía no es necesario iniciar tratamiento, valorándose la necesidad de suplementación mediante TSH a las 4-6 semanas. Dado el porcentaje no desdeñable de pacientes con recidiva de enfermedad nodular tras hemitiroidectomía, sería recomendable un control clínico y ecográfico cada 2 o 3 años, por parte del cirujano o el endocrinólogo148.
En el período posoperatorio del hipertiroidismo se suspenderán los antitiroideos. Los betabloqueantes deben ser disminuidos progresivamente a lo largo de una semana. La sustitución con levotiroxina puede iniciarse a la semana a dosis de 1,7mcg/kg24,149.
En afección maligna (cáncer diferenciado de tiroides), la dosis dependerá del estadio de la enfermedad, de la intención de administrar radioyodo y de la manera en que se pretenda estimular la TSH. Si no se planea realizar ablación o si se realiza utilizando TSH recombinante, se iniciará la sustitución con levotiroxina a 1,6-2mcg/kg para obtener frenación de TSH (<0,1mUI/L). En casos de alto riesgo de recidiva se precisarán dosis supresoras de TSH (<0,01mUI/L)5,7,150,151 (NE 2b, GR B).
Respecto al control de la función paratiroidea, si el paciente ha requerido tratamiento sustitutivo, se recomienda hacer control analítico precoz. Dosis máximas de calcio y vitamina D precisan control analítico a los 3 días, o reducir el aporte de calcitriol y/o calcio oral a los 3 días y control analítico a la semana. Dosis menores permiten el control a la semana. Sería recomendable una analítica con PTH al mes posoperatorio para evaluar la recuperación de la función paratiroidea7,24,152–155 (NE 2b, GR B).
Debe valorarse la función vocal. Aunque hay controversia e insuficiente evidencia, y depende de la disponibilidad de cada centro, sería recomendable realizar laringoscopia posoperatoria en todos los casos, especialmente si se ha realizado preoperatoriamente, como control de calidad de las unidades9,156 (NE 5, GR D). Resulta indispensable en pacientes con alteración preoperatoria de motilidad de las cuerdas vocales, y en aquellos con desarrollo posoperatorio de disfonía, fonoastenia, voz bitonal o trastorno deglutorio o si se ha efectuado neuromonitorización intraoperatoria.
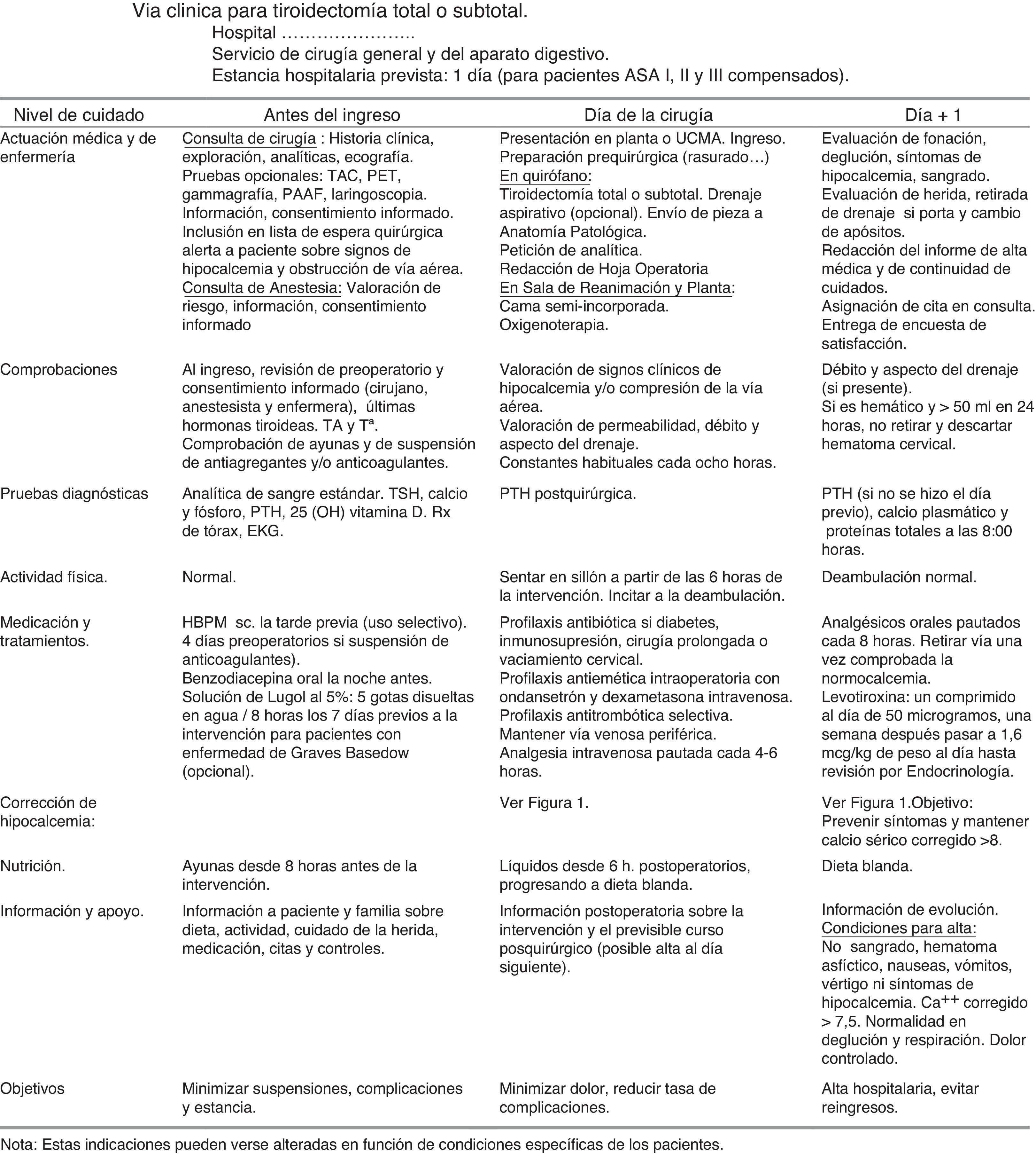
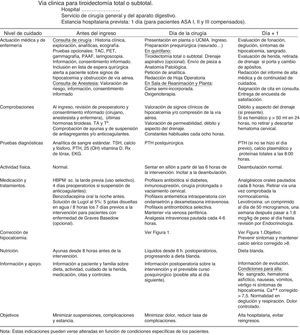
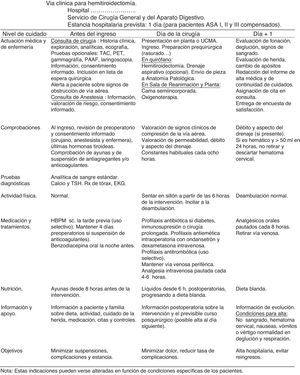
Documentos propios de la vía clínica de tiroidectomíaMatriz temporal. Gráfico que relaciona el tiempo (en divisiones por días u horas) con las acciones e intervenciones realizadas al paciente: evaluaciones y asistencias, determinaciones o test de laboratorio, tratamientos médicos, cuidados de enfermería, medicación, actividad, dieta, información, criterios de ingreso o de alta. Se adjunta en la figura 2.
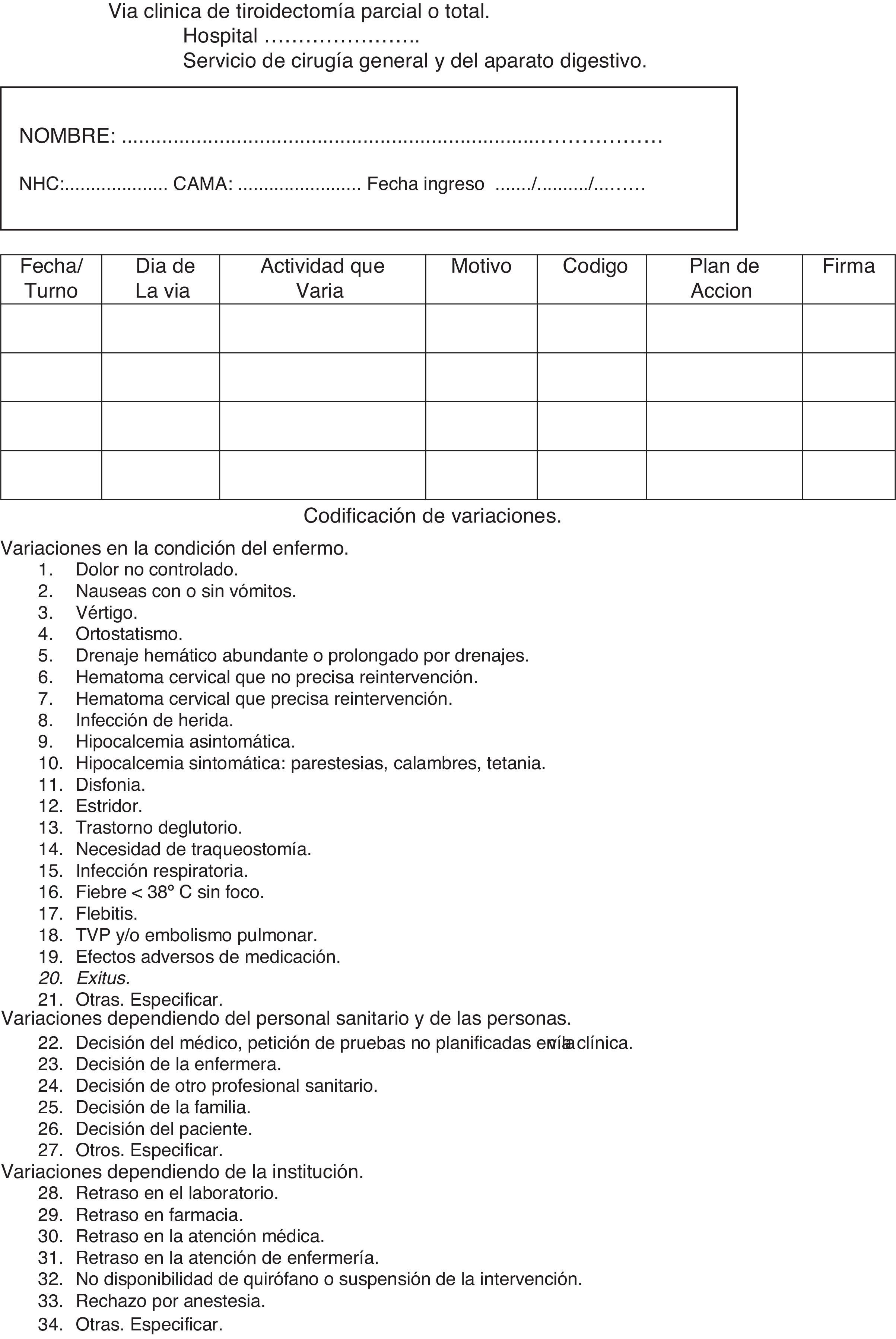
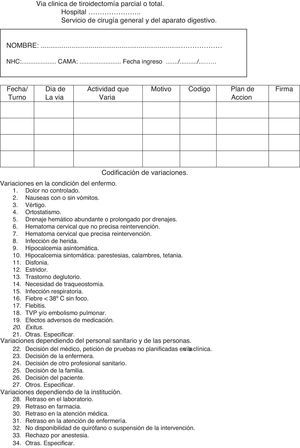
Hoja de variaciones. Recoge las variaciones sobre lo planificado producidas y la solución adoptada. Asigna códigos a las variaciones más relevantes. Se recoge en la figura 3.
Hoja de información para el paciente. Brinda información de las actividades a realizar durante el proceso. Su conocimiento incrementa la colaboración y disminuye la ansiedad inducida por la intervención (fig. 4).
Encuesta de satisfacción. Utiliza indicadores de percepción, evaluación y mejora. Aumentar la satisfacción del enfermo no siempre es más costoso. Se incluye en la figura 5.
Indicadores de evaluación. Se ha seleccionado un grupo de indicadores relevantes, definiendo su fórmula, tipo, justificación, origen, exclusiones, aclaraciones necesarias y bibliografía relevante. Se recogen en el material suplementario (tabla 6 del anexo 1).
FinanciaciónApoyos recibidos para la realización del estudio en forma de becas: ninguno.
Conflicto de interesesNinguno de los autores ha recibido financiación relacionada con la elaboración del presente trabajo ni declara conflicto de intereses alguno.
Parte de la información de esta Vía clínica de la tiroidectomía fue presentada públicamente el 25 de octubre de 2013, durante la XIX Reunión Nacional de Cirugía celebrada en Burgos.