Introducción
No fue hasta el siglo xix que se desarrolló el concepto de metástasis celular desde una lesión local a través de ganglios regionales1. Los ganglios linfáticos regionales se consideraron barreras biológicas a la diseminación de la enfermedad y su exéresis ha formado parte del tratamiento quirúrgico sistemático en la mayoría de los tumores malignos sólidos.
Aunque en general domina el concepto de que el cáncer es una enfermedad sistémica desde los inicios de su historia natural2-4, el tratamiento de los ganglios linfáticos regionales continúa siendo una parte integral del tratamiento quirúrgico del cáncer. Algunos lo argumentan según el valor pronóstico de una depurada estadificación y el control regional de la enfermedad obtenido con la linfadenectomía. El impacto en la supervivencia general, sin embargo, tras la linfadenectomía regional sigue generando considerable debate, sobre todo en el melanoma y el cáncer de mama en los cuales la morbilidad asociada a la linfadenectomía puede no ser insignificante y el número de procedimientos "no terapéuticos" son considerables. Ha sido dentro de este marco conceptual que se han desarrollado técnicas alternativas al tratamiento quirúrgico de los ganglios linfáticos regionales.
El reconocimiento de que no todos los individuos con un melanoma se beneficiarán de una linfadenectomía regional inmediata ha llevado a la búsqueda de estrategias para maximizar la posibilidad de predecir de forma precisa si hay o no afección ganglionar.
Concepto del ganglio centinela y sus implicaciones
El concepto de ganglio centinela (GC) fue referido por Virchow a mitad del siglo xix y Braithwaite utilizó este término en 1923. El concepto fisiológico de la detección del GC fue propuesto y descrito por Cabanas5 en 1977 para el tratamiento del cáncer de pene. Pero el método se abandonó hasta que Morton et al6 redefinieron y mejoraron la técnica aplicada en el melanoma maligno en 1992. Desde entonces, la validación del concepto ha sido confirmada en multitud de estudios realizados en diferentes centros en todo el mundo.
Su concepto surge a partir de la consideración de que la diseminación linfática de las células tumorales se produce en un foco ganglionar inicial (GC) antes de afectar al resto de los territorios linfáticos. Ha quedado demostrado que la situación del GC refleja de forma muy exacta la situación general de los ganglios regionales, no sólo en pacientes con melanoma o cáncer de mama, sino también en un amplio abanico de lesiones malignas7.
El GC es el primer ganglio que recibe el drenaje de células tumorales desde la lesión primaria. Aunque puede haber un GC único, frecuentemente se encuentran entre uno y tres o más8.
El GC no siempre se encuentra en la región ganglionar más próxima y se define mejor como "cualquier ganglio linfático que recibe drenaje linfático directo desde el tumor primario"9.
El desarrollo de la cirugía del GC en la última década ha inducido importantes cambios en el tratamiento quirúrgico de los territorios ganglionares correspondientes a un tumor sólido. El cirujano puede identificar, con un nivel de especificidad antes imposible, los ganglios regionales que más probablemente pueden estar afectados en cada individuo. Esta nueva posibilidad implica una revaloración de los principios que han guiado la extensión de la cirugía ganglionar. La extensión de la resección quirúrgica requerida para conseguir cada uno de los objetivos de la cirugía ganglionar (establecimiento del pronóstico, obtener un control regional, y mejoría de la supervivencia general) no puede basarse simplemente en la idea de la "resección ganglionar regional" y puede variar según los objetivos clínicos. Además, la metodología utilizada para el estudio patológico de los GC es inseparable de esta nueva técnica quirúrgica. Es trascendental que tanto patólogos como clínicos lleven a cabo los estudios clínicos necesarios para definir el papel y el impacto de la cirugía de GC en cada uno de los objetivos quirúrgicos8.
Aplicabilidad en cirugía digestiva
Aunque el concepto de GC ha sido validado en melanoma maligno y en cáncer de mama, la aplicación de este concepto a otros tumores sólidos, incluidos los gastrointestinales, es todavía controvertida. Algunos autores10 han demostrado la posibilidad técnica de la marcación radioguiada de los GC durante una laparotomía en pacientes con cáncer esofágico, gástrico y colorrectal. En 188 pacientes, Kitagawa et al10 obtuvieron por dicha técnica una especificidad diagnóstica del 96% para las metástasis en ganglios linfáticos regionales identificados como GC. Este método también permite detectar los casos con un drenaje aberrante, denominado skip metastasis a partir de la lesión primaria.
El progresivo aumento en la aplicación de la laparoscopia desde principios de los años noventa ha cambiado el pensamiento quirúrgico en el campo de la cirugía gastrointestinal y, recientemente, se ha realizado la determinación de los GC mediante abordaje laparoscópico. Una combinación de radiotrazador y tinta china optimiza su identificación en tumores gastrointestinales. Los resultados preliminares obtenidos indican que la identificación del GC por laparoscopia es una técnica válida para detectar micrometástasis en los ganglios linfáticos, y puede convertirse en un componente importante del tratamiento mínimamente invasivo de tumores gastrointestinales en estadios iniciales.
Ganglio centinela en patología esofagogástrica
El término "progresión ordenada" es difícilmente aplicable para describir el patrón de diseminación del cáncer esofagogástrico. Sano et al11 publicaron que el área ganglionar perigástrica próxima al tumor primario es la primera estación metastásica en tan sólo el 62% de los casos de cáncer gástrico, basados en un análisis retrospectivo de casos con metástasis solitaria. A partir de estas observaciones clínicas, se han establecido como procedimientos estándar las resecciones radicales amplias con linfadenectomía D2 en caso de cáncer gástrico o esofagectomía con disección linfática de tres campos en el cáncer esofágico, incluso en aquéllos con ganglios negativos12,13. Sin embargo, la realización de estos procedimientos implica un incremento significativo de la morbimortalidad14,15.
Con el objetivo de evitar la realización de una cirugía muy invasiva de forma uniforme, la detección del ganglio centinela puede desempeñar un importante papel para obtener información individualizada y, de esta forma, modificar el procedimiento quirúrgico u otras alternativas terapéuticas. Varios estudios apoyan la validez del concepto de GC en el cáncer esofagogástrico16-20.
Detección del ganglio centinela en cáncer gástrico
En la actualidad hay dos procedimientos para la detección del GC: a) método basado en radioisótopo, y b) método basado en tinción.
Utilización de trazador radiactivo. Hay varios tipos de trazadores radiactivos. El 99mTc coloidal y el 99mTc phytate son los más comúnmente utilizados en Japón. En estudios pilotos iniciales, Kitagawa et al utilizaron el 99mTc coloidal, cuyas partículas presentan un tamaño relativamente grande y migra a los ganglios en las primeras 2 h, permaneciendo allí durante más de 20 h a través de la fagocitosis por parte de los macrófagos. Esta característica de las partículas del trazador permite depender menos del tiempo de detección. Las partículas del 99mTc phytate son de menor tamaño y existe el riesgo de migración en ganglios secundarios más allá de los ganglios centinelas. Es por ello que en el momento actual se recomienda la utilización del 99mTc coloidal como trazador óptimo en la detección de GC en el cáncer gástrico.
Se administra el día anterior a la cirugía por inyección submucosa en los cuatro cuadrantes de la lesión primaria mediante endoscopia. Es importante la cantidad de trazador administrada que se sitúa en un volumen de 2 ml (150 MBq).
Detección intraoperatoria de GC mediante combinación de trazador radiactivo y tinción. La observación en tiempo real de los vasos linfáticos y las rutas de drenaje con la utilización de la tinción resulta un método útil de apoyo al trazador radiactivo. La tinción se realiza mediante inyección endoscópica submucosa intraoperatoria. La justificación de la inyección submucosa en lugar de una inoculación subserosa directa se debe a varios motivos; por una parte es difícil identificar lesiones T1 y es importante que la inyección de la tinción sea cuidadosa, además, en el caso de cirugía laparoscópica, no es práctica la inoculación subserosa de la tinción. El procedimiento para la inoculación de la tinción es el mismo que para inocular el trazador radiactivo. Los vasos linfáticos se visualizan claramente de forma inmediata tras la inyección de la tinta, aproximadamente a los 5-15 min tras la inyección. Es importante que la movilización del estómago antes de la inyección se realice sin destruir el drenaje linfático. Por otra parte, es también crucial que al utilizar la sonda para detección del radioisótopo no esté orientada hacia el tumor primario.
Una vez realizada la detección de los GC se lleva a cabo la exéresis del tejido que los contiene, de forma que se lleva a cabo una linfadenectomía selectiva que se puede combinar con una resección modificada del estómago. Miwa et al20 recomiendan este procedimiento con el objetivo de evitar falsos negativos debido a una recogida errónea del tejido ganglionar.
Kitagawa et al21 llevaron a cabo un estudio para la validación de la detección de GC en cáncer gástrico mediante radioisótopo. Para ello realizaron marcación en 270 casos consecutivos de pacientes diagnosticados de cáncer gástrico T1 o T2N0. En dicho estudio la detección de ganglios fue del 97% con un número medio de 4 ganglios; la sensibilidad fue del 92% con una precisión del 99%.
Generalmente, en el cáncer gástrico los GC son múltiples, con una distribución multidireccional. El método radioguiado es una técnica factible y estable para la detección de GC múltiples en el cáncer gástrico. Sin embargo, existen limitaciones prácticas, como la regulación de la seguridad y equipamientos especiales para la utilización del método radioguiado como procedimiento clínico sistemático.
El método basado en la tinción también es aplicable en el cáncer gástrico, sobre todo en cirugía abierta, con el que es posible movilizar el estómago y ver los ganglios linfáticos en tiempo real. Aunque hay varias limitaciones en este método (tránsito rápido y zonas no visibles), la utilización de la tinción es útil. Hay varias opciones para llevar a cabo este método, como diferentes tipos de tinción, lugar de la punción (submucosa o subserosa), volumen de trazador y tiempo de observación. En general, los factores técnicos afectan a los resultados de la cartografía de los GC.
Los errores técnicos que se producen al utilizar un único sistema de detección de los GC se reducen al combinarlo con otro sistema. El método radioguiado permite confirmar la obtención completa de los ganglios con distribución multidireccional, mientras que el sistema basado en la tinción nos permite observarlos en tiempo real. Hasta el momento se recomienda la combinación de ambos para una correcta y sistemática cartografía de los GC en el cáncer gástrico.
Se han obtenido resultados aceptables en diferentes estudios con la utilización de varios métodos (tabla 1). Desde el año 2004 se lleva a cabo en Japón un estudio prospectivo multicéntrico de validación de la determinación de los GC en el cáncer gástrico.
Indicaciones de la determinación del ganglio centinela en el cáncer gástrico
Teniendo en cuenta la información que nos aporta la determinación del ganglio centinela y en qué situaciones podría cambiar el planteamiento del tratamiento a realizar, su indicación se situaría en tumores en estadios iniciales: T1, T2N0.
Arigami et al22 llevaron a cabo un estudio en pacientes con cáncer gástrico con el objeto de valorar la utilización de la RT-PCR (reverse transcriptase polymerase chain reaction) en el estudio de las micrometástasis y objetivaron que, en el 23% de los casos (14 pacientes) en los que la inmunohistoquímica no determinó micrometástasis, éstas se identificaron por RT-PCR. Sólo un paciente presentaba micrometástasis detectables por RT-PCR en otros ganglios que no eran GC, pero este paciente presentaba un tumor cT2. En pacientes con cT1 y cN0, el porcentaje de falsos negativos y de índice de precisión fueron del 0 y el 100%, respectivamente. En conclusión de este estudio, Arigami et al22 consideran que aunque la incidencia de micrometástasis detectadas por técnica de RT-PCR fue bastante elevada, el estudio del GC identificó estas metástasis en todos los pacientes excepto en un caso. En consecuencia, el concepto de GC fue aplicable a pacientes con tumores gástricos cT1 y cN0.
Así pues, dado que el objetivo principal de introducir esta técnica en la cirugía del cáncer gástrico es ampliar la indicación de cirugía mínimamente invasiva en casos con ganglios negativos, no hay ventajas para la inclusión de casos avanzados en los cuales no es aplicable la realización de una cirugía menos invasiva. El tamaño de la lesión primaria también es un factor importante que considerar en la utilización de esta técnica puesto que es difícil cubrir completamente el drenaje linfático en caso de tumores de gran tamaño. Grupos con experiencia en la utilización de esta técnica, como el de Kitagawa, incluyen a pacientes con lesiones primarias únicas que no excedan los 4 cm de diámetro.
A pesar del drenaje linfático multidireccional y complicado de la mucosa gástrica, la situación anatómica del estómago permite un abordaje sencillo para la realización de una cartografía de los ganglios linfáticos en comparación con otros órganos situados en espacios cerrados como el caso del esófago y el recto. En particular, el cáncer gástrico en estadio T1N0 parece ser la entidad más adecuada para intentar la realización de abordajes menos invasivos en cuanto al tratamiento radical, además la resección local laparoscópica es teóricamente factible para el tratamiento curativo del early gastric cancer con ganglios negativos10. En Japón, las aplicaciones clínicas de este reciente procedimiento mínimamente invasivo podrían tener un gran impacto en el tratamiento de los pacientes con esta enfermedad, puesto que el 60-70% de los casos de cáncer gástrico tratados en la mayoría de las instituciones tienen esa categoría.
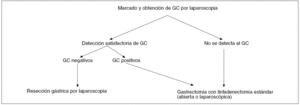
En definitiva, el algoritmo de estrategia terapéutica del early gastric cancer con lesión primaria de un tamaño inferior a los 4 cm de diámetro se puede observar en la figura 123.
Fig. 1. Algoritmo para el tratamiento del cáncer gástrico. GC: ganglio centinela. Tomada de Kitagawa et al23.
Detección del ganglio centinela en el cáncer de esófago
En el caso del cáncer esofágico, la detección del ganglio centinela es más compleja que en el cáncer gástrico. En primer lugar, no es posible su marcación mediante tinción debido a que los ganglios linfáticos de la región del esófago torácico están frecuentemente pigmentados por antracosis y ello dificulta identificar los nódulos marcados por tinción y, por otra parte, en órganos como el esófago y el recto, es preciso realizar una movilización previa de la lesión primaria para conseguir una correcta visualización en tiempo real de la ruta linfática mediante tinción. Pero dicha movilización implica una destrucción de trayectos linfáticos. Por ello, el método utilizado es el basado en radioisótopo19,24. En Occidente, el número de cánceres esofágicos en estadio inicial es muy limitado y es difícil realizar estudios clínicos que investiguen la detección de los GC en estos pacientes. En el cáncer esofágico, los GC son múltiples y con amplia distribución desde el área cervical a la abdominal. En más del 80% de los casos, al menos un GC está localizado en el segundo o el tercer compartimento de los ganglios linfáticos regionales19. La realización de una linfoscintigrafía preoperatoria 3 h después de la inoculación endoscópica del trazador es muy útil para la detección de GC en lugares inesperados distantes de la lesión primaria esofágica. Esta distribución característica de los GC se atribuye al drenaje linfático multidireccional desde el tumor primario. Es esencial plantear y realizar un estudio de validación multicéntrico de cartografía de GC en el cáncer esofágico.
Obtención de los ganglios centinelas
Los GC localizados en el área cervical pueden identificarse con la sonda de forma percutánea y su resección puede llevarse a cabo mediante procedimientos menos invasivos. Por otra parte, la detección y la obtención de los GC intraabdominales se puede llevar a cabo por vía laparoscópica siguiendo el mismo procedimiento que en el caso del cáncer gástrico. Sin embargo, la obtención de los GC mediastínicos es relativamente complicada e invasiva ya que requiere la movilización del esófago torácico, además del obstáculo que representa una lesión primaria para la detección de los GC con la sonda en esa área.
Aplicaciones clínicas de la determinación del ganglio centinela en el cáncer esofágico
Linfadenectomía selectiva basada en el estudio de los GC. El procedimiento de elección del cáncer esofágico torácico en Japón se basa en la esofagectomía con linfadenectomía radical de las tres áreas ganglionares, debido al impredecible y amplio patrón de diseminación linfática12. Por otra parte, la indicación de realizar una disección del tejido ganglionar del mediastino alto en el cáncer de esófago cervical, así como del territorio ganglionar mediastínico bajo en el cáncer de esófago abdominal, es controvertida. La determinación de los GC permitiría una información importante para llevar a cabo una linfadenectomía selectiva individualizada para cada paciente. Por el momento, la resección local de la lesión primaria con GC negativos no es un procedimiento en práctica. Sin embargo, una linfadenectomía selectiva y modificada dirigida al territorio donde se detectan los GC para los casos con N0 es factible y útil desde el punto de vista clínico. Kitajima et al25 comprobaron en su experiencia inicial que las micrometástasis indetectables clínicamente en pacientes con cáncer de esófago en estadio cT1N0 suelen limitarse al tejido donde se incluyen los GC. Aunque la linfadenectomía de los tres campos en el cáncer esofágico torácico es un procedimiento extenso y curativo, su significación pronóstica todavía es un punto de controversia. La aplicación uniforme de este procedimiento muy invasivo incrementa la morbilidad y reduce la calidad de vida de los pacientes. La linfadenectomía selectiva individualizada en los casos cN0 basada en los GC parece ser un procedimiento quirúrgico razonable20. La incidencia de carcinoma de la unión esofagogástrica, incluido el carcinoma de Barrett, se ha ido incrementando, y hay diferentes procedimientos quirúrgicos para esta entidad clínica26. La linfadenectomía individualizada en el carcinoma de Barrett basada en el estudio de la diseminación linfática será uno de los aspectos que destacar en la cirugía oncológica del tracto gastrointenstinal alto, como muestran Stein et al27.
Influencia del GC en la terapia adyuvante mediante una estadificación más depurada. Algunos estudios han objetivado un mayor beneficio de la quimioterapia en los pacientes con ganglios positivos. Pero aunque diferentes autores han demostrado que con los procedimientos convencionales se subestiman las micrometástasis en los ganglios linfáticos regionales, la aplicación de un examen mediante inmunohistoquímica y RT-PCR de todos los ganglios obtenidos es inviable. Un examen de este tipo centrado en los GC puede ayudar a resolver este problema.
Influencia del GC en la aplicación de procedimientos no quirúrgicos en el cáncer esofágico. Recientemente, la quimiorradioterapia ha atraído la atención como un tratamiento curativo multidisciplinario en los casos de cáncer de esófago cT1N0. Aunque se consigue un aceptable efecto en el control local mediante este tratamiento, la recurrencia en ganglios distantes fuera del campo de irradiación es un problema serio por resolver en el seguimiento a largo plazo. Con este tratamiento es indispensable el control de las micrometástasis no visibles. La linfoscintigrafía para objetivar la distribución de los GC en cada paciente es útil para indicar el campo de irradiación.
Ganglio centinela en patología colónica
El cancer colorrectal es la segunda enfermedad maligna más frecuente en los países desarrollados y la segunda causa de muerte secundaria a proceso neoplásico.
El tratamiento con intención curativa se basa en la resección quirúrgica, combinada o no con tratamiento adyuvante y, como en la mayoría de los tumores malignos, la estadificación tumoral en el momento del diagnóstico es el factor pronóstico más importante para predecir la supervivencia.
Aunque la cirugía sola se considera curativa en pacientes con enfermedad localizada en el colon (AJCC, estadios I y II), la supervivencia decrece dramáticamente a aproximadamente el 25-35% en caso de diseminación más allá de la pared del colon con afección ganglionar (AJCC, estadio III). Está demostrado que la supervivencia aumenta en función del número de ganglios negativos analizados y, en el momento actual, el tratamiento adyuvante no se recomienda en pacientes sin afección neoplásica de los ganglios linfáticos (en ausencia de características desfavorables del tumor primario). Así pues, la afección o no de los ganglios linfáticos influye en el pronóstico de los pacientes y en la decisión de realizar quimioterapia adyuvante a la cirugía, ya que se ha mostrado curativo en más de la tercera parte de los pacientes con afección ganglionar28,29.
Sin embargo, el 10-25% de los pacientes con presumible enfermedad localizada en el colon (AJCC, estadios I y II) desarrollarán progresión de su enfermedad y metástasis a distancia en los 5 años siguientes tras la realización de una cirugía con intención curativa. Aunque el motivo de este error es multifactorial, estos resultados obligan a plantearse la inexactitud de los actuales métodos de estadificación que pueden llevar a una infraestadificación. Es razonable asumir que muchos de estos pacientes presentaron micrometástasis ganglionares no detectadas con el examen histológico convencional de los ganglios linfáticos. Este grupo de pacientes es la base para que algunos autores estimen que hay un porcentaje de infraestadificación del 10-20% en pacientes con cáncer colorrectal cuando se realiza cirugía convencional sin determinación del ganglio centinela y con métodos histológicos convencionales30. Ello lleva a buscar métodos que ayuden a obtener una correcta estadificación del paciente31. En el caso del estudio histológico de los ganglios linfáticos, estos métodos incluyen la realización de secciones seriadas32, así como técnicas de inmunohistoquímica con citoqueratina33 y, más recientemente, mediante técnicas de RT-PCR. Estos métodos permiten una mayor detección de micrometástasis (inferiores a 2 mm), pero su realización puede ser impracticable en la clínica diaria debido al volumen de ganglios linfáticos existentes en la pieza operatoria.
En consecuencia, la detección del ganglio centinela permitiría la identificación de un pequeño número de ganglios representativos del estado histopatológico del territorio ganglionar34, y en ellos se puede realizar un estudio más exhaustivo con el objetivo de conseguir una estadificación más exacta de los pacientes, con posible trascendencia en el tratamiento adyuvante requerido.
Métodos de detección de los ganglios centinelas en el cáncer colorrectal
El marcador más frecuentemente utilizado para la determinación de GC en el cáncer colorrectal es el azul de isosulfán al 1% a dosis de 1-2 ml. Con la progresiva mayor utilización de este marcador en la detección de GC se han descrito casos de reacciones anafilácticas35-37, así como posibles interferencias con la monitorización del pulsioxímetro38,39. Por otra parte, en algunos lugares no es de fácil adquisición o bien tiene precios prohibitivos. La fluoresceína 10% es más fácil de obtener y mucho más económica, además de no estar asociada a reacciones alérgicas conocidas. Su aplicación es comparable a la que se describe para el azul de isosulfán tanto en la forma de administración como en la cantidad administrada. Por ello, Saha et al30 intentaron validar la utilización de fluoresceína al 10% como marcador. La han utilizado en los últimos 120 pacientes de su serie con resultados comparables a los obtenidos con azul de isosulfán. El contraste llega rápidamente a los GC que se hacen fluorescentes y se puede identificarlos como nódulos de color amarillo brillante al dejar la sala oscura con la única iluminación de una luz de Wood. También se ha descrito la utilización de radioisótopos. Kitagawa et al19 han utilizado tecnecio tin colloid con buenos resultados.
La determinación del ganglio centinela se ha llevado a cabo en estudios tanto in vivo como ex vivo.
Estudios in vivo. Una de las ventajas observadas en los estudios in vivo en algunos pacientes ha sido la detección de ganglios aberrantes, fuera del territorio ganglionar tradicional, lo que ha permitido llevar a cabo exéresis del territorio linfático más amplias y apropiadas. En el cáncer de colon, Saha et al30, con una serie de 189 casos de cáncer de colon, describen la técnica in vivo utilizada, que consiste en la inoculación de 1-2 ml de azul de isosulfán (Lymphazurin®) al 1% de forma subserosa y circunferencial alrededor del tumor primario. A los 5-10 min de la inoculación comienzan a teñirse de azul los primeros ganglios y se marcan con un punto los cuatro primeros para que los identifique el patólogo, puesto que cuando éste revise la pieza, es posible que los verdaderos GC hayan perdido su color azul y otros ganglios sean los que en ese momento estén marcados con la tinción. Mediante este método se consigue la detección de los GC en el 100% de los casos con un 89% de sensibilidad, un 100% de especificidad y un valor predictivo negativo del 93,5%; se detectaron 4 casos de drenaje linfático aberrante que obligó a exéresis más amplia del territorio linfático. Waters et al40, con la utilización de la técnica in vivo, también consiguen la detección de los ganglios centinelas en el 100% de los casos, con un 5% de sobreestadificación (casos en los que los ganglios centinelas fueron los únicos en los que se detectó células tumorales). En la unión rectosigmoidea, o bien en recto situado por encima de la reflexión peritoneal, se puede utilizar la misma técnica descrita. En pacientes con cáncer de recto medio o bajo, por debajo de la reflexión peritoneal, a quienes se deberá practicar una escisión total del mesorrecto, se puede realizar la inoculación in vivo a través de proctoscopio30, o bien ex vivo en la submucosa, de 1-2 ml de azul de isosulfán (y cuya descripción técnica se presenta en el apartado siguiente). Los ganglios teñidos próximos al tumor se pueden considerar como los GC. Saha et al30 consiguen en el recto la identificación de GC en el 90,6% de los casos con un valor predictivo negativo del 100%.
Estudios ex vivo. Técnica descrita por Wong et al41, consiste en la inoculación de 1 ml de azul de isosulfán al 1% en los cuatro cuadrantes donde se encuentra el tumor (0,25 ml por cuadrante) y en la submucosa una vez realizada la resección oncológica estándar y con la pieza abierta longitudinalmente en el área antimesentérica. Una vez realizada la inoculación, se lleva a cabo un masaje de la zona inoculada durante 5 min. Los ganglios teñidos de azul se designan como GC. La ventaja que defienden los estudios ex vivo es que el tumor se puede manipular y disecador los ganglios linfáticos para identificar los ganglios centinelas sin el riesgo de diseminación de células tumorales. Wong et al41 consiguieron identificar el ganglio centinela en el 92,3% de los pacientes, con una media de 3 GC por paciente, y obtuvieron un 29% de sobreestadificación al identificar las micrometástasis; mientras que Fitzgerald et al42 identificaron los ganglios centinelas en el 88% de los pacientes con cáncer colorrectal. En el estudio de Fitzgerald et al, se sobreestadificó al 8% de los pacientes. Otros estudios han llevado a cabo la detección del ganglio centinela mediante ambos métodos43,44, y se los identificó en un 94-100% de los casos.
También se ha descrito la determinación de GC en el cáncer de colon con técnicas laparoscópicas45. El marcador puede ser inoculado en la submucosa por endoscopia o bien en subserosa bajo visualización por laparoscopia. Kitagawa et al19 han descrito la técnica con localización correcta de los GC con la utilización de una sonda gamma por laparoscopia, al igual que otros autores han utilizado azul de isosulfán 1% con resultados comparables. Wood et al45 describen la detección de GC en el 100% de los casos con una precisión del 100% en una serie de 9 pacientes intervenidos por laparoscopia y con una media de 2 GC identificados por paciente.
Aplicaciones clínicas de la determinación de ganglios centinelas en cáncer colorrectal
En el caso del cáncer colorrectal, la aplicación clínica de su determinación permite una mejor estadificación de un grupo de pacientes en los que las técnicas convencionales no detectarían afección ganglionar (estadios I y II) y en los que el análisis histopatológico de los ganglios con nuevos métodos, como la inmunohistoquímica, permite la detección de micrometástasis y, en consecuencia, la administración de quimioterapia adyuvante que ha demostrado mejorar los resultados en pacientes con afección ganglionar.
Ganglio centinela en patología hepatobiliopancreática
Todavía no se ha encontrado una aplicabilidad evidente del GC en patología hepatobiliopancreática y son muy escasas las referencias que se pueden hallar en la literatura. Algunos estudios han mostrado que el grupo ganglionar pancreaticoduodenal posterior (n.° 13) es el lugar de drenaje regional más importante en los tumores de cabeza de páncreas, y que la situación de estos ganglios permite predecir la de los paraaórticos (n.° 16). Según estos resultados, Ohta et al46 han llevado a cabo el estudio del ganglio centinela en el cáncer de páncreas durante la intervención, con el objetivo de encontrar una cirugía menos invasiva y al tiempo más curable. Ello lo realizan mediante inoculación de tinción de azul al 2% en la zona peritumoral. Aproximadamente 5 min tras la administración del contraste objetivaron uno o más nódulos marcados en el área del grupo ganglionar n.° 13. Estos ganglios se resecaron y se analizaron peroperatoriamente. La decisión quirúrgica posterior se basó en el resultado del análisis de estos ganglios. Así pues, si los GC del territorio ganglionar n.° 13 eran negativos, no se realizó la disección del territorio ganglionar n.° 16, con intención de reducir la morbilidad. En cambio, si los GC del territorio ganglionar n.° 13 eran positivos, se llevó a cabo la disección del territorio ganglionar n.° 16. Hasta el momento de presentar sus resultados habían llevado a cabo la marcación en 9 pacientes del total de 21 casos a los que se sometió a cirugía con intención curativa desde 1997. Pudieron detectar los GC en 8 casos de los 9 realizados (89%). En 4 casos no se realizó la disección del territorio ganglionar n.° 16 ya que los GC del territorio n.° 13 eran negativos. La supervivencia media a los 3 años de los 21 pacientes de la serie fue del 36% y 4 pacientes (3 con GC negativo y 1 con GC positivo) en estadio IVa estaban vivos 3 años después de la cirugía. A estos 3 pacientes con GC negativos se les practicó una duodenopancreatectomía cefálica (DPC) con preservación pilórica combinada con resección de vena porta con intención curativa y sin extensión de la disección ganglionar al territorio n.° 16; no se objetivó en estos pacientes una peor evolución, por lo que los autores consideran que la detección de GC relacionada con la DPC en pacientes con adenocarcinoma de cabeza de páncreas localmente avanzado puede ser una alternativa a la disección sistemática del territorio ganglionar n.° 16, con el objetivo de reducir la morbilidad de estos pacientes.
Son datos muy iniciales y por el momento está por establecer si la detección de GC en este tipo de tumores determinará cambios en la estrategia terapéutica a seguir.
Dificultades y contraindicaciones en la detección del ganglio centinela
El fallo en la detección de GC puede ser el resultado de la quimiorradioterapia neoadyuvante, como es el caso del cáncer de recto. Ello puede deberse a la fibrosis producida por la radioterapia. En casos de una intensa inflamación peritoneal, como puede ocurrir en caso de contaminación por un carcinoma perforado, el marcador puede no se capaz de penetrar en los ganglios linfáticos inflamados. Además, en casos de tumores grandes y con invasión de estructuras adyacentes, puede alterarse la vía de drenaje linfático. Esto puede llevar a error en la identificación de GC. A menudo, en estos casos avanzados, algunos ganglios linfáticos pueden estar completamente reemplazados por tumor y el marcador no puede penetrar en estos ganglios. De todas formas, como se ha objetivado en las diferentes localizaciones, el objetivo de la determinación del GC suele remitirse a casos en estadios no evolucionados, bien sea para llevar a cabo intervenciones menos invasivas, como es el caso de cáncer esofagogástrico, o bien para mejorar la estadificación de pacientes en estadios I y II en el caso de cáncer colorrectal.
Por otra parte, no tendrá indicación de detección de GC en los pacientes con metástasis a distancia o bien en caso de detección clínica de afección ganglionar.
Conclusiones
El GC no siempre se localiza en el territorio linfático más próximo y la definición más adecuada es la de ganglio linfático que recibe el drenaje linfático directo desde el tumor primario9.
En el cáncer esofagogástrico, aunque la determinación de los GC permite una importante información pronóstica, es necesario esperar los resultados de estudios aleatorizados para determinar si la linfadenectomía selectiva del GC, con disección del territorio ganglionar en caso de GC positivo, es de valor terapéutico. Es posible que la positividad del GC sea meramente un marcador de enfermedad con potencial para la diseminación hemática y metástasis sistémicas. Por otra parte, a medida que aumentan los tiempos de seguimiento, se incrementan los índices de GC falsos negativos y se trabaja en hallar los medios para reducir estos índices. Los métodos se dirigen a incrementar la precisión de la identificación de GC tanto en el momento de la cirugía como en el estudio postoperatorio. El objetivo último es desarrollar métodos mínimamente invasivos, e incluso no invasivos, para la valoración de los GC. La tomografía por emisión de positrones (PET) es una técnica que podría hacer posible este objetivo y evitar la morbilidad actual y el coste de la disección de GC mediante cirugía7.
La detección de GC en cáncer colorrectal parece estar bien establecida y la curva de aprendizaje para llevar a cabo la técnica es corta. En los últimos años se han llevado a cabo estudios para la valoración de la dosis de trazador adecuada o bien la posibilidad de utilizar otros trazadores como la fluoresceína, cuyos resultados han sido comparables a los obtenidos con azul de isosulfán con un menor coste y sin asociar riesgos de reacción anafiláctica.
En la actualidad se desarrolla un estudio multiinstitucional llevado a cabo por el American College of Surgeons Oncology Group (ACOSOG-Z0170) con el objetivo de evaluar y verificar la eficacia de esta técnica y valorar su impacto en la supervivencia de los pacientes con cáncer colorrectal. Si esto se verifica, la aplicación de la detección de GC en cáncer colorrectal podría convertirse en una parte de la práctica estándar.
Asimismo, los datos preliminares obtenidos indican que la determinación de GC por laparoscopia es técnicamente factible y puede considerarse como parte del abordaje terapéutico mínimamente invasivo en estadios iniciales del cáncer gástrico10, así como en el tratamiento del cáncer colorrectal en pacientes en estadios I y II a quienes se realice la determinación de GC.
Correspondencia: Dra. C. Balagué.
Servicio de Cirugía General y Digestiva. Hospital de la Santa Creu i de Sant Pau.
Sant Antoni Maria Claret, 167. 08025 Barcelona. España.
Correo electrónico: cbalague@hsp.santpau.es
Manuscrito recibido el 26-2-2007 y aceptado el 27-2-2007.