El análisis citológico tiene un papel fundamental en el estudio de los nódulos tiroideos. Sin embargo, hasta un 30% de estos muestran citologías indeterminadas (BethesdaIII o IV). En estos casos, se realizan cirugías diagnósticas que únicamente demuestran malignidad en un 15-35% de los pacientes. Se precisa una herramienta de mayor precisión para determinar la benignidad o malignidad del nódulo tiroideo con citología indeterminada sin precisar cirugías diagnósticas, evitando así posibles complicaciones y/o costes innecesarios. El uso complementario de paneles moleculares junto con la citología ha sido, de momento, la única herramienta que parece ayudar en este difícil escenario. Se realiza una revisión de la bibliografía sobre el estudio molecular complementario de los nódulos tiroideos para tratar de resumir las características intrínsecas de cada uno de los test disponibles, su coste-efectividad, y determinar sus indicaciones y su aplicabilidad en la práctica clínica habitual.
Even though cytology remains the gold standard to assess the nature of thyroid nodules, up to 30% of the results are indeterminate (BethesdaIII and IV). In these cases, current guidelines recommend performing diagnostic surgery, which proves malignancy in only 15-30% of cases. A more precise method is needed to avoid unnecessary surgeries, surgical complications and costs in the process of diagnosing indeterminate nodules. Complementary use of molecular profiling tests seems to help in this complex scenario. We present a review of the current literature on the usefulness of molecular profiling of thyroid nodules so as to define its indications, costs and usability for clinical practice.
La patología nodular tiroidea es un problema frecuente, con una prevalencia en la población general entre el 3 y el 8%, aunque en series de autopsias el porcentaje se acerca al 50%, siendo la mayoría de nódulos benignos. Solamente alrededor del 5% de los nódulos tiroideos son malignos y en general con buen pronóstico, pero su incidencia está aumentando en los últimos an¿os1.
La importancia fundamental de esta patología tan frecuente radica en diferenciar los nódulos benignos del cáncer de tiroides. La ecografía y el diagnóstico citológico por punción aspiración con aguja fina (PAAF), en general, clasifican correctamente la mayoría de los casos; sin embargo, cuando el resultado citológico es indeterminado (fundamentalmente clasificación de BethesdaIII y IV), el paciente es sometido con frecuencia a una intervención quirúrgica con finalidad diagnóstica. En esta situación, en hasta tres cuartas partes de los pacientes el diagnóstico final suele ser una lesión benigna (adenoma folicular o de células de Hu¿rtle), pero aproximadamente en el 15 al 35% será un cáncer (folicular, variante folicular de cáncer papilar o de células de Hu¿rthle)2.
Diversos estudios citológicos y pruebas de imagen han tratado de aumentar la precisión diagnóstica en estos casos, pero hasta ahora no han llegado a tener resultados concluyentes que eviten la cirugía en los casos en los que finalmente el nódulo se demuestra que es benigno.
Tanto los avances radiológicos como la investigación en biología molecular, incluyendo los estudios de expresión génica, pilares en el diagnóstico del cáncer de tiroides, han proporcionado multitud de datos; pero aún hoy no existe un marcador único con la suficiente capacidad discriminativa entre nódulos benignos y malignos cuando la citología no es concluyente.
Estudios recientes parecen indicar que incluir el estudio molecular en el estudio preoperatorio de nódulos tiroideos con citología indeterminada puede aumentar la precisión diagnóstica en la clasificación de nódulos tiroideos, y con ello reducir la tasa de hemitiroidectomías diagnósticas innecesarias en nuestro medio.
Mediante esta revisión se analiza la literatura sobre el estudio molecular de nódulos tiroideos, con el objetivo de tratar de aclarar sus posibles indicaciones, ventajas y potenciales en su uso en la práctica clínica.
Marcadores moleculares y cáncer de tiroidesLos marcadores moleculares tiroideos son aquellas mutaciones genéticas que presentan las células tiroideas malignas y que pueden estudiarse en fragmentos de biopsia de tejido tiroideo obtenidos por PAAF mediante técnicas de biología molecular. En el carcinoma papilar de tiroides la mejor conocida es la mutación BRAF, presente hasta en el 40-45% de los casos, seguida de RAS y RET/PTC en alrededor de un 20% de los casos. En el carcinoma folicular de tiroides existe mutación RAS en un 40-50% de los casos, seguida por PAX8/PPARγ en un 30-35%3.
Existen actualmente varios paneles moleculares que incluyen el diagnóstico de la mayoría de las mutaciones implicadas en el cáncer de tiroides. Entre ellos se encuentran Thyroseq®, ThyGenX™, ThyraMIR™, Afirma® y RosettaGx Reveal. Incluyen las principales mutaciones (BRAF, KRAS, NRAS, HRAS) y reordenamientos genómicos (RET/PTC1, RET/PTC3 y PAX8/PPARγ), estudiando las mutaciones somáticas a partir de DNA y los reordenamientos a partir de mRNA extraído del material citológico. El análisis se realiza por secuenciación de nueva generación tras amplificación del DNA y mRNA por PCR en tiempo real y el uso de microarrays.
Las principales indicaciones de uso propuestas para estos paneles, aún pendientes de validación, son las siguientes4:
- -
En nódulos con citología indeterminada (BethesdaIII y IV) para tratar de mejorar el diagnóstico y reclasificarlos como probablemente benignos o malignos.
- -
En nódulos benignos por citología (BethesdaII) en los que las características ecográficas sean altamente sospechosas (discordancia entre pruebas complementarias).
- -
En nódulos malignos (BethesdaV y VI) en los que se pretende que las características moleculares guíen la extensión quirúrgica.
Por un lado, los paneles moleculares (Thyroseq® y ThyGenX™) analizan genes específicos cuyas mutaciones están relacionadas con el cáncer de tiroides. Por otro lado, se encuentran los clasificadores de la expresión génica (Afirma® y ThyraMIR™, RosettaGx) que analizan los niveles de expresión de múltiples genes de forma simultánea en microarrays para crear un perfil de la expresión génica del nódulo a estudio. A modo de resumen, las características de estos paneles serían:
- -
ThyroSeq® incluye 60 genes. Su versión Tyroseq V2 mejoró sus características especialmente el valor predictivo positivo (VPP)5 incluyendo más de 1.000 mutaciones de 14 genes para estudio de DNA y 42 fusiones genéticas en 16 genes para evaluar la expresión de RNA. Ha sido evaluado principalmente para neoplasias de estirpe folicular. Además, incluye genes para diferenciar si el tejido a estudio es de origen paratiroideo.
- -
ThyGenX™ incluye la secuenciación de los 8 genes más habituales relacionados con el cáncer de tiroides, incluyendo PIK3CA (involucrado en la progresión del cáncer folicular y anaplásico), para su uso en citologías indeterminadas independientemente de la estirpe.
- -
Afirma® analiza el mRNA de la expresión de 167 genes buscando patrones de expresión asociados a benignidad a través de algoritmos. Al contrario que los paneles previos, Afirma es un test diseñado para descartar malignidad, no para aumentar su sospecha. Ayuda a seleccionar a los pacientes de bajo riesgo. Existen dos variantes específicas para valorar mutaciones BRAF o asociadas a carcinoma medular (Afirma® BRAF y Afirma® MTC, respectivamente)6.
- -
ThyraMIR™ es otro panel de expresión génica que analiza 10 microRNA implicados en la proliferación y progresión de células tumorales tiroideas, y utiliza algoritmos para clasificarlos como probablemente benignos o sospechosos de malignidad. Este panel ha sido diseñado para aumentar la potencia del panel ThyGenX.
- -
RosettaGx Reveal es el más moderno de los paneles de expresión génica. Tras estudios de validación, incluye 24 mRNA, entre ellos el mRNA hsa-miR-375 relacionado con el carcinoma medular de tiroides.
De momento, todos ellos dan un resultado dicotómico (probablemente benigno-probablemente maligno) o positividad/negatividad de mutaciones concretas, aunque en el caso de los clasificadores de expresión génica sería interesante poder obtener un resultado probabilístico.
¿Qué diferencias se encuentran entre los principales paneles moleculares?En función del riesgo de malignidad del propio nódulo y de si buscamos confirmar una malignidad o descartarla, debemos escoger el test más adecuado. Escogeremos por tanto un «rule out» test (alto valor predictivo negativo [VPN] y especificidad [E]) cuando queramos buscar aquellos nódulos en los que se pueda evitar cirugía, y un «rule in» (alto VPP y sensibilidad [S]) test cuando busquemos los nódulos a los que indicar cirugía.
Afirma® ofrece una S del 90%, E del 52%, con un VPN del 94-95% y un VPP del 37-38%. Su principal uso sería no tanto para corroborar la sospecha citológica sino para descartar malignidad (rule out test), pudiendo identificar así aquellos nódulos benignos que puedan evitar la cirugía. Afirma® está diseñado para obtener los mejores resultados en poblaciones con una prevalencia de malignidad en los nódulos indeterminados de entre el 15 y el 21% (rango 12-25%)4. Se ha observado que Afirma® puede dar falsos positivos con la presencia de células de Hürthle, por lo que es menos fiable su resultado. En el estudio de Hang et al.7 no recomiendan el estudio molecular a los nódulos con citología indeterminada que tengan células de Hürtle, ya que su baja E hace poco fiable su resultado. Además, hacen referencia al posible empeoramiento de las propiedades de Afirma® tras la reclasificación de los nódulos tiroideos de estirpe folicular con alteraciones nucleares similares al carcinoma papilar como nódulos benignos (previamente considerados subtipos foliculares de carcinomas papilares).
ThyGenX y ThyroSeq combinan buen VPN y VPP, siendo los de ThyroSeq v2 los mejores salvo cuando se complementa el uso de ThyGenX con ThyraMIR™, momento en el cual el VPN asciende al 96%. Estos dos paneles podrían usarse por tanto para descartar malignidad como para confirmarla (rule out y rule in test), pero su uso mayoritario es para confirmar malignidad.
De momento, RosettaGx, al ser el último comercializado, solo ha sido incluido en el último estudio comparativo y con un único artículo del metaanálisis8. Sin embargo, a diferencia del resto, es el único aplicable a muestras previamente fijadas y tintadas, congeladas o en bloques de parafina, sin necesidad de disponer de tejido en fresco para el estudio9. No precisa por lo tanto una segunda biopsia (tras el resultado citológico indeterminado), sino que puede ser usado en la misma muestra.
El estudio más reciente es un metaanálisis realizado por Vargas-Salas et al.8 en el que comparan los diferentes paneles disponibles, incluyendo 26 estudios de centros estadounidenses (19 Afirma®, 5 ThyroSeq®, 1 ThyGenX™/ThyraMIR™ y 1 RosettaGx Reveal), 8 de ellos multicéntricos. Comparando los diferentes test no se encontraron diferencias significativas en cuanto a la S (en torno al 90%) y VPN (92-96%), si bien llama la atención que la S de ThyGenX™/ThyraMIR™ era mayor en los casos de BethesdaIV. En cuanto a la E, ThyGenX™/ThyraMIR™ (92%) y ThyroSeq® (85%) son notablemente mejores que Afirma® (52%) y RosettaGx Reveal (74%). Lo mismo pasa con ThyGenX™/ ThyraMIR™ y ThyroSeq®, presentando un VPP en torno al 78% (que aumenta hasta 82% en los casos de BethesdaIV) frente a Afirma® (37%) y RosettaGx Reveal (43%), que además no muestran diferencias en los subgrupos. No todos los estudios tuvieron control del resultado tras cirugía, y además los estudios incluidos utilizando ThyGenX™/ThyraMIR™ y RosettaGx Reveal, además de ser menos numerosos, fueron globalmente de peor calidad científica, por lo que los resultados hay que tomarlos con cautela.
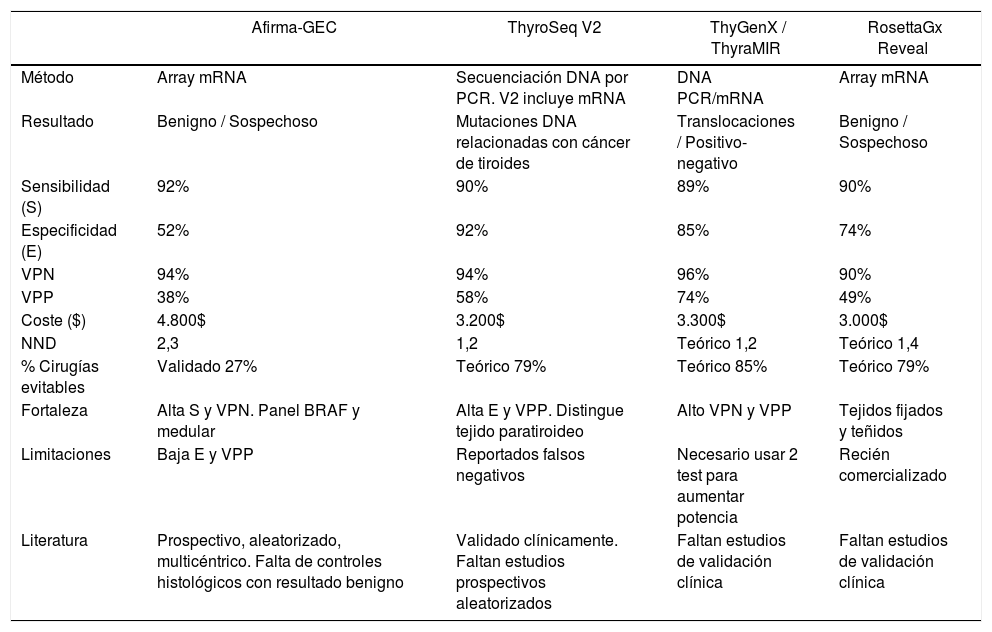
En la tabla 1 se resumen las características de cada test derivadas del metaanálisis, incluyendo el número teórico de cirugías evitadas (NND) y el precio por el cual se comercializa en Estados Unidos.
Comparación de las principales características de los paneles moleculares disponibles
| Afirma-GEC | ThyroSeq V2 | ThyGenX / ThyraMIR | RosettaGx Reveal | |
|---|---|---|---|---|
| Método | Array mRNA | Secuenciación DNA por PCR. V2 incluye mRNA | DNA PCR/mRNA | Array mRNA |
| Resultado | Benigno / Sospechoso | Mutaciones DNA relacionadas con cáncer de tiroides | Translocaciones / Positivo-negativo | Benigno / Sospechoso |
| Sensibilidad (S) | 92% | 90% | 89% | 90% |
| Especificidad (E) | 52% | 92% | 85% | 74% |
| VPN | 94% | 94% | 96% | 90% |
| VPP | 38% | 58% | 74% | 49% |
| Coste ($) | 4.800$ | 3.200$ | 3.300$ | 3.000$ |
| NND | 2,3 | 1,2 | Teórico 1,2 | Teórico 1,4 |
| % Cirugías evitables | Validado 27% | Teórico 79% | Teórico 85% | Teórico 79% |
| Fortaleza | Alta S y VPN. Panel BRAF y medular | Alta E y VPP. Distingue tejido paratiroideo | Alto VPN y VPP | Tejidos fijados y teñidos |
| Limitaciones | Baja E y VPP | Reportados falsos negativos | Necesario usar 2 test para aumentar potencia | Recién comercializado |
| Literatura | Prospectivo, aleatorizado, multicéntrico. Falta de controles histológicos con resultado benigno | Validado clínicamente. Faltan estudios prospectivos aleatorizados | Faltan estudios de validación clínica | Faltan estudios de validación clínica |
Tras su comercialización, muchos han sido los grupos que han incorporado estos paneles moleculares en el algoritmo diagnóstico para tratar de afinar la clasificación de aquellos nódulos tiroideos con citologías indeterminadas.
Chaudhary et al.10 comparan el resultado de Afirma® frente a la anatomía patológica definitiva en 158 casos de nódulos BethesdaIII/IV entre los años 2012 y 2015. Tras el estudio con Afirma®, el 86% de los nódulos clasificados como sospechosos por el test se intervinieron, resultando ser un 62% histológicamente benignos. En el caso de los nódulos con resultado Afirma® de benignidad, el 13% se intervinieron, confirmándose en el 100% la histología benigna de la lesión (VPN del 100% y VPP del 38%). Afirma® logró reclasificar el 40% de nódulos tiroideos con categoría BethesdaIII/IV como benignos, consiguiendo reducir la tasa de resecciones quirúrgicas (52% vs 76%) solo en el grupo BethesdaIV pero no en el III, en comparación con los años 2009-2012 (sin uso complementario de Afirma®), posiblemente debido al tamaño muestral.
Kloos6 realiza una revisión sistemática de todas las publicaciones relacionadas con el impacto del uso de Afirma® en las decisiones clínicas. De esta revisión se extrae que un resultado de Afirma® no sospechoso conlleva un riesgo de malignidad menor del 5% (VPN>94%) para nódulos BethesdaIII y IV en poblaciones con prevalencia de malignidad de alrededor del 20% en estos nódulos. Este resultado es comparable al riesgo de malignidad que presentan los nódulos con citología benigna (6-8%), lo que apoya el manejo de los nódulos BethesdaIII y IV tras resultado de Afirma® no sospechoso como si fuesen nódulos benignos. Se evalúa también la tasa de indicación quirúrgica antes y después de la implantación de Afirma®, demostrándose una reducción significativa del 73% histórico al 10% con Afirma® para nódulos BethesdaIII/IV con un seguimiento de 3años. De esta revisión se extrae que el número necesario a tratar (NNT) para poder evitar una cirugía a un paciente es 2; es decir, por cada dos pacientes estudiados con el panel molecular (BethesdaIII y IV), uno de ellos podría potencialmente evitar la cirugía5. En el caso de citologías con células de Hürthle, Kloos6 también describe el aumento de falsos positivos, por lo que el NNT asciende a 3.
Sacks et al.11 publicaron en 2016 un estudio donde comparaban pacientes estudiados con Afirma® entre julio de 2013 y diciembre de 2014 (post-Afirma®) con una cohorte retrospectiva entre enero de 2012 y julio de 2013 (pre-Afirma®), analizando en total 4.292 muestras obtenidas mediante PAAF. Llama la atención en este estudio el aumento de diagnóstico de BethesdaIII y IV en el grupo post-Afirma® (con una disminución secundaria de diagnósticos BethesdaII). Esta diferencia es interpretada por los autores como consecuencia de que la propia existencia y disponibilidad del test molecular haría preferir de forma inconsciente a los patólogos el incluir los nódulos en categorías indeterminadas para complementar su estudio. La tasa de cirugía y de malignidad no demostró diferencias significativas entre ambos grupos. Además, un tercio de los pacientes fueron estudiados con Afirma® tras un primer resultado de citología indeterminado, sin repetir PAAF. Sin embargo, el 35% de los pacientes con citologías indeterminadas en los que se repitió la PAAF fueron reclasificados (no-indeterminada) a través de esta segunda punción, sin precisar el estudio molecular complementario. Cabe destacar en este estudio el posible sesgo al comparar con una cohorte retrospectiva.
¿Significa esto que es fiable un resultado Afirma® negativo, pudiendo obviar la cirugía y seguir a los pacientes como si se tratase de un nódulo benigno? Existen dos artículos recientes que evalúan el seguimiento a largo plazo en estos casos (entre 20 y 36 meses) y concluyen que su comportamiento a largo plazo es superponible al de los nódulos con citología benigna, por lo que el seguimiento sin cirugía es factible y seguro en estos casos. Por un lado, el artículo de Sipos et al.12 en 2016 realiza una encuesta a los médicos implicados en la toma de decisiones clínicas de estos pacientes y encuentra que el 86% de estos lo considera útil y que aporta beneficio para los pacientes el estudio molecular de los nódulos con Afirma®. Por otro lado, Singer et al.13 publican en 2016 un estudio retrospectivo comparando el seguimiento y las tasas de resección de pacientes con citologías positivas y aquellos con citologías indeterminadas y estudio molecular Afirma® sugestivo de benignidad. Se incluyeron 804 pacientes (201 estudiados molecularmente y 603 solo citológicamente) y observaron que no había diferencias ni en las tasas de cirugía durante los primeros 20 meses de seguimiento (el 86,6% de los pacientes con estudio molecular sugestivo de benignidad se manejó de forma conservadora), ni en la necesidad de repetir pruebas de imagen.
No existen publicaciones acerca del uso en la práctica clínica de ThyGenX™/ThyraMIR™, ni de RosettaGx, ya que ha sido el último comercializado.
En cuanto al panel de expresión génica Thyroseq®, el número de estudios es menor. Shapouran et al.14 publicaron un estudio retrospectivo con 66 pacientes (38 Thyroseq® y 28 Afirma®). El 57% de los pacientes tuvieron un resultado Afirma® sospechoso, de estos el 69% se intervinieron, presentando malignidad solo el 36%. Por el contrario, de los 43% no sospechosos, se confirmó benignidad en el 100% durante el seguimiento o con cirugía por crecimiento del nódulo. Por otro lado, en los pacientes estudiados con Thyroseq® un 34% mostraron resultado sospechoso, interviniéndose el 54% y confirmando malignidad en un 71% (mejor VPP que Afirma®). Sin embargo, del 66% de nódulos clasificados como benignos, solo hubo un falso negativo. Concluyen que el estudio con panel molecular consiguió evitar la cirugía a el 51% de los pacientes.
Nikiforov15 publica en una revisión varios estudios con resultados del uso de Thyroseq® en 465 nódulos con citología indeterminada recogidos entre mayo de 2014 y mayo de 2015. La S, la E y los valores predictivos son superponibles a los expuestos previamente. Llama la atención que el 77% de los nódulos sospechosos intervenidos demostraron malignidad; de estos, el 90% fue de estirpe folicular y un 10% papilar. Hubo además dos casos de falsos negativos (ambos carcinomas papilares) y 5 casos de falsos positivos, todos adenomas con RAS mutado, proliferación clonal con atipias nucleares e inmunohistoquímica característica de carcinoma papilar. Además, tres nódulos tiroideos expresaron en el panel molecular genes de estirpe paratiroidea (resultaron ser adenomas paratiroideos, demostrándose hiperparatiroidismo analítico), por lo que los autores concluyen que no solo puede ser usado para distinguir malignidad y benignidad sino para distinguir tejido no tiroideo.
Existe también controversia en la literatura acerca de si el estudio molecular de los nódulos puede ayudarnos a decidir la extensión de la tiroidectomía. Nicholson e Yip16 proponen que el estudio molecular sea además utilizado en nódulos tiroideos de entre 1 y 4cm con citología de carcinoma papilar para guiar la extensión de la cirugía.
Hasta el momento no hay ningún estudio que compare la alteración de la calidad de vida percibida tras la tiroidectomía diagnóstica en comparación con el seguimiento a largo plazo de los nódulos con citología indeterminada reclasificados como benignos a través del uso de un panel molecular.
Coste-efectividadEn cuanto a los costes, estudios previos que comparaban exclusivamente el test genético con los costes de la tiroidectomía inclinaban la balanza a favor del uso del panel molecular. Sin embargo, cuando en estos estudios se incluye el seguimiento a largo plazo (5años) de los nódulos se observa que los costes derivados son mayores.
El último estudio publicado al respecto es el estudio de Balentine et al.17, basado en un modelo económico probabilístico que concluye que, aunque los costes iniciales de la cirugía son mayores en comparación con el estudio molecular del nódulo, la actitud quirúrgica de entrada es más coste-efectiva, ya que evita los costes derivados del seguimiento. Wu et al.18 concluyen que la estrategia de seguimiento tras estudio molecular solo es superior en coste efectividad en aquellas áreas en las que la prevalencia de malignidad sea baja (dado que el valor predictivo negativo depende de la prevalencia de enfermedad).
De momento no existen estudios prospectivos y aleatorizados que evalúen el coste-eficacia de ambas intervenciones, ni estudios que evalúen los costes secundarios de variables subjetivas derivadas de la ansiedad percibida por los pacientes al evitar la cirugía, la seguridad percibida tras realizar un test genético o la alteración en la calidad de vida en las dos ramas de tratamiento.
¿Cuándo debería usarse?Tanto la American Association of Clinical Endocrinologists (AACE) como el American College of Endocrinology (ACE) y la Associazione Medici Endocrinologi (AME) decidieron incluir recomendaciones sobre su uso en las Guías del 2016 en aquellos nódulos:
- -
Con citología indeterminada (no para revalorar nódulos con citologías claramente benignas ni malignas).
- -
En los que el diagnóstico molecular no sustituya la reevaluación citológica si lo precisa.
- -
Siempre y cuando es esperable que el resultado que cambie el manejo clínico.
Además, de momento no hay evidencia suficiente para que el resultado del estudio molecular marque la extensión de la cirugía en el caso de que esta se indique ni suficientes resultados a largo plazo como para distanciar o suspender el seguimiento en los pacientes estratificados como de bajo riesgo tras el estudio molecular19.
Las mismas recomendaciones fueron incluidas en las guías 2017 del Carcinoma de Tiroides del National Comprehensive Cancer Network (NCCN), recomendando su uso para aquellos nódulos con citología indeterminada (BethesdaIII y IV) en los que se quiera afinar el diagnóstico para ayudar a decidir manejo conservador o cirugía diagnóstica. Permite realizar seguimiento (evidencia 2B) en los nódulos que el estudio molecular estratifique como de bajo riesgo de malignidad20.
Las recomendaciones de la ATA en el año 2015 añaden que el paciente debe ser informado en todo momento de los posibles beneficios y limitaciones del estudio molecular, y que dicho estudio debe realizarse en laboratorios específicos moleculares que hayan realizado una validación analítica previa21. De momento, recomiendan el uso de paneles moleculares como rule out test, sin poder recomendar un panel molecular frente al otro hasta que no se disponga de estudios de validación clínica a largo plazo.
Vargas-Salas et al.8 en su metaanálisis recomiendan que la necesidad de realizar un test molecular y cuál de ellos escoger viene marcada —además de por las características indeterminadas de la citología— por las características clínicas y ecográficas. Así, un nódulo de alto riesgo ecográfico y/o clínico no debería ser estudiado molecularmente, ya que, independientemente del resultado, es altamente probable que sea intervenido quirúrgicamente.
ConclusionesHasta en el 30% de los casos de PAAF realizadas durante el estudio de nódulos tiroideos, la citología es indeterminada. El problema se encuentra en diferenciar cuáles de esos nódulos son benignos y pueden seguirse en el tiempo, y cuáles de ellos son malignos y requieren cirugía. El uso complementario de paneles moleculares junto con la citología ha sido, de momento, la única herramienta que parece ayudar en este difícil escenario.
Hasta la fecha, solo el panel molecular Afirma® ha podido probar (en estudios multicéntricos, prospectivos y aleatorizados) su eficacia para reclasificar nódulos con citología indeterminada como benignos y así evitar la cirugía.
Faltan a día de hoy estudios prospectivos, aleatorizados, multicéntricos que estudien la utilidad real en la práctica clínica, en los costes y en la calidad de vida de los pacientes, así como recomendaciones acerca del seguimiento a largo plazo o la necesidad de reevaluación citológica/molecular de estos pacientes.
FinanciaciónEste artículo no ha recibido ninguna fuente de financiación.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.