La fuga quilosa es una complicación muy poco frecuente después de las operaciones de cirugía mayor abdominal y se caracteriza por la acumulación de líquido quiloso en la cavidad peritoneal. La fuga quilosa postoperatoria se produce principalmente como resultado de la lesión quirúrgica de conductos linfáticos como los vasos quilíferos, los conductos tributarios o el propio conducto linfático principal y la cisterna quilosa. Puede tratarse de una fuga quilosa localizada o de un peritoneo quiloso difuso. Las intervenciones quirúrgicas que se ha descrito que se asocian a una fuga quilosa son principalmente las que comportan una disección retroperitoneal, como las practicadas para el cáncer testicular1, la resección pancreática2, la cirugía aórtica abdominal3 y el cáncer gástrico con disección D34. Dado que se trata de una complicación poco habitual, no se ha definido todavía su incidencia real, la evolución natural ni algoritmos de tratamiento apropiados. Un retraso en el tratamiento o un manejo incorrecto pueden conducir a consecuencias muy negativas, como la pérdida de líquidos, proteínas, grasas, linfocitos y la consiguiente caquexia1. Aunque se han descrito unos pocos casos de fuga quilosa después de la resección colorrectal5,6, no se ha establecido ni su incidencia ni los factores asociados a ella. Presentamos aquí el tratamiento de 4 casos de fuga quilosa después de una resección colorrectal.
Entre junio de 2004 y abril de 2010, se registraron prospectivamente en una base de datos, aprobada por el consejo de revisión interno de nuestro hospital, la información de todos los pacientes a los que se practicó una resección colorrectal por cáncer en el Vakif Gureba Training and Research Hospital. Se obtuvo el consentimiento informado de todos los pacientes. Se adoptó un protocolo de recuperación postoperatoria temprana a partir de 2006, y se inició la alimentación oral a partir del día 1 del postoperatorio con líquidos claros. Al tercer día, los pacientes tratados por cáncer colorrectal recibieron una dieta normal con un contenido de fibra mínimo. Al igual que en los pacientes con cáncer colorrectal, en los pacientes con cáncer gástrico se inició una alimentación oral con líquidos claros el día 1 del postoperatorio. La fuga quilosa se sospechó postoperatoriamente cuando se observaba un drenaje de aspecto lechoso. El diagnóstico de fuga quilosa se confirmó por la presencia de un nivel de triglicéridos >110mg/dl en el líquido de drenaje. En todos los pacientes se utilizó una nutrición parenteral total inmediatamente después del diagnóstico. Tras el cese del drenaje de líquido, los pacientes iniciaron una alimentación oral con una dieta pobre en grasas. Antes del alta del hospital los pacientes reanudaron una alimentación oral normal, que incluía grasas. Se registraron los datos demográficos, la forma de presentación clínica, el diagnóstico primario, el tipo y la amplitud de la cirugía, las características y estadio del tumor, el número de ganglios linfáticos obtenidos, las características del líquido de drenaje, la duración del derrame, el tratamiento y las complicaciones.
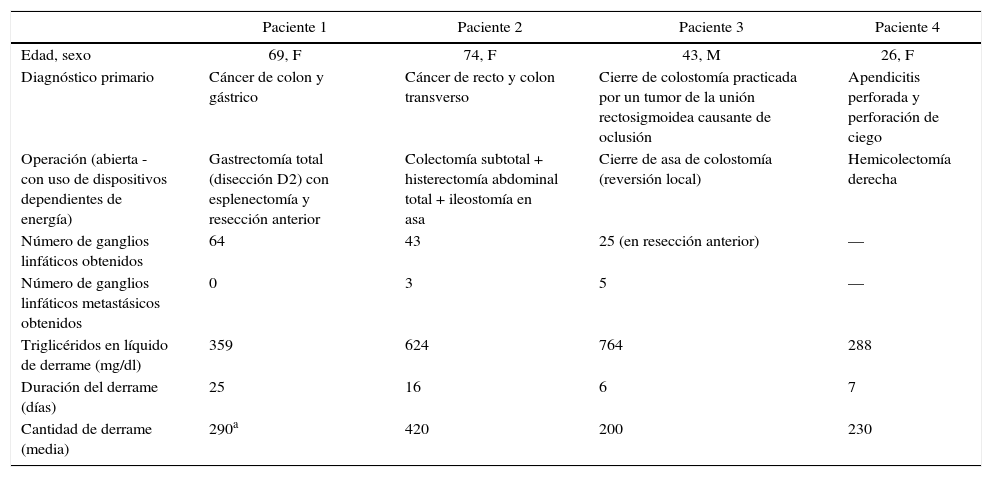
Durante el periodo de tiempo especificado, se llevaron a cabo 273 resecciones colorrectales en nuestras unidades. Se realizaron mediante resecciones de cirugía abierta o laparoscópica, y excepcionalmente en combinación con resecciones de otros órganos (sobre todo gástricas). Se identificaron 3 mujeres y un varón con quiloperitoneo. La incidencia del quiloperitoneo después de las resecciones colorrectales fue de un 1,46% (4/273). De los 4 pacientes, en 3 la resección colorrectal se había practicado por una enfermedad maligna. En un paciente, la fuga quilosa se apreció después del cierre de la colostomía que se había realizado antes por un cáncer de rectosigma causante de oclusión. En el periodo de seguimiento (antes de la intervención de cierre de la colostomía), la TC no identificó ninguna colección abdominal anormal y en la operación no hubo líquido quiloso. Dos pacientes presentaron tumores sincrónicos que motivaron resecciones de múltiples órganos y 2 pacientes fueron tratados con radioterapia antes de la operación. El único paciente sin tumor fue una mujer con una apendicitis perforada operada tardíamente. A la exploración tanto el apéndice como el ciego estaban perforados a causa de una inflamación y necrosis intraabdominal masiva. En un paciente (paciente número 1) se colocó un catéter bajo guía ecográfica para el tratamiento de una colección intraabdominal tras la retirada prematura del drenaje. El líquido de drenaje estaba contaminado por bacterias gramnegativas y el paciente fue tratado con los antibióticos apropiados. Dos pacientes (pacientes números 1-4) presentaron infecciones de la herida. No hubo mortalidad postoperatoria. Las características demográficas, las características del líquido y el diagnóstico y tratamiento de los pacientes se presentan en la tabla 1.
Características de los pacientes con fuga quilosa
| Paciente 1 | Paciente 2 | Paciente 3 | Paciente 4 | |
|---|---|---|---|---|
| Edad, sexo | 69, F | 74, F | 43, M | 26, F |
| Diagnóstico primario | Cáncer de colon y gástrico | Cáncer de recto y colon transverso | Cierre de colostomía practicada por un tumor de la unión rectosigmoidea causante de oclusión | Apendicitis perforada y perforación de ciego |
| Operación (abierta - con uso de dispositivos dependientes de energía) | Gastrectomía total (disección D2) con esplenectomía y resección anterior | Colectomía subtotal + histerectomía abdominal total + ileostomía en asa | Cierre de asa de colostomía (reversión local) | Hemicolectomía derecha |
| Número de ganglios linfáticos obtenidos | 64 | 43 | 25 (en resección anterior) | — |
| Número de ganglios linfáticos metastásicos obtenidos | 0 | 3 | 5 | — |
| Triglicéridos en líquido de derrame (mg/dl) | 359 | 624 | 764 | 288 |
| Duración del derrame (días) | 25 | 16 | 6 | 7 |
| Cantidad de derrame (media) | 290a | 420 | 200 | 230 |
El quiloperitoneo es una colección de líquido linfático en la cavidad peritoneal y puede ser debido a una alteración de la circulación linfática normal a causa de una obstrucción, lesión o exudación a través de las paredes de los vasos linfáticos. Las causas más frecuentes en los adultos son las enfermedades malignas intraabdominales como el linfoma y los cánceres de ovario y de próstata causantes de obstrucción de los vasos linfáticos en la base del mesenterio o en el retroperitoneo7. Dado que los vasos linfáticos principales ascienden a lo largo de la aorta en la zona retroperitoneal, las operaciones en las que se actúa sobre el retroperitoneo, como las de un aneurisma de la aorta abdominal3, los cánceres testiculares con linfadenectomía retroperitoneal1, la cirugía gástrica con disección D34 y la cirugía pancreática2 comportan un aumento del riesgo de fuga quilosa postoperatoria. Aunque la cisterna quilosa parece ser más uniforme en la localización que se le supone, los vasos linfáticos que desembocan en ella pueden presentar grandes variaciones en su forma, orientación y tamaño1,3. Así pues, las variables anatómicas podrían ser también un factor contribuyente en la lesión de los vasos linfáticos que conduce al quiloperitoneo.
La incidencia real de la fuga quilosa no está bien documentada. En un estudio anterior se observó una incidencia global de 1 por cada 20.000 casos tras las intervenciones de cirugía mayor abdominal. Posteriormente se publicaron cifras superiores de entre el 1,3 y el 7% tras intervenciones quirúrgicas específicas1,2. La incidencia descrita de la fuga quilosa tras la disección retroperitoneal por un cáncer testicular varió entre el 2 y el 7%1,8. En un reciente estudio bien documentado con más de 3.500 pacientes a los que se practicaron resecciones pancreáticas, la incidencia de la fuga quilosa fue del 1,3%2. La fuga quilosa después de una resección colorrectal se ha descrito con una incidencia muy baja5,6. En nuestra serie, la incidencia de fuga quilosa fue del 1,46%. Sin embargo, esta incidencia (tanto para los casos puramente colorrectales como para los combinados) debe interpretarse con precaución, dado que el número de pacientes de nuestra serie es bastante bajo.
Hay muchos factores predictivos que se han asociado a un mayor riesgo de fuga quilosa postoperatoria, como son el número de ganglios linfáticos obtenidos, la resección vascular simultánea, la quimioterapia preoperatoria y la pérdida de sangre intraoperatoria1,2. En informes anteriores se ha observado que una linfadenectomía amplia en el cáncer testicular1, la gastrectomía4 y la pancreatectomía2 se asoció a un aumento del riesgo de fuga quilosa. Cada uno de nuestros pacientes tenía al menos uno de los factores predisponentes al quiloperitoneo identificados en la literatura. De hecho, 2 pacientes presentaban cánceres sincrónicos de localización gástrica y rectal que requirieron una extirpación amplia que afectó a zonas de posible lesión de tributarios linfáticos presentes en el retroperitoneo alrededor del eje celíaco y la raíz de la vena mesentérica inferior. En ambos pacientes se obtuvo un número elevado de ganglios linfáticos (n: 64 y n: 43) durante la operación. Tan solo un tercer paciente recibió tratamiento de quimioterapia antes de la operación (cierre de colostomía en un paciente al que se había practicado una operación de Hartmann a causa un tumor de rectosigma causante de obstrucción un año antes). La razón de la fuga quilosa pudo ser o bien un daño causado a los vasos linfáticos intestinales tras la quimiorradioterapia, o bien la lesión de tributarios linfáticos durante el cierre de la colostomía a causa de la disección de adherencias densas. El último paciente presentó una apendicitis perforada complicada con una perforación del ciego, operada tardíamente. Esta paciente presentaba una masa inflamatoria que afectaba al retroperitoneo y al abdomen y que motivó una hemicolectomía derecha.
Se ha propuesto un algoritmo basado en un tratamiento escalonado de la fuga quilosa, destinado a reducir la producción de linfa al tiempo que se mantiene el balance nutricional9. Como principales medidas de tratamiento se ha recomendado empezar con medidas conservadoras como la regulación de la dieta, la nutrición parenteral total y continuar con métodos más agresivos, incluida la cirugía. La mayor parte de los estudios han descrito un porcentaje de éxitos del tratamiento de un 75 a un 85% con los métodos conservadores1,2,6,8–10. Nosotros pudimos tratar a todos nuestros pacientes con métodos conservadores, empezando con una nutrición parenteral total y ayuno, con objeto de permitir un reposo intestinal y reducir el flujo de linfa de manera temprana una vez detectada la fístula quilosa. Después de controlar la fístula, se inició la alimentación oral con una dieta sin grasas. Aunque algunos investigadores han reservado la NPT para los pacientes en los que no han dado resultado las medidas conservadoras previas, como la restricción alimentaria con triglicéridos de cadena media, otros han utilizado la NPT de forma temprana en el tratamiento1,8. Se ha sugerido el uso de análogos de somatostatina de acción prolongada, dado que el porcentaje de éxitos descrito con su empleo como adyuvante a otras medidas conservadoras es satisfactorio10. Aunque nosotros no hemos utilizado octreótida ya que el tratamiento de la fístula tuvo éxito en un tiempo relativamente corto (la duración media de la fístula fue inferior a 2 semanas en nuestros pacientes), su empleo podría contemplarse en los casos de fístulas refractarias o de alto drenaje antes de pasar a las opciones quirúrgicas. En conclusión, en nuestra experiencia el tratamiento no operatorio tuvo un resultado satisfactorio.
Contribución de los autores del manuscrito- 1.
Concepción y diseño: AI e IO
- 2.
Obtención de los datos: DF y OI
- 3.
Análisis e interpretación de los datos: AI y IO
- 4.
Versión preliminar del artículo: IO
- 5.
Revisión crítica: AI
- 6.
Aprobación final del manuscrito: AI, IO, DF y OI
Los autores declaran no tener ningún conflicto de intereses.