Introducción
Los tumores hepáticos sólidos benignos (THSB) son lesiones relativamente frecuentes que se encuentran en cerca del 10% de la población y suelen ser asintomáticas1 . En los pacientes que presentan síntomas hay que asegurarse de que no estén causados por otro proceso patológico2,3 . En muchas ocasiones, los THSB se diagnostican casualmente en métodos de imagen o laparotomías realizadas por otras causas1-7 . La mayoría de los THSB no precisa tratamiento y es importante obtener un diagnóstico preciso y descartar malignidad (metástasis o hepatocarcinoma)1,6,8 . Todos los tipos celularespresentes en el hígado pueden producir tumoraciones benignas1,6 . Los THSB se pueden clasificar, según el tipo de origen celular, en epitelial, mesenquimal y un grupo miscelánea5 (tabla 1). Para un diagnóstico correcto de los THSB es preciso realizar una exhaustiva historia clínica y una adecuada exploración abdominal5 (tabla 2); en cambio, los estudios analíticos (bioquímica hepática y marcadores tumorales) suelen ser normales5 . La ecografía suele ser la prueba inicial7 , seguida posteriormente de una tomografía computarizada (TC). La resonancia magnética (RM) se ha convertido en un método diagnóstico clave en los THSB con un acierto diagnóstico cercano al 95%4,9 . La gammagrafía fue un pilar diagnóstico, pero está siendo sustituida por los métodos ya citados. La arteriografía está prácticamente en desuso5 . La biopsia percutánea suele estar contraindicada por el riesgo de sangrado, la escasa rentabilidad diagnóstica y la posibilidad de diseminación tumoral3,4,7 . Pese a los avances diagnósticos, todavía hay algunos casos en los que no es factible realizar un diagnóstico de certeza1,5 .
TABLA 1. Clasificación de los tumores hepáticos sólidos benignos según la célula de origen
La mayoría de los THSB, excepto el adenoma hepático, se pueden tratar de manera conservadora1 . Las indicaciones de cirugía para el resto de los THSB son: diagnóstico incierto con sospecha de malignidad, síntomas graves o progresivos debido al tamaño del tumor y aparición de complicaciones (hemorragia o rotura)3,4 . La mayoría de estas lesiones se puede extirpar sin margen de seguridad (enucleación), excepto en los adenomas6,10 . La mortalidad del tratamiento quirúrgico de los THSB no complicados debe ser < 1% y su morbilidad < 15%; es, por tanto, un tratamiento efectivo y seguro2,11 . Los THSB no recidivan y su exéresis supone habitualmente la desaparición de los sín-tomas3,4,6 . Su resección laparoscópica es factible, con excelentes resultados cuando no aparecen complicaciones, no son voluminosos (< 5 cm) o se encuentran en determinadas localizaciones (segmento lateral izquierdo y segmentos anteriores)4,6,12-15 . El trasplante hepático como tratamiento de los THSB es una opción terapéutica excepcional6,7,16 .
Hemangioma cavernosoEl hemangioma es el tumor sólido benigno más frecuente del hígado1,5,17-24 y se observa en el 0,4-7,3% de la población general1,6,8,17-23 . No tiene preferencia por ningún grupo de edad y parece ser algo más frecuente en mujeres1,17 . La etiología no está clara y se ha postulado que se podría tratar de lesiones congénitas que, ante determinados factores no aclarados, crecen repentinamen-1,5 . Su frecuencia diagnóstica se ha incrementado en los últimos años al ser observados en pruebas de imagen realizadas por otras razones médicas5,18,23 . Macroscópicamente son lesiones de tamaño variable pero en general < 5 cm, circunscritas, rodeadas por una fina cápsula fibrosa, de color rojo-púrpura y compresibles1,5,23 . Histológicamente son grandes lagunas vasculares recubiertas por una capa de células endoteliales y separadas por finos septos fibrosos1,21,23 . Hasta un 40% de los pacientes presenta varios hemangiomas y aparece en cualquiera de los segmentos hepáticos1 .
Los hemangiomas suelen ser asintomáticos1,3,5,6,19,24 , pero pueden causar múltiples síntomas. El dolor abdominal es el más frecuente5,6,19,23 ; también pueden producir sensación de saciedad precoz21,25 y, en ocasiones, náuseas, vómitos, dispepsia, fiebre, obstrucción biliar o hipo-fibrinogenemia6,8,24 . El mecanismo exacto por el que se que produce el dolor abdominal es desconocido, puede deberse a la compresión de órganos vecinos, trombosis intratumoral, hemorragia, infarto del hemangioma o estiramiento de la cápsula de Glisson1,5,18,23 . La rotura espontánea es muy infrecuente y su malignización es excepciçon1,5-8,18,19,23,26 . En las lesiones de gran tamaño puede presentarse el síndrome de Kassabach-Merritt, consistente en una coagulopatía de consumo debido al secuestro y la destrucción de plaquetas por el tumor1,18,19,21,23 .
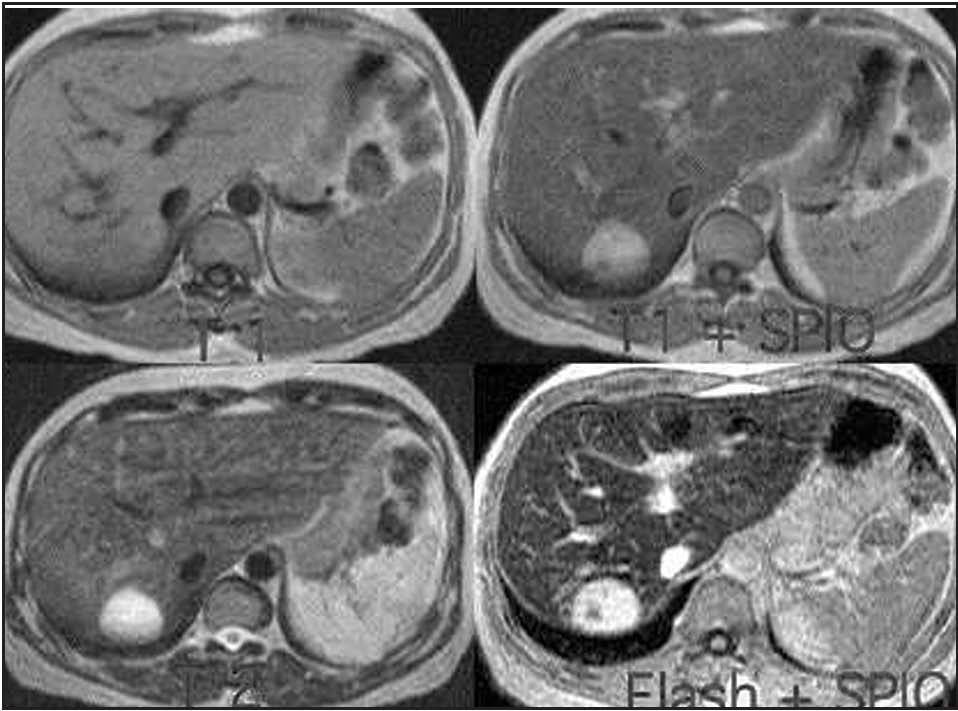
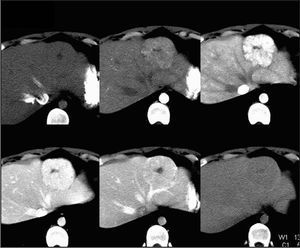
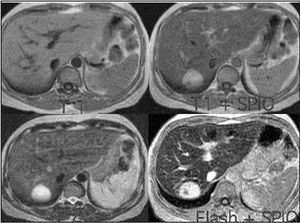
El diagnóstico de hemangioma se realiza habitualmente mediante ecografía y posteriormente mediante TC o RM como técnicas de confirmación18,21,25 (fig. 1). En algunas ocasiones es un hallazgo casual en una laparotomía21 . En la ecografía, los hemangiomas pequeños se observan como masas homogéneas lobuladas hiperecoicas con márgenes bien definidos respecto al parénquima circundante y refuerzo acústico posterior5,17,18 , mientras que los grandes presentan áreas heterogéneas internas7 . La sensibilidad de la ecografía es del 57%23 . En la TC sin contraste se observa una lesión hipodensa que varía hacia un patrón de captación periférica globular con opacificación centrípeta, haciéndose el hemangioma isodenso
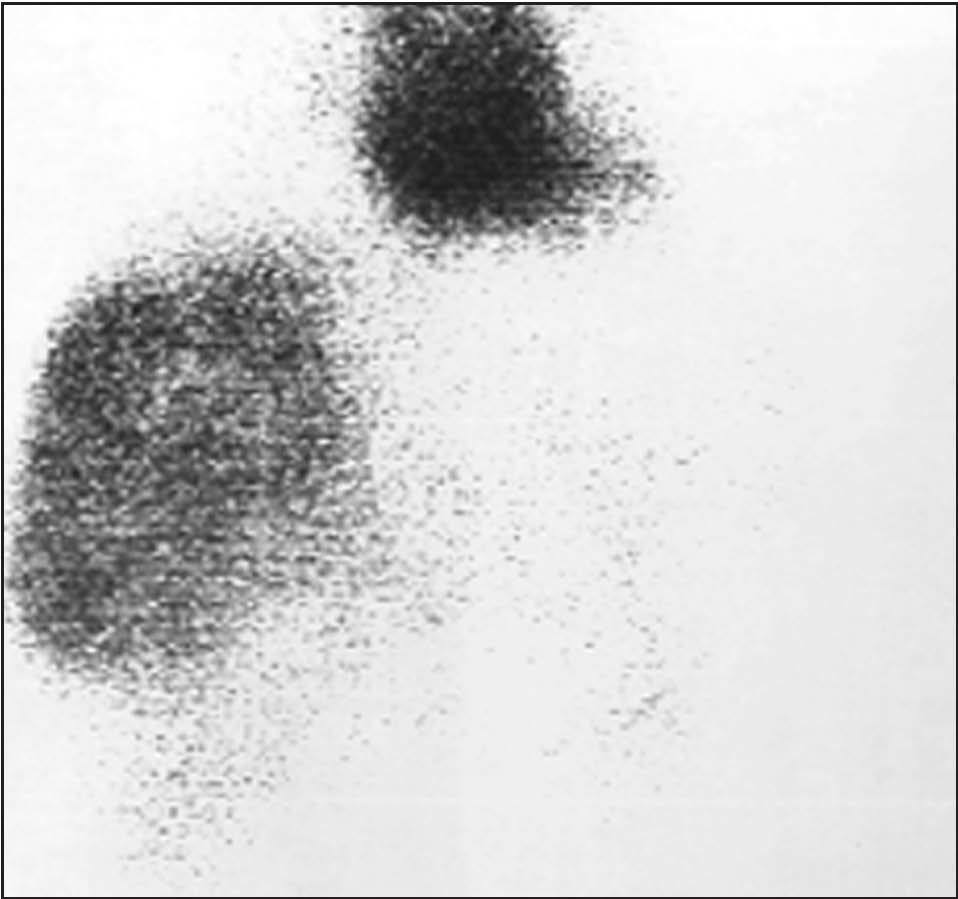
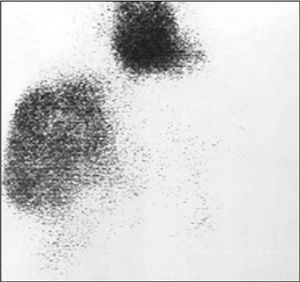
o hiperdenso respecto al parénquima hepático5,21,22 . Lamentablemente, sólo el 54% de los hemangiomas presenta las características citadas22 . El porcentaje de acierto diagnóstico con la angio-TC es del 93%5,23 . La angioTC es útil para la planificación de grandes resecciones 23 . La RM posee una alta sensibilidad (85-95%) y especifici- 1,3,5,9,18,20,23 . En la RM se observa una masa con señal hiperintensa heterogénea y captadora de gadolinio en T2 9,23 , y una lesión hipointensa con refuerzo nodular periférico en T1 17,18 . En la RM, sólo las metástasis hepáticas de tumores neuroendocrinos y los hemangiomas < 1,5 cm pueden producir problemas de diagnóstico diferencial 9 . La gammagrafía fue una prueba muy importante en el diagnóstico del hemangioma 5,23 (fig. 2). En la gammagrafía con coloide aparece como una lesión fría, y en el estudio con hematíes marcados la captación tardía del trazador es muy característica 6,7 . Su sensibilidad y especificidad es del 85-90 y 100%, respectivamen- 1,20 . Con la combinación de los 4 métodos diagnósticos citados se obtiene una eficacia diagnóstica muy alta, pero no del 100% 20 . No se recomienda la realización de biopsia percutánea por el riesgo de sangrado, aunque esta complicación es infrecuente 1,4,5,18,21,25 . Los marcadores tumorales (alfafetoproteína, CA19-9, CEA) no se encuentran elevados 1,20 y la analítica hepática es normal 1,5 . La experiencia con tomografía por emisión de positrones (PET) es escasa 23 .
TABLA 2. Diferenciación entre adenoma hepatocelular e hiperplasia nodular focal
El tratamiento de elección del hemangioma asintomático es la observación periódica1 . En múltiples series se ha demostrado que los pacientes en seguimiento no suelen presentar complicaciones1,4-7,17,18,21,23,27,28 . Las indicaciones quirúrgicas son: pacientes sintomáticos, duda diagnóstica o que se presenten complicaciones (crecimiento rápido, trombocitopenia importante, riesgo de rotura, 5-7,18,20,21,23,24 . El crecimiento del hemangioma se produce por la ectasia de los canales sanguíneos y no por neovascularización1,20,23 . El dolor abdominal es la causa más frecuente de indicación quirúrgica20 , pero se debe confirmar que los síntomas no se deben a otra 1,5,20 . Los > 10 cm se han resecado clásicamente por el riesgo de sangrado, por los síntomas que causan o por ambas razones25 , pero el tamaño no es un criterio suficiente para indicar la intervención18 .
La cirugía es el único tratamiento efectivo del heman-gioma17,23 . Las opciones terapéuticas quirúrgicas son la resección hepática, la enucleación, la ligadura de la arteria hepática6,17,29,30 y el trasplante hepático20,31 . La embolización de la arteria hepática6,18,23,32 , la radioterapia5,17,23,33 y la administración de interferón α2a y de corticoides17 también han sido utilizados como tratamientos paliativos17 . La enucleación es probablemente la técnica de elección4,5,23 , pero si el hemangioma ocupa la totalidad de un segmento o lóbulo puede realizarse una resección anatómica5,21 . El porcentaje de pacientes a los que se les efectúa enucleación oscila en las series entre el 60 y el 82%23 . Si comparamos ambas técnicas, se observa que en la enucleación los requirimientos transfusionales son menores7,20 , disminuye la tasa de fugas biliares, se evita la pérdida de parénquima sano y la tasa de recidiva es similar23 ; además, la utilización del plano entre el hemangioma y el parénquima hepático facilita la cirugía. La resección laparoscópica es una alternativa factible en los hemangiomas pequeños localizados en la perife-1,13,14,23 . La cirugía no suele presentar morbimortalidad asociada, ya que el parénquima remanente es normal y los pacientes suelen ser jóvenes y sanos7,25 . La morbilidad grave descrita en la bibliografía oscila entre el 0 y el 1,7,23 , y la mortalidad oscila entre el 0 y el 4% 1,7,18 .Se ha postulado que el dato más importante para la aparición de complicaciones no es el tamaño inicial del hemangioma sino la tasa de crecimiento que presente en el seguimiento 27 . La ligadura de la arteria hepática es un método prácticamente en desuso y reservado para los tumores irresecables 5,20 . Los hemangiomas gigantes pueden tratarse de manera excepcional mediante trasplante hepático 1,16,20,28,31.
Fig. 1. Gammagrafía con hematíes marcados en la que se aprecia un hemangioma gigante.
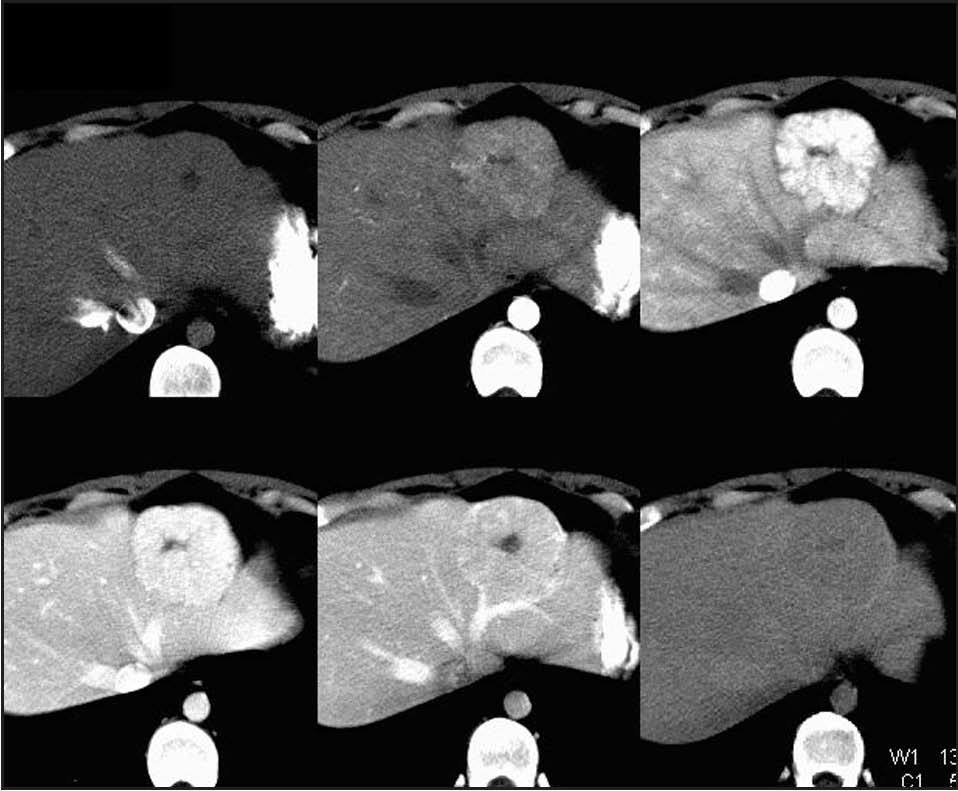
Fig. 2. Tomografía computarizada que revela una hiperplasia nodular focal.
La exéresis del hemangioma elimina el dolor abdominal en el 90% de los pacientes18,20 . Las recidivas posquirúrgicas son infrecuentes y, en realidad, se deben más al crecimiento de otros focos de hemangioma en el hígado no resecado que a verdaderas recidivas20 .
Fig. 3. Resonancia magnética en la que se observa un hemangioma.
Hiperplasia nodular focalEs el segundo tumor benigno hepático más frecuen-1,5,19 y supone el 8% de todos los tumores hepáticos34 . Se presentan a cualquier edad y en ambos sexos, pero aparecen con mayor frecuencia en mujeres jóvenes en edad fértil1,5,8,10,35 . En la última década parece observarse un aumento del número de casos de hiperplasia nodular focal (HNF) diagnosticados1 . La HNF es una lesión pálida, nodular, homogénea, hipervascular y claramente separada del parénquima circundante pero sin cápsu-1,5,19,34,35 , y aproximadamente un 50-60% presenta una cicatriz estrellada central5,7,19,35,36 . La HNF no presenta áreas de necrosis ni focos de hemorragia1,22,36 , y habitualmente es de pequeño tamaño y se localiza en la periferia del parénquima hepático2,5 . Un 10% de los casos son multifocales1,2,5,22 ; estos últimos presentan un riesgo aumentado de asociar tumores cerebrales y malformaciones vasculares en otros órganos1 . Su patogenia es desconocida10 ; para algunos no es un verdadero tumor sino una malformación por proliferación celular, es decir, una hiperplasia más que una neoplasia1,5,19,22,34 . Una malformación vascular o un traumatismo hepático previo podrían ser los mecanismos desencadenantes. La HNF no está relacionada con el consumo de anticonceptivos orales, aunque las pacientes que los toman parece que pueden tener una mayor tasa de complicaciones y un crecimiento tumoral por el efecto trófico de los estróge-2,5,10,19,22,36 . Cerca de un 10-20% de los pacientes con HNF presenta también hemangiomas1,2,5,36 , pero es excepcional que se asocie con adenoma hepatocelular (AH)2 .
En general, la HNF es asintomática, es excepcional que se necrose o se rompa1,2,5-7,10,36 y no se maligni-2,6-8,10 . La aparición de síntomas está directamente relacionada con el tamaño5 . Los pacientes no suelen presentar alteraciones analíticas10 , pero la compresión de los grandes troncos venosos hepáticos pueden causarlas34 . Con frecuencia su diagnóstico es incidental1,5 .En la ecografía se aprecia como una masa sólida con ecogenicidad aumentada1,10 . En la TC se observa una lesión hipervascular y bien circunscrita en la fase arterial que se hace hipodensa o isodensa en la fase portal, donde hay un refuerzo de la cicatriz en un 30-50% de los casos5,6,8,22 (fig. 3). En la RM se observa una imagen de baja densidad o isointensa en T1, que se hace intensa y reforzada en T24,9,35 . También podemos apreciar la típica cicatriz central y en un tercio de los casos se observa una arteria central nutricia10 . La RM tiene una sensibilidad del 70% y una especificidad del 91%10 .En la gammagrafía con coloide, el tumor presenta una captación normal o aumentada; si se realiza con DISIDA, la HNF se hace evidente por retención del trazador y captación intensa. Este hecho se debe a la presencia de células de Kupffer en la HNF5,2 . No está recomendada la biopsia percutánea5 .
Los pacientes asintomáticos sólo requieren controles ecográficos 2,4,5,8,10 . La certeza diagnóstica preoperatoria suele ser baja, con frecuencia < 50%, lo que implica que la duda diagnóstica es la causa más frecuente de indicación quirúrgica4,5 . Las otras indicaciones son la presencia de síntomas y un crecimiento súbito2,4,5 . La morbimortalidad de la resección en la HNF es muy baja2 . Algunos autores recomiendan la escisión de los tumores pequeños periféricos hallados incidentalmente y la realización de una biopsia de los de gran tamaño2 . La resección laparoscópica se puede realizar en casos seleccionados (tumores pequeños y periféricos)2,13 . En un estudio múlticentrico europeo se incluían 48 resecciones laparoscópicas14 . La diferenciación histológica tras la resección entre HNF y cirrosis es en ocasiones compleja5 . Se ha postulado que la HNF podría ser un precursor del hepatocarcinoma fibrolamelar36 . La recidiva es excepcional2 .
Adenoma hepatocelularEl adenoma es un tumor benigno que aparece con mayor frecuencia en mujeres jóvenes que habitualmente consumen anticonceptivos orales (ACO) 1,10,19,22,35,37,38 consumen anticonceptivos orales . Suelen ser tumores únicos, aunque pueden ser múltiples (adenomatosis hepática)1,5,6,37-39 . Macroscópicamente son lesiones amarillentas, bien circunscritas y no lobuladas, con apariencia homogénea y seudocápsula36,37 . Se suelen localizar en el lóbulo derecho y en la zona subcapsular36 . En el AH es frecuente observar áreas de necrosis y hemorragia1,36 . Microscópicamente, los AH carecen de células de Kupffer y de los conductos biliares presentes en la HNF5,36 ; además, los hepatocitos de los pacientes con AH presentan vacuolas prominentes que representan áreas ricas en glucógeno5,36 .
Su prevalencia aumentó con el uso extendido de ACO en la década de los sesenta1,2,5,7,19,35,39 y se ha relacionado con la tasa de estrógenos, especialmente el mestranol37 . Así, entre las mujeres que no consumen ACO, la tasa de AH es 1 por millón, y se incrementa a 30-40 por millón en las consumidoras37 . El 90% de los pacientes con AH consumen o han consumido ACO5 . Además, el efecto es dependiente de la dosis, de modo que el uso de ACO durante 5 años incrementa 2,5 veces el riesgo de padecer un AH, si se toman más de 5 años se incrementa a 7,5 veces y si utilizan más de 9 años se eleva a 25 veces36 . La tasa menor de estrógenos de los actuales ACO ha disminuido la frecuencia de aparición del AH8,36 . Hay casos aislados de regresión tras la retirada de los ACO1,2,5,10,19 y también de su aparición años después de la retirada de ACO2,6 .Tam-bién se ha observado el crecimiento y el aumento de las complicaciones, especialmente la rotura del AH durante el embarazo2,5,19,36 . Otros fármacos relacionados con el desarrollo de AH son anabolizantes, andrógenos, clomifeno, danazol y hormona del creci-1,5,6,35 . Parece que hay una incidencia mayor de AH en pacientes con galactosemia, síndrome de Klinefelter, síndrome de Turner y glucogenosis tipo I, III y IV, lo que ha llevado a postular una teoría genética por fallo del metabolismo de los hidratos de carbono1,5,35 . Las pacientes con AH que han tomado ACO presentan mayor tasa de complicaciones1 .
La mayoría de los pacientes con AH presentan síntomas causados por la tumoración2,3,36 . El más frecuente es el dolor abdominal producido por el rápido crecimiento tumoral, la hemorragia intratumoral o la compresión directa1 . Otros síntomas son la sensación de masa y síntomas gastrointestinales inespecíficos8,10,35 . Ocasionalmente, un AH se manifiesta como una complicación grave: rotura o hemorragia1 . El riesgo de rotura es del 7,8,10,36,40,41 , el de sangrado oscila entre el 15 y el 33%10 , y el riesgo de malignización se ha cifrado en un 5,8,10,36 . Aunque habitualmente los AH grandes presentan más complicaciones, no hay correlación entre el tamaño y la localización, y la aparición de complicaciones1 .
En el AH, las analíticas suelen ser normales, pero se puede observar elevación de la fosfatasa alcalina y gamma-GT5,10 . Los marcadores tumorales suelen ser normales1 . En la ecografía se aprecia como un tumor heterogéneo con ecogenicidad mixta5 , pero la apariencia ecográfica es inespecífica1 . La TC sin contraste muestra una lesión hipodensa bien delimitada, y al efectuarla con contraste se observa una lesión con refuerzo arterial periférico y zonas de variable densidad intratumorales correspondientes a los focos hemorrágicos6 , pero el diagnóstico de certeza es difícil22 . En la RM se observan lesiones heterogéneas típicamente brillantes hipointensas o moderamente hiperintensas en T1 e hiperintensas, comparadas con el parénquima circundante, y con halo periférico en T237 . Estos hallazgos típicos son infrecuentes; así, sólo se aprecia una masa heterogénea hiperintensa en T2 en el 51% de los pacientes y el halo periférico en el 31%10 . El diagnóstico del AH mediante RM no es tan efectivo como en la HNF o el hemangioma9 . En la gammagrafía puede aparecer como una área fría o hipodensa no captante, pero esta prueba no es suficientemente específica5 . La biopsia se desaconseja porque puede presentar complicaciones y la información que aporta es nula o incluso puede llevar a confusión7 .
Los pacientes diagnosticados de AH no deben tomar ACO y precisan resección del tumor con margen para evitar los riesgos ya citados1-3,5-8,10,35,42 . La mortalidad de la resección del AH en centros especializados es < 1%, pero se eleva al 10% cuando hay complicaciones2,10 .La embolización arterial, en los casos de sangrado o irresecabilidad, puede ser una medida terapéutica útil1,4,5 .En casos seleccionados, la resección se puede efectuar mediante laparoscopia1,13,14 . La resección del AH elimina la sintomatología y no se producen recidivas1 .
La diferenciación histológica entre AH y el carcinoma hepatocelular diferenciado tras la resección es en ocasiones difícil5,8 .
Adenomatosis hepáticaLa adenomatosis hepática (AHM) es una enfermedad poco conocida (sólo hay 38 casos publicados hasta el 2000)43 de etiología no aclarada38,39 . Se cree que está causada por la presencia de shunts vasculares intrahepáticos39,44 . Cliche et al describieron a una familia con herencia autosómica dominante asociada con diabetes, lo que implicaría un componente genéti43.
En 1985, Flejou et al definieron arbitrariamente la adenomatosis como la presencia de más de 10 adenomas en pacientes con parénquima hepático normal, y excluían a los pacientes con glucogenosis o ingesta de corticoides36,43 . Con posterioridad, Ribeiro et al43 disminuyeron la cifra a 4 tumores. Un 60% de los pacientes con glucogenosis IA desarrolla AHM. Los adenomas de la AHM suelen ser pequeños, bien delimitados y con cápsula parcial o total. Presentan mayor tasa de complicaciones (necrosis, hemorragia, malignización)36,37,39,43 .Aun-que se creía que afectaban indistintamente a ambos 1,36,39 , ahora parece observarse un predominio en las mujeres (3:1)43 . Su aparición, clásicamente, no se relacionaba con el consumo de ACO36 , aunque las últimas series demuestran que el 46% de las mujeres afectadas los toman; asimismo, en 1 paciente los adenomas regresaron al retirar los ACO, lo que sugiere que podría ser un factor etiológico en casos concretos6,38 .
El diagnóstico de AHM puede producirse por la aparición de complicaciones (necrosis, hemorragia), por hepatomegalia o como hallazgo incidental en una laparotomía43 . Los adenomas de la AHM presentan radiológicamente un aspecto variado por su hetereogeneidad tisular43 . En la ecografía-Doppler, la TC y la RM son tumores hipervascularizados. La combinación (ecografía-RM) consigue la mayor eficacia diagnóstica43 . En la analítica se puede observar elevación de la fosfatasa alcalina y gamma-GT.
Las opciones terapéuticas son la resección hepática y el trasplante hepático6 . En la enfermedad unilobar o en los casos extirpables, la resección es la técnica de elección. En los pacientes en los que la extirpación completa no es factible se pueden resecar los AH más grandes, que son los que presentan más complicaciones, pero hay el riesgo de estimulación y crecimiento de los adenomas restantes o su malignización43 .El trasplante hepático se recomienda ante la transformación maligna de algún adenoma, infrecuente pero factible, y en pacientes muy sintomáticos con tumores múltiples irresecables1,16,36,43 . En los pacientes con glucogenosis se debe realizar prevención de la hipoglucemia.
Tumores epiteliales
Hay dos variedades de tumores epiteliales: adenoma y hamartoma biliar. Habitualmente son asintomáticos y presentan una apariencia macroscópica y radiológica similar a la de las lesiones metastásicas hepáticas. Los hamartomas biliares son nódulos de color gris-blanco, habitualmente múltiples5 . Los adenomas suelen ser únicos, de color blanco y de localización subcapsular.
Tumores mesenquimalesEntre los tumores benignos de origen mesenquimal podemos distinguir: el tumor fibroso solitario, los lipomas (mielolipoma, angiomioliopoma, etc.), el hamartoma mesenquimal, el mixoma y el teratoma. Por su frecuencia, desarrollaremos el tumor fibroso solitario y el angiomiolipoma.
Tumor fibroso solitario
Los tumores fibrosos solitarios son lesiones grandes y sintomáticas que pueden ser confundidas con lesiones metastásicas hepáticas por su apariencia radiográfica e intraoperatoria5 . Su comportamiento no está claro, ya que se han descrito casos benignos y otros muy agresivos. En el análisis inmunohistoquímico muestran positividad al CD34 y a la vimentina5 .
Angiomiolipoma
El angiomiolipoma hepático (AML) es un tumor benigno, habitualmente único, muy infrecuente44-49 . En España sólo hay 9 casos publicados45,46,50-53 .
Suele detectarse de manera incidental, aunque en ciertos pacientes puede producir dolor abdominal54,55 . Excepcionalmente puede romperse56 o malignizarse57 . Predomina en las mujeres44,46,47,55 y en un 5,8-15% de los pacientes con AH ocurre en el contexto de una esclerosis tuberosa44-48 .
La etiología del AML es desconocida44-46 . La positividad para HMB 45 prácticamente es exclusiva y se admite como definitiva para su diagnóstico55 ; asimismo, permite postular su histogénesis e incluirlo en el grupo de tumores denominados PEC-omas46,51 .
En la ecografía se aprecia como una lesión hipereco-génica47,55 . La TC muestra una lesión hipodensa, bien definida, heterogénea, de baja densidad con áreas de hipoatenuación características45,47 . En la RM, el AML se observa hiperintenso en T1 y T245,47 . En la arteriografía se aprecia como un tumor hipervascular45,48,55 . La pun-ción-aspiración con aguja fina puede ser concluyente52,54 , pero se puede confundir con un hepatocarcinoma bien diferenciado con grasa. La presencia de componente muscular es específico de AH55 .
El tratamiento es quirúrgico cuando el paciente es sintomático o hay duda diagnóstica45,55 . Los pequeños tumores asintomáticos, sobre todo si están asociados a ET, sin duda diagnóstica, sólo requieren control periódico55-57 .
Correspondencia: Dr. J.M. Ramia. Buensuceso, 6, 4. o D. 18002 Granada. España. Correo electrónico: jose_ramia@hotmail.com
Manuscrito recibido el 1-12-2004 y aceptado el 1-2-2005.