Los adenocarcinomas de la unión esofagogástrica representan un 27% de todos los tumores gástricos. En los últimos años se está clasificando como una entidad propia, con tratamientos específicos y en ocasiones diferenciados de los tratamientos de los adenocarcinomas de cuerpo gástrico. El esquema de tratamiento puede basarse en quimioterapia (QT) o quimiorradioterapia (QTRT), que se administra de forma preoperatoria (neoadyuvante), postoperatoria (adyuvante) o perioperatoria. Existen estudios que han testado las diversas modalidades de tratamiento, pero en estos momentos no se dispone de una única secuencia protocolizada válida. Los resultados apuntan a una mejoría de la supervivencia cuando administramos tratamiento preoperatorio, con evidencia a favor de la QTRT y de la QT. Ya están en marcha estudios con tratamientos dirigidos que pretenden conseguir aumentar la actividad de la QT tradicional y en los próximos años deberemos conocer el papel de la inmunoterapia en este grupo de pacientes.
Adenocarcinomas of the gastroesophageal junction represent 27% of all gastric tumors. n recent years, it has been classified as an entity of its own, with specific treatments that are sometimes differentiated from gastric treatments. Treatment can be based on chemotherapy (CTx) or chemoradiotherapy (CRTx) that is administered preoperatively (neoadjuvant), postoperatively (adjuvant) or perioperatively. There are studies that have tested several treatment modalities, but there is currently no single protocolized sequence. The results point to an improvement in survival when we administer preoperative treatment, with evidence in favor of CRTx and CTx. Studies are already underway with targeted treatment that aim to increase the activity of traditional chemotherapy. In the next few years, we should know the role of immunotherapy in this group of patients.
En 2012, el cáncer gástrico (CG) presentó una incidencia de 951.000 casos a nivel mundial, siendo la quinta causa de cáncer y la tercera causa de muerte por cáncer con 723.000 casos1. En España es la sexta neoplasia en frecuencia, con 7.810 nuevos casos y 5.389 muertes2 anuales.
Se puede diferenciar el CG en 2categorías topográficas3: cardias o de la unión esofagogástrica (UEG)4 y no cardias o resto del estómago. Ambos tumores tienen factores de riesgo diferenciados.
Los tumores de la UEG representan el 27% de los CG (30% hombres; 21% mujeres), con una incidencia de 3,3/100.000 habitantes (5,3 hombres; 1,6 mujeres)5.
A pesar de una cirugía R0, hay una elevada incidencia de recidiva local y a distancia. Estos resultados han llevado a la evaluación de terapias combinadas con quimioterapia (QT) y radioterapia (RT) de forma neoadyuvante, perioperatoria o adyuvante, no estando aún bien establecida la mejor estrategia de tratamiento.
Esta revisión pretende proporcionar una visión detallada de los tratamientos que disponemos a nivel oncológico para el tratamiento multimodal de los adenocarcinomas de la UEG6.
Tratamiento preoperatorioEn el carcinoma de la UEG se han estudiado tanto la QT como la quimiorradioterapia (QTRT) neoadyuvantes (tabla 1). El metaanálisis de Gebski et al.7 analizaba la QT neoadyuvante (QTNeo) (8 estudios; 1.724 pacientes) y la QTRT preoperatoria (QTRTNeo) (10 estudios; 1.209 pacientes), mostrando un beneficio absoluto en supervivencia global (SG) a 2 años del 7% para QT y del 13% para QTRT. Ambos tratamientos mejoraban la supervivencia (QTRT [p = 0,02] y QT [p = 0,014]) en el caso del adenocarcinoma, pero únicamente la QTRT mostró beneficio en los pacientes con carcinoma escamoso (p = 0,04). El ensayo fase iii CALBG 97818 comparaba cirugía de inicio con QT (CDDP + 5-FU) y RT seguida de cirugía. Reclutó a 56 de los 475 pacientes previstos, consiguiendo demostrar beneficio en SG de 4,48 años frente a 1,79 años (p = 0,002).
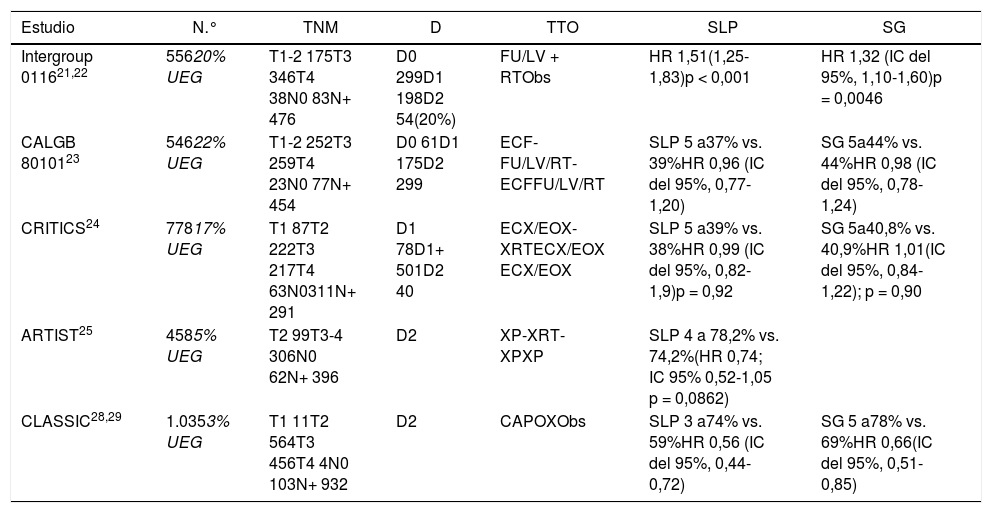
Ensayos clínicos de tratamiento preoperatorio y perioperatorio con quimioterapia y radioquimioterapia en los que se incluyen a pacientes con adenocarcinoma de UGE
| Estudio | N.° | TNM | D | TTO | SLP | SG |
|---|---|---|---|---|---|---|
| Intergroup 011621,22 | 55620% UEG | T1-2 175T3 346T4 38N0 83N+ 476 | D0 299D1 198D2 54(20%) | FU/LV + RTObs | HR 1,51(1,25-1,83)p < 0,001 | HR 1,32 (IC del 95%, 1,10-1,60)p = 0,0046 |
| CALGB 8010123 | 54622% UEG | T1-2 252T3 259T4 23N0 77N+ 454 | D0 61D1 175D2 299 | ECF-FU/LV/RT-ECFFU/LV/RT | SLP 5 a37% vs. 39%HR 0,96 (IC del 95%, 0,77-1,20) | SG 5a44% vs. 44%HR 0,98 (IC del 95%, 0,78-1,24) |
| CRITICS24 | 77817% UEG | T1 87T2 222T3 217T4 63N0311N+ 291 | D1 78D1+ 501D2 40 | ECX/EOX-XRTECX/EOX ECX/EOX | SLP 5 a39% vs. 38%HR 0,99 (IC del 95%, 0,82-1,9)p = 0,92 | SG 5a40,8% vs. 40,9%HR 1,01(IC del 95%, 0,84-1,22); p = 0,90 |
| ARTIST25 | 4585% UEG | T2 99T3-4 306N0 62N+ 396 | D2 | XP-XRT-XPXP | SLP 4 a 78,2% vs. 74,2%(HR 0,74; IC 95% 0,52-1,05 p = 0,0862) | |
| CLASSIC28,29 | 1.0353% UEG | T1 11T2 564T3 456T4 4N0 103N+ 932 | D2 | CAPOXObs | SLP 3 a74% vs. 59%HR 0,56 (IC del 95%, 0,44-0,72) | SG 5 a78% vs. 69%HR 0,66(IC del 95%, 0,51-0,85) |
En los estudios y metaanálisis posteriores9 se mantuvo la hipótesis de beneficio del tratamiento neoadyuvante y en 2012 el estudio fase iii CROSS10 validó la estrategia de QTRTNeo. Se incluyó a 368 pacientes (24% UEG) y se comparó QTNeo (CBCA-paclitaxel) y RT concomitantes seguida de cirugía con cirugía sola. La SG fue de 49 meses frente a 24 meses a favor del tratamiento QTRTNeo (p = 0,003). Las resecciones R0 fueron del 92% frente al 69% a favor de QTRTNeo (p < 0,001), siendo la morbimortalidad igual en ambas ramas de tratamiento.
Quimioterapia neoadyuvanteEl ensayo fase iii OE0211 reclutó a 802 pacientes con cáncer de esófago y de la UEG (10%), y comparó la cirugía directa con la QTNeo (cisplatino-5-FU) seguida de cirugía. El ensayo demostró un beneficio en SG a 5 años del 23% frente al 17% a favor de la neoadyuvancia (p = 0,03). El ensayo fase iii OE05 comparó cisplatino-5-FU con el triplete epirrubicina-cisplatino-capecitabina (ECF) neoadyuvantes seguidos de cirugía y no demostró beneficio para la triple terapia. Un metaanálisis publicado por Sjoquist et al.9 confirmó el beneficio en SG para la QTNeo de 5,1% a 2 años (p = 0,005), el cual se mostró en pacientes con adenocarcinoma (p = 0,01) pero no en el carcinoma escamoso (p = 0,18).
Quimiorradioterapia frente a quimioterapia preoperatoriaEn un estudio dirigido específicamente a pacientes con adenocarcinoma de la UEG12, se incluyó a 126 pacientes de 354 previstos. Se comparó QTNeo (cisplatino + 5-FU) y cirugía posterior frente a QTRTNeo seguida de cirugía. La SG a 3 años (47,4% vs. 27,7%; p = 0,07) y a 5 años13 (p = 0,055), aunque fue mayor en el grupo de QTRT, no alcanzó diferencias estadísticamente significativas. La mortalidad perioperatoria también fue mayor en el grupo de QTRT (10,2% vs. 3,8%). Un segundo estudio14 incluyó a 181 pacientes (18% UEG) comparando QTNeo (cisplatino-5-FU) frente a QTRTNeo. El brazo de QTRTNeo mostró mayor tasa de respuestas patológicas completas (pRC) (28% vs. 9%, p = 0,002) y resecciones R0 (87% vs. 74%; p = 0,004), aunque la SG fue similar en ambos grupos.
Por tanto, el beneficio del tratamiento neoadyuvante tiene una evidencia consistente, aunque sigue existiendo controversia en el tipo de estrategia más beneficiosa.
Debido al beneficio del tratamiento con trastuzumab en pacientes que sobreexpresan HER2 en el estadio metastásico15, están en marcha el estudio fase ii-iii INNOVATION (NCT02205047) (QT + trastuzumab ± pertuzumab neoadyuvante) y el ensayo fase ii (NCT01196390) (RT-carboplatino-taxol ± trastruzumab) para demostrar el potencial efecto de estas terapias en el tratamiento de estos tumores.
Cetuximab (anticuerpo monoclonal anti-EGFR) añadido a QTRTNeo no demostró beneficio en SG en el ensayo fase ii/iii SCOPE116 ni en el ensayo fase iii RTOG 043617. Tampoco bevacizumab (anticuerpo monoclonal anti-VEGF) ha demostrado actividad en un estudio fase ii18, comparando bevacizumab y erlotinib asociado a QTRTNeo (CBDCA-paclitaxel-5-FU).
Actualmente, están en desarrollo ensayos que evalúan la efectividad de otros fármacos inmunoterápicos en neoadyuvancia, como el nivolumab y el ipilimumab (NCT03604991), y el pembrolizumab (NCT02730546).
Tratamiento adyuvanteLa SG después de la resección de los tumores de la UEG oscila entre el 18 y el 50%19, existiendo una tasa de recaída superior al 50%. Por este motivo, es necesario, en muchas ocasiones, el uso de tratamiento adyuvante20.
Existen estudios que evalúan el tratamiento adyuvante con QT (QTAdy) o QTRT (QTRTAdy) (tabla 2).
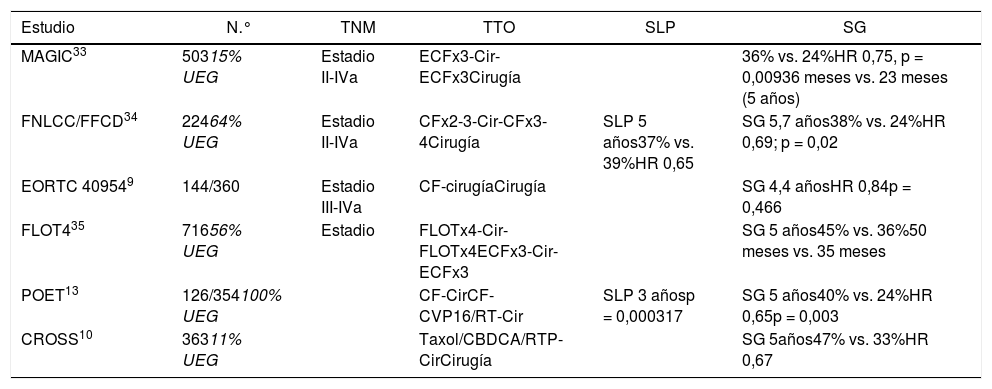
Ensayos clínicos de tratamiento postoperatorio adyuvante con quimioterapia y radioquimioterapia en los que se incluyen pacientes con adenocarcinoma de UGE
| Estudio | N.° | TNM | TTO | SLP | SG |
|---|---|---|---|---|---|
| MAGIC33 | 50315% UEG | Estadio II-IVa | ECFx3-Cir-ECFx3Cirugía | 36% vs. 24%HR 0,75, p = 0,00936 meses vs. 23 meses (5 años) | |
| FNLCC/FFCD34 | 22464% UEG | Estadio II-IVa | CFx2-3-Cir-CFx3-4Cirugía | SLP 5 años37% vs. 39%HR 0,65 | SG 5,7 años38% vs. 24%HR 0,69; p = 0,02 |
| EORTC 409549 | 144/360 | Estadio III-IVa | CF-cirugíaCirugía | SG 4,4 añosHR 0,84p = 0,466 | |
| FLOT435 | 71656% UEG | Estadio | FLOTx4-Cir-FLOTx4ECFx3-Cir-ECFx3 | SG 5 años45% vs. 36%50 meses vs. 35 meses | |
| POET13 | 126/354100% UEG | CF-CirCF-CVP16/RT-Cir | SLP 3 añosp = 0,000317 | SG 5 años40% vs. 24%HR 0,65p = 0,003 | |
| CROSS10 | 36311% UEG | Taxol/CBDCA/RTP-CirCirugía | SG 5años47% vs. 33%HR 0,67 |
El ensayo SWOG 9008/INT-0116 evaluó la eficacia de la cirugía seguida de QTRTAdy en la SG de pacientes con adenocarcinoma de estómago resecable o de la UGE (20%)21. La SG a 10 años fue beneficiosa para la QTRTAdy (27 meses vs. 36 meses; p = 0,0046). La recaída local (19% vs. 27%) benefició a la QTRTAdy22. Estos resultados han estandarizado la QTRTAdy en CG o de la UEG completamente resecado sin tratamiento preoperatorio.
El estudio CALGB 80101 evaluó a 546 pacientes (22% UEG)23 y comparó 5FU frente al esquema ECF asociado a RT. No se encontraron diferencias en la SG a 6,5 años (44% vs. 44%; HR 0,98) ni en SLP (37% vs. 39%; HR 0,96).
El estudio CRITICS incluyó un 17% tumores de la UEG24. Comparó el esquema ECX/EOX con QTRT adyuvantes, sin diferencias en la SG a 5 años (40,8% para QT vs. 40,9% para QTRT).
El estudio ARTIST comparó QT con cisplatino y capecitabina (XP) con QTRT (XP-XRT-XP)25, incluyendo únicamente un 3% de tumores de la UEG. No hubo diferencias en SG (HR: 1,13) ni en recurrencias (p = 0,0862). Los pacientes con ganglios positivos presentaron una SLP a 3 años favorable a QTRTAdy (76% vs. 72%, p = 0,0365). Actualmente, el estudio ARTIST-2 está testando el beneficio en pacientes con ganglios linfáticos positivos.
Si bien la adición de QTRTAdy se ha asociado a beneficios de supervivencia en pacientes con cáncer de la UEG con ganglios positivos26,27, la eficacia de la QTRT postoperatoria en comparación con la cirugía sola no se ha demostrado en un ensayo aleatorizado.
Quimioterapia adyuvanteHay más de 30 estudios aleatorizados que comparan la QT adyuvante con la cirugía sola en el CG resecado. La mayoría son negativos en el objetivo de mejorar la SG y no aportan datos para los tumores de la UEG.
En el estudio asiático CLASSIC, en pacientes con adenocarcinoma gástrico (3% UEG) con linfadenectomía D228, se comparó QTAdy (capecitabina + oxaliplatino) con cirugía sola. La SLP a 3 años (74% vs. 59%, HR: 0,56;) y la SG a 5 años benefició al grupo de QTAdy (78% vs. 69%), siendo los pacientes con mayor beneficio aquellos con afectación ganglionar29.
Los metaanálisis30,31 otorgan mejor pronóstico a los pacientes asiáticos, reduciendo el riesgo de muerte un 15% cuando se tratan con QTAdy (HR: 0,85)32.
Tratamiento quimioterápico perioperatorioExisten 4estudios relevantes de tratamiento quimioterápico perioperatorio frente a cirugía sola en pacientes diagnosticados de CG (tabla 1).
El estudio MAGIC33 incluyó a pacientes con adenocarcinoma potencialmente resecable de estómago (74%), esófago distal (15%) y de la UEG (11%). La QT (ECFx6 perioperatoria) se comparó con cirugía sola y consiguió mayor cirugía R0 (79% vs. 70%), tumores T1/2 (52% vs. 37%), enfermedad N0 (84% vs. 71%) y SG a 5 años del 36% frente al 23% del grupo de cirugía sola.
El estudio francés FNCLCC/FFCD34 (144 UEG) estudió QT perioperatoria con cisplatino-5-FU frente a cirugía sola. La SLP a 5 años (34% vs. 19%) y la SG (38% vs. 24%) favorecieron a la QT.
Un metaanálisis9 concluyó que QTNeo aumentaba la SG (HR: 1,32) y la SLP (HR: 1,85).
El estudio fase iii FLOT4-AIO35 comparó el tratamiento perioperatorio FLOT (docetaxel + oxaliplatino + 5-FU) con ECF/ECX y aleatorizó a 716 pacientes con CG (44%) y de la UEG (56%). FLOT fue significativamente mejor en pRC (16% vs. 8%), T0/T1 (25% vs. 15%), N0 (49% vs. 41%) y SG a 5 años (45% vs. 36%). Las complicaciones posquirúrgicas fueron similares. Estos resultados han posicionado el esquema FLOT como estándar en el tratamiento perioperatorio.
Actualmente, está siendo testado el tratamiento con inmunoterapia en la estrategia perioperatoria (NCT03221426, NCT03421288) y adyuvante (NCT2743494, NCT03006705).
Tratamiento estadio iv (metastásico)Los tumores de la UEG han sido incluidos en estudios que exploran el tratamiento del adenocarcinoma gástrico estadio iv. Una revisión de Cochrane36 evidenció el beneficio en la SG del tratamiento con QT comparado con el mejor tratamiento de soporte (4,3 vs. 11 meses).
Los fármacos con efectividad demostrada en CG/UEG metastásico son fluoropirimidinas (5-FU, capecitabina), sales de platino (oxaliplatino y cisplatino), taxanos (paclitaxel, docetaxel), irinotecán y TAS 102. También los anticuerpos monoclonales trastuzumab y ramucirumab, y la inmunoterapia (pembrolizumab y nivolumab), especialmente en tumores con inestabilidad de microsatélites o sobreexpresión de PDL1.
La elección del tratamiento dependerá del estado general y la comorbilidad del paciente, así como de la sobreexpresión HER2 en el tejido tumoral. Los tratamientos de combinación con 2fármacos (fluoropirimidinas-platino) son el estándar37, pero combinaciones con 3fármacos(5-FU + platino + docetaxel, ECF) en pacientes con excelente estado general, o la monoterapia (fluoropirimidina, irinotecán, taxano semanal) en pacientes con mal estado general, podrían ser la elección37.
Primera línea de tratamientoEl ensayo fase iii ToGA aleatorizó a los pacientes con sobreexpresión de HER238 (20% UEG) a cisplatino + 5-FU ± trastuzumab16. Tanto la SG (13,8 frente a 11,1 meses; p = 0,0046) como la tasa de respuesta objetiva (47% frente 35%; p = 0,0017) fue favorable al empleo de trastuzumab. En tumores sin sobreexpresión de HER2, los principales esquemas de combinación son FOLFOX y CAPOX. El uso de tripletes39 (cisplatino + docetaxel + 5-FU) consigue más respuestas y SLP con mayor toxicidad. La contribución de antraciclinas e irinotecán no demuestra un claro beneficio en la SLP ni la SG40. Los anticuerpos monoclonales anti-EGFR (cetuximab, panitumumab) o anti-VEGF/VEGF-R (bevacizumab, ramucirumab, aflibercept) no han demostrado actividad.
Segunda línea de tratamientoAlgunos tratamientos son paclitaxel semanal, docetaxel o irinotecán41. La combinación paclitaxel + ramucirumab (estudio fase iii RAINBOW42 con 20% de tumores de la UEG) presentó una SLP de 4,4 frente a 2,9 meses y una SG de 9,6 meses frente a 7,4 meses (p = 0,017) a favor de añadir ramucirumab a taxol, pasando a ser el tratamiento de elección en segunda línea37.
InmunoterapiaLa utilidad de la inmunoterapia se ha demostrado en el estadio metastásico43 con pembrolizumab y nivolumab en los estudios KEYNOTE-5944, KEYNOTE-6145 y ATTRACTION-246.
ConclusionesEl adenocarcinoma de la UEG es una entidad que está aumentando en incidencia, debido, en parte, a los hábitos alimentarios y de conducta. Los tumores de la UEG localizados pueden tratarse consiguiendo curaciones superiores a los tumores del cuerpo gástrico. Los estudios han implicado a la cirugía y el tratamiento con QT o RT administrado de forma neoadyuvante, adyuvante o perioperatoria. Pero a día de hoy, no hemos podido definir una estrategia como estándar. Es por este motivo que el tratamiento de los adenocarcinomas de la UEG sigue siendo un reto terapéutico para el comité de tumores multidisciplinar.
Conflicto de interesesLos autores declaran no tener conflictos de interés en la redacción de este manuscrito.