El trasplante de páncreas-riñón simultáneo constituye el tratamiento de elección en la diabetes tipo1 o tipo2 con fallo renal terminal o preterminal (diálisis o prediálisis), por ser la única terapia que consigue el estado euglucémico (insulino-independiente) en el paciente diabético.
MétodosEstudio retrospectivo y descriptivo de una serie de 175 pacientes trasplantados de páncreas-riñón simultáneo entre marzo de 1995 y abril de 2016. Se analizan las características de los donantes y receptores, variables perioperatorias e inmunosupresión, morbimortalidad postrasplante, supervivencia del paciente e injerto y factores de riesgo de supervivencia del paciente e injerto.
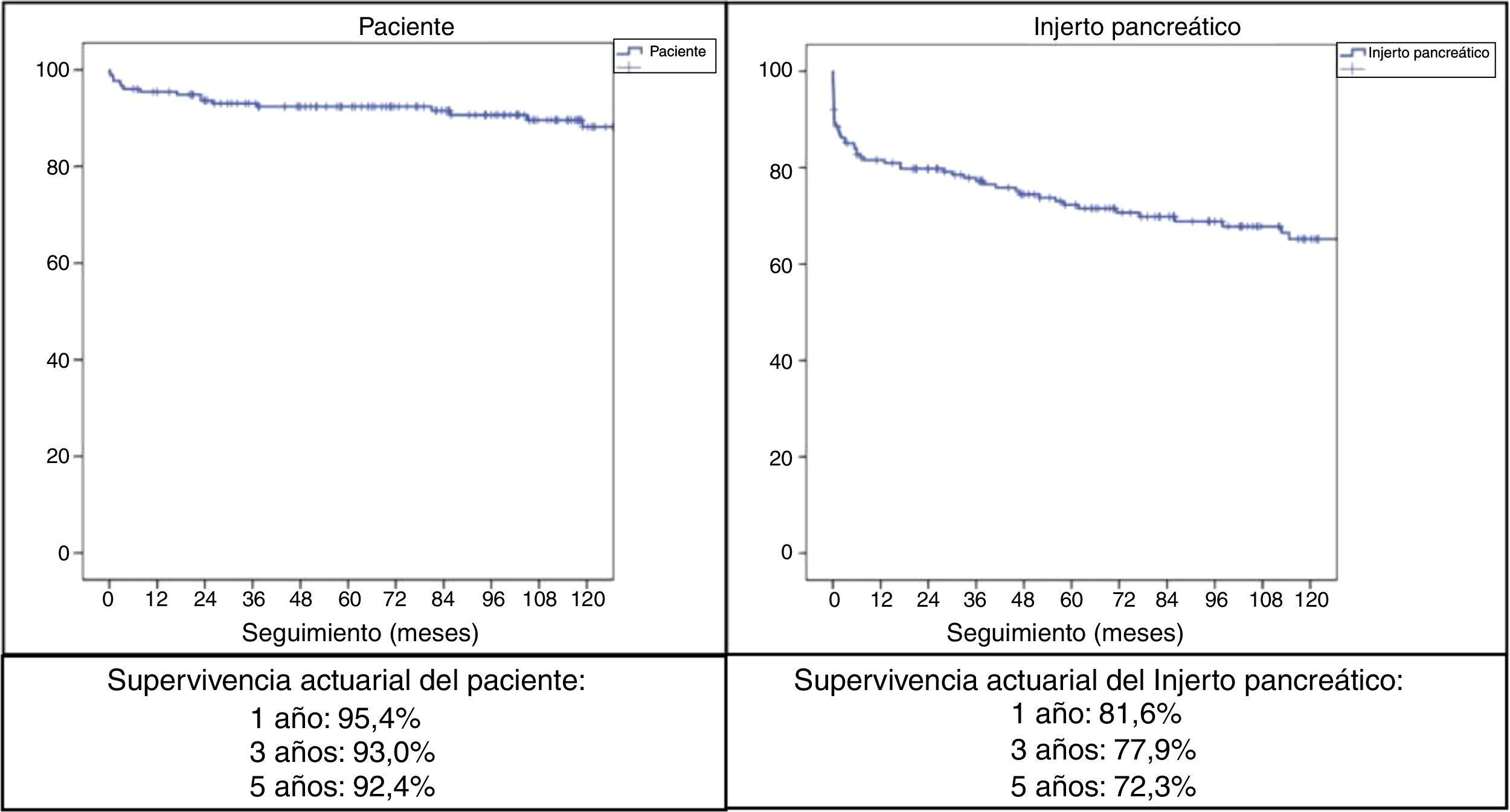
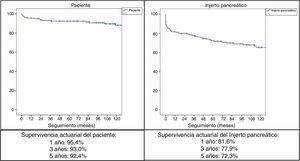
ResultadosLa mediana de edad de los donantes fue de 28años y la media de los receptores, de 38,8±7,3años, siendo 103 hombres y 72 mujeres. La derivación duodeno-entérica se realizó en 113 casos y la duodeno-vesical, en 62. Las tasas de complicaciones postrasplante fueron las siguientes: infección global (70,3%), pancreatitis del injerto (26,3%), hemorragia intraabdominal (17,7%), trombosis del injerto (12,6%) y rechazo pancreático global (10,9%). Las causas de mortalidad fueron fundamentalmente cardiovasculares e infecciosas. La supervivencia del paciente a 1, 3 y 5años fue del 95,4, del 93 y del 92,4%, respectivamente, mientras que la del injerto correspondió al 81,6, al 77,9 y al 72,3%, respectivamente, durante el mismo periodo.
ConclusionesEn nuestra experiencia de 20años de trasplante pancreático-renal simultáneo las tasas de morbilidad y supervivencia del paciente y del injerto a 5años son similares a las referidas en los registros internacionales de trasplante pancreático.
Simultaneous pancreas-kidney transplantation (SPKT) constitutes the therapy of choice for diabetes type1 or type2 associated with end-stage renal disease, because is the only proven method to restore normo-glicemic control in the diabetic patient.
MethodsRetrospective and descriptive study of a series of 175 patients who underwent SPKT from March 1995 to April 2016. We analyze donor and recipient characteristics, perioperative variables and immunosuppression, post-transplant morbi-mortality, patient and graft survival, and risk factors related with patient and graft survival.
ResultsMedian age of the donors was 28years and mean age of recipients was 38.8±7.3years, being 103 males and 72 females. Enteric drainage of the exocrine pancreas was performed in 113 patients and bladder drainage in 62. Regarding post-transplant complications, the overall rate of infections was 70.3%; graft pancreatitis 26.3%; intraabdominal bleeding 17.7%; graft thrombosis 12.6%; and overall pancreas graft rejection 10.9%. The causes of mortality were mainly cardiovascular and infectious complications. Patient survival at 1, 3 and 5-year were 95.4%, 93% and 92.4%, respectively, and pancreas graft survival at 1, 3 and 5-year were 81.6%, 77.9% y 72.3%, respectively.
ConclusionsIn our 20-year experience of simultaneous pancreas-kidney transplantation, the morbidity rate, and 5-year patient and pancreas graft survivals were similar to those previously reported from the international pancreas transplant registries.
El trasplante de páncreas-riñón simultáneo (TPRS) constituye el tratamiento de elección de la diabetes tipo1 en estadio de fallo renal terminal, ya que es la única terapia que consigue un estado euglucémico insulino-independiente con normal homeostasis de la glucosa1,2. En la diabetes tipo2 el trasplante de páncreas se recomienda en pacientes con glucemia inestable, insulinodependiente, diabetes de al menos 5años de duración, índice de masa corporal (IMC) menor de 32kg/m2 y ausencia de enfermedad cardiovascular3,4. El resultado del TPRS, en términos de supervivencia del paciente y del injerto, es similar en diabéticos tipo1 y tipo25. Entre las ventajas del trasplante de páncreas se señalan la mejoría de las complicaciones relacionadas con la diabetes: nefropatía diabética incipiente de los riñones nativos, neuropatía periférica sensitiva y autonómica, gastroparesia, retinopatía, enfermedad microvascular y macrovascular, función cardiaca y sexual6–16 y calidad de vida17.
Desde que Lillehei y Kelly18 llevaron a cabo el primer trasplante de páncreas, en Minneapolis, en 1966, hasta diciembre de 2014, se habían registrado más de 48.000 trasplantes de páncreas en todo el mundo (más de 29.000 en Estados Unidos y más de 19.000 en el resto de los países), en sus diferentes modalidades simultáneo de páncreas riñón (TPRS), pancreático después del renal (TPDR) o de páncreas aislado (TPA)19. En este trabajo analizaremos nuestros resultados obtenidos con la realización del TPRS.
MétodosEn el Hospital Universitario Doce de Octubre, desde marzo de 1995 hasta abril de 2016, hemos realizado 206 trasplantes de páncreas en sus diferentes modalidades: 175 trasplantes de páncreas-riñón simultáneos (TPRS), 15 de páncreas después del riñón (TPDR) y 16 retrasplantes. En este estudio observacional y retrospectivo analizamos nuestra experiencia correspondiente a los TPRS realizados durante el periodo referido, teniendo en cuenta un seguimiento mínimo postrasplante de 6meses. Se analizaron las variables del donante, del receptor y perioperatorias, así como las complicaciones postrasplante y la supervivencia del paciente y del injerto, y factores de riesgo de supervivencia del receptor y del injerto.
Criterios de selección de donantesEn nuestro protocolo se aceptaron injertos pancreáticos de donantes de entre 10 y 50años, hemodinámicamente estables, con peso superior a 30kg, color y consistencia normales y ausencia de: diabetes1 en el donante o familiares de primer orden, parada cardiaca o estancia prolongada en UVI, alcoholismo, calcificaciones, esteatosis, edema pancreático importante, traumatismo o pancreatitis crónica del injerto, contaminación bacteriana abdominal, infección (viral, bacteriana o fúngica), tumores (excepto piel y cerebro) y drogadicción i.v. La hiperamilasemia superior al doble de lo normal y la glucemia mayor de 200mg/ml se consideraron contraindicaciones relativas, sobre todo cuando se trataba de un traumatismo craneoencefálico como causa de fallecimiento del donante.
Criterios de selección de receptoresLos candidatos se evaluaron por el equipo de trasplante de órganos abdominales, el de trasplante renal y el de anestesiología, siguiendo nuestro protocolo de pruebas.
El TPRS se indicó en pacientes diabéticos tipo1 o2, de edad comprendida entre 25 y 66años, presentando nefropatía terminal en fase de diálisis o preterminal (aclaramiento de creatinina menor de 40ml/min) con neuropatía y/o retinopatía grave. Asimismo, estos pacientes no debían presentar contraindicaciones absolutas para el trasplante (gangrena periférica, infección activa, tumor tratado en periodo inferior a 5años o recidiva de este, enfermedad neuropsiquiátrica grave, VIH+, drogadicción i.v., coronariopatía grave intratable, insuficiencia cardiaca o respiratoria terminales). Como contraindicaciones relativas consideramos la retinopatía hemorrágica, ateromatosis ílio-femoral avanzada y neuropatía periférica incapacitante. Realizamos rutinariamente un angio-TAC aortoilíaco para descartar ateromatosis ilíaca, y una prueba de esfuerzo con talio o ecocardiografía con dobutamina para descartar enfermedad coronaria, que se complementó con coronariografía en caso de sospecha de coronariopatía20.
Técnica quirúrgicaLa extracción del injerto duodenopancreático se realizó en bloque, perfundiéndolo con solución de Belzer o de Celsior, dependiendo de la época del trasplante. En banco se preparó el injerto, cerrando los extremos proximal y distal del duodeno en 3 planos (grapado lineal y 2 suturas continuas de polipropileno 4/0) e interponiendo un injerto arterial en Y invertida de arteria ilíaca común, anastomosando la rama externa con la arteria mesentérica superior (AMS) del injerto y la interna con la arteria esplénica, mediante sutura continua o interrumpida de prolipropileno 6-7/0. La arteria ilíaca común del injerto interpuesto en Y es la que se anastomosó con la arteria ilíaca común (AIC) o arteria ilíaca externa (AIE) del receptor.
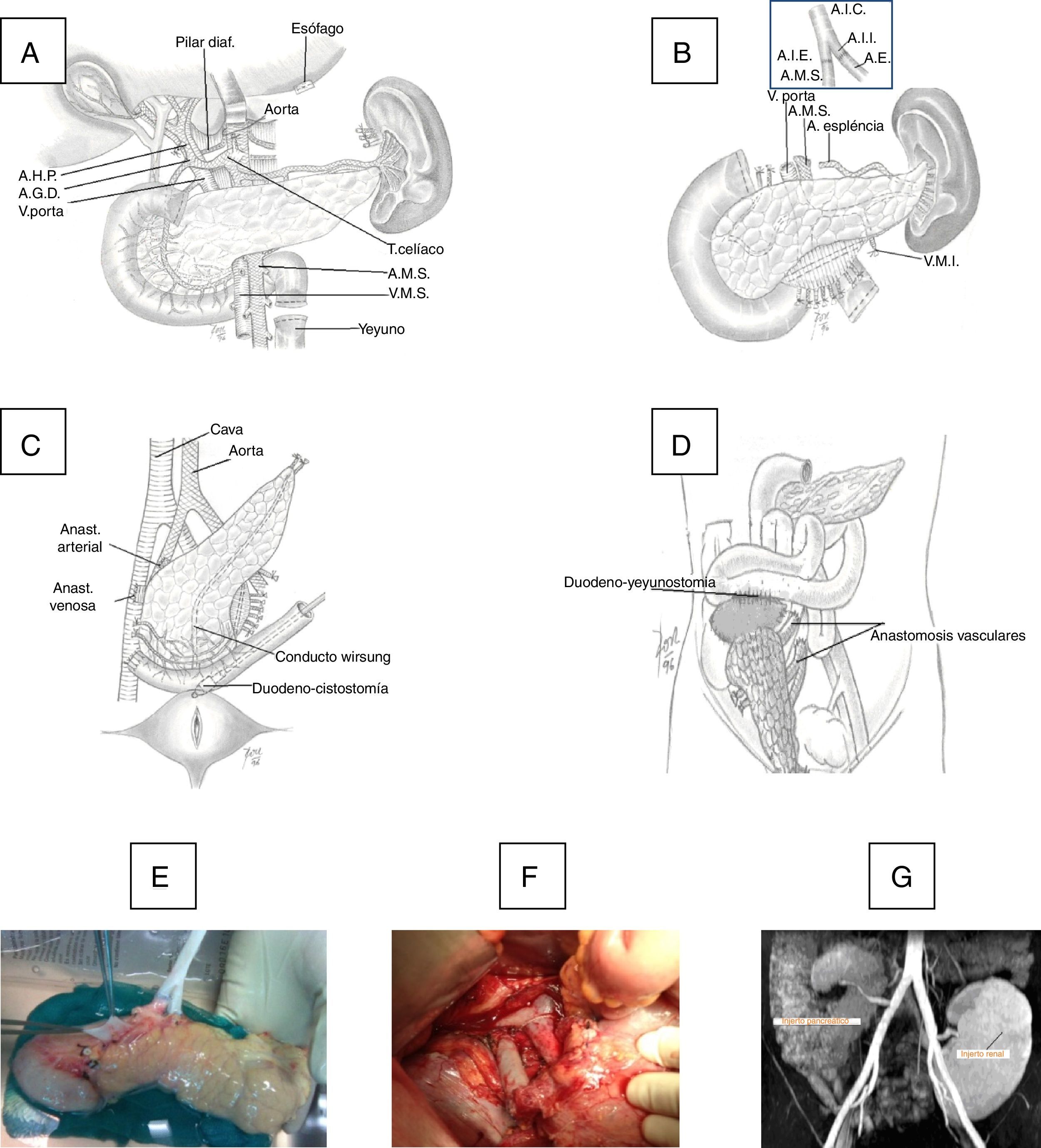
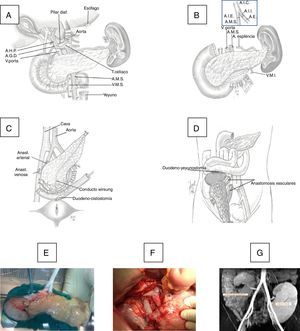
El injerto duodeno-pancreático se implantó en fosa ilíaca derecha. En una primera época se anastomosó la vena porta del injerto con la vena ilíaca externa del receptor en término-lateral con polipropileno 6/0 en sutura continua, y en una segunda época se realizó una anastomosis porto-cava en término-lateral. Al inicio del programa, la secreción exocrina del injerto se derivó a la vejiga mediante una duodeno-cistostomía con sutura circular instrumental, reforzada internamente con poligluconato 4/0. En época más reciente cambiamos esta técnica por una duodeno-enterostomía, bien con el yeyuno cuando la cabeza del injerto se colocó en posición cefálica o bien con el íleon terminal (a 100cm de la válvula íleo-cecal) cuando la cabeza del páncreas se situó en posición caudal (fig. 1).
A)Técnica de la extracción de páncreas en donante. B)Banco: anastomosis del injerto ilíaco arterial en Y con arteria mesentérica superior (AMS) y arteria esplénica (AE) del injerto. C)Implante en fosa ilíaca derecha: anastomosis arterial entre el extremo del injerto en Y con la arteria ilíaca común o externa del receptor y anastomosis venosa entre la vena porta del injerto con la vena ilíaca común o vena cava del receptor y anastomosis duodeno-vesical con grapadora mecánica. D)Implante en fosa ilíaca derecha con anastomosis duodeno-yeyunal latero-lateral con cabeza de páncreas en posición craneal. E)Injerto en banco. F)Anastomosis vasculares e injerto reperfundido. G)Imagen de RM con injerto pancreático en fosa ilíaca derecha y renal en fosa ilíaca izquierda.
El régimen actual de profilaxis de la infección bacteriana es con ceftazidima y teicoplanina, siendo la micafungina de la fúngica, valganciclovir del CMV (donante+/receptor−) y trimetoprim-sulfametoxazol de Pneumocystis carinii. La profilaxis de la trombosis del injerto ha cambiado a lo largo de los años, utilizando inicialmente dextrano o heparina i.v., y actualmente heparina de bajo peso molecular (enoxaparina, 4.000UI/día) a las 24h del trasplante y ácido acetilsalicílico (100mg/día) a partir del 5.°-7.°día. Las medidas postrasplante consistieron en mantener normal la hemodinámica, realizando determinaciones periódicas de glucemia, creatinina, iones y hemograma, efectuando un ecodoppler al segundo día para constatar la vascularización de los injertos. En caso de dudas de la permeabilidad vascular se realizó un angio-TAC. Los pacientes se trataron en el postoperatorio con nutrición parenteral hasta la reanudación de la alimentación oral. La glucemia >150mg/dl se trató con insulina.
La inmunosupresión consistió en cuádruple terapia: inducción con anticuerpos (1,5mg/kg/día timoglobulina durante 7días o basiliximab, 20mg el día del trasplante y 20 al 4.° día), tacrolimus (dosis para mantener niveles entre 10-15ng/ml durante los 6 primeros meses y después entre 5-10ng/ml), azatioprina durante 3meses que posteriormente se sustituyó por micofenolato mofetilo (MMF) y corticoides (125mg, día 1.°; 100mg, día 2.°; 20mg, día 3.°, y reducción progresiva hasta 5mg/día al año). Se sospechó rechazo agudo por la clínica, la elevación de creatinina, el descenso de la actividad de amilasa en orina (derivación duodeno-vesical), y se confirmó por biopsia renal. El rechazo agudo se trató con bolos de corticoides de 250-500mg y anticuerpos (timoglobulina o basiliximab).
Se consideró disfunción o retraso en la función del injerto cuando el paciente requirió transitoriamente aporte de insulina o tratamiento con antidiabéticos orales para mantener niveles normales de glucemia. El diagnóstico de pancreatitis del injerto se basó en criterios clínicos (fiebre, dolor abdominal, rebote, íleo), hiperamilasemia, drenaje peritoneal >250ml/día con amilasa >1.000UI/l, duodenitis por cistoscopia en derivación vesical, edema pancreático, inflamación y líquido peripancreático por TAC o confirmación de estos hallazgos por laparotomía21.
Se definió como pérdida del injerto a la necesidad permanente de insulina con dosis similares a las previas al trasplante o cuando el paciente falleció por cualquier causa.
Análisis estadísticoPara describir las variables cualitativas se utilizaron las frecuencias absolutas y relativas en forma de porcentaje. Las variables cuantitativas con una distribución normal se expresaron mediante la media y la desviación estándar, mientras que cuando la distribución no era normal se utilizó la mediana y los percentiles 25 y 75. La normalidad de las variables cuantitativas se estudió con el test de Kolmogorov-Smirnov. La supervivencia de los pacientes y de los injertos se calculó mediante el método actuarial de Kaplan-Meier.
Además, se construyó un modelo multivariante de regresión de Cox para analizar conjuntamente la supervivencia del paciente y del injerto, evaluando cada una de las variables. Las variables significativas o con relevancia clínica en el análisis univariante se analizaron utilizando el modelo de regresión de Cox. El modelo final fue descrito a través del hazard ratio, aportando su intervalo de confianza del 95% junto al valor de p. Una p<0,05 se consideró estadísticamente significativa. Los datos de este estudio han sido recogidos y procesados para el análisis mediante el programa estadístico SPSS 15.0.
ResultadosCaracterísticas de los donantes y receptoresLa mayoría de los donantes de la serie eran hombres (70%), con una mediana de edad de 28años, siendo la principal causa de muerte un traumatismo craneoencefálico, presentando parada cardiaca el 12% y una mediana de estancia en UCI de 30h. En cuanto a los receptores, el 58,9% eran varones, siendo 38,8±7,3años la edad media de la serie. La mediana de duración de la diabetes fue de 23años, hallándose en hemodiálisis 99 (56,5%) pacientes, en diálisis peritoneal 68 (38,9%) y en prediálisis 8 (4,6%). El resto de variables se muestra en la tabla 1.
Características de los donantes y receptores
| Donantes | |
| Sexo | |
| Hombre | 117 (70%) |
| Mujer | 58 (33%) |
| Edad (años) | 28 (rango: 21-35) |
| IMC (kg/m2) | 23,7 ± 2,9 |
| Causa del fallecimiento | |
| TCE | 110 (62,8%) |
| Hemorragia cerebral | 49 (28%) |
| ACVA isquémico | 8 (4,6%) |
| Otras causas | 8 (4,6%) |
| Estancia en UCI (horas) | 30 (rango: 24-49) |
| Hipotensión | 75 (43%) |
| Parada cardiaca | 21 (12%) |
| Uso de fármacos vasoactivos | |
| Noradrenalina | 145 (82,9%) |
| Dopamina | 39 (22,3%) |
| Datos de laboratorio | |
| Glucemia (mg/dl) | 141 (rango: 119-164) |
| Creatinina (mg/dl) | 0,8 (rango: 0,6-0,93) |
| Amilasemia (UI/l) | 107 (rango: 56-216) |
| Actividad protrombina (%) | 71,8 ± 19 |
| Serología CMV(+) | 128 (78%) |
| Receptores | |
| Sexo | |
| Hombre | 103 (58,9%) |
| Mujer | 72 (41,1%) |
| Edad (años) | 38,8 ± 7,3 |
| IMC (kg/m2) | 23,7 (rango: 17-40) |
| Duración de la diabetes (años) | 23 (rango: 21-26) |
| Hemodiálisis | 99 (56,5%) |
| Diálisis peritoneal | 68 (38,9%) |
| Prediálisis | 8 (4,6%) |
| Antecedentes personales | |
| Nefropatía | 175 (100%) |
| Retinopatía | 167 (95,4%) |
| Neuropatía | 129 (74%) |
| Gastropatía | 31 (18%) |
| Cardiopatía | 53 (30%) |
| HTA | 161 (93%) |
| Datos de laboratorio | |
| Glucemia (mg/dl) | 187 (rango: 118-303) |
| Creatinina (mg/dl) | 7,3 ± 2,3 |
| Hb1Ac (%) | 7,8 ± 0,76 |
| Péptido C < 0,1 ng/ml | 169 (97%) |
| Hemoglobina (g/dl) | 12,3 ± 1,6 |
| Serología CMV(+) | 121 (69%) |
| Estatus CMV (D+/R−) | 42 (24%) |
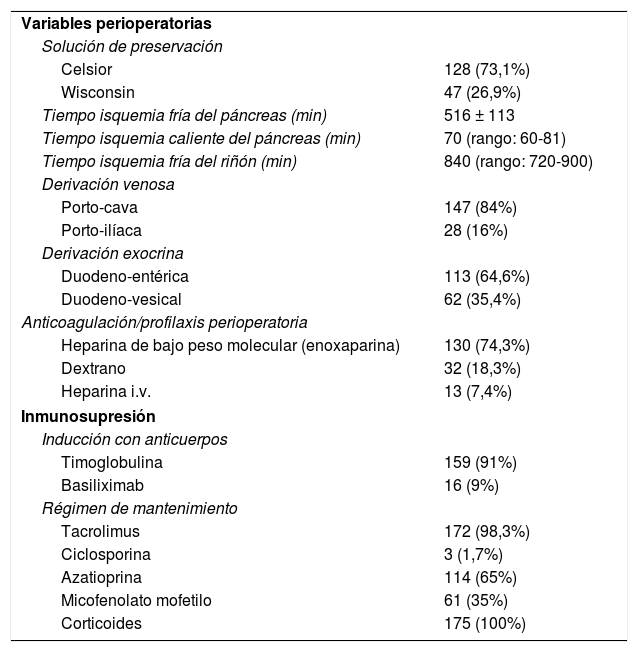
La mayoría de los injertos se perfundieron y preservaron con solución de Celsior (73,1%), la mediana de los tiempos de isquemia fría fue de 840 y la mediana de la isquemia caliente fue de 70min, predominando la derivación venosa porto-cava (84%) frente a la porto-ilíaca (16%), mientras que la derivación exocrina duodeno-entérica prevaleció (64,6%) frente a la duodeno-vesical (35,4%). Como prevención de la trombosis del injerto utilizamos heparina de bajo peso molecular en la mayoría de los casos (74,3%). Con relación a la inmunosupresión, la mayoría de los pacientes se indujeron con timoglobulina (91%), siendo la terapia de inmunosupresión basal con tacrolimus (98,3%) y azatioprina (65%) durante los 3-4 primeros meses postrasplante. A partir de este momento la azatioprina se sustituyó por MMF. La terapia esteroidea se administró a todos los enfermos (tabla 2).
Variables perioperatorias e inmunosupresión
| Variables perioperatorias | |
| Solución de preservación | |
| Celsior | 128 (73,1%) |
| Wisconsin | 47 (26,9%) |
| Tiempo isquemia fría del páncreas (min) | 516 ± 113 |
| Tiempo isquemia caliente del páncreas (min) | 70 (rango: 60-81) |
| Tiempo isquemia fría del riñón (min) | 840 (rango: 720-900) |
| Derivación venosa | |
| Porto-cava | 147 (84%) |
| Porto-ilíaca | 28 (16%) |
| Derivación exocrina | |
| Duodeno-entérica | 113 (64,6%) |
| Duodeno-vesical | 62 (35,4%) |
| Anticoagulación/profilaxis perioperatoria | |
| Heparina de bajo peso molecular (enoxaparina) | 130 (74,3%) |
| Dextrano | 32 (18,3%) |
| Heparina i.v. | 13 (7,4%) |
| Inmunosupresión | |
| Inducción con anticuerpos | |
| Timoglobulina | 159 (91%) |
| Basiliximab | 16 (9%) |
| Régimen de mantenimiento | |
| Tacrolimus | 172 (98,3%) |
| Ciclosporina | 3 (1,7%) |
| Azatioprina | 114 (65%) |
| Micofenolato mofetilo | 61 (35%) |
| Corticoides | 175 (100%) |
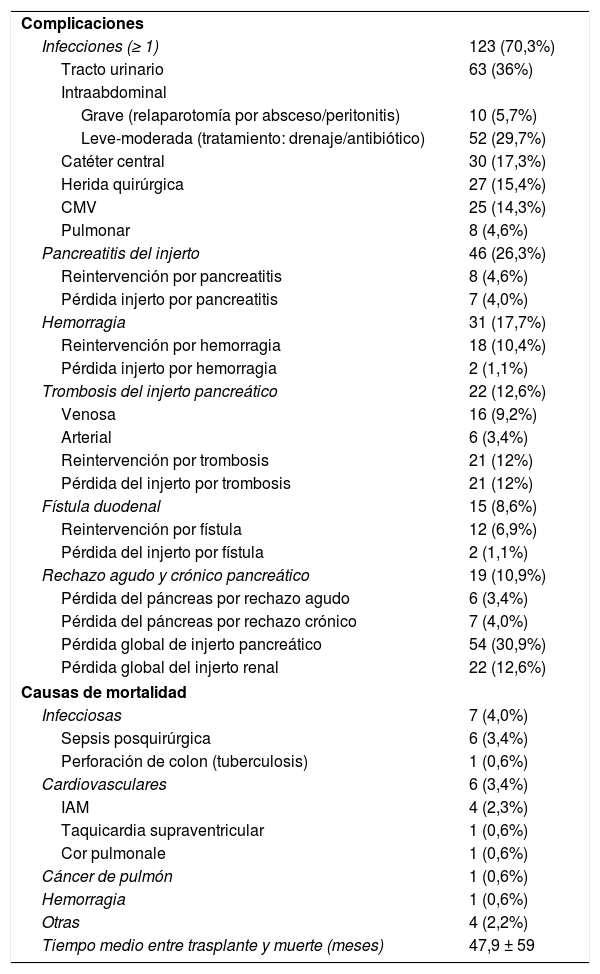
Las infecciones fueron las complicaciones más frecuentes después del trasplante: al menos un episodio en 123 pacientes (70,3%), destacando las intraabdominales y las infecciones del tracto urinario (fundamentalmente en derivaciones duodeno-vesicales). Siguieron en frecuencia la pancreatitis del injerto (26,3%), hemorragia intraabdominal o del injerto (17,7%), trombosis global del injerto (12,6%) y fístula duodenal (8,6%).
La trombosis del injerto fue venosa en 16 (9,2%) casos y arterial en 6 (3,4%), reinterviniéndose por esta complicación 21 pacientes y realizándose trasplantectomía en todos ellos por ser inviable el injerto, a excepción de un injerto con trombosis venosa que se diagnosticó y trató intraoperatoriamente cuando se iba a proceder al cierre de la laparotomía. El rechazo agudo se presentó en 19 (10,9%) pacientes, evolucionando 7 (4%) a rechazo crónico. Así, se perdieron un total de 13 (7,4%) injertos por rechazo (6 por agudo y 7 por crónico). Incluyendo el rechazo, la pérdida global del injerto pancreático fue del 30,9%, mientras que la del renal fue del 12,6%. Después de un periodo de seguimiento medio postrasplante de 82,7meses, 19 (10,9%) pacientes de la serie fallecieron, siendo las causas más frecuentes las infecciosas (7 pacientes; 4%) y las cardiovasculares (6 pacientes; 3,4%). El tiempo medio entre el trasplante y el fallecimiento fue de 47,9±59meses (tabla 3).
Complicaciones y mortalidad postrasplante
| Complicaciones | |
| Infecciones (≥ 1) | 123 (70,3%) |
| Tracto urinario | 63 (36%) |
| Intraabdominal | |
| Grave (relaparotomía por absceso/peritonitis) | 10 (5,7%) |
| Leve-moderada (tratamiento: drenaje/antibiótico) | 52 (29,7%) |
| Catéter central | 30 (17,3%) |
| Herida quirúrgica | 27 (15,4%) |
| CMV | 25 (14,3%) |
| Pulmonar | 8 (4,6%) |
| Pancreatitis del injerto | 46 (26,3%) |
| Reintervención por pancreatitis | 8 (4,6%) |
| Pérdida injerto por pancreatitis | 7 (4,0%) |
| Hemorragia | 31 (17,7%) |
| Reintervención por hemorragia | 18 (10,4%) |
| Pérdida injerto por hemorragia | 2 (1,1%) |
| Trombosis del injerto pancreático | 22 (12,6%) |
| Venosa | 16 (9,2%) |
| Arterial | 6 (3,4%) |
| Reintervención por trombosis | 21 (12%) |
| Pérdida del injerto por trombosis | 21 (12%) |
| Fístula duodenal | 15 (8,6%) |
| Reintervención por fístula | 12 (6,9%) |
| Pérdida del injerto por fístula | 2 (1,1%) |
| Rechazo agudo y crónico pancreático | 19 (10,9%) |
| Pérdida del páncreas por rechazo agudo | 6 (3,4%) |
| Pérdida del páncreas por rechazo crónico | 7 (4,0%) |
| Pérdida global de injerto pancreático | 54 (30,9%) |
| Pérdida global del injerto renal | 22 (12,6%) |
| Causas de mortalidad | |
| Infecciosas | 7 (4,0%) |
| Sepsis posquirúrgica | 6 (3,4%) |
| Perforación de colon (tuberculosis) | 1 (0,6%) |
| Cardiovasculares | 6 (3,4%) |
| IAM | 4 (2,3%) |
| Taquicardia supraventricular | 1 (0,6%) |
| Cor pulmonale | 1 (0,6%) |
| Cáncer de pulmón | 1 (0,6%) |
| Hemorragia | 1 (0,6%) |
| Otras | 4 (2,2%) |
| Tiempo medio entre trasplante y muerte (meses) | 47,9 ± 59 |
A lo largo del seguimiento de la serie se realizaron 46 intervenciones: conversión de derivación duodeno-vesical a duodeno-entérica en 14 pacientes (22,6%) sobre un total de 62, donde se utilizó la derivación vesical, laparotomía por obstrucción intestinal en 7 (4%), colecistectomía en 6 (3,5%), litotricia vesical en 5 (2,9%), amputaciones distales de miembros inferiores en 4 (2,3%), eventroplastia en 2 (1,1%) y otras en 8 (4,6%) (tabla 4).
Intervenciones quirúrgicas durante el seguimiento (n = 46)
| Reconversión duodeno-vesical a duodeno-entérica (14/62) | 14 (22,6%) |
| Obstrucción intestinal | 7 (4,0%) |
| Colecistectomía | 6 (3,4%) |
| Litotricia vesical | 5 (2,9%) |
| Amputación distal | 4 (2,3%) |
| Eventroplastia | 2 (1,1%) |
| Estenosis ureteral | 1 (0,6%) |
| Resección pulmonar por tumor | 1 (0,6%) |
| Bypass vascular | 1 (0,6%) |
| Colectomía subtotal | 1 (0,6%) |
| Otras | 4 (2,3%) |
Con un seguimiento medio de la serie de 89,5meses, la supervivencia actuarial a 1, 3 y 5años del paciente fue del 95,4, del 93 y del 92,4%, respectivamente, mientras que la supervivencia actuarial del injerto pancreático a 1, 3 y 5años fue del 81,6, del 77,9 y del 72,3%, respectivamente (fig. 2).
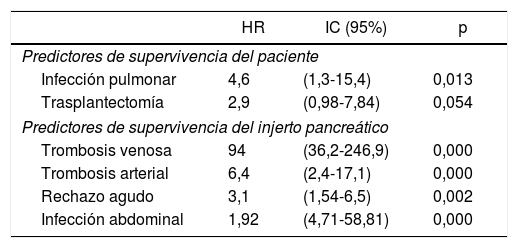
Factores de riesgo de supervivencia del paciente y del injertoEn el análisis multivariable se observó que la infección pulmonar influyó significativamente sobre la supervivencia del paciente, no alcanzando la significación estadística (p=0,054) el hecho de tener que realizar una trasplantectomía. Por otro lado, sobre la supervivencia del injerto influyeron adversamente de forma significativa la presencia de una trombosis venosa o arterial del injerto, el rechazo agudo y la infección abdominal (tabla 5).
Análisis multivariable de regresión de Cox de supervivencia del paciente e injerto pancreático
| HR | IC (95%) | p | |
|---|---|---|---|
| Predictores de supervivencia del paciente | |||
| Infección pulmonar | 4,6 | (1,3-15,4) | 0,013 |
| Trasplantectomía | 2,9 | (0,98-7,84) | 0,054 |
| Predictores de supervivencia del injerto pancreático | |||
| Trombosis venosa | 94 | (36,2-246,9) | 0,000 |
| Trombosis arterial | 6,4 | (2,4-17,1) | 0,000 |
| Rechazo agudo | 3,1 | (1,54-6,5) | 0,002 |
| Infección abdominal | 1,92 | (4,71-58,81) | 0,000 |
Se considera un donante ideal de páncreas al de edad comprendida entre 10 y 40años que presenta IMC<27,5kg/m2 y muerte encefálica no causada por accidente cerebrovascular22, ajustándose nuestros donantes a una mediana de 28años. Aunque debido a la escasez de donantes se están evaluando donantes de hasta 50-55años de edad, la utilización de estos se asocia a una mayor tasa de complicaciones quirúrgicas (pancreatitis y trombosis del injerto) y, por tanto, menor supervivencia del injerto23,24. La utilización de donantes >45años supone un riesgo 4 veces mayor de desarrollar trombosis del injerto25. La excesiva reposición de fluidos por inestabilidad hemodinámica del donante se asocia a edema del injerto, empeorando su microcirculación y favoreciendo la trombosis del injerto23, debiendo en este caso desecharse para trasplante.
La hiperglucemia del donante es frecuente y se atribuye a la liberación de esteroides endógenos y catecolaminas y administración de sueros glucosados y corticoides. Por tanto, en ausencia de insuficiencia endocrina, la hiperglucemia no es una contraindicación absoluta para utilizar el injerto26. En esta serie hemos llegado a utilizar un injerto de un donante con 299mg/dl de glucemia.
La hiperamilasemia, en ausencia de traumatismo pancreático, no constituye una contraindicación de uso para trasplante, ya que suele asociarse a traumatismo craneoencefálico, infarto cerebral y tratamiento con corticoides27,28. Así, en esta experiencia hemos utilizado injertos de hasta 807UI/l de amilasemia con buen resultado.
La edad media de nuestros receptores ha sido de 38,8años, con un caso excepcional de 66años con buena edad biológica (ausencia de ateromatosis ilíaca), trasplantado hace 10años sin complicaciones. La gravedad de la enfermedad y la comorbilidad son mejores predictores de las complicaciones postrasplante que la edad per se, habiéndose obtenido resultados similares (supervivencia del paciente e injerto o tasa de complicaciones) en series comparativas entre receptores mayores o menores de 50años29 o mayores o menores de 55años30. La obesidad en trasplante pancreático se asocia a una mayor dificultad técnica e incidencia de complicaciones y recidiva de la diabetes, y disminución de la supervivencia del paciente e injerto31,32. La situación ideal para realizar un TPRS es la de prediálisis, hecho evidenciado en 8 (4,6%) pacientes de nuestra serie. La diálisis peritoneal pretrasplante de páncreas se ha referido como factor de riesgo para el desarrollo de infecciones intraabdominales postrasplante33,34. En nuestra experiencia, esta incidencia también fue mayor, aunque no estadísticamente significativa en el grupo de diálisis peritoneal frente a la hemodiálisis, siendo similar en ambos grupos la supervivencia del paciente y del injerto35.
La solución de preservación más frecuentemente utilizada por nosotros ha sido la de Celsior frente a la de Wisconsin, obteniendo resultados similares con ambas en un estudio comparativo previo36. La derivación duodeno-vesical, realizada al inicio de nuestro programa, la sustituimos por la más fisiológica derivación duodeno-entérica, ya que con la primera la incidencia de trombosis e infecciones urinarias era significativamente mayor, aunque las supervivencias del paciente e injerto eran similares con ambas derivaciones37. En recientes publicaciones, las incidencias de complicaciones y pérdida del injerto son similares en las derivaciones duodeno-vesicales y duodeno-entéricas2,19,38. La incidencia de infecciones en receptores de páncreas alcanza hasta el 80% durante el primer año postrasplante, experimentando una media de dos episodios de infección grave por año39,40, atribuyéndose el 50% de los fallecimientos a estas infecciones39. Según una extensa serie, el 70% de las infecciones postrasplante eran intraabdominales41, precisando una relaparotomía el 90% de los pacientes y un explante del injerto el 70%42. Nuestra incidencia global de infecciones ha sido del 70%, siendo las abdominales las más graves y las urinarias las más frecuentes, con presentación preferente a partir del tercer mes del trasplante y la mayoría en casos de derivación duodeno-vesical43. La pancreatitis del injerto se ha referido en el 35% de los casos, asociándose a complicaciones graves (absceso, necrosis, fístula, colecciones)21. Nuestra incidencia de pancreatitis del injerto es del 26,3%, habiendo realizado el explante del injerto pancreático en 7 (4%) pacientes por pancreatitis grave.
La trombosis del injerto presenta una incidencia entre el 8,8 y el 35%, asociándose a la pérdida del injerto en prácticamente todos los casos, siendo el bajo flujo sanguíneo del injerto el principal factor de riesgo23,44–47. Nuestra incidencia global de trombosis del injerto ha sido del 12,6% (22 casos), más frecuente la venosa (9,2%), explantándose 21 injertos y preservándose solo uno, que se diagnosticó y trató intraoperatoriamente antes del cierre.
Nuestra tasa de reintervenciones por hemorragia del injerto es del 10,4%, fundamentalmente ocurrida en casos con profilaxis de la trombosis mediante heparina i.v., desde años sustituida por heparina de bajo peso molecular. Las fístulas duodenales se presentan entre el 5 y el 20% en derivaciones duodeno-vesicales frente al 5-8% en derivaciones duodeno-entéricas48, correspondiendo al 8,6% en nuestra serie, donde todas las fístulas se localizaron en el cierre lateral del duodeno, no en la anastomosis propiamente dicha.
Cuando se utiliza la doble terapia tacrolimus +MMF, la incidencia de rechazo agudo es del 27%49, perdiéndose al año la función del injerto pancreático en el 20% de los pacientes que presentan rechazo agudo50. En nuestra serie, 19 (10,9%) pacientes presentaron rechazo agudo, perdiéndose un total de 13 injertos pancreáticos por rechazo (agudo en 6 y crónico en 7).
Los pacientes con TPRS tienen un riesgo de mortalidad 2,8 veces menor que los que permanecen en lista de espera de trasplante (mortalidad del 31% en lista de espera frente a 12% en trasplantados)51. Cuando el injerto pancreático se mantiene funcionante al cabo del año del trasplante, la supervivencia del paciente a 5años es mayor del 90% en todas las categorías (TPRS, TPDR, TPA).
En la serie de 1.000 TPRS de la Universidad de Wisconsin, la supervivencia del paciente a 5años es del 89% y las causas más frecuentes de fallecimiento son cardiopulmonares (7,2%), infecciosas (3,4%), cerebrovasculares (1,8%), fallo renal (1,5%) y tumores (1,3%)52. El factor de riesgo más importante sobre la mortalidad es la pérdida del injerto por el consiguiente retorno al tratamiento insulínico53. La supervivencia a 5años de nuestros pacientes con TPRS ha sido del 92,4%, siendo las causas más frecuentes de mortalidad las infecciosas y las cardiovasculares.
Según el Registro Internacional de Trasplante de Páncreas (IPTR), en relación al TPRS durante el periodo 2008-2009, la supervivencia del injerto renal a 5años es del 81% y la del páncreas, del 73%5. Las supervivencias actuariales del injerto pancreático de nuestra serie de TPRS, a 1, 3 y 5años, son del 81,6, del 77,9 y del 72,3, respectivamente. En el IPTR también se observa que, durante el periodo 2008-2009, el TPRS es el que presenta mayor supervivencia del injerto a 5años: 73% en TPRS, 64% en TPDR y 53% en TPA, habiéndose señalado una serie de factores favorecedores de una mayor supervivencia del injerto a 5años en TPRS: ausencia de diálisis pretrasplante, nivel <20% del panel de anticuerpos reactivos, donantes jóvenes, tiempo corto de isquemia y ausencia de rechazo agudo durante el primer año5.
A lo largo del seguimiento, al igual que otros autores han observado54, las intervenciones más frecuentemente realizadas en nuestros pacientes (46 intervenciones en total) han sido: reconversión de derivación duodeno-vesical a duodeno-entérica por complicaciones urológicas (infecciones, cálculos vesicales) o pancreatitis por reflujo, relaparotomía por obstrucción intestinal, colecistectomía, litotricia vesical, amputaciones distales, eventroplastia y herniorrafias.
En el análisis multivariable hemos observado que la infección pulmonar ha constituido un factor de riesgo de mortalidad, mientras que, como han señalado otros equipos de trasplante, la trombosis venosa o arterial54, el rechazo agudo54 y la infección intraabdominal54 se han confirmado como factores de riesgo de pérdida del injerto.
Como conclusión, en nuestros 21años de experiencia en trasplante pancreático-renal simultáneo, la morbilidad y la supervivencia del paciente y del injerto a 5años son similares a las referidas en los registros internacionales de trasplante pancreático.
AutoríaCarlos Jiménez-Romero: diseño del estudio; redacción del artículo; revisión crítica y aprobación de la revisión final.
Alberto Marcacuzco Quinto: diseño del estudio y adquisición y recogida de datos.
Alejandro Manrique: análisis e interpretación de resultados; revisión crítica y aprobación de la revisión final.
Iago Justo: revisión crítica y aprobación de la revisión final; diseño del estudio.
Jorge Calvo: adquisición y recogida de datos; análisis e interpretación de resultados.
Félix Cambra Molero: adquisición y recogida de datos y análisis e interpretación de datos.Óscar Caso: adquisición y recogida de datos; análisis e interpretación de resultados.Álvaro García-Sesma: adquisición y recogida de datos; análisis e interpretación de resultados.
Enrique Moreno González: diseño del estudio; revisión crítica y aprobación de la revisión final.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.