Introducción
El objetivo en el tratamiento de los pacientes diabéticos ha sido la obtención de unos valores de glucemia normales que permitan un control metabólico lo más correcto posible. Son bien conocidos los esfuerzos que se han realizado con la utilización de diferentes pautas de administración de insulina, bien de forma convencional o bien con la optimización de su uso a través de las bombas subcutáneas. Pese a que no han permitido unos valores de control glucémico comparables a los que presentan los no diabéticos, estas medidas han servido para demostrar que el control metabólico es fundamental para prevenir la aparición de las complicaciones o para frenar su progresión cuando éstas ya existen1,2.
El trasplante pancreático es la única opción que, hasta la actualidad, ha demostrado su efectividad para la obtención de un control metabólico correcto; de este modo, un injerto pancreático producirá insulina en función de la demanda y ritmo biológico individuales, con lo que se consigue un estado de normalización de la glucemia que permite alcanzar unos valores fisiológicos de hemoglobina glucosilada3.
El objetivo de este trabajo es analizar los resultados de nuestra serie, estudiando, por un lado, las complicaciones postoperatorias y, por otro, el grado de funcionalidad del injerto pancreático y los factores por los que pueden influirlo.
Material y método
En el Hospital Universitario Carlos Haya de Málaga y se reinició el programa de trasplante pancreático en febrero de 2000, y desde entonces se han realizado 43 trasplantes de páncreas en 42 receptores. Los pacientes fueron seleccionados entre pacientes con insuficiencia renal crónica (IRC) secundaria a diabetes mellitus (DM) tipo 1 o 2 que cumplieran los siguientes requisitos: edad menor de 45 años (por encima se realizó valoración individualizada); ausencia de vasculopatía periférica severa y/o neuropatía motora o autonómica incapacitante; ausencia de coronariopatía o cardiopatía isquémica no conocidas, que se valoró mediante la realización de un test de esfuerzo con talio-201 dipiridamol y eventual coronariografía y revascularización, si éste fue positivo; aclaramiento de creatinina ≥ 40 ml/min cuando se trató de trasplante pancreático posterior a uno renal, y capacidad de adhesión al tratamiento posterior.
Los criterios de contraindicación fueron: presencia de infección activa; alteraciones de la coagulación; pruebas cruzadas positivas; drogadicción o alcoholismo; presencia de lesiones coronarias no corregibles; fracción de eyección < 50%; historia previa de incumplimiento de los tratamientos prescritos; enfermedad psiquiátrica; neoplasia, y obesidad extrema (peso mayor del 50% del ideal). No se consideró contraindicación para el trasplante la existencia de retinopatía grave (33% de incidencia de amaurosis).
Los criterios de selección del donante fueron: edad inferior a 40 años; sin historia de diabetes ni traumatismo pancreático; ausencia de episodios previos de pancreatitis aguda o crónica, así como de etilismo crónico; sin cirugía pancreática ni esplenectomía previas; ausencia de enfermedad maligna; serología negativa para el virus de la inmunodeficiencia humana (VIH), virus de la hepatitis B (VHB) y C (VHC); estabilidad hemodinámica y ausencia de hipotensión prolongada o hipoxemia con evidencia de daño funcional de otros órganos; no presentar obesidad importante, y ausencia de enfermedad infecciosa no tratada. Para la preservación del injerto utilizamos la solución de Wisconsin.
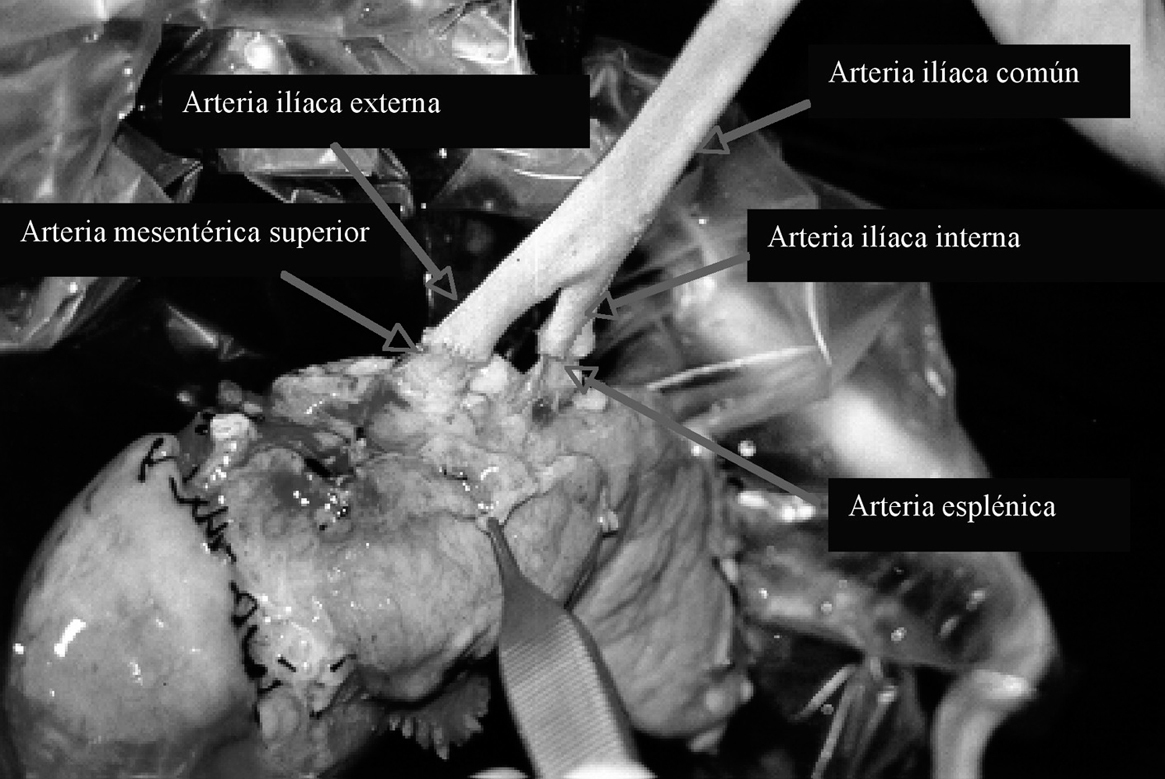
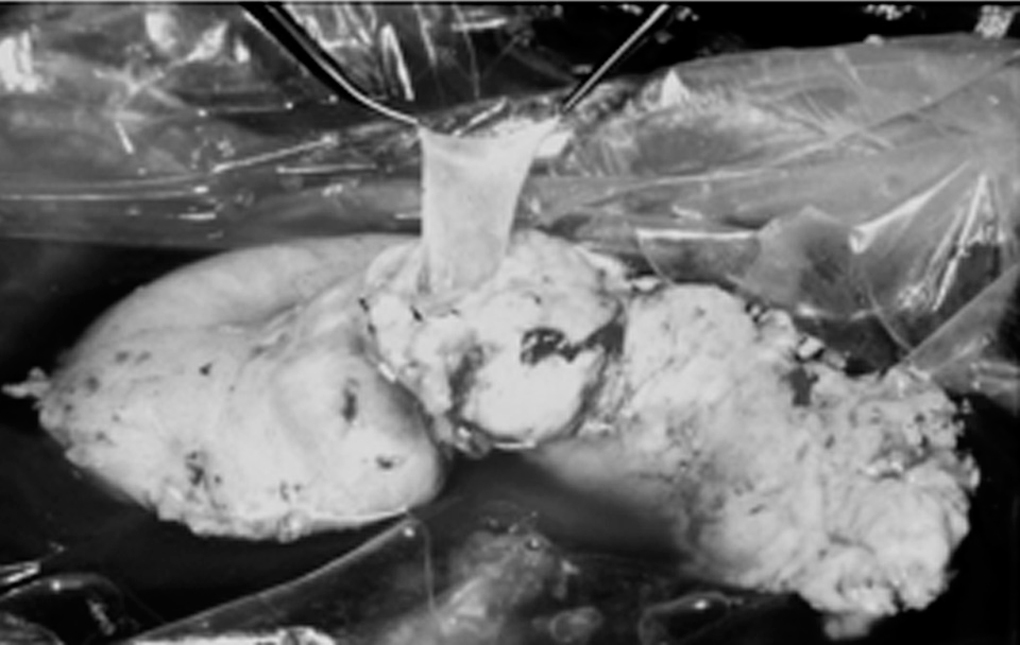
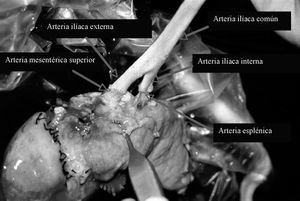
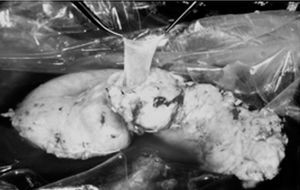
En la cirugía de banco, la reconstrucción arterial se realizó con injerto en "Y" de arteria ilíaca del donante, mediante anastomosis términoterminal entre la arteria esplénica y la arteria ilíaca interna, y la arteria mesentérica superior con la arteria ilíaca externa (fig. 1). La arteria ilíaca común del donante se anastomosó a la arteria ilíaca común del receptor, y se realizó una anastomosis venosa de la porta del donante a la cava del receptor, sin utilizar injertos venosos (fig. 2). El segmento duodenal se acortó hasta 8-9 cm teniendo cuidado de respetar la papila. Los laterales duodenales se suturaron en 3 planos: el primero con grapadora y los otros 2 mediante puntos sueltos de Lembert con material irreabsorbible, siguiendo la técnica de Sollinguer et al4. En cuanto a la secreción exocrina, se realizó derivación intestinal mediante duodenoyeyunostomía laterolateral.
Fig. 1. Reconstrucción arterial.
Fig. 2. Vena porta del injerto tras disección intrapancreática.
La determinación de la glucemia se realizó de forma horaria con administración de insulina (en caso de que fuera necesaria) para mantener cifras de glucemia < 150 mg/dl. Durante el período de ingreso se realizó monitorización de la función renal y pancreática con determinaciones diarias de creatinina, glucemia, péptido C y amilasa en plasma. En todos los pacientes se realizaron controles de injerto pancreático con ultrasonografía-Doppler, a partir de las 24 h del trasplante, que permitió valorar la estructura del injerto, el flujo y el índice de resistencia vascular; en caso de duda, se realizaron angiotomografía computarizada (TC) y/o arteriografía.
El diagnóstico de rechazo se basó en criterios clínicos (dolor en la zona del injerto y febrícula), analíticos (aumento de creatinina, amilasa y lipasa en sangre) y/o histológicos (biopsia de injerto renal o pancreático).
Como régimen inmunosupresor, se utilizó la inducción con 20 mg de basiliximab los días primero y cuarto, tacrolimus (0,1 mg/kg/12 h con el ajuste de la dosis para conseguir valores de 15-20 ng/ml en la primera semana y de 10-15 ng/ml para la segunda), micofenolato-mofetil (1g/12 h vía oral durante el primer mes, después se redujo progresivamente en un período de 2 semanas hasta 500 mg/12 h) y prednisona (125 mg intravenosos [i.v.] el primer y segundo días, a partir del tercer día 30 mg/día vía oral y a partir del 14.o día postoperatorio la dosis se fue reduciendo hasta llegar al cuarto mes en el que se administraron 5 mg/ día).
El protocolo de profilaxis infecciosa ha sido: bacteriana, con ampicilina y ceftriaxona en los 5 primeros días del postoperatorio; antifúngica, con fluconazol 100 mg i.v. cada 24 h durante 7 días y posteriormente 200 mg oral cada 24 h durante 2 meses; frente a Pneumocistis carinii, con trimetroprim/sulfametoxazol, y la antiviral frente a citomegalovirus (CMV) con ganciclovir 5 mg/kg/12 h i.v. durante 14 días, en los siguientes casos: a) donante y receptor positivos; b) donante positivo, receptor negativo, y c) donante negativo, receptor positivo. La profilaxis de trombosis vascular se realizó con clexane 40 mg subcutáneo cada 12 h hasta el décimo día, para seguir con ácido acetilsalicílico 100 mg cada 24 h.
Se definió la pérdida del injerto pancreático como la suma de la mortalidad postoperatoria (en los 3 meses siguientes al implante) y/o la necesidad de reinicio de tratamiento insulínico. Se consideró como reintervención la necesidad de una nueva laparotomía dentro de los 3 meses siguientes al trasplante. El retraso de función de injerto se estableció como la necesidad de 30 o más unidades de insulina entre el primer y el décimo días postoperatorio y/o la necesidad de 15 o más unidades de insulina entre el undécimo y decimoquinto días postoperatorio.
El análisis estadístico se realizó mediante la utilización del paquete estadístico SPSS versión 11.0 para Windows, y se utilizó regresión lineal cuando las variables resultado fueron continuas, regresión logística cuando las variables resultado fueron dicotómicas y test de la χ2 cuando la variable resultado y predictoras eran dicotómicas. Debido al número corto de la serie, se consideró estadísticamente significativo cuando el error alfa fue < 10% (p < 0,1).
Resultados
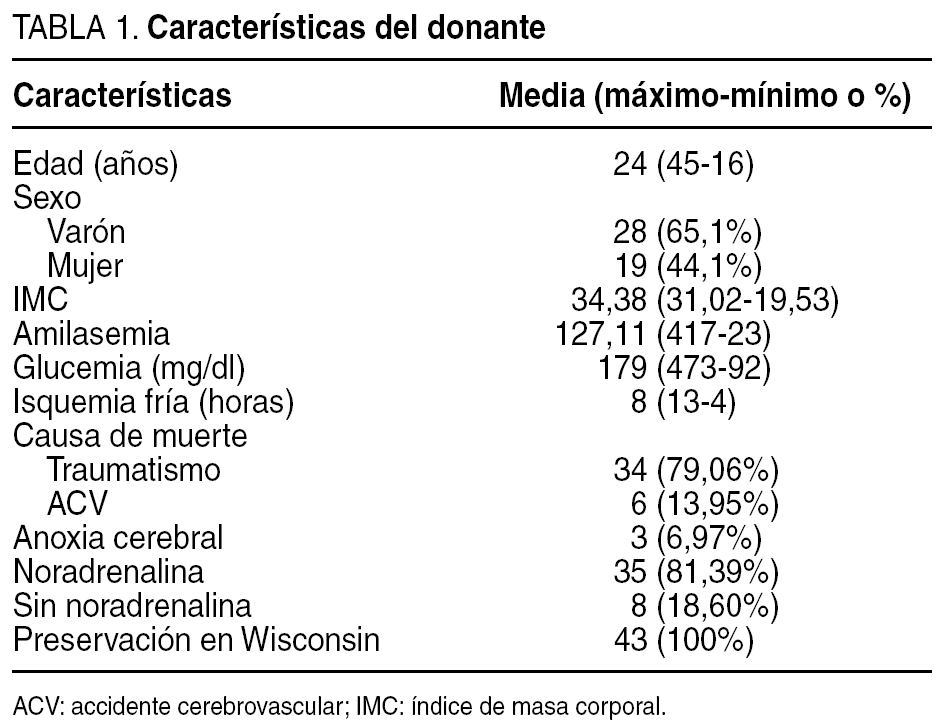
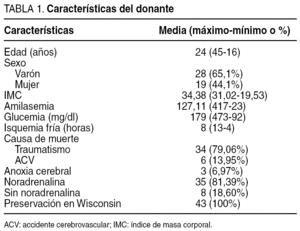
Entre febrero de 2000 y junio de 2004, se realizaron 43 trasplantes en 42 receptores. En el 80,9% (34 casos) eran varones y el 19,1% (8 casos) restante, mujeres. Las características del donante se reflejan en la tabla 1. La edad media de los pacientes fue de 38 años (rango, 20-54 años). En 37 (88,1%) pacientes se realizó trasplante simultáneo páncreas-riñón, en 4 (9,5%) trasplante después del renal y en 1 (2,4%) se hizo un retrasplante.
Las tasas de supervivencia actuarial del paciente y del injerto al año han sido en nuestro grupo del 91 y del 84%, respectivamente.
El injerto pancreático se perdió en el 16% (7 pacientes) de los casos, y en un 9% se debió a mortalidad postoperatoria. En el 11,6% el injerto se perdió por causas técnicas: 1 trombosis venosa, 1 caso de síndrome de isquemia-reperfusión, 1 trombosis de arteria esplénica a los 7 meses postrasplante, 2 sepsis abdominales por fístula duodenal; en otros 2 pacientes (4% del global) la pérdida se debió a causas médicas: 1 caso de edema pulmonar no cardiogénico y otro de síndrome hemolítico-urémico (tabla 2).
En nuestra serie, la reintervención ha sido necesaria en 13 (30,16%) casos. Las causas fueron: hemoperitoneo (la más frecuente), 4 (9,3%) casos; fístula duodenal lateral, también en 4 (9,3%) casos, cuya presentación fue siempre tardía y localizada en la cara lateral del duodeno donante, y en 3 pacientes se constató la presencia de rechazo del injerto; trombosis venosa del injerto, sólo en 1 (2,32%) caso, que obligó a la trasplantectomia inmediata. En 1 caso la reintervención se debió a necrosis pancreática masiva precoz (< 12 h), secundaria a síndrome de isquemia-reperfusión (en el examen del explante había permeabilidad tanto de las anastomosis arteriales como de la sistema venoso), en el único órgano importado (SIR), que también precisó la retirada del injerto y retrasplante con sistemática de código 0, es decir, de forma inmediata.
Por último, hubo 1 caso de dehiscencia parcial de la anastomosis arterial ilíaca, solventada mediante la interposición de una prótesis de Goretex. En 2 casos, la reintervención fue sin hallazgos.
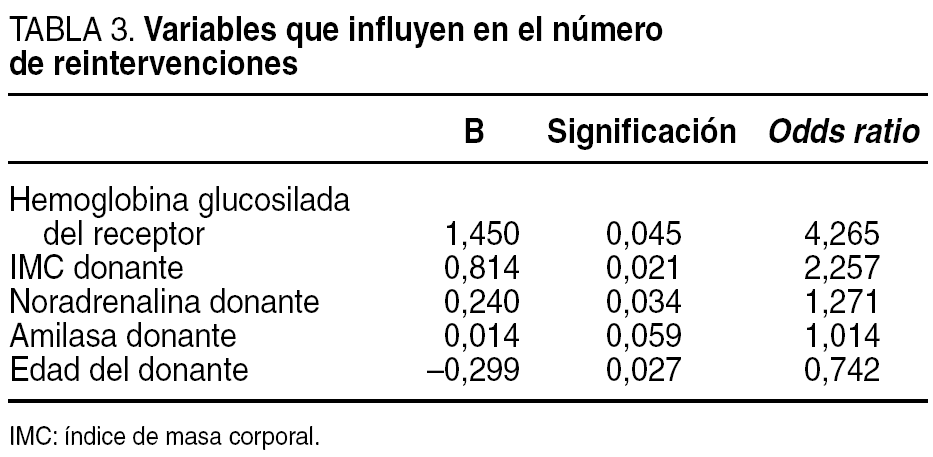
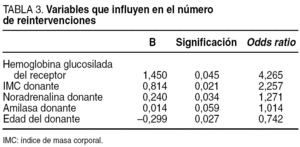
Controlando por la experiencia quirúrgica (dado que todas las intervenciones salvo el órgano importado se realizaron por el mismo equipo quirúrgico en todas sus fases) se construyó un modelo de análisis multivariante cuyos resultados se muestran en la tabla 3. Así, la hemoglobina glucosilada del receptor (p = 0,04), el índice de masa corporal del donante (p = 0,02), el tratamiento del donante con noradrenalina (p = 0,03) y la edad del donante (p = 0,02) son variables que aumentan el riesgo relativo a presentar una reintervención (R2 = 21%).
El 17,3% de los pacientes presentaron edema agudo de pulmón no cardiogénico (EAP) en el postoperatorio inmediato, es decir, con presión venosa y de enclavamiento pulmonar normales, y fue la causa de fallecimiento por muerte súbita en un caso; esto hizo variar nuestra política para ingresar en la unidad de cuidados intensivos (UCI) a los enfermos en el postoperatorio.
Tres pacientes presentaron un síndrome hemolítico urémico sistémico, confirmado por biopsia renal que demostró la presencia de trombosis glomerular y que se trató con éxito mediante la reconversión de tacrolimus a rapamicina y plasmaféresis (fallecimiento en el tercer caso; en la necropsia se demostró púrpura trombótica sistémica, tanto en los injertos como cardíaca, pulmonar y cerebral).
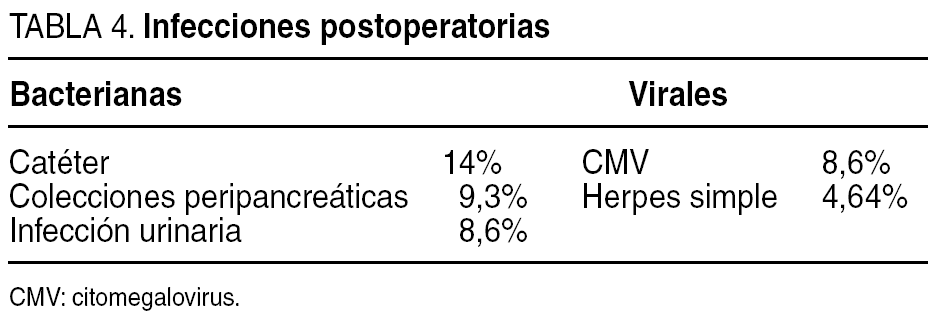
La causa de infección bacteriana más frecuente fue la producida por Staphylococcus aureus relacionada con catéter vascular (14% de los casos). La morbilidad infecciosa se desglosa en la tabla 4.
La infección por CMV fue la causa más frecuente de infección viral, y representó el 8,6% en nuestra serie, con una presentación fundamentalmente digestiva, constatada por PCR de biopsia tisular mediante endoscopia (tabla 5).
El 31% de los pacientes presentó retraso de función de injerto. Se analizó qué variables pudieron influir en la presencia de retraso de función de injerto, y se observó que sólo la glucemia del donante parece influir en la presencia del retraso de función de injerto (p = 0,08) (tabla 4).
El rechazo agudo presentó una incidencia del 37,12% (16 casos). Se realizó biopsia pancreática en el 7% (3 pacientes); en el 4,6% fue rechazo aislado pancreático. Todos los episodios de rechazo agudo se controlaron con choques de esteroides, excepto en un paciente que necesitó timoglobulina para su control.
Todos los enfermos trasplantados que conservan el injerto son en la actualidad independientes de la insulina, con normalización de hemoglobina glucosilada (mediana, 5,5%) y péptido C (2,82 ng/ml).
Discusión
Desde su inicio, el trasplante pancreático planteó numerosos problemas, por lo que siempre se ha cuestionado. Las reacciones inflamatorias después del implante (en forma de pancreatitis aguda) y el rechazo del segmento duodenal (extremadamente rico en tejido linfoide), conducían a la aparición frecuente de fístulas, responsables de múltiples complicaciones sépticas, con la consiguiente repercusión sobre el injerto y el paciente. Además, tampoco va a ayudar el propio sustrato del paciente trasplantado, muy debilitado por los años de diabetes y por la insuficiencia renal crónica, así como extremadamente susceptible a la inmunosupresión. Con el paso de los años, el mejor conocimiento de las peculiaridades de este tipo de trasplante ha permitido una notable disminución de las complicaciones con la consiguiente mejoría de los resultados.
Según los datos obtenidos del último Registro Internacional de Trasplante de Páncreas (IPTR), sobre un total de 19.685 trasplantes de páncreas a escala mundial, 14.332 corresponden a Estados Unidos y 6.353 no corresponden a Estados Unidos. La supervivencia al año del paciente y del injerto pancreático (Estados Unidos) es del 95 y del 83%, respectivamente, cifras que son similares a las conseguidas en nuestra serie, con una supervivencia del paciente del 91% y una supervivencia del injerto pancreático del 84%5.
El estudio del Diabetes Control and Complications Trial (DCCT) puso de manifiesto que un tratamiento intensivo con insulina disminuye significativamente el desarrollo y la progresión de las complicaciones diabéticas. El mayor inconveniente del tratamiento intensivo en el estudio DCCT fue el riesgo de episodios hipoglucémicos, 2-3 veces mayores a los observados con el tratamiento estándar1. Hasta el momento, el trasplante de páncreas vascularizado es el único tratamiento que puede conseguir la independencia de la insulina y, por tanto, conseguir controlar las complicaciones derivadas de las alteraciones metabólicas.
Nuestra tasa de reintervenciones se sitúa en el 30,16%, dato que puede parecer elevado si se compara con la tasa de reintervenciones aceptadas tras la cirugía general, del 2-5%6,7, pero que está dentro de lo publicado por las grandes series de trasplante pancreático. Así el grupo de Minneapolis publica un 32%8, el grupo de Nebraska un 36%9, el de Menphis un 26%10 y el de Pittsburg un 40%11. No obstante, en el último período, y al igual que en los grupos citados anteriormente, se ha ido reduciendo nuestra tasa de relaparotomías.
En nuestro estudio, diversas variables tanto del donante (índice de masa corporal [IMC], noradrenalina administrada, edad) como del receptor (hemoglobina glucosilada preoperatoria), contribuyen en la incidencia de reintervenciones. Sutherland et al12 demuestran que la edad del donante superior a 45 años es un factor de riesgo que conlleva al aumento de relaparotomías. Drachenberg et al13 publican que el elevado IMC del donante puede llevar a pancreatectomía por trombosis vascular temprana del injerto, así como la hiperamilasemia del donante puede conllevar a la pérdida del injerto por rechazo agudo grave. En nuestra serie se demostró que la amilasa del donante aumenta el riesgo relativo de reintervención. Por su parte, Reddy et al14 muestran como el IMC y la edad del donante, así como el tiempo de estancia en la UCI (inestabilidad hemodinámica) y, por tanto, el uso de fármacos vasoactivos (noradrenalina), son factores de riesgo que pueden conllevar relaparotomía y, por tanto, la pérdida del injerto, lo que coincide con lo que encontró nuestro grupo.
Los valores elevados de hemoglobina glucosilada traducen hiperglucemia, estado que es tóxico para las células beta y, además, conduce a una disminución de óxido sintetasa, enzima que interviene en la síntesis del óxido nítrico, un potente vasodilatador que regula el funcionamiento del endotelio vascular15. En nuestra serie, por cada 1,4% de elevación de la hemoglobina glucosilada preoperatoria el riesgo relativo de reintervención aumentó en un 4,21%. Por tanto, se puede concluir que una rigurosa selección del donante y la optimización de la terapia insulínica en el receptor previa al trasplante, disminuirán el número de reintervenciones postoperatorias.
La incidencia de trombosis venosa en nuestra serie es del 2,32% (1 caso), que obligó a realizar trasplantectomía. Nuestra incidencia de trombosis vascular es inferior a lo publicado por las grandes series; la incidencia es del 0,8% del grupo de Madison4, el grupo de Barcelona publica una tasa de trombosis venosas de 17,8%, aunque sólo requirió trasplantectomía por esta causa el 7,14%16, en el grupo de Memphis la incidencia es del 14,45%9 y en el Minneápolis, del 27%8. El control postoperatorio mediante ultrasonografía Doppler y la realización sistemática de arteriografía o angio-TC ante mínimos indicios de complicación vascular ha permitido el diagnóstico precoz y el desarrollo de diversas formas de recuperación orgánica como trombectomías percutáneas o quirúrgicas y perfusión de fibrinolíticos16, aunque en la mayoría de las ocasiones derivan irremediablemente hacia la pancreatectomía del injerto, motivo por el cual se realizó profilaxis antitrombótica, ya que una complicación hemorrágica es controlable, a diferencia de una complicación trombótica que conlleva casi siempre la pérdida del injerto. Wullstein et al17 han puesto de manifiesto cómo los factores procoagulantes que están presentes tanto por el tipo de paciente, y los asociados a la cirugía (reperfusión de injerto pancreático que acarrea la presencia de SIR y posible formación de microtrombos en la microcirculación del injerto) predisponen a la aparición de trombosis vascular, y la trombosis venosa es la principal causa de pérdida de injerto de causa no inmunógena18. Benz et al19 barajan, además, la alta resistencia vascular de un páncreas trasplantado al que se le ha privado de su salida natural (es decir el bazo), además del estado de hipercoagulabilidad tras la reperfusión del injerto. El grupo de Minneápolis muestra cómo el uso de anticoagulación profiláctica disminuye el riesgo de trombosis vascular, y muestra que la incidencia de esta complicación fue del 4% mediante anticoagulación profiláctica y del 10,8% sin anticoagulación12,20. La mejora en la selección del donante y del receptor, así como un mayor refinamiento de la técnica quirúrgica y el no utilizar la técnica de drenaje venoso portal, disminuyen el riesgo de trombosis vascular4,21,22. Otra causa que puede aumentar el riesgo de trombosis vascular es el uso de anticalcineurínicos (tacrolimus y/o ciclosporina), ya que ambos producen vasoconstricción y lesión del endotelio23.
Nuestra incidencia de hemoperitoneo se sitúa en el 9,3%, todos los pacientes fueron sometidos a relaparotomía, sin hallar punto claro de sangrado, excepto en un caso que presentó dehiscencia parcial de anastomosis arterial que precisó prótesis de goretex. Nuestra incidencia de hemoperitoneo es semejante a la publicada por las grandes series8 y se debió al uso de heparina profiláctica. Se ha demostrado que la utilización de heparina aumenta la incidencia de hemorragia intraperitoneal y, sin embargo, disminuye la tasa de trombosis vascular8,24.
En nuestra serie, el 2,32% fue reintervenido por pancreatitis necrótica precoz (< 24 h), sin hallar trombosis vascular mayor, motivo que llevó a la pancreatectomía y retrasplante inmediato, previo código 0. La indicación del retrasplante precoz se ha aceptado por diversos grupos de trabajo y se ha realizado en una ocasión por nuestro grupo, por lo que se propuso la adopción por parte de la Organización Nacional de Trasplantes (ONT) del código 0 en trasplante pancreático (esto se ha aceptado recientemente). Diversos autores muestran que la supervivencia del injerto tras el retrasplante es del 72% y que éste constituye el 3% de todos los trasplantes. El retrasplante es una opción para los pacientes trasplantados que perdieron el injerto pancreático (trombosis vascular, rechazo agudo severo...); el éxito del retrasplante es muy similar al primer trasplante14.
En nuestros enfermos hubo un 9,3% de fístulas duodenales y colecciones intraabdominales, las cuales nunca se aislaron. La incidencia de fístulas duodenales y colecciones intraabdominales varía en torno al 8 y al 18%13,20,25,26, lo que coincide con nuestra experiencia (9,3%). En todos nuestros casos la fístula fue en el muñón lateral del duodeno del donante y nunca de la anastomosis, lo que permitió el tratamiento percutáneo en 1 caso; por otra parte, el tiempo de presentación fue tardío (a partir de la segunda semana del trasplante) y al demostrar, mediante biopsia intraoperatoria del injerto, la presencia de rechazo agudo en 2 casos, hace pensar en la existencia de factores inmunológicos más que en defectos técnicos. Drachenberg et al13 estudian 74 pancreatectomías achacables en principio a trombosis vascular por defecto técnico, y encuentran que en el 33% de los casos ésta se debía a rechazo agudo. No se ha publicado en la bibliografía otro estudio similar. En nuestra serie no se ha observado ningún caso de infección intraabdominal que no estuviese asociado a una fístula duodenal, lo que nos hace pensar que la incidencia de fístula duodenal podría estar infravalorada en la bibliografía; el grupo de Memphis publica un 6%27, el de Minneápolis un 6,5%18, el de Wisconsin un 8%4, el de Estocolmo un 3%28 y el de Pittsburg un 20%25.
Hubo un 7% de síndrome hemolítico-urémico sistémico, que se trató con plasmaféresis y con sustitución del tacrolimus por rapamicina con éxito, excepto en 1 caso que falleció súbitamente durante la plasmaféresis (en la necropsia se objetivaron infartos microangiopáticos renales, pancreáticos, pulmonares y cerebrales). Este síndrome se presenta del 3 al 14% de los pacientes tratados con anticalcineurínicos29 y tiene una mortalidad del 10-20% en las primeras 48 h si no se diagnostica y no se trata, por esto la importancia de su diagnóstico precoz30. Desde 1993 hasta 2003, se han publicado 115 casos de síndrome hemolítico-urémico por anticalcineuríticos29-35.
En algunos trabajos el retraso de función de injerto se ha cifrado en torno al 69%36. La incidencia en nuestra serie fue del 31%. La diferencia podría explicarse por nuestra política de selección de donantes (jóvenes y de causa de muerte traumática), ya que la mayor edad del donante y la muerte de origen cardíaco o cerebrovascular favorecen esta entidad, la cual tiene impacto a corto y a largo plazos en la supervivencia del injerto.
Se estudió qué variables pudieran contribuir a la presencia de retraso de función de injerto, y se observó que ni el IMC del donante, ni la hemodinámica del donante, ni la administración de noradrenalina al donante justifican el retraso de función de injerto; diversos autores describen como la edad del donante (con edad superior a 45 años, la masa de células beta puede estar disminuida) puede conllevar a la aparición de retraso de función de injerto36, y que la hiperglucemia del donante puede tener efectos deletéreos en la función inicial y a largo plazo del injerto (glucemias > 150 mg/dl son tóxicas para la célula beta), aunque la hiperglucemia moderada del donante no sea contraindicación de trasplante pancreático37; en nuestro estudio la glucemia del donante alcanzó diferencias significativas en relación con el retraso de función de injerto.
La incidencia de rechazo agudo en el trasplante pancreático se cifra entre el 9 y el 27%38. En nuestra serie la incidencia de rechazo agudo fue del 37,2%, aunque la confirmación histológica sólo se obtuvo en el 11,62% (por biopsia pancreática y/o renal). El 4,6% se presentó como rechazo agudo aislado del injerto pancreático y el resto como rechazo agudo de ambos injertos; si bien, puede parecer algo elevado, atribuible a la reticencia del uso de la biopsia para el diagnóstico al inicio del programa. El diagnóstico de rechazo de injerto sigue siendo un problema en el postrasplante, ya que no existen parámetros clínicos ni analíticos que orienten al diagnóstico de rechazo, aunque el ascenso de la creatinina, la lipasa y la amilasa sérica ponen en alerta de la presencia de éste; con el apoyo de técnicas de imagen (Doppler y angio-TC), la biopsia es la técnica que lleva a la confirmación del rechazo agudo de injerto38,39. En nuestro hospital no se tiene acceso las 24 h a la gammagrafía; no obstante, aunque esta prueba tiene sensibilidad (y poca especificidad) para la detección de la perfusión, no ocurre lo mismo con el diagnóstico del rechazo, pues no excluye otras causas (pancreatitis, colecciones peripancreáticas) que puedan ser responsables de las alteraciones clínicas y analíticas que acompañan el rechazo, motivo por lo que no la realizamos en nuestro grupo.
Conclusiones
La experiencia quirúrgica a lo largo del tiempo hace disminuir el número de reintervenciones.
La optimización de la insulina pretrasplante, así como el IMC, la edad y la estabilidad hemodinámica del donante, disminuyen el número de reintervenciones.
Nuestros resultados son equiparables a los publicados por las grandes series.
Correspondencia: Dr. A. Navarro-Piñero.
Servicio de Cirugía General.
Hospital Regional Universitario Carlos Haya.
Avda. Carlos Haya, s/n. 29010 Málaga. España.
Correo electrónico: alfonso.navarro.sspa@juntadeandalucia.es
Manuscrito recibido el 1-4-2005 y aceptado el 19-9-2005.