El seudotumor inflamatorio (PTI) y el tumor miofibroblástico inflamatorio (TMI) son 2 entidades muy poco frecuentes que se incluían antiguamente en la misma categoría; sin embargo, en la actualidad se consideran 2 enfermedades diferentes debido al origen neoplásico del TMI. Nuestro objetivo es compartir nuestra experiencia en el manejo de estos 2 tipos de lesiones que debemos tener en cuenta en el diagnóstico diferencial de masas o nódulos pulmonares.
MétodosFueron estudiados retrospectivamente 13 pacientes con diagnóstico anatomopatológico de PTI o TMI, intervenidos entre los años 2008 y 2019. Registramos la información pre y postoperatoria de cada uno, así como el análisis de supervivencia.
ResultadosDe los 13 pacientes, 8 eran varones y 5 mujeres. La media de edad de presentación fue de 53,5 años. En 6 pacientes se practicó una segmentectomía atípica, en 6 fue necesario realizar una lobectomía y en un caso una neumonectomía. En todos los casos se consiguió una resección completa. El diagnóstico fue posible gracias a la histología, técnicas de inmunohistoquímica (IHQ) y de hibridación fluorescente in situ (FISH) determinando la expresión de IgG4 y el reordenamiento de ALK, respectivamente. Tras una mediana de seguimiento de 49 meses no se observaron datos de recidiva locorregional ni a distancia en los pacientes estudiados.
ConclusiónEl PTI y el TMI son tumores poco frecuentes con muy buen pronóstico. El diagnóstico de ambas entidades se basa principalmente en técnicas anatomopatológicas específicas. La cirugía tiene, en la mayor parte de las ocasiones, un papel tanto diagnóstico como terapéutico.
Inflammatory pseudotumor (IPT) and inflammatory myofibroblastic tumor (IMT) are two very rare entities that were formerly included in the same category; however, today they are considered two different diseases due to the neoplastic origin of the IMT. Our objective is to share our experience in the management of these two types of tumors that we must take into account in the differential diagnosis of pulmonary masses or nodules.
MethodsThirteen patients with a pathological diagnosis of IPT and IMT who underwent surgery between 2008 and 2019 were retrospectively studied. We recorded the pre and postoperative information of each one, as well as the survival analysis.
ResultsOf the 13 patients, 8 were men and 5 women. The mean age of presentation was 53,5 years. An atypical segmentectomy was performed in 6 patients; a lobectomy was necessary in 6 and a pneumonectomy in 1 case. In all cases a complete resection was achieved. Diagnosis was possible thanks to histology, immunohistochemical (IHQ) and fluorescent in situ hybridization (FISH) techniques determining the expression of IgG4 and the rearrangement of ALK, respectively. After a median follow up of 49 months, we didńt find any loco-regional or distant recurrence in the patients studied.
ConclusionIPT and IMT are rare tumors with a very good prognostic. The diagnosis of both entities is based mainly on specific anatomopathological techniques. Surgery has, in most cases, both a diagnostic and therapeutic role.
El término seudotumor inflamatorio (PTI) fue descrito por primera vez en el año 19391 para identificar un grupo heterogéneo de enfermedades fibroinflamatorias tanto reactivas como de origen neoplásico. Desde entonces ha recibido muchas denominaciones (granuloma de células plasmáticas, tumor fibromixoide seudosarcomatoso, proliferación miofibrohistiocítica inflamatoria, etc.)2,3 lo que refleja su variada composición celular. Existen diferentes hipótesis acerca del origen de esta lesión. Una de ellas, es la apoyada por Melloni et al.4, que lo describe como una reacción inflamatoria desproporcionada a un proceso infeccioso subyacente. Así, se ha sugerido su posible asociación con el virus Epstein-Barr5,6 y el virus herpes tipo 87.
El tumor miofibroblástico inflamatorio (TMI), se caracteriza por una proliferación de miofibroblastos íntimamente relacionada con un infiltrado inflamatorio de células plasmáticas, linfocitos y eosinófilos8. Puede presentarse en cualquier región anatómica, pero muestra predilección por los pulmones, tejido blando y cavidad abdominopélvica de niños y adultos jóvenes9,10. Tradicionalmente se ha clasificado en el pasado como una lesión benigna, si bien actualmente es considerado una neoplasia de potencial biológico intermedio por su capacidad de recidivar y de producir metástasis3.
Antiguamente, tanto el PTI y el TMI se incluían en la misma categoría debido a características morfológicas similares desde el punto de vista anatomopatológico, como la proliferación fibroblástica-miofibroblástica y la presencia de células inflamatorias. De hecho, es frecuente que en algunos trabajos publicados recientemente se confundan ambas entidades11,12. Sin embargo, en la actualidad se consideran 2 tumores diferentes debido al origen neoplásico que presenta el TMI3. Dada la escasa cantidad de casos publicados en la literatura hasta el momento, presentamos nuestra experiencia de los últimos 11 años, con una serie quirúrgica de los pacientes intervenidos en nuestro servicio con el diagnóstico de PTI y TMI, analizando diagnóstico, tratamiento y supervivencia.
MétodosEntre los años 2008 y 2019 hemos intervenido quirúrgicamente un total de 13 pacientes con el diagnóstico final de PTI o TMI. En todos los pacientes se llevó a cabo una exploración fibrobroncoscópica preoperatoria. En los casos de localización periférica se realizó una punción aspiración con aguja fina (PAAF) transtorácica con intención diagnóstica. En los 13 casos, el diagnóstico definitivo de PTI o TMI se realizó mediante estudio anatomopatológico de la pieza de resección. Para la realización del estudio, los datos fueron recogidos de forma retrospectiva en una base informatizada convenientemente codificada y anonimizada, de acuerdo con la legislación española vigente sobre protección de datos personales y bajo la conformidad del comité de ética del hospital.
Se han estudiado las siguientes variables: edad, sexo, comorbilidad (consumo de tabaco y antecedentes oncológicos), manifestaciones clínicas, localización de la lesión y morfología en la tomografía computarizada (TC), tamaño de la lesión en milímetros, valor estandarizado de captación (SUV) en la tomografía por emisión de positrones (PET) en la tomografía por emisión de positrones (PET), realización de PAAF o FB, abordaje quirúrgico (cirugía videoasistida o toracotomía/esternotomía), tipo de resección quirúrgica (lobectomía, resección atípica o neumonectomía), estancia postoperatoria, complicaciones posquirúrgicas, análisis inmunohistoquímico (vimentina, desmina, citoqueratinas, actina de músculo liso, EMA, IgG4 y ALK), técnicas de biología molecular (FISH) y supervivencia.
El análisis estadístico fue realizado mediante la herramienta informática SPSS® v.24.0 para Windows. Los resultados globales se han expresado como frecuencias absolutas y relativas para las variables cualitativas. Para las variables cuantitativas, hemos utilizado la media, la mediana y el rango. Se consideró que se alcanzaba la significación estadística cuando resultaba el valor de p<0,05.
ResultadosDe los 13 pacientes incluidos, 9 casos fueron diagnosticados anatomopatológicamente como PTI y 4 como TMI. De ellos, 8 eran varones (61,53%) y 5 mujeres (38,46%), predominando el sexo masculino en el PTI (6/3). La media de la edad de presentación en la serie fue de 53,5 años, con una mediana de 48 años (rango: de 11 a 82 años), siendo de 60,1 años en el grupo PTI y de 47,8 años en el grupo TMI (p=0,243). En el estudio de comorbilidades destacó que 6 pacientes (46,15%) eran fumadores al momento del diagnóstico y 2 pacientes tenían antecedentes oncológicos (tumor germinal y gastrinoma pancreático).
En cuanto a la presentación clínica, solo 2 pacientes estaban sintomáticos en el momento del diagnóstico, un caso de TMI con disnea y un caso de PTI con hemoptisis, mientras que en el resto de los casos fue un hallazgo casual. No se detectaron alteraciones analíticas significativas en ninguno de los pacientes estudiados. Al analizar las características radiológicas de estos tumores en la TC, pudimos comprobar que las lesiones eran predominantemente sólidas y de bordes lisos (12 de los 13 casos) y solo uno de los casos presentaba cavitación; la mediana del tamaño tumoral medido radiológicamente fue de 22mm (rango: de 8 a 135mm). Ningún paciente presentaba datos de infiltración tumoral de estructuras vecinas por técnicas de imagen. La PET demostró captación patológica en todos los pacientes estudiados, con una media del valor estandarizado de captación máximo (SUVmáx) de 4,3g/ml para el PTI y 2,6 para el TMI (p=0,198). Las lesiones se localizaron principalmente en los lóbulos inferiores (4 en el izquierdo y 3 en el derecho), con predominio del PTI (71,42%). Aunque se tomaron muestras endoscópicas en 12 de los 13 pacientes a los que se realizó una FBC (92,30%), la muestra fue insuficiente para llegar al diagnóstico en todos los casos. Se realizó una PAAF en los pacientes con lesiones de localización periférica, aunque esta no fue diagnóstica en ninguno de los casos.
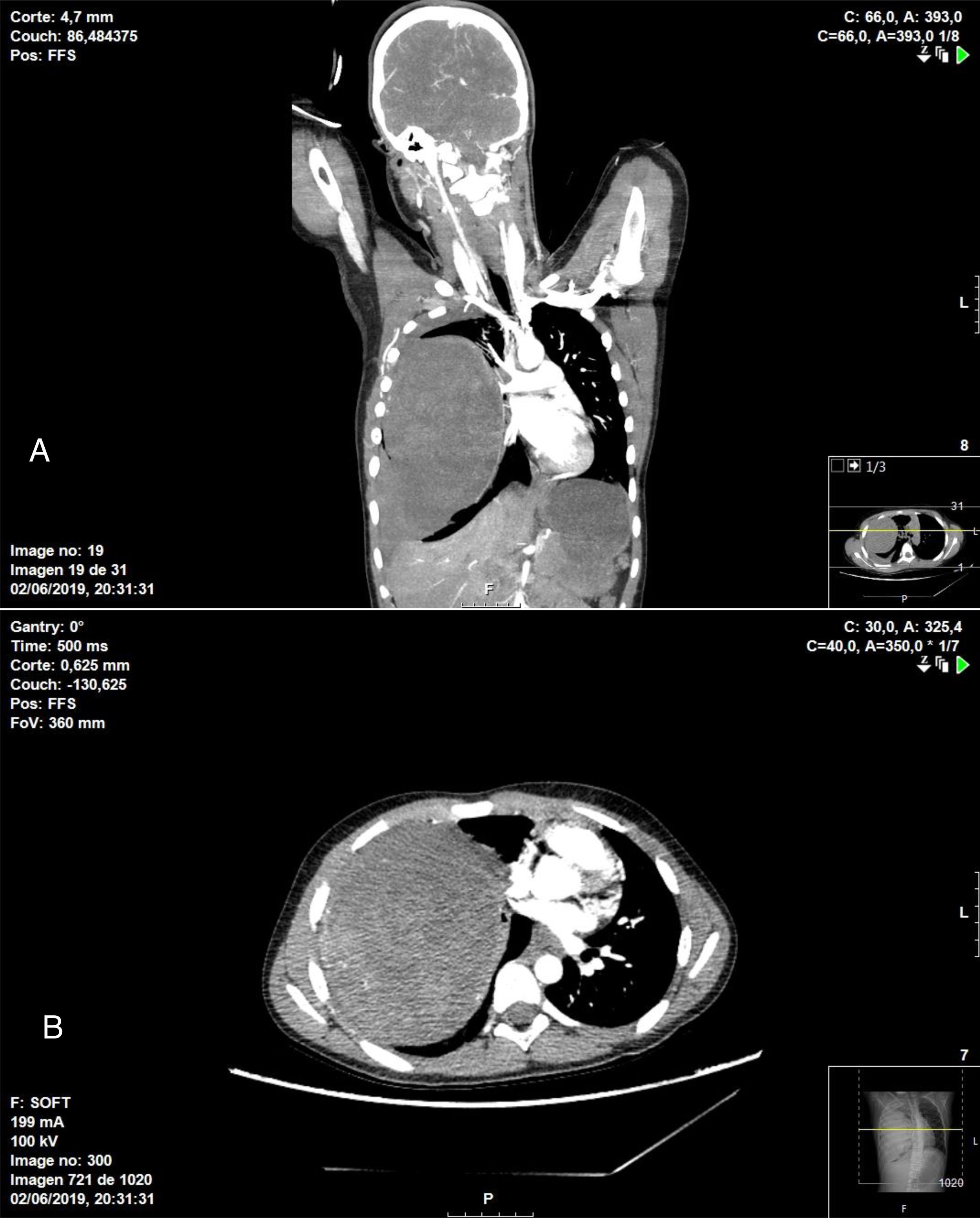
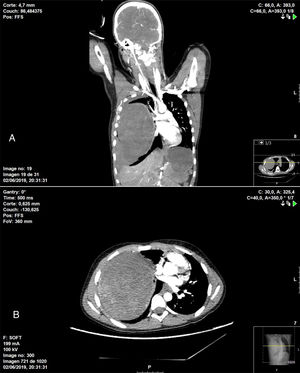
En cuanto a la técnica quirúrgica realizada, en 6 pacientes se practicó una resección en cuña (4 PTI y 2 TMI) tras confirmación anatomopatológica intraoperatoria de la tumoración, que fue informada como enfermedad benigna. En 6 pacientes fue necesaria una lobectomía por la localización de la lesión (4 PTI y 2 TMI) y en un paciente se realizó una neumonectomía derecha (un caso de PTI) a través de una esternotomía media. Este caso fue un paciente de 11 años de edad que se operó en colaboración con el servicio de cirugía pediátrica de forma urgente, debido a su presentación clínica (hemoptisis y shock hemorrágico), evidenciándose en la TC de tórax una tumoración de gran tamaño que ocupaba la totalidad del hemitórax derecho con datos de sangrado intratumoral, hemotórax y desplazamiento mediastínico (fig. 1).
TC de tórax en la que se visualiza masa intrapulmonar heterogénea asociada a hemotórax de moderada cuantía que ocupan prácticamente la totalidad del hemitórax derecho y que condicionan importante efecto de masa con colapso completo de vasos pulmonares ipsilaterales, además de desplazamiento de estructuras mediastínicas. A) Corte coronal. B) Corte axial.
En todos los casos se realizó una resección completa del tumor. La vía de abordaje más empleada fue la cirugía videoasistida (61,53%). La media de la estancia hospitalaria postoperatoria fue de 3,2 días (rango: entre 3 y 6 días), sin existir complicaciones postoperatorias durante este período.
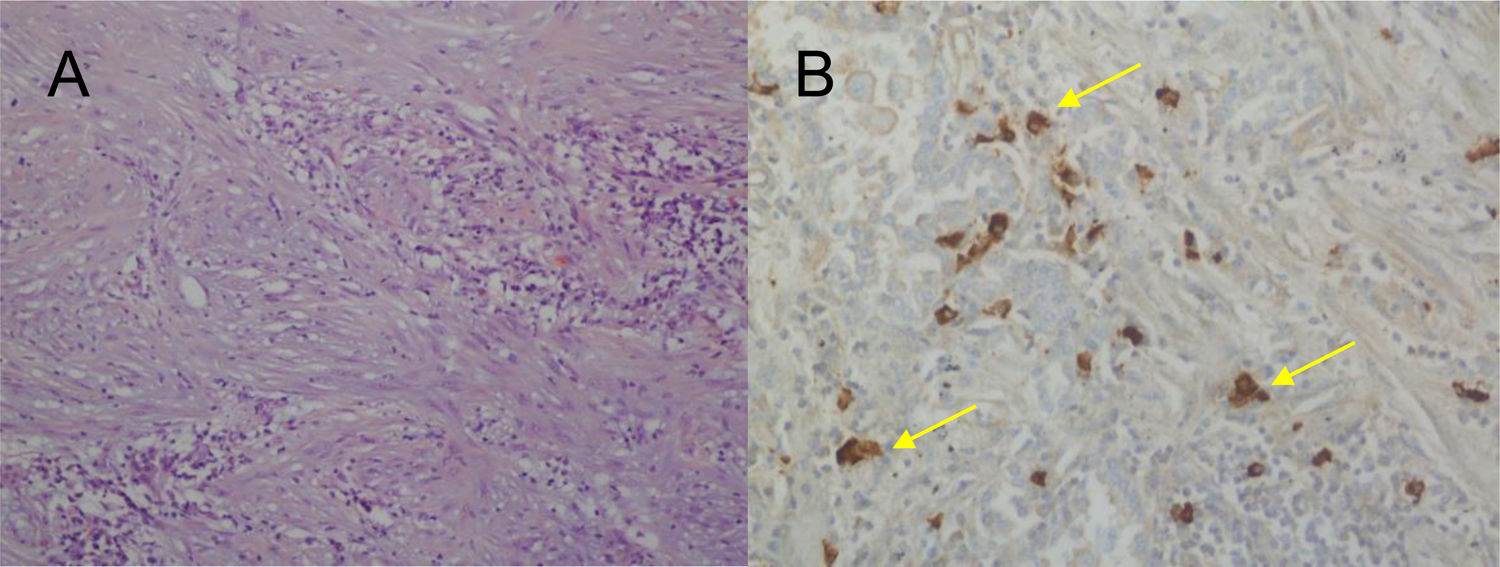
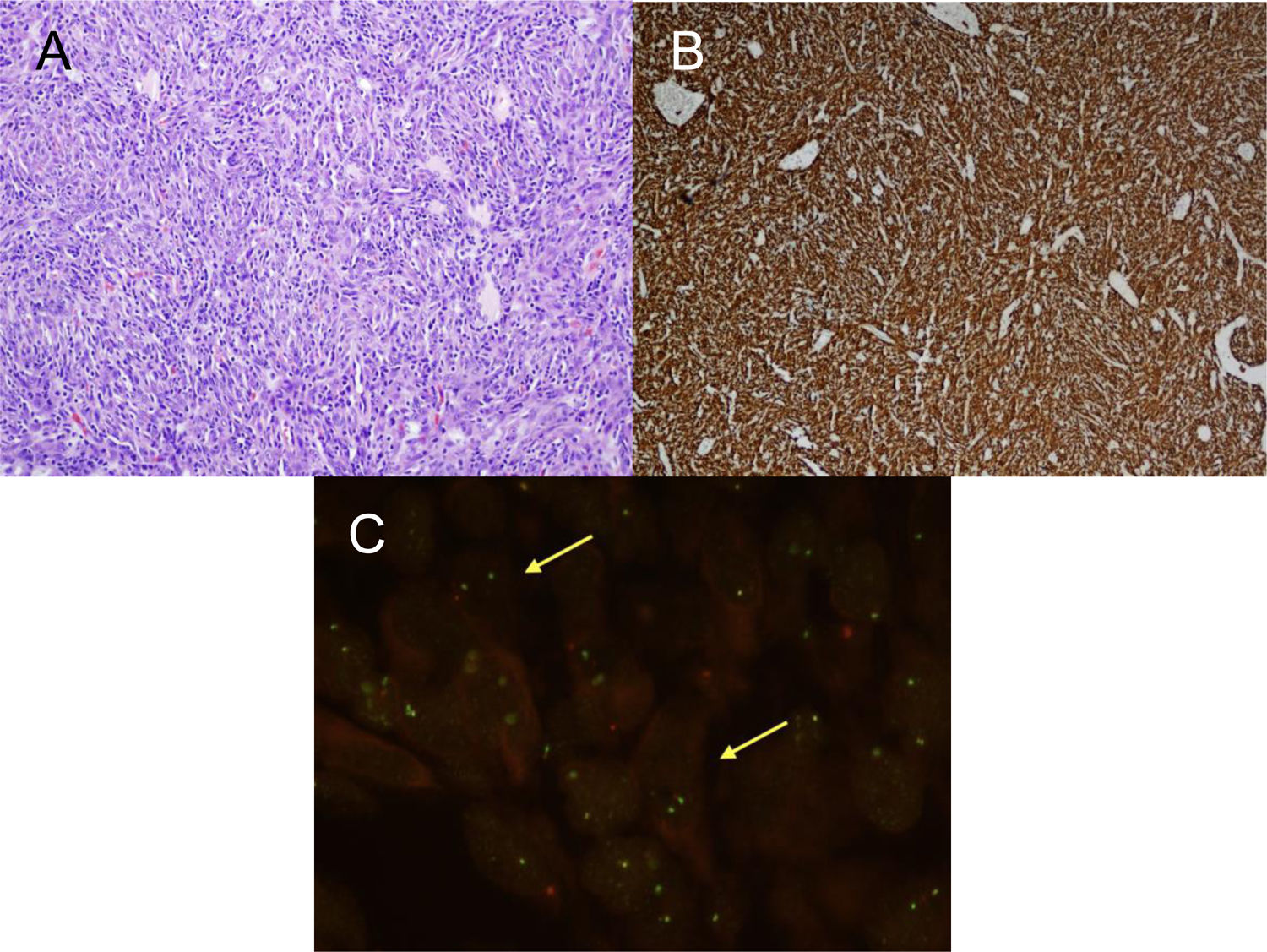
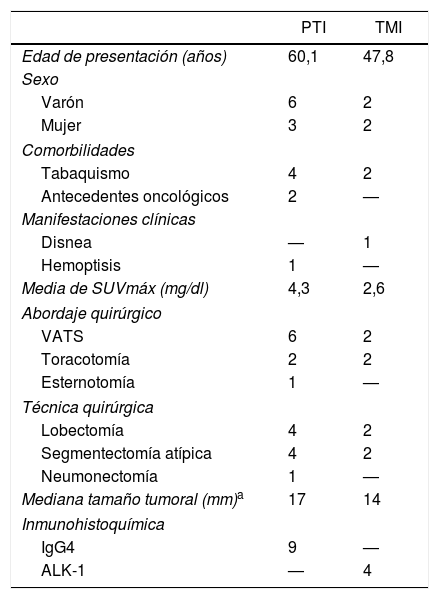
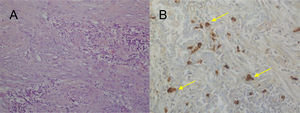
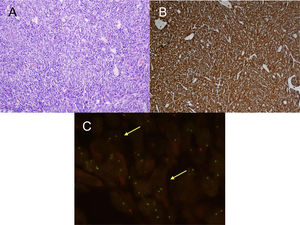
En el estudio anatomopatológico de las piezas de resección se usaron secciones de tejido fijadas en formol e incluidas en parafina. Se realizaron tinciones de hematoxilina-eosina y técnicas de inmunohistoquímica (IHQ) para vimentina, desmina, citoqueratinas, actina de músculo liso, antígenos de membrana epitelial, IgG4/IgG y ALK (fig. 2A y B y fig. 3A y B). También se analizó la translocación para el gen ALK mediante la técnica de FISH (fig. 3C). El diagnóstico definitivo de PTI o TMI se basó en criterios histopatológicos, inmunohistoquímicos y citogenéticos. Cuatro casos fueron clasificados como TMI y 9 como PTI. La mediana del tamaño tumoral medido en la pieza de resección fue de 14mm (rango: de 9 a 85mm). Los 4 pacientes diagnosticados como TMI presentaron positividad para ALK, mientras que los 9 diagnosticados como PTI mostraron expresión para IgG4 en células plasmáticas asociadas (relación IgG4/IgG), siendo este uno de los criterios diagnósticos seguidos. Las principales diferencias entre PTI y TMI de nuestra serie vienen relacionadas en la tabla 1.
A) H&E: Proliferación celular fibrohistiocitaria, que se dispone en fascículos cortos o estoriformes con un prominente infiltrado inflamatorio acompañante. No se observa necrosis ni permeación vascular. B) IHQ: Tinción de inmunohistoquímica positiva para ALK. C) FISH: Translocación para el gen ALK (flechas amarillas).
Características de la serie
| PTI | TMI | |
|---|---|---|
| Edad de presentación (años) | 60,1 | 47,8 |
| Sexo | ||
| Varón | 6 | 2 |
| Mujer | 3 | 2 |
| Comorbilidades | ||
| Tabaquismo | 4 | 2 |
| Antecedentes oncológicos | 2 | — |
| Manifestaciones clínicas | ||
| Disnea | — | 1 |
| Hemoptisis | 1 | — |
| Media de SUVmáx (mg/dl) | 4,3 | 2,6 |
| Abordaje quirúrgico | ||
| VATS | 6 | 2 |
| Toracotomía | 2 | 2 |
| Esternotomía | 1 | — |
| Técnica quirúrgica | ||
| Lobectomía | 4 | 2 |
| Segmentectomía atípica | 4 | 2 |
| Neumonectomía | 1 | — |
| Mediana tamaño tumoral (mm)a | 17 | 14 |
| Inmunohistoquímica | ||
| IgG4 | 9 | — |
| ALK-1 | — | 4 |
PTI: pseudotumor inflamatorio; TMI: tumor miofibroblástico inflamatorio; VATS: Video-Assisted Thoracoscopic Surgery.
Tras una mediana de seguimiento de 49 meses no se observaron datos de recidiva locorregional ni a distancia en los pacientes estudiados en ambas entidades. Solo un paciente con el diagnóstico de PTI falleció durante el seguimiento por causa independiente a este.
DiscusiónEl PTI afecta generalmente a adultos mayores o ancianos con una edad media de 60 a 65 años, mostrando un predominio en los varones (60-80%)13, al igual que ocurre en nuestros pacientes. En cuanto al TMI, algunos estudios han puesto de manifiesto que afecta con mayor frecuencia a los niños y los adultos jóvenes14,15. Sin embargo, nuestra serie mostró una media de edad sensiblemente superior (53,5 años). Esto se explica porque nuestro servicio no atiende población pediátrica con la única excepción del caso arriba mencionado que motivó nuestra colaboración urgente. Por otra parte, atendemos un perfil amplio de población rural con una edad media superior a la habitual, lo que unido a lo indolente de la clínica podrían justificar que nuestra media de edad sea mayor a la publicada en la literatura. De todos modos, lo escaso de la muestra no permite extraer conclusiones en este sentido.
La presentación clínica de ambos tumores depende de la localización de la lesión, y suele ser inespecífica (tos, disnea, fiebre y dolor torácico). En cuanto al PTI, Zen et al.16 encontraron que en el 53% de los casos con afectación pulmonar o pleural no presentaban síntomas al momento del diagnóstico y se diagnosticaban de forma incidental. En nuestra serie, más del 80% de los pacientes con PTI fueron asintomáticos. Hasta un 15-30% de TMI puede presentarse como síndrome constitucional con trombocitosis, hiperglobulinemia policlonal, elevación de la velocidad de eritrosedimentación y retraso del crecimiento en niños9. De los 4 pacientes diagnosticados de TMI en nuestra serie, solo uno presentó sintomatología (hemoptisis), siendo la analítica sanguínea preoperatoria rigurosamente normal.
El diagnóstico de confirmación de estos tumores se lleva a cabo mediante su caracterización histopatológica. En nuestra serie, en todos los casos tanto de PTI como de TMI se llegó al diagnóstico a través del estudio anatomopatológico de la pieza de resección tras la cirugía. Se ha sugerido como punto de corte para el diagnóstico histopatológico de PTI la presencia de más de 50 células plasmáticas positivas para IgG4 por campo de gran aumento, un índice IgG4/IgG>0,48,17 y niveles séricos de IgG4 mayores o iguales de 135mg/dl18, aunque este último se puede encontrar alterado en otras enfermedades y hasta en 5% de la población sana.
Aunque podría ser interesante la determinación preoperatoria de IgG4 en el despistaje de esta enfermedad, lo inespecífico de su sintomatología y pruebas de imagen hacen que no parezca un método diagnóstico rentable, salvo en casos con un elevado índice de sospecha. Por otra parte, entre el 50 y el 70% de los TMI presentan una translocación en el gen ALK en el brazo corto del cromosoma 2 (2p23) que resulta en la expresión aberrante de la proteína ALK en los miofibroblastos, la cual puede ser detectada mediante inmunohistoquímica o hibridación fluorescente in situ (FISH)19–21. La positividad de ALK debe servir como un criterio de exclusión de PTI. Sin embargo, la negatividad para ALK no descarta un TMI ya que, como se mencionó anteriormente, en menos de la mitad de los TMI ALK puede ser negativa en las IHQ o FISH.
Diferentes estudios han demostrado la presencia de células plasmáticas positivas para IgG4 en los acúmulos linfoides del PTI, indicando que este tipo de células podría estar relacionado en su patogénesis3,22,23. Asimismo, se ha descrito un reordenamiento cromosómico presente en más de la mitad de los TMI8,9,24. Estos hallazgos apoyan que el TMI y el PTI deben ser considerados 2 enfermedades por separado, con diferente patogenia, características histológicas y moleculares.
Se desconoce el curso natural de ambas enfermedades ya que no existen series largas publicadas respecto a la enfermedad ni su tratamiento. En el caso del PTI, el objetivo del tratamiento es la prevención de fibrosis y el daño irreversible del órgano. La terapia inicial con corticoides ha mostrado ser efectiva tanto para la enfermedad pulmonar como extrapulmonar25,26, al igual que el tratamiento con inmunosupresores27, incluyendo el rituximab para los casos resistentes a corticoides y otros inmunosupresores28,29. En nuestros casos no se aplicó ninguna terapia con corticoides previa a la cirugía dado que no se dispuso del diagnóstico preoperatorio en ningún paciente. Aunque se han publicado casos de resolución espontánea30, muchos autores recomiendan la cirugía si el paciente no presenta contraindicaciones tanto para el diagnóstico como para el tratamiento, mostrando supervivencias en pacientes con resecciones completas del 96% a los 5 años y del 90% a los 10 años24,31. Nuestros casos han presentado una mortalidad nula sin recidiva, habiendo sido todos ellos resecados de forma completa.
En cuanto al TMI, tradicionalmente se ha clasificado en el pasado como una lesión benigna, si bien actualmente es considerado una neoplasia de potencial biológico intermedio por su capacidad de recidivar y de producir metástasis3,32,33. En nuestra serie, sin embargo, tuvo un comportamiento biológico más favorable, aunque el escaso número de casos obliga a ser cautos en este análisis. De cualquier modo, la cirugía es el tratamiento de primera elección en el TMI10,34, con un índice de recidiva menor del 2% después de la resección completa; aunque sin mostrar diferencias en los casos en los cuales la resección fue incompleta9 y un período libre de recidiva del 80% a los 10 años35. La cirugía es también el tratamiento de elección en las recidivas, siempre y cuando no se presente ninguna contraindicación36.
En conclusión, el PTI y el TMI son lesiones poco frecuentes con diferente patogenia y características clínicas e histológicas. Pueden plantear problemas a la hora de realizar un diagnóstico diferencial con otras neoplasias pulmonares dado que el diagnóstico se basa en técnicas anatomopatológicas específicas. La cirugía tiene un papel tanto diagnóstico como terapéutico, consiguiendo buenas tasas de supervivencia y período libre de recidiva tras resección completa.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.