Introducción
Las fístulas aortoentéricas secundarias (FAEs) a cirugía aórtica se producen por decúbito de un asa sobre la prótesis en su cuerpo o sus ramas (fístula paraprotésica) o sobre la línea de sutura aórtica. En este último caso la comunicación directa de la luz aórtica con la luz intestinal constituye la verdadera FAEs. Es una complicación poco frecuente y su curso natural es la defunción por hemorragia y/o sepsis, a menos que un rápido diagnóstico y un tratamiento quirúrgico adecuado eviten el fatal desenlace.
Ante un episodio de hemorragia digestiva, puede ser difícil realizar un diagnóstico de existencia o exclusión de FAEs. En la literatura, ninguna prueba ha demostrado absoluta eficacia para establecer el diagnóstico de esta complicación1.
Los resultados del tratamiento quirúrgico de las FAEs diagnosticadas y tratadas apropiadamente son pobres, con alta morbimortalidad (25-90%)2. La retirada de la prótesis y el bypass extraanatómico se ha descrito como el tratamiento estándar2,3, aunque debido a las altas tasas de mortalidad asociadas, otros realizan la sustitución in situ de la prótesis como alternativa menos agresiva y solución más duradera en casos seleccionados4,5.
El objetivo del presente trabajo es realizar una revisión sistemática de la literatura disponible sobre el diagnóstico y el tratamiento de las FAEs. Se analizan los métodos diagnósticos, modalidades y resultados del tratamiento quirúrgico.
Pacientes y métodos
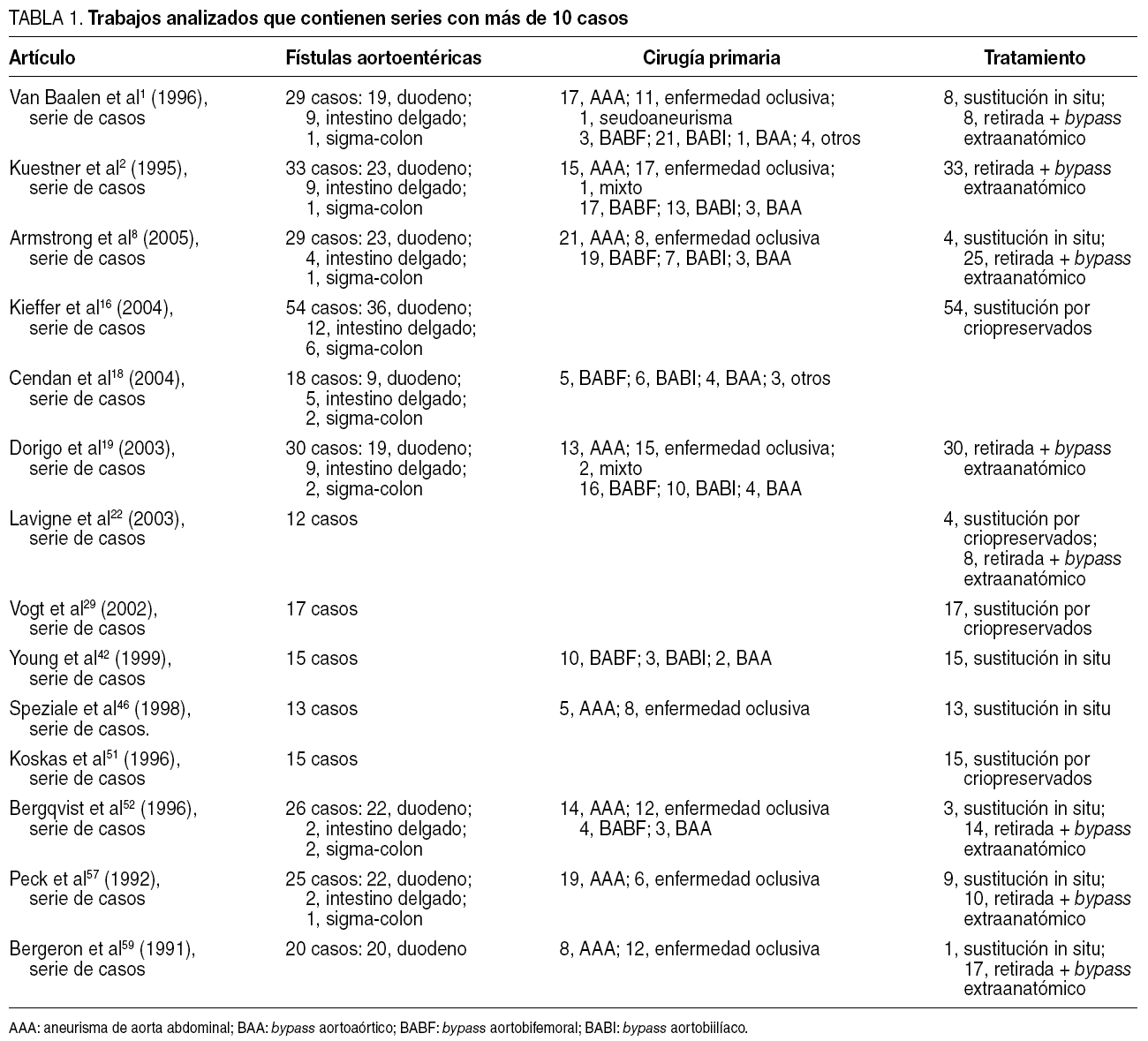
Dos revisores independientes realizaron una búsqueda sistemática de la literatura en MEDLINE, usando las palabras clave "aortoenteric", "aortoduodenal", "aorto-enteric", "aorto-duodenal", "secondary" y "fistula", en combinación con los operadores AND y OR. Se realiza una selección de los artículos publicados, en lengua inglesa y castellana, entre enero de 1991 y agosto de 2006. Dada la naturaleza de la patología estudiada, todos los artículos publicados en la literatura fueron casos clínicos o series de casos. Se seleccionaron los artículos referidos a fístulas aortoentéricas secundarias en los que se describían las variables para analizar. En la tabla 1 se presenta únicamente los trabajos analizados con series de más de 10 casos.
Se realiza un análisis descriptivo de los datos descritos en los artículos publicados en cuanto a edad, enfermedad que ocasionó la cirugía primaria, tiempo medio de presentación de los síntomas desde la cirugía primaria, cirugía primaria realizada, localización de la FAEs, síntomas de presentación, pruebas diagnósticas y tratamiento realizado, aunque no en todos los artículos revisados se describía todos los datos requeridos.
Resultados
Se seleccionaron 58 artículos1,2,6-61, de los 124 encontrados, los cuales incluían a 464 pacientes con diagnóstico de fístula aortoentérica, y de éstos se excluyó a 12 por tratarse de fístulas aortoentéricas primarias (varónes: mujeres, 4,6:1 )1,2,6-45,47-50,52,54-61. Se valoró a los pacientes para los factores considerados, ya que no en todos los artículos aparecía descrito el dato evaluado. La media de edad de los pacientes en el momento de la cirugía primaria fue 62,45 años (55-83 años)1,2,6-15,17-21,23-45,47-51,54-60. Las indicaciones para la cirugía primera aórtica fue: aneurisma de aorta abdominal en el 54,51% (n = 151), en el 14,44% (n = 40) de éstos, sintomática; en el 42,96% (n = 119) por afección arterial oclusiva, y en el 2,52% (n = 7) la indicación primaria fue otra causa (seudoaneurisma, mixta, etc.)1,2,6-12,14,19-21,23-28,30-35,37-41,43-50,52,55,57,59. No en todos los artículos seleccionados se describía el tipo de enfermedad por la que se indicó la cirugía primaria. El tiempo de aparición de la FAEs desde la cirugía primaria fue 74,41 ± 45,95 (2-192) meses1,2,6-13,15-17,19-21,23-35,37-50,52,54-60. La opción quirúrgica realizada fue bypass aortobifemoral en el 50,2% (n = 121) de los casos, bypass aortobiilíaco en el 29,87% (n = 72), bypass aortoaórtico en el 13,27% (n = 32), tratamiento intravascular en el 2,9% (n = 7) y en un 3,73% (n = 9) se realizó otro tipo de cirugías1,2,6,8-10,12,13,15,17-21,23,24,26-28,30-32,35-39,41-45,47-50,52-55,58. Existen pocos datos acerca de la metodología quirúrgica utilizada en la reconstrucción aórtica: tipo de anastomosis (terminoterminal o lateroterminal), cobertura de la prótesis (epiploplastia, cierre del saco aneurismático, etc.), complicaciones intraoperatorias, etc. La localización de la fístula entérica fue: duodeno, 75,65% (n = 261); intestino delgado, 17,68% (n = 61); sigma-colon, 5,5% (n = 19), y en un 1,15% (n = 4) de los casos, otras localizaciones menos frecuentes1,2,6-16,18-21,23-28,30,31,33-36,38-41,43,45,47-50,52,54-59.
El síntoma más frecuente en estos pacientes fue la hemorragia digestiva (n = 280; 77,99%); el 29,64% de éstos se encontraba en shock hipovolémico por el sangrado en el momento del diagnóstico. El 31,78% de los pacientes que se presentaron con hemorragia digestiva tenía antecedentes de sangrados previos. La infección protésica fue el cuadro de presentación en el 48,74% (n = 175) de los casos. Otros síntomas menos frecuentes fueron la anemia crónica en el 14,48% (n = 52) y la trombosis del bypass en el 5,01% (n = 18),2,6-15,17-28,30-32,34-43,45-49,52,54-61.
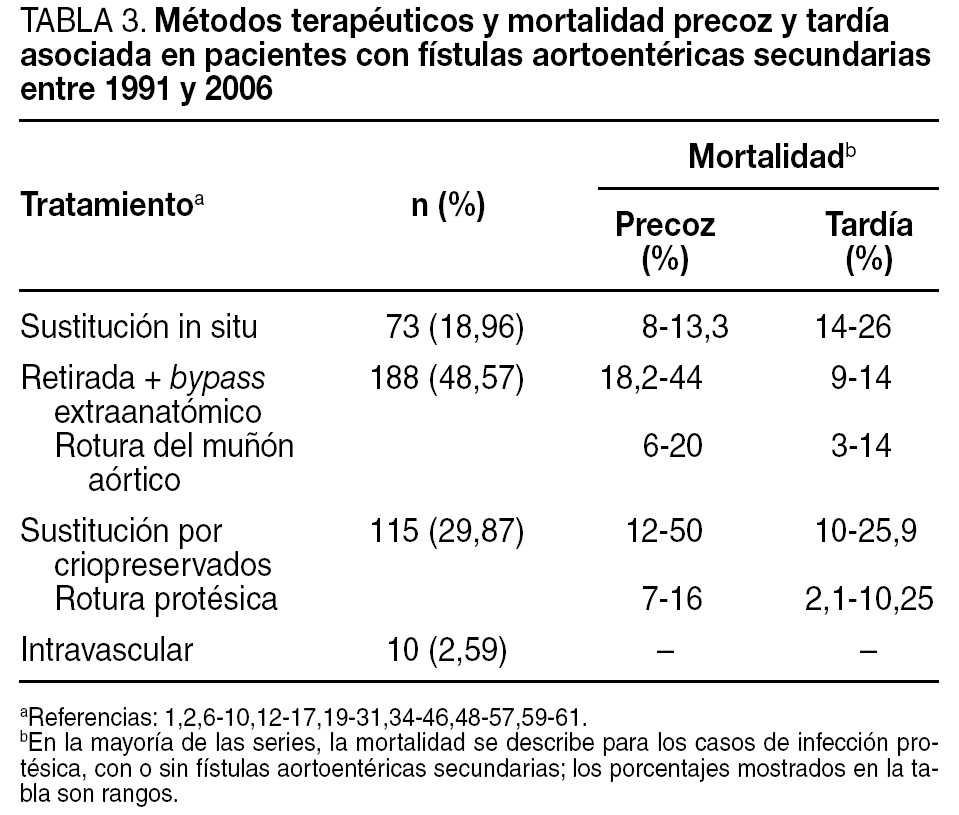
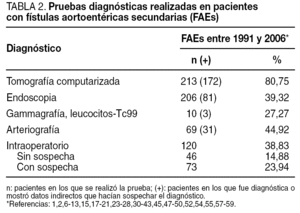
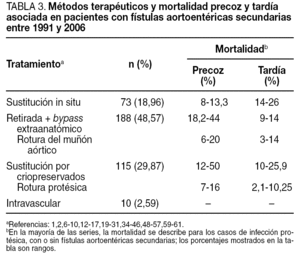
En más de un tercio de los casos (38,83%), el diagnóstico se confirmó intraoperatoriamente o fue un hallazgo quirúrgico en el seno de una infección protésica. Los métodos diagnósticos más eficaces fueron la tomografía computarizada (TC), seguida de la endoscopia y la arteriografía (tabla 2). Los métodos de tratamiento utilizados, así como la mortalidad precoz y tardía asociada a ellos, se describen en la tabla 3. Igualmente, en esta tabla se describe la mortalidad precoz y tardía asociada a la rotura del muñón aórtico tras retirada de la prótesis y revascularización extraanatómica, y la mortalidad asociada a la rotura de la prótesis en el caso de sustitución por criopreservados.
Discusión
Las FAEs a cirugía aórtica son una complicación rara y potencialmente letal. Su incidencia oscila en el 0,35-1,6%2. En la literatura médica, hay datos que indican que esta complicación podría estar relacionada con la indicación y el curso de la cirugía primaria. En las primeras series publicadas, se ha descrito que esta complicación tenía una mayor incidencia cuando la cirugía primaria era por un aneurisma de aorta abdominal sintomático (0,66-1,7%), comparado con cirugía electiva por afecciones oclusivas (0,2-0,5%) o aneurismáticas (0,17%)1,62. En nuestra revisión, se observa que en más de la mitad de los casos (54,31%) la cirugía primaria fue por afección aneurismática, y hasta casi 1/3 de ellos estaba sintomático.
En la literatura hay datos que indican que muchas fístulas podrían ser prevenibles y, aunque el mecanismo exacto de la patogenia de las FAEs es desconocido por el momento, los factores mecánicos e infecciosos parecen ser las causas más frecuentes de esta complicación posquirúrgica. El estrés mecánico pulsátil produciría la erosión intestinal y conduciría a la contaminación de la prótesis. Es complicado dilucidar en muchos casos si el factor mecánico ha sido el desencadenante de la fístula o si ésta se debe a una infección protésica. Por un lado, las infecciones protésicas precoces, por dehiscencia de la sutura aórtica, producen seudoaneurismas anastomóticos que causarían una erosión intestinal, lo que conllevaría la formación de una FAEs. Sin embargo, en las fístulas y erosiones entéricas tardías, años después de la cirugía primaria, es frecuente encontrar la prótesis bien incorporada y sin signos de infección, excepto en el punto de comunicación con el intestino, lo que hace más probable que sea el factor mecánico lo que desencadena estas fístulas. Existen diversos factores técnicos que podrían influir en el origen de la FAEs. El factor que más predispone la formación de una FAEs es el fallo al separar la prótesis y la anastomosis del intestino adyacente. Así, es importante prevenir la elongación protésica y asegurar la cobertura de toda la prótesis con tejido retroperitoneal o con epiplón para evitar el contacto directo de la prótesis y el intestino. Las reintervenciones quirúrgicas de la aorta infrarrenal, la disección excesiva de la flexura duodenoyeyunal y de su pedículo mesentérico, la lesión entérica identificada y reparada o a veces inadvertida son factores que aumentan el riesgo de infección protésica y de FAEs. Un factor discutido en la literatura científica como posible predisponente a la aparición de FAEs sería el tipo de anastomosis realizada durante la reconstrucción aórtica primaria. Se ha propuesto que la realización de una anastomosis proximal terminolateral favorecería la adhesión directa y la consiguiente erosión del tracto gastrointestinal en mayor medida que una anastomosis terminoterminal, aunque no hay ningún estudio que demuestre mayor incidencia de esta complicación en anastomosis terminolaterales que en terminoterminales8,63.
Se han descrito otros factores que podrían estar implicados en la dehiscencia de la sutura aórtica y en la formación de seudoanerismas anastomóticos, como la hipertensión arterial, la fatiga del material de sutura, la degeneración de la pared aórtica o el tipo de anastomosis realizada. En este sentido, también se ha propuesto una mayor predisposición a la formación de seudoaneurismas cuando se realiza anastomosis terminolateral39. También se han propuesto las cirugías complicadas, la necesidad de varias cirugías, la endarterectomía aórtica y la cirugía aórtica urgente como factores predisponentes para el desarrollo de FAEs1,18,63-65. En el caso de FAEs con tratamiento intravascular, su desarrollo podría estar relacionado con la angulación de la endoprótesis, sobre todo por la migración o rotura de ésta, que favorecería un mecanismo de erosión de la pared aórtica y daría lugar al desarrollo de una FAEs30.
En las series publicadas, la hemorragia digestiva se ha descrito como el síntoma más frecuente (61-94%)23,57, seguido de los signos de infección (50-70%)1,23 y de los síntomas de isquemia aguda (20-30%)2,66. Normalmente, los episodios iniciales de melenas o hematemesis ceden espontáneamente, configurando el sangrado "centinela", el cual tiende a recurrir en períodos de horas o días antes de la hemorragia masiva final. Su prevalencia fue del 31,78%.
Por lo tanto, la hemorragia digestiva en un paciente portador de una prótesis aórtica debería suscitar un alto índice de sospecha de existencia de una FAEs, incluso en ausencia de signos o síntomas de infección crónica. De hecho, cuando hay hemorragia digestiva tras cirugía reconstructiva aórtica, debería considerarse que es causada por una FAEs hasta que se demuestre lo contrario.
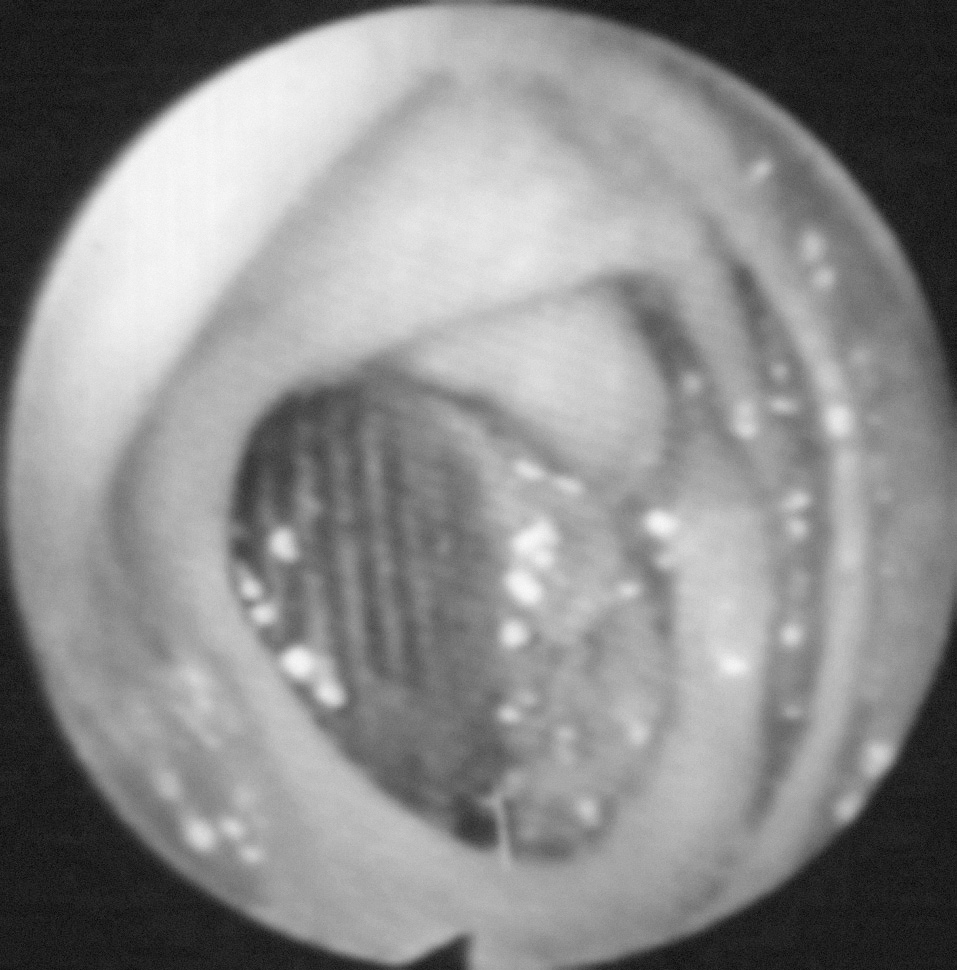
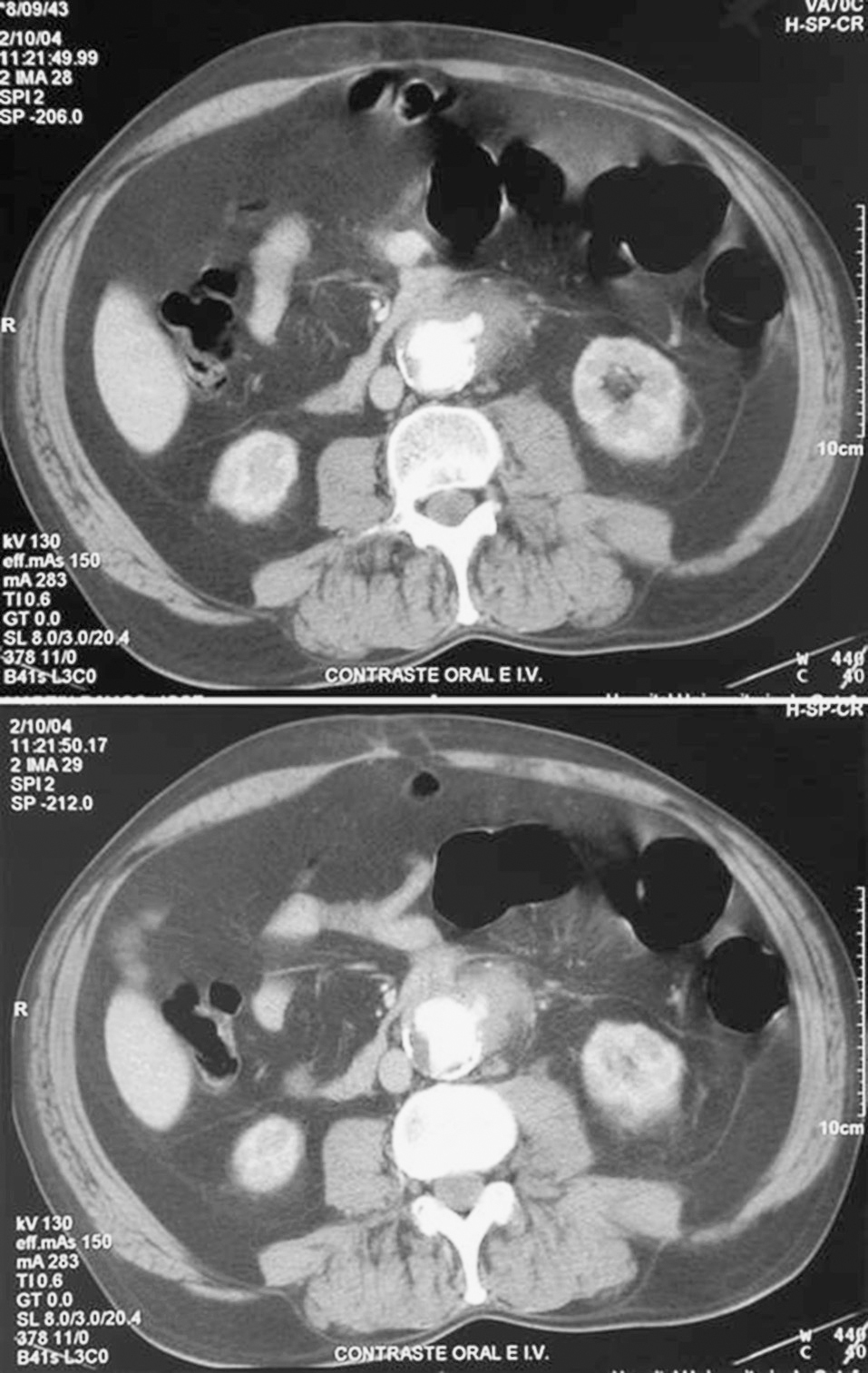
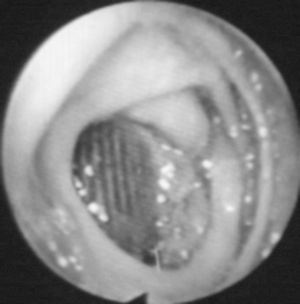
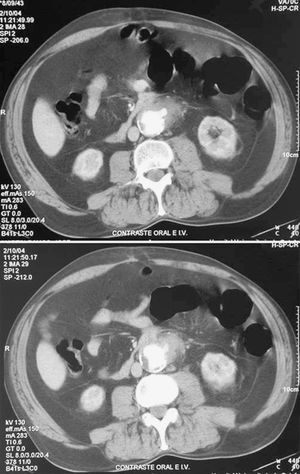
Existen varias pruebas diagnósticas que se han usado para demostrar la presencia de una FAEs, pero no todos estos estudios se han utilizado en todos los casos, por lo que es difícil de determinar su especificidad y su sensibilidad. La selección de los estudios depende del estado clínico del paciente y de los recursos existentes. La endoscopia es conveniente, tanto para descartar las causas más comunes de sangrado gastrointestinal como para diagnosticar FAEs. La situación preferente de las FAEs en la tercera y la cuarta porciones duodenales hace de la endoscopia digestiva alta un procedimiento de bajas sensibilidad o especificidad diagnóstica, aunque puede aportar datos que indiquen el diagnóstico: masa pulsátil ex-traluminal, ulceración de la pared y/o hemorragia activa1,12,47,57. Hay autores que defienden que, como las FAEs pueden presentarse en cualquier segmento intestinal, debería realizarse endoscopia digestiva alta y baja. El hallazgo endoscópico de otras enfermedades gastrointestinales o la ausencia de hallazgos patológicos en la endoscopia no excluyen la presencia de una FAEs, y algunos autores enfatizan la necesidad de repetir la endoscopia si no se hallan lesiones en la primera exploración (fig. 1)23,39,67. La TC con contraste oral e intravenoso podría ser más sensible a la hora de detectar cambios secundarios en la anastomosis relacionados con una FAEs, ya que permite evaluar el espacio retroperitoneal y visualizar seudoaneurismas anastomóticos, engrosamiento del tejido adyacente al intestino, alteración de la integridad protésica, erosión de la luz intestinal y existencia de líquido o gas periprotésico, datos que podrían apoyar la sospecha de que hay una FAEs (fig. 2); la extravasación de contraste de la aorta a la luz intestinal es el único signo definitivo de FAE12,13. En nuestra revisión, la TC fue diagnóstica o mostró hallazgos indicativos de FAEs hasta en un 80,75% de los casos (tabla 2). La arteriografía no suele considerarse útil, aunque podría serlo para planear la cirugía si la situación clínica del paciente permite su realización. El hallazgo de una dilatación importante en la anastomosis aórtica se ha propuesto como indicación de posible existencia de FAEs1,68, que fue patológica hasta en el 44,92% de los casos revisados. En algunas series, los autores plantean que la resonancia magnética (RM) podría llegar a ser una herramienta útil en el diagnóstico, aunque su utilidad no está aún definida1. La gammagrafía con leucocitos marcados tiene elevadas sensibilidad y especificidad, mayor del 80%, para el diagnóstico de infección protésica24,69.
Fig. 1. Imagen endoscópica de una fístula aortoentérica secundaria.
Fig. 2. Visualización de salida de contraste, gas periprotésico y seudoaneurisma a nivel de la anastomosis proximal del bypass.
Ninguna técnica diagnóstica puede ser recomendada por sí sola para realizarla en los pacientes en quienes se sospeche una FAEs. La combinación de la endoscopia con una técnica de imagen (TC, angiografía o RM) podría ser la mejor opción para detectar las FAEs, aunque no hay estudios que lo avalen62. En un paciente con hemorragia digestiva y antecedentes de cirugía aórtica, aunque las pruebas diagnósticas fuesen negativas para el diagnóstico de FAEs, algunos autores han llegado a plantear la laparotomía para excluir con seguridad dicho proceso patológico19. Es importante insistir en la necesidad de un elevado índice de sospecha clínica basada en la historia y el examen físico del paciente para el correcto diagnóstico, ya que en la literatura publicada se describen hasta 105 casos de FAEs en los que el intervalo entre la aparición de los síntomas y el diagnóstico fue de 55,7 días de media (3-390 días)1,6-10,12,15,21,24,31,32,35,39,40,43,47,52, y se ha descrito tasas de mortalidad superiores al 75% en el caso de diagnóstico tardío54.
La existencia de una FAEs implica la muerte del paciente si no se trata, e incluso con un tratamiento agresivo los resultados son pobres. Las elevadas tasas de mortalidad y amputación en estos enfermos dependen de la severidad de las manifestaciones clínicas, el pobre estado general de la mayoría de estos pacientes cuando se los diagnostica y la magnitud de la intervención quirúrgica19.
De la revisión general de series de casos con todas las opciones de tratamiento, se deduce que, incluso tras un tratamiento quirúrgico exitoso, hay una elevada morbilidad, con tasas de amputación de miembros inferiores de hasta el 9%2, el 22,22% de reinfección protésica23 y el 20% de trombosis en los casos de bypass extraanatómico19. Asimismo, cuando se realiza un bypass extraanatómico, tras retirada de la prótesis y ligadura de la aorta, hay un riesgo de fuga posterior y sangrado a través de la ligadura del muñón aórtico, y se ha descrito tasas de mortalidad relacionadas con esta complicación de hasta el 89%23,48. El riesgo de sangrado del muñón aórtico se describe en el 6-50%, según las series, mientras que el riesgo de presentar una nueva fístula sería del 9-22%2,8,24,57,62. La epiploplastia se ha descrito como método para disminuir esta incidencia70. Cuando el defecto intestinal es menor de 3 cm, puede realizarse una sutura directa de la pared intestinal. Si el defecto es mayor, debe realizarse resección duodenal1. En las series revisadas, no se aportan datos suficientes acerca del tamaño del defecto intestinal. En general, la sustitución in situ se ha considerado que debe reservarse para situaciones en que la infección esté circunscrita, como en erosiones enteroprotésicas, y está relativamente contraindicada en caso de sepsis sistémica, supuración y necrosis periaórtica difusa y en casos de infección por bacterias gramnegativas, especialmente Pseudomonas, Proteus y Staphylococcus aureus71. En nuestra revisión, no hemos encontrado datos suficientes para poder relacionar los resultados a corto y largo plazo de las distintas opciones terapéuticas con el tipo de germen cultivado. El tiempo que se debe tener al paciente con cobertura antibiótica una vez realizada la sustitución in situ continúa siendo controvertido, y no se ha encontrado datos suficientes al respecto en la literatura revisada. Los factores predictivos que se han asociado con una mayor tasa de mortalidad precoz incluyen la inestabilidad hemodinámica como clínica de presentación, la necesidad de cirugía urgente, la necesidad de transfusión sanguínea preoperatoria por anemia y la necesidad de pinzamiento suprarrenal8,16.
La sustitución in situ aportaría mejores resultados a largo plazo en cuanto a permeabilidad de la prótesis (del 86-90% a los 5 años42, el 62% a los 2 años19 y el 70% a los 4 años para los bypass extraanatómicos60). En series publicadas anteriormente a nuestra revisión, se describen tasas de permeabilidad del 85-90% a los 5 años y el 70-75% a los 10 años para sustitución in situ72, y el 33-85% a los 5 años para los bypass extraanatómicos73.
En el tratamiento de las FAEs se han descrito tasas de mortalidad a 30 días de entre el 13 y el 70%73. En nuestra revisión, se describen tasas de mortalidad precoz para la reconstrucción in situ de entre el 8 y el 13,3%42,50, mientras que para la retirada de la prótesis y bypass extraanatómico, éstas son de entre el 18,2 y el 44%2,23, con tasas de rotura del muñón aórtico de hasta el 20% a los 30 días42. Las tasas de mortalidad precoz en la sustitución por criopreservados oscilan entre el 12 y el 50%, con tasas de rotura precoz de la prótesis de hasta el 16%14,16,17,22,29,44,51.
Los procedimientos intravasculares se muestran como un tratamiento menos invasivo de las FAEs y, aunque sus resultados a corto plazo parecen óptimos, los casos descritos son escasos y no solucionarían el problema de la infección residual, por lo que muchos autores se inclinan a utilizarlos como un puente a la reparación quirúrgica abierta en pacientes hemodinámicamente inestables con hemorragia activa7,8,35. Burks et al34 describen su serie de 5 pacientes con diagnóstico de FAEs tratados de manera intravascular. Tres de estos pacientes continuaron con sepsis persistente y fallecieron a los 11, 13 y 18 meses (infarto de miocardio, fallo multiorgánico y accidente cerebrovascular, respectivamente)35.
En resumen, el mayor conocimiento de este tipo de complicaciones de la cirugía aórtica permitiría el reconocimiento precoz del problema y la realización de las pruebas diagnósticas apropiadas para su diagnóstico. Es esencial el diagnóstico de sospecha en todo paciente con hemorragia gastrointestinal y antecedentes de cirugía aórtica, teniendo en cuenta que la negatividad de las pruebas no excluye la existencia de una FAEs y que la realización de una laparotomía estaría justificada para descartarla. Debe enfatizarse en la prevención de dicha complicación, realizando una adecuada cobertura de la prótesis para evitar el contacto directo con las asas intestinales, así como administrar una profilaxis antibiótica adecuada y un tratamiento correcto de la infección postoperatoria. Aunque la sustitución in situ de la prótesis aporta aparentemente mejores tasas de mortalidad que la retirada y la revascularización extraanatómica, cuál es el mejor método de tratamiento de esta enfermedad continúa siendo un tema controvertido hoy en día, dada la ausencia de estudios comparativos sobre el tema. La elección de uno u otro método deberá basarse en las características del paciente, los hallazgos en las pruebas diagnósticas y en la experiencia del equipo quirúrgico, así como en la infraestructura disponible para ello.
Correspondencia: Dra. E. Martínez Aguilar.
Ctra. de Toledo, km 12,5. 28905 Getafe. Madrid. España.
Correo electrónico: esthermartinezaguilar@hotmail.com
Manuscrito recibido el 3-10-2006 y aceptado el 11-6-2007.