Introducción
La reparación de procesos herniarios sigue siendo una de las intervenciones quirúrgicas más frecuentes en cirugía general. Cuando se intervienen grandes defectos de pared abdominal hernias incisionales, generalmente secundarias a laparotomías previas, la colocación de un biomaterial de sustitución y/o refuerzo está hoy en día casi plenamente consensuado por parte de todos los cirujanos. Estudios recientes1 han demostrado, incluso desde el punto de vista económico, la superioridad de la utilización de prótesis frente al cierre simple en la reparación de hernias incisionales con el fin de evitar recidivas.
En trabajos previos2,3 hemos valorado el comportamiento de diferentes biomateriales en distintas interfaces. La correspondiente al contacto de la prótesis con el peritoneo visceral puede dar origen a complicaciones. En la bibliografía se han comunicado casos de fístulas intestinales y formación adherencial que han provocado cuadros de obstrucción intestinal4.
Nuestro grupo5 ha demostrado que la estructura y la porosidad del biomaterial desempeñan un importante papel en el desarrollo de adherencias, en la consistencia de éstas y en la organización del neoperitoneo formado entre biomaterial y peritoneo visceral.
La formación de adherencias, cuya etiopatogenia sigue todavía sin estar aclarada, se ha tratado de modular mediante el empleo de diferentes y variados sistemas, que van desde la adición de sustancias químicas en la cavidad peritoneal6 hasta el implante de células mesoteliales pluripotenciales previamente cultivadas in vitro7.
Otra posibilidad es el empleo de biomateriales que lleven algún pretratamiento, o bien que estén formados por dos componentes, uno de los cuales es el que se interpone en la interfaz prótesis/peritoneo visceral con la finalidad de modularla. Estas prótesis en forma de composite generalmente tienen dos componentes: uno de ellos puede ser el biomaterial principal (primer componente), al que se puede añadir otro que cumpla la función específica que no puede llevar a cabo el primero (segundo componente). De esta forma, el diseño de estas prótesis va dirigido a que el biomaterial que constituye el primer componente asuma el papel de integración tisular, y el segundo componente sea el que quede ubicado en contacto directo con el peritoneo visceral y module el comportamiento en esta interfaz. Ambos componentes suelen estar unidos mediante pegamentos acrílicos, termosellado e incluso sutura.
Los biomateriales que forman el primer componente suelen ser prótesis de tipo reticular, bien polipropileno o poliéster. El segundo componente (barrera) suele ser de tipo laminar y puede ser absorbible o no absorbible.
El objetivo del presente trabajo ha sido realizar un estudio comparativo entre distintos tipos de prótesis composite con la finalidad de evaluar el segundo componente de éstas, ya sea en forma de barrera física o química.
Material y método
Se emplearon 24 conejos blancos Nueva Zelanda machos, con un peso aproximado de 2.200-2.500 g. Los animales fueron estabulados en condiciones de luz y temperatura constantes durante todo el tiempo de estudio (normativa de la CEE 2871-22 A9).
La anestesia fue realizada con una mezcla de clorhidrato de ketamina, 70 mg/kg, diazepam, 1,5 mg/kg, y clorpromazina, administrada por vía intramuscular. Durante el acto operatorio, a algunos animales se les administró una dosis adicional por vía intraperitoneal. Todos los animales recibieron una dosis preoperatoria de 0,125 mg de cefazolina.
Mediante una técnica quirúrgica estéril se crearon defectos en la pared anterior del abdomen de 7 x 5 cm que comprendían todos los planos excepto la piel. Los defectos fueron reparados con fragmentos del mismo tamaño con diferentes materiales protésicos, que fueron fijados al tejido receptor mediante una sutura continua de polipropileno de 4/0.
Los biomateriales empleados fueron prótesis de tipo composite. Se establecieron dos grupos de prótesis. Grupo A (n = 12): prótesis con barrera física (no absorbible) polipropileno + politetrafluoroetileno expandido (PL + PTFEe) (Marlex®, Bard, Inc. Murray Hill, NJ y Preclude Dura-Substitute® Gore-Tex, Flagstaff, AZ) unidos por una sutura de polipropileno de 4/0 en los angulos de la prótesis; y polipropileno + poliuretano (PL+ PU) (Marlex®, Bard, Inc. Murray Hill, NJ y un film de 26 µm de poliuretano, Op-Site, Smith & Nephew Medical Limited, Hull HU3 2BN, Reino Unido) unidos mediante un adhesivo de cianocrilato; grupo B (n = 12): prótesis con barrera química reabosorbible, poliéster + film de polietilenglicol/glicerol (PO + gl) (Parietex Composite® + Sofradim Production, 116 Avenue de Formans, Trévoux, Francia), y polipropileno + ácido hialurónico (PL + hial) (Sepramesh®, Genzyme Surgical Products, Cambridge, MA).
Las prótesis en la vertiente interna quedaron en contacto con el peritoneo visceral y en su vertiente superficial con el tejido celular subcutáneo. Antes de efectuar los implantes quirúrgicos, las prótesis con barrera química PO + gl y PL + hial fueron hidratadas durante unos minutos en una solución de agua destilada estéril. Los animales fueron sacrificados a los 14 días del implante.
Se evaluaron la presencia de infección y los lugares de relajación en la zona de los implantes.
Las adherencias fueron clasificadas, tomando como parámetro principal su consistencia, en: a) laxas, de aspecto transparente y de fácil sección; b) firmes, de aspecto blanquecino y más difíciles a la sección, y c) integradas, en la interfaz prótesis/peritoneo visceral, con difícil plano de disección entre el biomaterial y la serosa intestinal.
La extensión y superficie de ocupación de las adherencias en las prótesis fueron evaluadas de acuerdo con un diseño de nuestro grupo6. Para ello se crearon unas plantillas de polietileno de las mismas dimensiones que las prótesis implantadas. Una vez extraídas las prótesis, las zonas adherenciales eran marcadas sobre la plantilla. Posteriormente, dichas plantillas eran sometidas a un análisis de imagen con un aparato computarizado (MICRON). La superficie era medida en cm2. Los resultados en cuanto a las áreas afectadas se sometieron a examen estadístico empleando el test de la U de Mann-Whitney.
Se tomaron muestras de la interfaz prótesis/peritoneo visceral y prótesis/tejido receptor para su estudio morfológico mediante microscopia óptica y electrónica de barrido (SEM).
Para los estudios de microscopia de luz, las piezas fueron fijadas en líquido de Bouin, incluidas en parafina y cortadas en secciones de 5 µm. Las tinciones empleadas fueron hematoxilina-eosina, Rojo-Sirius y Tricrómico de Masson (variedad Goldner-Gabe).
Las muestras destinadas a estudio con SEM fueron fijadas en glutaraldehído al 3%, colocadas en una solución tampón de Milloning (pH 7,3) y deshidratadas en series graduales de acetonas. El punto crítico se llevó a cabo en un Polaron E-3000. Por último, las piezas fueron metalizadas en oro-paladio y estudiadas en un microscopio electrónico de barrido Zeiss (DSM-950).
El estudio inmunohistoquímico fue efectuado con un anticuerpo monoclonal especifico para macrófagos de conejo RAM-11 (Dako M-633). El método empleado fue el de avidina-biotina, descrito en trabajos previos. Se efectuó el porcentaje de células marcadas positivamente en 30 campos microscópicos (*16) elegidos al azar para cada biomaterial y cada tiempo. De los valores obtenidos del recuento celular se obtuvieron la media aritmética y la desviación estándar. Posteriormente se aplicó el test de comparación de medias de Student-Newman-Kauls, de forma independiente para cada biomaterial.
El peritoneo neoformado sobre cada uno de los biomateriales fue evaluado mediante un estudio morfométrico de 25 secciones histológicas (5 µm) por grupo, para lo que se empleó un analizador de imagen computarizado (MICRON). De cada sección tisular se tomaron dos medidas al azar del espesor del neoperitoneo, el cual estaba delimitado por el componente protésico de la vertiente peritoneal de cada una de las prótesis composite. Las mediciones obtenidas a través del analizador de imagen fueron sometidas a estudio estadístico mediante el test de la U de Mann-Whitney.
Resultados
Todos los animales fueron válidos para estudio y no se observó la presencia de infección y/o rechazo en ninguno de ellos. En 2 animales del grupo A (PL + PU) y en 2 del grupo B (PO + gl) se detectó la presencia de seroma ubicado entre los films de polietilenglicol y poliuretano y en el de poliéster/polipropileno, respectivamente.
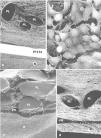
La consistencia de las adherencias fue en todos los implantes de características laxas y en algunos casos estaban ubicadas en la zona de la interfaz prótesis/tejido receptor (fig. 1).
Fig. 1. Fotografía macroscópica de las adherencias: a) PL + PTFEe; b) PL + PU; c) PO + gl; d) PL + hial. PL: polipropileno; PTFEe: politetrafluoroetileno expandido; PU: poliuretano; PO: polietilenglicol; gl: glicerol; hial: ácido hialurónico.
El área ocupada por las adherencias fue: en el grupo A (PL + PTFEe, 010 ± 0,13 cm2; PL + PU, 0,10 ± 0,07 cm2) y en el grupo B (PO + gl, 0,11 ± 0,02 cm2; PL + hial 6,53 ± 1,41 cm2). No hubo diferencias significativas entre las prótesis con barrera física (p > 0,05), pero sí entre las de barrera química (p < 0,05), y el área adherencial fue significativamente mayor en la prótesis PL + hial.
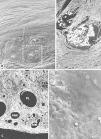
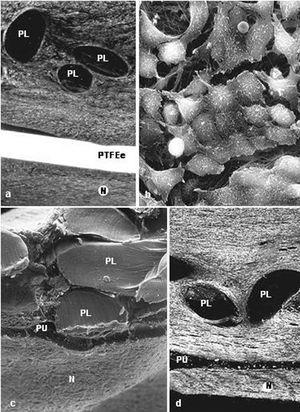
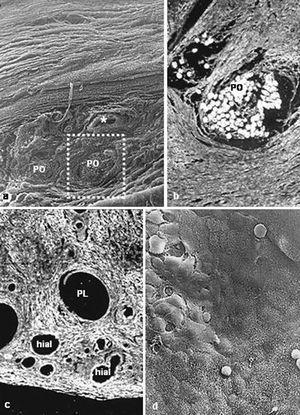
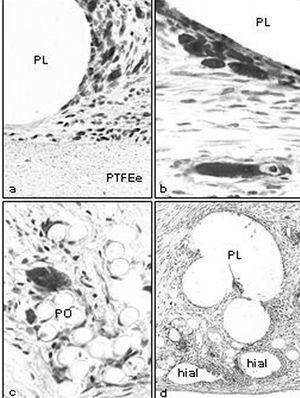
La integración de las prótesis con barrera física fue muy similar. La prótesis por la vertiente del polipropileno se rodeó de un tejido conectivo compacto, dispuesto de manera concéntrica a los filamentos de la prótesis. A partir de la vertiente laminar del composite (PTFE frente a PU), se formó un neoperitoneo de estructura ordenada, bien vascularizado y tapizado por células mesoteliales (fig. 2).
Fig. 2. Barreras físicas (grupo A). a) Implantes de PL + PTFEe a los 14 días (Rojo Sirius,x100); b) detalle de las células mesoteliales que tapizan el neoperitoneo (flecha = célula blanca) (x1.000); c) vista panorámica en la microscopia electrónica de barrido de la integración de la prótesis de PL+PU con el tejido receptor (x100); d) aspecto del implante de PL + PU en la microscopia óptica (Rojo Sirio, x100). PL: polipropileno; PTFEe: politetrafluoroetileno expandido; N: neoperitoneo, PU: poliuretano.
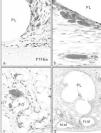
La integración de las prótesis con barrera química mostró un comportamiento igual en la vertiente reticular de la prótesis (PL frente a PO), encontrándose incluidas en un tejido cicatrizal denso y compacto. Sin embargo, en la barrera química, el film de polietilenglicol estaba íntegro y a partir de él se observaba la formación de un neoperitoneo, ordenado, paralelo al film y tapizado por un típico mesotelio. En la prótesis con barrera de hialurónico, el comportamiento en cuanto a la integración del polipropileno no mostró diferencia alguna en relación con las otras prótesis. Sí las hubo en la barrera de hialurónico, en la que se objetivó la presencia de cavidades correspondientes a zonas biodegradadas (fig. 3).
Fig. 3. Barreras químicas (grupo B). a) Tejido de integración muy vascularizado en la prótesis de PO + gl (x100); b) Detalle de microscopia óptica de la zona recuadrada en la imagen anterior (Rojo Sirio,x100); c) implante de PL + hial (Rojo Sirio,x100); d) mesotelio formado en los implantes de PL + hial en el que puede apreciarse la presencia de células blancas (flechas) (x500).PO: poliester; PL: polipropileno; hial: ácido hialurónico.*Vaso sanguíneo.
La morfometría del espesor del neoperitoneo formado mostró los siguientes valores: en el grupo A (PL + PTFEe, 546,44 ± 66,19; PL + PU, 286,20 ± 44,76) y en el grupo B (PO + gl, 276,89 ± 38,87; PL + hial, 84,49 ± 19,05). Hubo diferencias significativas entre las prótesis con barrera física (p < 0,05), y entre las de barrera química (p < 0,05). En general, todos los composites mostraron una buena mesotelización.
El estudio inmunohistoquímico con el anticuerpo monoclonal específico para conejo (RAM-11) (fig. 4) puso de manifiesto los siguientes valores en porcentaje de células marcadas para cada biomaterial: en el grupo A (PL + PTFEe, 17,39 ± 4,11; PL + PU, 19,84 ± 4,01) y en el grupo B (PO + gl, 15,74 ± 2,48; PL + hial, 27,33 ± 4,13). No hubo diferencias significativas entre la prótesis con barrera física (p > 0,05), pero sí entre las de barrera química (p < 0,05).
Fig. 4. Marcaje inmunohistoquímico específico para macrófagos de conejo (RAM-11). a) PL + PTFEe (x400); b) PL + PU (x630); c) PO + gl (x630); d) PL + hial (x100). PP: polipropileno; PTFEe: politetrafluoroetileno expandido; PO: poliéster; hial: ácido hialurónico.
Discusión
De acuerdo con algunos autores8, la prótesis ideal destinada a reparar defectos de pared abdominal debería tener una buena integración tisular, una buena resistencia biomecánica y, por último, un buen comportamiento cuando queda ubicada en contacto con el peritoneo visceral, sin generar la formación de adherencias.
La interfaz entre el biomaterial y el peritoneo visceral tiene una importancia máxima, ya que a través de ella pueden tener explicación algunas de las complicaciones que se presentan en los pacientes a los que se le ha implantado una prótesis intraperitoneal. Nuestra clasificación en laxas, firmes e integradas indica que estas últimas, debido al contacto íntimo que adquieren con la serosa del intestino, son las que pueden provocar problemas de fistulización con el intestino.
La interfaz del biomaterial con el peritoneo visceral se ha tratado de modular con el empleo de diferentes y variados sistemas.
En estos sistemas hay fundamentalmente 2 métodos: a) procedimientos de pretratamiento de las prótesis, que tienen como finalidad crear una interfaz entre el biomaterial y las zonas de contacto de éste con el peritoneo visceral y que, generalmente, son barreras reabsorbibles o soluciones químicas, y b) el empleo de barreras de tipo físico, sobre todo con el empleo de biomateriales no degradables.
En relación con el primer método se han publicado diferentes trabajos. Así, Jenkins et al9 demostraron que la colocación de un film de gelatina entre un biomaterial de polipropileno y el peritoneo visceral no disminuía el número de adherencias y que el número de éstas era igual al de los controles. Naim et al10 comprobaron que la interposición entre una prótesis de polipropileno y el peritoneo visceral de una lámina de Interceed® disminuía la formación de adherencias.
Nuestro grupo6 realizó un pretratamiento de las prótesis de polipropileno con fosfatidilcolina con la finalidad de modular el proceso adherencial, sin que se obtuvieran resultados en cuanto a su disminución.
Posteriormente, otros grupos, como Alponat et al11, evaluaron la eficacia de un compuesto de carboximetil-celulosa y obtuvieron una disminución de la formación de adherencias. Ensayaron también Interceed® y demostraron su ineficacia para impedir la formación de adherencias. En un estudio similar, estos autores interpusieron como barrera una membrana de ácido hialurónico biorreabsorbible y observaron la disminución de la formación adherencial, al igual que en estudios experimentales publicados recientemente por Dinsmore et al12, Baptista y et al13 y Szabo et al14, que emplearon una misma membrana de ácido hialurónico.
En nuestros ensayos, el mejor comportamiento como barrera química lo obtuvo el PO + gl respecto al PL + hial. Probablemente, ello se deba a que en el primer biomaterial la barrera química está diseñado en forma de film, muy parecido a lo que se realiza con las barreras físicas de tipo laminar. Ello, a pesar de ser reabsorbible, permite en los primeros momentos un óptimo y homogéneo depósito mesotelial. A diferencia de éste, el componente de hialurónico tiene que adaptarse a las distintas irregularidades de la estructura del polipropileno. Quizá por ello, el espesor del neoperitoneo en este último sea significativamente menor con respecto al PO + gl.
Hubo una mayor respuesta macrofágica en la prótesis con hialurónico. Ello podría atribuirse a la propia composición química.
Otra posibilidad es el empleo de barreras de tipo físico, normalmente materiales no biodegradables.
Diversos autores han ensayado estas barreras. Así, Walker et al15 realizan un trabajo de investigación en conejos en el que implantan, en un defecto en pared anterior del abdomen, una prótesis de polipropileno y en contacto con el peritoneo visceral una prótesis de PTFEe. Con ello obtienen una disminución del número de adherencias en dicha interfaz.
Amid et al16 obtienen los mejores resultados de inhibición de formación de adherencias con la combinación de una malla de polipropileno con una lámina de silastic o bien con una lámina de polipropileno.
Greenawalt et al17 emplean una prótesis composite (Sepramesh®) y obtienen una menor formación adherencial que con el empleo de controles solos de polipropileno. Los mismos resultados son obtenidos por otros autores18 que emplean el mismo composite y, además, analizan la formación adherencial de una forma secuencial con el empleo de laparoscopia.
Sodji et al19 ensayan un composite formado por poliéster y poliuretano y encuentran una mínima formación adherencial, aunque el diseño no tiene controles.
En el presente trabajo hemos empleado como barreras físicas el PTFEe laminar y el poliuretano. Esta segunda barrera física, que forma un composite diseñado por nuestro grupo20, obtiene junto con el PTFEe los mejores resultados en cuanto a formación adherencial. Asimismo, la formación del neoperitoneo consigue alcanzar el mejor espesor.
Para obtener una buena mesotelización es necesario que la barrera sea lisa y que no haya ningún tipo de obstáculo que impida que las células mesoteliales colonicen el material protésico. De acuerdo con Baptista et al13, solamente las zonas con buen mesotelio están desprovistas de adherencias. De hecho, algunos autores, como Soler et al21, no encontraron mejoría en la formación adherencial cuando combinaban 2 prótesis reticulares.
La reacción macrofágica ha sido similar en ambas barreras físicas y no hubo diferencias estadísticamente significativas en el porcentaje de macrófagos entre unas y otras.
Por todo ello, del presente estudio podemos concluir afirmando que: a) tanto las barreras físicas como químicas ubicadas en las distintas prótesis tienen un comportamiento en cuanto a formación de mesotelio muy similar, y b) en cuanto a la formación adherencial, las barreras físicas se comportan de una forma más homogénea, aunque no ocurre lo mismo con las químicas, en las que probablemente la composición química del segundo componente de la prótesis module la formación de adherencias en la interfaz peritoneal.
Este estudio ha sido financiado por una ayuda de investigación: CICYT-MAT 2004-02114.