Introducción
El cáncer de mama es el proceso tumoral maligno más frecuente en las mujeres y sigue constituyendo una verdadera amenaza para la salud en el mundo occidental. No es de extrañar, pues es la segunda causa de muerte por cáncer en la mujer y la primera en una franja de edad entre los 40 y los 44 años1.
En la actualidad se considera que el cáncer de mama es una enfermedad sistémica y, sin riesgo de equivocarnos, en la mayoría de las enfermas, conocer el estado de los ganglios linfáticos axilares nos permite precisar cómo es la relación del tumor con el huésped. Citando a Veronesi2, los ganglios linfáticos metastatizados son "indicadores" de una diseminación a distancia que obliga a una terapia oncológica adyuvante, ya que significa un incuestionable riesgo de enfermedad sistémica ulterior.
El hallazgo clínico o con técnicas de imagen de metástasis a distancia más allá de la frontera de los ganglios regionales siempre se ha considerado sinónimo de enfermedad incurable. Es innegable que, en ausencia de otras causas intercurrentes de muerte, todas las pacientes con metástasis a distancia morirán por esa enfermedad, con una tasa de supervivencia a los 20 años próxima al 0%3. Es igualmente cierto, sin embargo, que la introducción de nuevas modalidades de quimioterapia en los últimos años ha incrementado la supervivencia de las pacientes con enfermedad metastásica. Un estudio de Giordano et al4 examinó la supervivencia de 1.986 cánceres de mama que recibieron un tratamiento similar para la enfermedad primaria. De la muestra de pacientes, en 843 se desarrolló enfermedad metastásica. Entre 1974 y 1979, la media de supervivencia en este subgrupo era de 15 meses. En los siguientes 20 años, con la introducción de nuevos regímenes de tratamiento, las cifras de supervivencia obtenidas fueron sensiblemente mayores. Así entre 1999 y 2004, la media alcanzó los 51 meses de vida.
Junto al mayor éxito de respuesta en las nuevas modalidades terapéuticas, existe otro concepto asociado a la enfermedad metastásica del cáncer de mama que confiere a ésta mayores esperanzas de vida: un estado oligometastásico5. Es decir, las pacientes cuya enfermedad metastásica se comporta de forma autolimitada y se reduce a un único órgano sólido (un 5% de las enfermas con metástasis), lo que abre un campo de actuación a la cirugía exerética.
Que exista un estado oligometastásico no está aceptado por toda la comunidad científica. Sus detractores lo consideran una fase temprana dentro de una futura y segura diseminación a múltiples órganos y, por ello, no justifican tratamientos tan agresivos como el quirúrgico. Sus defensores entienden que en la idiosincrasia propia del tumor cabe cierta "benignidad" dentro de su comportamiento metastásico. En efecto, la realidad clínica de ciertas series, que luego estudiaremos, refleja cifras de supervivencia próximas a un 30% a los 5 años del tratamiento quirúrgico de la "oligometástasis" de origen mamario.
Todavía no hemos alcanzado a explicar cuáles son los mecanismos ciertos que permiten a ciertos tumores el desarrollo de un estado oligometastásico y, lo que sería más rentable desde el punto de vista terapéutico, cuáles son los que lo van a desarrollar. Ni el concepto halstediano, que consideraba el carcinoma de mama como una enfermedad local, con una propagación linfática desde el foco primario hasta los ganglios regionales, ni los estudios de comportamiento biológico tumoral en el cáncer de mama de Fisher y Veronesi, que conferían a los ganglios regionales la etiqueta de identificadores de siembra metastásica, sirven como argumentos.
Esta falta de conocimiento está impulsando líneas de investigación más recientes, la secuenciación de la expresión genética del tumor de mama, que permita en un futuro predecir cuáles son los tumores de buen pronóstico, cuáles los de mal pronóstico e incluso los lugares más probables de implantación metastásica.
En este sentido, de enorme interés son algunos trabajos de publicación reciente desarrollados a partir de una observación común en nuestras pacientes: hay diferentes supervivencias y diferentes índices de respuestas terapéuticas a pesar de un mismo TNM, lo que induce a considerar la existencia de otros factores pronósticos distintos de los consabidos tamaño tumoral y número de ganglios regionales con metástasis6,7. Su intención ha sido diseñar un perfil genético con carácter pronóstico basado en la expresión tumoral de ciertos genes (hasta 70). En esencia, los tumores que sobreexpresen genes relacionados con el ciclo celular, la angiogénesis o mecanismos de transducción intracelular (ciclina E2, MCM6, metaloproteinasas MMP9 y MP1, RAB6B, PK428, ESM1 y el receptor de VEGF llamado FLT1) serían catalogados de mal pronóstico, frente a los de buen pronóstico, sin sobreexpresión de los genes mencionados. Van de Vijver et al6 publicaron los resultados de la validación de su perfil genético con éxito, en una serie de 151 pacientes con ganglios negativos, al comprobar que los pacientes con "perfil genético malo" presentaban un riesgo relativo 5,5 veces superior de presentar metástasis a distancia respecto a los pacientes con "perfil genético bueno". Más aún, Al-Hajj et al8 caracterizaron diferentes subgrupos celulares dentro del conjunto de células tumorales de mama que se podría comparar con células madre pluripotenciales por su alta capacidad replicativa. Sólo los tumores de mama que presentaran un porcentaje alto de esas células entre las suyas serían capaces de desarrollar metástasis a distancia, frente a los inocuos, sin estas células replicativas y sin capacidad para desarrollar metástasis, o en caso de presentarlas, limitadas a un solo órgano. De forma similar, Demicheli et al9 denominaron a este subgrupo celular de mal pronóstico, dentro del conjunto de todas las células tumorales, células con fenotipo angiogénico. El tumor con menor proporción de células con fenotipo angiogénico sería un tumor con predominio de células "letárgicas", las cuales, a pesar de estar repartidas por el torrente sanguíneo, no comportarían metástasis con relevancia clínica. En consecuencia, tales micrometástasis podrían manifestarse si la mayoría de sus células escaparan de su condición "letárgica", para convertirse en células con fenotipo angiogénico (modelo del letargo tumoral).
Sea cual fuere la explicación cierta de los fenómenos comentados, mayores éxitos de supervivencia tras los nuevos regímenes terapéuticos en el cáncer de mama diseminado, y la existencia de un 5% de enfermas con cáncer de mama metastásico con un estado de oligometástasis, la evidencia clínica ha demostrado que la cirugía puede tener un lugar destacado en el manejo de la enfermedad metastásica mamaria, si ésta puede ser controlada macroscópicamente tras el gesto quirúrgico.
Finalmente, y para abundar más en estas ideas, es preciso citar un trabajo clásico del año 1973, centrado en el estudio detallado de las autopsias de mujeres con cáncer de mama metastásico. En él, Viadana et al10 establecieron dos posibles secuencias cronológicas en el devenir de las metástasis del cáncer mamario: a) una secuencia simultánea a partir del tumor primario, en el que desde un primer momento hay implantes metastásicos en todo el cuerpo (enfermas que no se beneficiarían de la cirugía), y b) una secuencia escalonada a partir del tumor primario, en el que desde el tumor primario las metástasis alcanzan el pulmón, el hígado o los huesos (el 66, el 61 y el 70%, respectivamente). Salvo las metástasis cerebrales, las metástasis a otros lugares fueron excepcionales (< 3%) en ausencia de afección de huesos, pulmones o hígado. Consecuentemente, la hipótesis promulgada por los autores consideraba que en los casos secuenciales eliminar el primer asiento de metástasis (pulmón, corazón o hígado) frenaría el efecto "en cascada" en el resto del organismo.
Hemos considerado oportuno centrar la presente revisión en tres epígrafes independientes: cirugía de las metástasis hepáticas de origen mamario; cirugía de las metástasis pulmonares de origen mamario, y cirugía de las metástasis óseas de origen mamario. Las metástasis cerebrales, cuyo tratamiento, si son únicas, es también quirúrgico, no están incluidas por entender que entran en el campo de actuación de los neurocirujanos.
Cirugía de las metástasis hepáticas de origen mamario (MHM)
Importancia de la cirugía en el tratamiento de las MHM
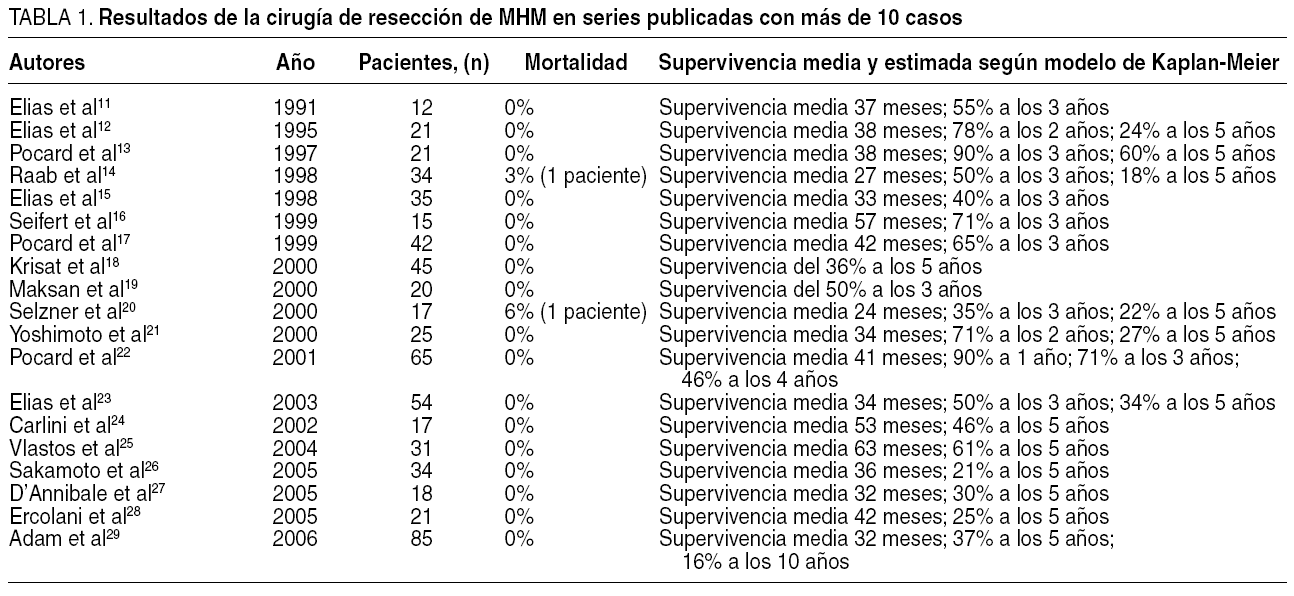
La recopilación y el estudio de los datos aportados en las diferentes revisiones y series (tabla 1)11-29 permite afirmar que la cirugía desempeña un papel primordial en el tratamiento de las MHM, siempre que concurran las siguientes condiciones: que puedan ser extirpadas en su totalidad; que el hígado sea el único asiento metastásico (algunas series incluyen a pacientes con metástasis óseas simultáneas radiosensibles); que la paciente goce de un buen estado de salud (OMS 0-1), y que las MHM no invadan estructuras vasculares mayores dentro del parénquima hepático (vena cava inferior, venas suprahepáticas extrahepáticas o hilio hepático). Es también cierto que en la evolución del cáncer de mama primario la MHM no tiene por qué haber sido el primer asiento de diseminación. En efecto, es frecuente encontrar entre las series a pacientes que previamente habían presentado en otros lugares (pulmón, pared torácica, columna lumbar)20,23 metástasis que tras la quimioterapia, convencional o a altas dosis, desaparecieron.
En el contexto científico actual que rodea a la medicina clínica, hay honda preocupación por presumir que todas las afirmaciones deban partir de la mejor evidencia clínica, la que se obtiene a partir de estudios con diseño prospectivo y aleatorizado. La evidencia clínica de las series quirúrgicas consultadas, sin embargo, está supeditada a series de casos (analizados de manera retrospectiva o prospectiva), cuya naturaleza metodológica obliga a considerar con reservas las conclusiones que aportan. En primer lugar, las series están conformadas por un número de enfermas escaso (en nuestro conocimiento hay hasta el momento sólo 14 series que superen la decena de enfermas. Nótese que en la tabla 1 hay 19 filas, pero en realidad pertenecen a 14 grupos de trabajo diferentes). En segundo lugar, las enfermas que constituyen las diferentes muestras son muy heterogéneas entre sí, con regímenes quimioterápicos diferentes, adyuvantes o neoadyuvantes, en algunos casos con quimioterapia regional en la arteria hepática o con quimioterapia a altas dosis. En tercer lugar, los criterios de inclusión han sido diferentes, y alguna de las series incluye a pacientes con metástasis óseas aisladas, con el pretexto de que son fácilmente controlables con radioterapia. Finalmente, las técnicas quirúrgicas aplicadas no son homogéneas y varían desde las metastasectomías hasta las resecciones hepáticas regladas.
Con todo ello, sin embargo, la evidencia de la cirugía, como mejor alternativa en el tratamiento, se presume a partir de los datos de supervivencia tan bajos publicados en otras series de enfermos no operados con MHM potencialmente resecables (con regímenes quimioterápicos nuevos, la respuesta inicial se cifra en torno al 55%, la remisión completa es muy rara, y la esperanza media de vida es de 24 meses sin supervivencia a los 4 años)30, frente a las enfermas con MHM resecables, finalmente operadas (esperanza media de vida próxima a los 50 meses, con supervivencias del 50% a los 5 años)24,25. Si además tenemos en consideración la práctica imposibilidad de elaborar diseños prospectivos por cuestiones de ética profesional (un estudio comparativo de pacientes con MHM resecables y características epidemiológico-patológicas similares, donde cada uno fuera asignado de forma aleatoria a uno de estos dos grupos: "grupo de tratamiento quirúrgico" y "grupo de tratamiento no quirúrgico), sería razonable admitir que siempre que la MHM pueda extirparse quirúrgicamente, el cirujano desempeñaría una acción adyuvante o neoadyuvante en el escenario terapéutico de esta enfermedad en estadios avanzados.
La superespecialización dentro de la cirugía general en áreas de especial capacitación, entre ellas la cirugía hepatobiliopancreática, ha sido determinante en el impulso de las unidades centradas en la cirugía del parénquima hepático. Es evidente que su realidad clínica es fundamentalmente el tratamiento de metástasis hepáticas de origen colorrectal y, consecuentemente, fueron las que acapararon las primeras series publicadas de metastasectomías, con cifras de mortalidad y morbilidad muy bajas31. Con tales resultados, ciertas unidades empezaron a ampliar el espectro de actuación incluyendo metástasis hepáticas de otros orígenes; Elias et al11 fueron los pioneros en publicar sus resultados con las de origen mamario en 1991.
Las metástasis colorrectales, respecto a las mamarias, tienen un matiz diferencial, ya que el hígado es el primer filtro que capta las células tumorales que le llegan por vía portal; por el contrario, en la mama, el hígado es un asiento más en su diseminación por todo el cuerpo. Así, aunque la MHM sea solitaria en el momento de su diagnóstico, hay que considerar que la enfermedad ha adquirido ya un estado de micrometástasis múltiples y extendidas por todo el organismo. En esencia, la cirugía debería ser considerada citorreductora, enmarcada dentro de un modelo terapéutico multimodal, y aplicada conjuntamente (neoadyuvancia o adyuvancia) con la quimioterapia.
Definir la esencia de la cirugía de las MHM como terapia citorreductora no es un asunto trivial. Su fundamento biológico se centra en que la reducción significativa de una masa tumoral induciría a las restantes células neoplásicas (en el caso considerado, extendidas ya por todo el organismo en forma de micrometástasis, aunque sólo sea clínicamente visible la MHM) a entrar en el ciclo proliferativo, con lo que se harían más sensibles a la quimioterapia y/o a la radioterapia.
Factores pronósticos (tabla 2)
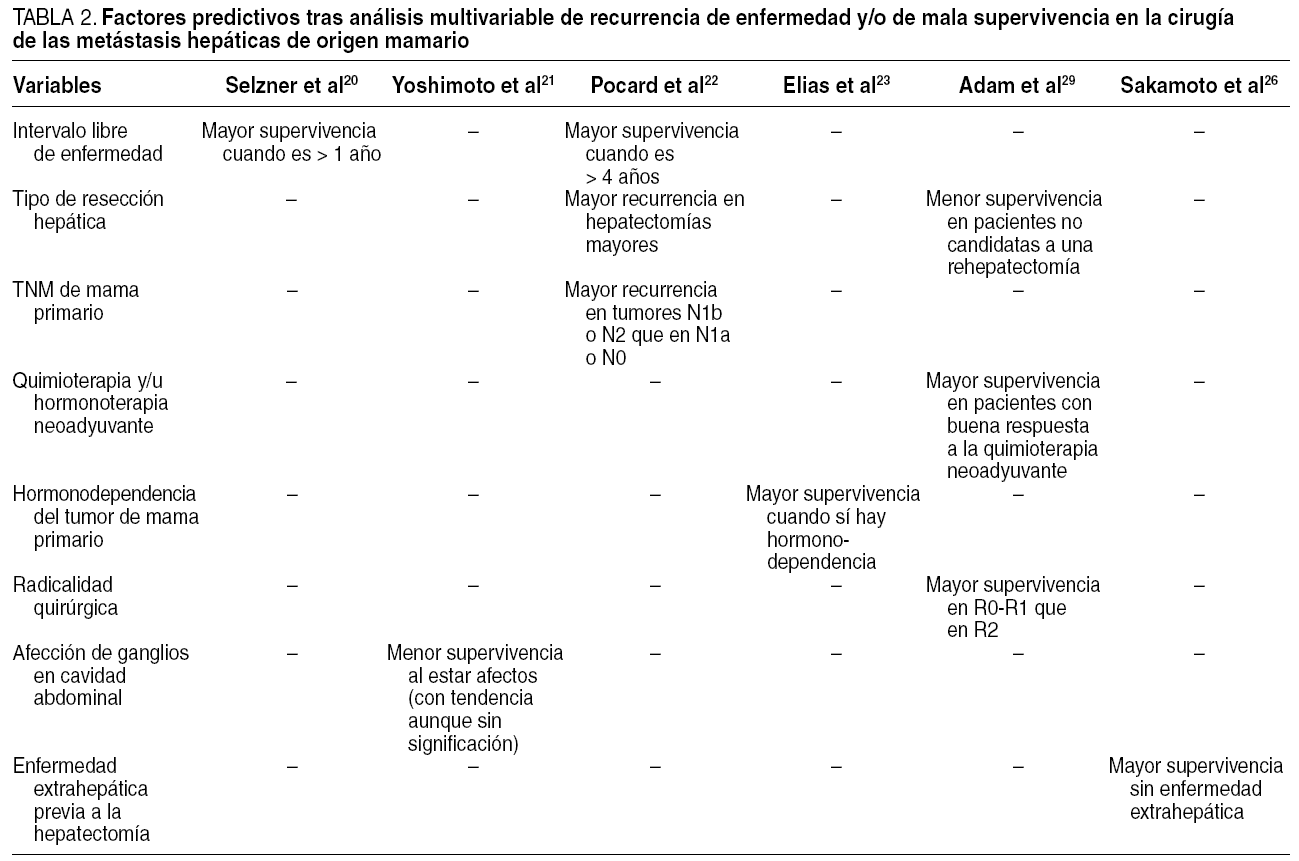
La ausencia de evidencia clínica de nivel I ha impulsado un fuerte deseo de identificar dentro del grupo reducido de pacientes con MHM resecadas los factores asociados con un pronóstico más severo.
La primera serie analizada es la de Pocard et al22, publicada en el año 2001, con un tamaño muestral de 65 pacientes. En el estudio multivariable de los factores pronósticos, se incluyó en el estudio varias variables: número de MHM; demora entre el diagnóstico del cáncer de mama primario y la aparición de MHM (más de 48 meses o menos); tipo de resección hepática (más de 3 segmentos o menos de 3 segmentos); que haya o no metástasis sincrónicas con las hepáticas, fundamentalmente óseas; edad (> 45 o < 45 años); estadificación TNM en el cáncer de mama primario; número de ciclos de quimioterapia previos a la cirugía (más de 6 ciclos o menos); estabilización y/o regresión o no de las MHM tras la hormonoterapia o la quimioterapia; localización de las MHM en el hemihígado izquierdo o en el derecho, y que el cáncer de mama primario sea hormonodependiente o no.
De entre todas ellas, sólo fueron significativas como factores de recurrencia en el hígado restante la estadificación TNM y el tipo de resección hepática. Así, en los tumores de mama N1b y N2, la tasa de recidivas a los 36 meses doblaba la de los tumores N0 y N1a (el 81 y el 40%, respectivamente). Finalmente, un porcentaje similar de diferencia de recurrencia se obtuvo también a los 36 meses cuando se comparó las hepatectomías mayores y las menores (el 76 y el 40%, respectivamente). Es evidente que las resecciones hepáticas que comprometían a más de 3 segmentos implicaban una mayor carga tumoral, esto es, una capacidad metastatizante mayor y por eso un comportamiento menos "benigno" de la MHM. Reincidiendo en la idea de la secuenciación genética, probablemente tales tumores expresarían un mayor número de genes involucrados en la división dentro del ciclo celular.
Sólo la demora entre el tumor primario y las MHM fue significativa como factor de supervivencia. Cuando el tiempo transcurrido fue > 48 meses, la supervivencia a los 4 años fue del 64%, frente al 25% cuando el tiempo fue < 48 meses. Es lógico suponer que una aparición precoz en las MHM era sinónimo de una mayor agresividad en el comportamiento del tumor primario.
La serie de Elias et al23, con un tamaño muestral de 54 pacientes, también incluye un estudio multivariable de factores pronósticos: edad (< 50 años o mayor); estadificación tumoral T; estadificación tumoral N; hormonodependencia; demora entre el diagnóstico del cáncer de mama primario y la aparición de MHM (más de 12 meses o menos); ganglios hiliares del hígado afectados o no afectados; haber recibido o no quimioterapia intraarterial regional hepática; el mayor tamaño de la MHM (> 3 cm o < 3 cm); el número de MHM (más de 3 o menos); tipo de resección hepática (mayor frente a menor), y radicalidad quirúrgica (R0: resección completa macroscópica y microscópica; R1: enfermedad residual microscópica; R2: enfermedad residual macroscópica).
De todos ellos, la hormonodependencia del tumor primario fue el único factor con significación estadística. La presencia de receptores hormonales supuso una supervivencia media de 44 meses, que descendió hasta 19 cuando los receptores fueron negativos. Asimismo, la ausencia de receptores hormonales multiplicaba por 3,5 el riesgo de morir por esta enfermedad.
Ni la extensión de la enfermedad hepática (número y tamaño de la mayor metástasis) ni la afección metastásica de los ganglios en la placa hiliar hepática ni la radicalidad quirúrgica (R0 contra R1 o R2) tuvieron significación en la supervivencia. La falta de significación estadística en los últimos tres factores induce a catalogar el papel de la hepatectomía en el tratamiento de las MHM como una terapia citorreductora, y no como un único tratamiento curativo aislado. Todo lo contrario, como ya comentamos, ha de ser evaluada en un contexto multidisciplinario con quimioterapia adyuvante. A la luz de estos resultados, es necesario insistir que la indicación quirúrgica en las MHM obedece y debe ceñirse a criterios técnicos quirúrgicos (posibilidad real de resecabilidad de las MHM) más que a criterios oncológicos.
La serie más reciente (2006) de Adam et al29, sin embargo, tras análisis multivariable, sí encontró diferencias significativas en las pacientes con resección R2 (pacientes con márgenes macroscópicamente positivos o mínima carga residual tumoral) respecto a aquellas con resección R0 o R1. Las pacientes R2, aun siendo subsidiarias de quimioterapia intraarterial hepática mediante sistemas de infusión colocados en el acto quirúrgico de la metastasectomía, presentaron una media de supervivencia de 16 meses y tasa de supervivencia a los 5 años del 10%, frente a una media de 43 meses y una tasa del 43% de las R0, y una media de 46 meses y una tasa del 42% de las R1. A partir de estas diferencias, los autores consideran el tratamiento quirúrgico de las MHM de origen mamario como parte integral de un tratamiento multidisciplinario sólo en casos macroscópicamente resecables, y desdeñan el margen positivo microscópico de resección por su nula incidencia en la supervivencia.
Es interesante que encontraran otros dos factores en el análisis multivariable: a) respuesta de la enfermedad intrahepática a la quimioterapia neoadyuvante: las pacientes con respuesta presentaron un porcentaje de supervivencia a los 5 años del 42%, frente al 12% de las pacientes sin respuesta, y b) la posibilidad de realizar una rehepatectomía: en esencia, las pacientes que no fueron candidatas a una rehepatectomía porque su recurrencia de enfermedad fue extrahepática, o porque en caso de ser intrahepática ésta fuera irresecable, presentaron un porcentaje de supervivencia a los 5 años del 29%, frente a aquellas en las que la recurrencia de la enfermedad fue intrahepática y resecable, cuya supervivencia a los 5 años fue del 81%.
En la serie de Yoshimoto et al21, con un tamaño muestral de 25 pacientes, ninguna de las variables estudiadas como factores pronósticos (muy similares a las citadas previamente) fue significativa como factor pronóstico de supervivencia. La variable más relevante fue que hubiera ganglios metastásicos en el resto de la cavidad abdominal o no. Cuando los había, la supervivencia a los 5 años fue del 0%, y del 67% cuando no los había. Sin embargo, de las 25 enfermas de la serie, este dato fue recogido sólo en 19 (con metástasis ganglionares, 8; sin, 11). Quizá el pequeño tamaño muestral fue la causa de la falta de significación estadística.
En la serie de Sakamoto et al26, la enfermedad extrahepática previa a la hepatectomía fue el único factor pronóstico estadísticamente significativo tras el análisis multivariable. Así, en las enfermas sin enfermedad extrahepática la supervivencia a los 5 años fue del 31%, frente al 0% cuando sí la tenían. En otros términos, el riesgo de fallecimiento por recurrencia de la enfermedad tras la hepatectomía era 2,6 veces mayor en este último grupo de pacientes.
Finalmente, la serie de Selzner et al20, con un tamaño de 17 pacientes, sólo encontró significación estadística como factor pronóstico de supervivencia en el tiempo transcurrido desde el diagnóstico del cáncer de mama hasta hallar MHM. Cuando el tiempo transcurrido fue < 1 año, la supervivencia media fue de 9 meses, frente a 27 meses cuando el tiempo fue > 1 año.
En conclusión, en los casos infrecuentes en que la enfermedad metastásica de la mama se ciña a un único órgano como el hígado y ésta sea resecable, se debe considerar la cirugía como una herramienta citorreductora en el tratamiento multidisciplinario, conjuntamente con la quimioterapia. La candidata ideal, aquella que alcance mayor número de meses de supervivencia una vez se resecan las MHM, es difícil de reconocer por los siguientes motivos: a) las características de los trabajos publicados (series de casos, ausencia de evidencia clínica de nivel I); b) la discreta casuística recogida (entre los trabajos publicados con más de 10 pacientes suman un total de 481), y c) la falta de consenso en los factores pronósticos tras el estudio multivariable. Igualmente complicado es predecir el momento más oportuno para aplicar la cirugía, antes o después de la quimioterapia.
Sin embargo, como el objetivo primordial del profesional de la salud es garantizarla en calidad y en tiempo, mientras no haya trabajos que demuestren mayores supervivencias con quimioterapia aislada en estas pacientes, deberemos incidir en la aplicación de la cirugía. Por último, si la cirugía es una opción, también deberemos proporcionar seguimientos ambulatorios minuciosos con el objeto de detectar la enfermedad metastásica, si la hubiere, en estadios precoces y, por ello, subsidiaria de resección quirúrgica.
Cirugía de las metástasis pulmonares de origen mamario (MPM)
Las consideraciones teóricas en torno a la cirugía en las MHM son en gran medida aplicables también a la cirugía en las MPM. En efecto, asistimos también a un epígrafe donde las conclusiones se derivan de series de casos con casuística limitada (sin trabajos prospectivos aleatorizados por su dudosa ética), aunque, nuevamente, los trabajos que consideran la aplicación de la quimioterapia aislada, incluso en altas dosis y en enfermos con metástasis potencialmente resecables, arrojan cifras de supervivencia menores que las de la aplicación de la cirugía como terapia única o combinada (25-30 meses frente a 42-79 meses, respectivamente) (tabla 3)32-39.
A diferencia de las MHM, el análisis de lo publicado, sin embargo, aporta trabajos donde sí se comparan los diferentes rangos de supervivencia entre ambos grupos: tratados con quimiorradioterapia y tratados con cirugía, aunque de forma retrospectiva. Staren et al32 obtuvieron una supervivencia media de 33 meses en un grupo de 30 pacientes a los que se aplicó quimioterapia (n = 22) o quimiorradioterapia (n = 8), frente a una supervivencia de 55 meses en un grupo de 33 pacientes con cirugía aislada (n = 20), cirugía más quimioterapia (n = 9) o cirugía más radioterapia (n = 4). Con resultados parejos concluyeron su revisión Murabito et al37, los cuales obtuvieron una supervivencia media de 79 meses en 28 pacientes con metástasis resecadas por cirugía (supervivencia a los 5 años del 80% y a los 10 años, del 60%), frente a 9 meses en los 34 pacientes que recibieron tratamiento médico. De especial interés es que la serie de Staren et al32 mantuvo la diferencia de supervivencia entre ambos grupos, incluso cuando se comparó a pacientes con un nódulo pulmonar único. A pesar de la naturaleza retrospectiva de estas dos series, sus resultados no deben ser despreciados, ya que ambos brazos de población (quirúrgico y médico) fueron similares en sus características (estadificación, histología tumoral, dependencia hormonal del tumor, número de metástasis e intervalo libre de enfermedad). Sin embargo, es legítimo reconocer que en ninguno de los dos trabajos se menciona el estado de salud o bienestar de las pacientes asignadas a cada brazo, lo que hace suponer que las que gozasen de mejor situación serían las candidatas a la cirugía. Sin duda, la falta de aleatorización en la asignación de las pacientes a uno u otro brazo introduce un sesgo que obliga a la moderación en la interpretación de las conclusiones.
Nuevamente, falta consenso entre las series quirúrgicas en la relación de los factores pronósticos de supervivencia con significación estadística. Así, en la serie de Staren et al32, con supervivencia de 55 meses, ni el número de metástasis resecadas ni el intervalo libre de enfermedad tuvieron participación en la supervivencia. Lanza et al33 examinaron una serie de 37 enfermos con resección completa de las MPM. La supervivencia media obtenida fue de 47 meses, con una supervivencia a los 5 años del 49%. En esa serie, el intervalo libre de enfermedad > 12 meses sí condicionó de forma significativa una mayor supervivencia, con cifras a los 5 años del 57%. Friedel et al34, en su serie de 68 pacientes con MPM resecadas satisfactoriamente, obtuvieron una supervivencia media de 36 meses, con cifras de supervivencia a los 5 años del 31%. No encontraron ningún factor pronóstico de supervivencia con significación estadística, aunque un intervalo libre de enfermedad > 24 meses y las metástasis solitarias se asociaron a supervivencias más prolongadas. La series de McDonald et al35 y Planchard et al39, esta última con 125 pacientes, la más amplia publicada sobre una única institución, subrayan que las supervivencias son similares independientemente de que se hubiera conseguido una resección completa (macroscópica y microscópica) o incompleta en el plano microscópico (R1). Sin embargo, también es cierto que la enfermedad residual macroscópica tras la exéresis disminuyó francamente la supervivencia, con cifras a los 5 años que no superaron el 20%.
Con el ánimo de superar las críticas de los detractores de la cirugía, que centran su discurso en que las conclusiones provienen de series con pequeñas muestras de pacientes, Friedel et al38, sumando la experiencia de 6 centros de Europa y Norteamérica, reunieron en su serie a 467 pacientes. De las 392 pacientes con resección completa macroscópica y microscópica, solamente un intervalo libre de enfermedad > 36 meses tuvo significación en la supervivencia (50 frente a 23 meses de supervivencia media). Las pacientes con una única metástasis tuvieron supervivencias también mayores (41 meses), frente a las pacientes con 2 o 3 metástasis (33 meses) o las pacientes con 4 o más metástasis (37 meses), aunque sin significación estadística.
Compilando todas las variables estudiadas, las pacientes de esta última serie fueron clasificadas en cuatro grupos de riesgo. Así, la cirugía desempeñaría un papel claramente superior al del tratamiento médico en las pacientes pertenecientes al grupo I: resección completa, intervalo libre de enfermedad > 36 meses y metástasis única (supervivencia media de 59 meses y un 26% de supervivencia a los 10 años). Sin embargo, en el otro extremo, el grupo IV pondría en evidencia el papel de la cirugía frente al tratamiento médico: enfermedad macroscópica residual (supervivencia media de 5 meses y un 18% de supervivencia media a los 5 años), cuyas cifras de supervivencia nunca serían superiores a las del tratamiento médico. El grupo II, que incluiría a las pacientes con resección completa, intervalo libre de enfermedad < 36 meses o múltiples metástasis (supervivencia media de 36 meses y un 21% de supervivencia a los 10 años), y el grupo III, que aglutinaría a las pacientes con resección completa, intervalo libre de enfermedad < 36 meses y múltiples metástasis (supervivencia media de 25 meses y un 13% de supervivencia a los 10 años), comprenderían ese cajón de sastre donde no es aventurado colocar a la cirugía por encima del tratamiento médico, aunque siempre con cautela y prudencia, a la espera de los resultados pendientes de publicación con las nuevas terapias que se está aplicando: nuevos fármacos antihormonales, inhibidores de los receptores Her2-neu, inhibidores de los receptores del factor de crecimiento endotelial vascular (VEGF).
Finalmente, es importante recordar que sólo un tercio de las lesiones pulmonares que aparecen en una paciente con historia pasada de cáncer de mama son MPM. Así, e independientemente de las cifras de supervivencia antes comentadas, se debe tener en cuenta el gesto quirúrgico por si se tratara de un tumor primario de pulmón o incluso de una metástasis de origen distinto (colorrectal, sarcomas óseos o de partes blandas, renal, cabeza o cuello), circunstancias en las que la cirugía está ampliamente aceptada.
Cirugía de las metástasis óseas de origen mamario (MOOM)
El hueso como destino de metástasis del cáncer de mama es uno de los lugares más frecuentes y de aparición más temprana. Sus síntomas clínicos por excelencia son el dolor y las fracturas frecuentes y obedecen a la naturaleza destructiva de las metástasis óseas.
Su manejo ordinario es el tratamiento médico, hormonal o quimioterápico, con cifras de supervivencia media próximas a los 50 meses. Más recientemente se han introducido los bisfosfonatos y la radioterapia.
La cirugía se ha reservado consecuentemente para las condiciones en que la MOOM se ha vuelto resistente a los tratamientos sistémicos o hay un riesgo cierto e inminente de deterioro de la calidad de vida de la paciente. Entonces, es usual acudir a ella por fracturas o estabilizaciones óseas para evitar compresiones medulares, radiculares o nerviosas. En efecto, más que extirpar la MOOM, se trata de estabilizar el hueso afectado.
Lo publicado considera la cirugía curativa de los huesos cuando la MOOM afecta de forma aislada al esternón. Encontramos 3 series40-42, 23 pacientes en total, con cifras de supervivencia del 60% a los 5 años. Tras la resección, se describe en los trabajos la técnica empleada para la reconstrucción con injertos autólogos e implante de prótesis.
Conclusiones
La revisión de los datos aportados por las distintas series indica que la cirugía en combinación con una terapia adyuvante sistémica ofrece mayor supervivencia que la quimioterapia o la radioterapia en la enfermedad metastásica de mama aislada en hígado, pulmón e incluso esternón, siempre que se obtenga una completa extirpación macroscópica de la metástasis.
Por la naturaleza de los estudios, las limitaciones antes comentadas y sus sesgos, el análisis de las cifras aportadas exige prudencia, aunque debe servir de base para acometer seguimientos clínicos exhaustivos en la paciente con historia de cáncer de mama. Sólo de esta forma la enfermedad metastásica puede resultar "oligometastásica" y beneficiarse de un control quirúrgico.
Mientras las nuevas terapias testadas en ensayos clínicos bien diseñados (nuevos fármacos antihormonales, inhibidores de los receptores Her2-neu, inhibidores de los receptores de VEGF) no ofrezcan resultados de supervivencia superiores a los obtenidos con la cirugía más la quimioterapia o la hormonoterapia, la elaboración de trabajos prospectivos aleatorizados que comparen cirugía y tratamiento médico son difícilmente justificables. No hay duda de que, si llegara ese momento, se antojaría imprescindible el análisis simultáneo de los tres brazos siguientes: a) cirugía y quimioterapia/hormonoterapia; b) nuevas terapias; c) cirugía y nuevas terapias.
Correspondencia: Prof. H.J. Durán Giménez-Rico.
Departamento de Cirugía. Facultad de Medicina. Campus
Universitario. Universidad de Alcalá.
Ctra. Madrid-Barcelona, km 33,600. 28871 Alcalá de Henares. Madrid. España.
Correo electrónico: hipolito.duran@uah.es
Manuscrito recibido el 11-10-2006 y aceptado el 19-3-2007.