Introducción. Se ha demostrado que la L-arginina mejora la cicatrización de las heridas cutáneas. Sin embargo, no hay estudios que reflejen la influencia de este aminoácido en la cicatrización de las anastomosis cólicas. El presente estudio pretende averiguar si la suplementación de arginina en la nutrición parenteral total mejora la cicatrización de las anastomosis cólicas experimentales.
Material y método. Se estudian tres grupos de ratas Wistar (20 animales por grupo), a los que se realizó una anastomosis término-terminal de colon izquierdo y se administró nutrición parenteral isocalórica e isonitrogenada, con distintas concentraciones de L-arginina: A (nutrición estándar) = 4,3 g/l, B (suplementada) = 7,3 g/l y C (suplementada) = 10,3 g/l. El séptimo día postoperatorio se estudió la anastomosis cólica (complicaciones locales, presión de rotura, histología e hidroxiprolina). Se realizó un análisis descriptivo, ANOVA de una vía, test de Newman-Keuls, regresión múltiple y prueba de la *2 de las variables.
Resultados. La presión de rotura, la hidroxiprolina, así como el grado de epitelización, fibrosis y neovascularización de las anastomosis fueron mayores de forma significativa en los grupos que recibieron mayor concentración de L-arginina en la nutrición (p < 0,005).
Conclusión. El suplemento de L-arginina en la nutrición parenteral de ratas Wistar mejora de forma significativa la cicatrización de las anastomosis cólicas experimentales, como se demuestra con las medidas de presión, la concentración de hidroxiprolina y los criterios histológicos.
Introducción
La dehiscencia anastomótica en la cirugía colorrectal sigue siendo una preocupación para el cirujano dada la alta morbimortalidad que conlleva.
La nutrición quirúrgica ha progresado de manera considerable y actualmente se estudian nutrientes específicos, así como medidas farmacológicas y hormonales, para aumentar la eficacia del sustrato aportado1. Este punto de vista es la base para la modificación o adición de nutrientes, especialmente de los aminoácidos, en el apoyo nutricional de los pacientes.
Sax2 resalta las propiedades de la L-arginina en la colagenogénesis de heridas cutáneas y destaca el interés que esta propiedad puede tener en la cicatrización de las anastomosis intestinales. Efectivamente, se ha demostrado que con el suplemento de L-arginina en la dieta se produce un aumento en la síntesis de colágeno y en la fuerza tensil de la herida cutánea3-5 y, del mismo modo, también se ha observado una cicatrización más acelerada en úlceras de intestino delgado6.
En este trabajo se valora el efecto de la L-arginina sobre la cicatrización de las anastomosis cólicas con el fin de disminuir la incidencia de las dehiscencias anastomóticas.
Material y método
Animales
Utilizamos 60 ratas albinas macho de raza Wistar, con un peso entre 260-300 g, que se mantuvieron a una temperatura (22-24 °C) y humedad relativa (60-70%) constantes. Se distribuyeron aleatoriamente en tres grupos de 20 ratas según la nutrición parenteral administrada.
El día previo a la intervención quirúrgica se administró un evacuante intestinal compuesto por senósidos A y B (X-Prep®) (1 ml/kg), mediante una sonda orogástrica. Los animales fueron alojados en jaulas metabólicas individuales (Tecniplast®, 3700MO-000) y permanecieron con suero glucosalino como única ingestión oral durante 24 h.
Intervención quirúgica
A las 24 h de administrar el evacuante intestinal, los animales fueron pesados y anestesiados por vía intraperitoneal, con una mezcla de 75 mg/kg de ketamina, 2,5 mg/kg de acepromacina y 0,05 mg/kg de atropina.
En condiciones de asepsia realizamos una laparotomía media, resección de 2 cm de colon descendente y una anastomosis término-terminal con 8 puntos de sutura entrecortada de polipropileno de 7 ceros siguiendo las pautas descritas por Vázquez7.
Se canalizó la vena yugular interna con un catéter de silicona de 0,635 mm de diámetro interno que, desde la yugular interna, comunicamos con la región interescapular de la rata. El catéter se pasa a través de la chaqueta protectora (Alice King Chatham, Medical Arts®) y se introduce en el aparato giratorio (Alice King Chatham, Medical Arts®, Los Ángeles, CA, EE.UU.) hasta conectarlo con la bomba de nutrición8,9.
Nutrición parenteral
Tras colocar al animal en la jaula metabólica se administró la nutrición parenteral con bomba de perfusión (Hardvard Apparatus® modelo 2265) a una velocidad de infusión de 0,033 ml/min.
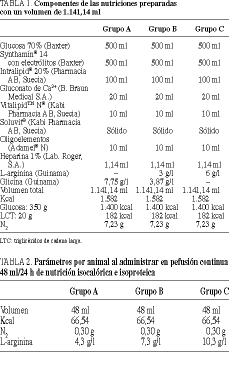
Los tres grupos recibieron, durante 7 días, nutrición parenteral isocalórica e isoproteica, con distintas concentraciones de L-arginina. La nutrición del grupo A, estándar, contenía 4,3 g/l de L-arginina suplementando los grupos B y C con 3 y 6 g/l (tabla 1). Las jeringas de nutrición se cambiaron diariamente tras la perfusión de 48 ml/día por animal (tabla 2) y los animales tuvieron libre acceso a la ingestión de agua.
Balance nitrogenado
La orina de 24 h se recogió diariamente y fue conservada en frascos con ClH 6 N y a 20 °C. Tras determinar la urea, se calculó en balance nitrogenado sin introducir ningún factor de corrección por pérdidas no cuantificables.
Reintervención
Las ratas de cada grupo fueron reintervenidas el séptimo día. Tras pesar y anestesiar al animal se realizó una laparotomía media en la que se valoró la existencia de complicaciones anastomóticas (dehiscencia, absceso, peritonitis, obstrucción). Se resecó un fragmento de colon de 2,5 cm incluyendo la anastomosis, con el que se realizaron estudios presivos, cuantificación de hidroxiprolina y valoración histológica de la cicatriz.
Presión de rotura
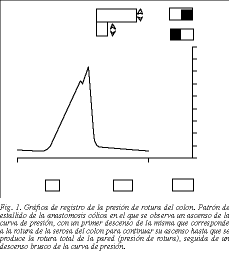
El segmento de colon seccionado se interpuso en el sistema detector de presiones. El extremo proximal se conectó a una bomba de perfusión continua (bomba de perfusión Harvard 975 para una jeringa), con la que se inyectaba suero fisiológico teñido con azul de metileno a 37 °C y a una velocidad constante de 8 ml/min. El extremo distal del colon se conectó a un transductor de presión (Sensor Nor 480) con amplificador de bioseñales (BIO-2000). Obtuvimos un registro gráfico (fig. 1) del aumento de presión hasta producir la rotura del colon, observándose la extravasación del colorante y si la rotura del colon fue anastomótica o extraanastomótica (fig. 2). Este registro se analizó en un ordenador Apple McIntosh dotado de tarjeta de adquisición de datos (NB-MIO-16L) y programa Lab-View II.
Estudio histológico
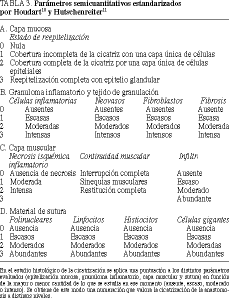
Separamos un fragmento de colon de 3 mm de ancho y 1 cm de longitud, que incluyó parte de la cicatriz de la anastomosis. El fragmento se fijó con formol al 10% y las preparaciones se tiñeron mediante la técnica estándar de hematoxilina-eosina. Para la evaluación del estado de cicatrización de las anastomosis utilizamos los parámetros semicuantitativos estandarizados por Houdart10 y Hutschenreiter11 (tabla 3). Todas la piezas fueron valoradas por el mismo patólogo.
Hidrólisis del segmento de colon y cuantificación de hidroxiprolina
Se tomó un segmento de 1 cm de longitud de la muestra resecada que incluyó la anastomosis en su zona medial. El segmento se pesó (peso del tejido húmedo) y se conservó a 20 °C en nitrógeno líquido. La hidrólisis de las piezas preservadas se realizó tras descongelación a temperatura ambiente, sumergiéndolas en 1 cm3 de ácido clorhídrico 6 N durante 3 h en autoclave a 130 °C. El hidrolizado resultante se neutralizó con hidróxido sódico 2,5 N, añadiendo gotas de metil rojo al 0,02% (C15 H15 N3 O3 ) como indicador de pH hasta obtener un color débilmente amarillo que equivale a un pH entre 6 y 7. Los ajustes finales se realizaron con ClH y NaOH diluidos. La dilución así obtenida se procesó según el método de Woessner12 y la absorbancia de estas soluciones se midió en el espectrofotómetro a 557 m µ .
Para conocer los resultados se construyó una curva patrón relacionando la concentración de hidroxiprolina y su absorbancia en el espectrofotómetro. Se prepararon 2 tubos con cantidades de 0 y 5 µ g/ml de hidroxiprolina (C5 H9 NO3) y 2 ml de estas soluciones se procesaron según el método de Woessner12. Trasladando los valores de la dilución a la curva patrón, obtuvimos las concentraciones de hidroxiprolina expresados en µ g/ml, y conociendo el volumen total de la solución y el peso del tejido obtuvimos la concentración de hidroxiprolina en el tejido ( µ g/mg de tejido húmedo).
Análisis estadístico
Se realizó análisis descriptivo, ANOVA de una vía, test de Newman-Keuls y análisis de regresión multivariante de las variables continuas (peso, balance nitrogenado, presión de rotura e hidroxiproliona). Además, se realizó la prueba de la * 2 para comprobar la relación entre las variables discretas (histología, lugar de estallido, complicaciones locales).
Resultados
Variables continuas
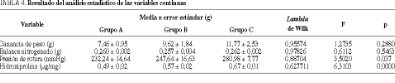
Peso, balance nitrogenado, presión de rotura e hidroxiprolina (tabla 4). Los animales pesaron entre 260 y 300 g al inicio de la experiencia, con un valor medio de 285,98 g. El 93,4% aumentaron su peso en el postoperatorio, con un valor medio de 295,03 g.
El incremento de peso fue mayor para los grupos que recibieron más concentración de L-arginina en la nutrición (C > B > A), pero sin diferencias significativas entre los tres grupos. Las medias de los balances nitrogenados recogidos a lo largo de los 7 días para cada animal fueron positivas y similares para los distintos grupos.
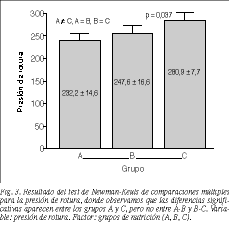
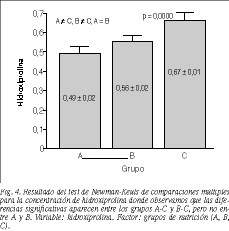
Los valores más altos para la presión de rotura los obtuvieron los animales del grupo C, seguidos del B y del A, con diferencias significativas entre los grupos A y C (p = 0,037) (fig. 3). La concentración de hidroxiprolina en la anastomosis también fue más elevada en los grupos con mayor concentración de L-arginina en la nutrición, con diferencias significativas entre los grupos A-C y B-C (p = 0,0000) (fig. 4).
En el análisis de regresión multivariante destaca la correlación significativa entre la hidroxiprolina con la presión de rotura (p = 0,000).
Variables discretas
Lugar de rotura, complicaciones e histología. La rotura del colon tuvo lugar mayoritariamente por fuera de la anastomosis (globalmente, 69,4%), siendo el grupo C el que presentó mayor número de roturas extraanastomóticas (85%), mientras que en los grupos A y B se produjeron en el 60 y 63,2%, respectivamente. Al realizar la prueba de la * 2 no aparece una relación significativa entre los grupos (p = 0,17567).
Se presentaron complicaciones en tres animales. Un animal del grupo B tuvo dehiscencia de la anastomosis y peritonitis difusa. Dos animales (grupo B y C) presentaron dilatación del colon proximal a la anastomosis. No se pudo demostrar relación significativa al aplicar el test de la * 2 de las variables (obstrucción, p = 0,59616; dehiscencia, p = 0,36170; peritonitis, p = 0,36170).
En la prueba de la * 2 del estudio histológico y los grupos de nutrición encontramos relación significativa con el grado de fibrosis (p = 0,04990), neovascularización (p = 0,00840) y reepitelización de la mucosa (p = 0,0005), pero no con el resto de las variables histológicas estudiadas. El grupo C presentó mayor fibrosis, es decir, la fibrosis intensa predominó en los animales del grupo C (45%), seguidos del B (21,1%) y del A (5,3%). La neovascularización intensa fue mayor en el grupo C (35%), seguidos del A y B (5,3 y 0%). La reepitelización completa predominó en el grupo C (35% de los animales) y en ningún animal de los grupos A y B.
Discusión
Peso y balance nitrogenado
El peso medio preoperatorio de nuestros animales fue de 285,98 ± 2,95 g, para los que se cifran necesidades de 31,45 kcal y 0,28 g de aminoácidos al día. Las necesidades nutritivas pueden llegar a ser un 40-100% más elevadas en situaciones catabólicas importantes13, por lo que las nutriciones administradas deben cubrir ampliamente las necesidades caloricoproteicas. Los tres grupos de nuestro estudio aumentaron de peso y la media del balance nitrogenado diario fue positiva y similar para los tres grupos, sin diferencias significativas entre ellos. De ello deducimos que las nutriciones administradas a los distintos grupos isocalóricas (66,54 kcal/rata/día) e isonitrogenadas (0,30 g N2/rata/día) fueron adecuadas para cubrir las necesidades, al igual que se desprende de otros trabajos experimentales que utilizan nutriciones parenterales con contenido caloricoproteico similar al de nuestra experiencia14-16.
Hidroxiprolina
La fuerza e integridad de todo tejido reparado reside en la síntesis y entrecruzamiento del colágeno. La hidroxiprolina es un aminoácido que se encuentra casi exclusivamente en el colágeno y supone un 14% de su peso, con lo que su determinación se convierte en un método indirecto para la valoración de la síntesis de colágeno.
Tanto en animales como en humanos4,5,17,18 se ha demostrado que la L-arginina estimula la síntesis del colágeno reparador y que existe una correlación entre la dosis de L-arginina y la acumulación de hidroxiprolina en heridas cutáneas3,5. De nuestros resultados se desprende que el efecto de la L-arginina también existe en la síntesis de colágeno en la cicatrización cólica, ya que encontramos una correlación significativa entre la dosis de L-arginina administrada y la concentración de hidroxiprolina de la anastomosis.
El mecanismo por el que aumenta la síntesis del colágeno en una herida cutánea por estímulo de la L-arginina no está claro4,19-21. Creemos, al igual que otros autores22,23 , que la L-arginina estimula la secreción de hormona del crecimiento y por esta vía se produce el aumento de la síntesis de colágeno en las anastomosis cólicas, como ha demostrado Christensen24,25. En esta misma línea, Harrison26 encuentra que la administración de hormona del crecimiento en animales sometidos a quimioterapia aumenta la síntesis de colágeno, la fuerza de rotura en la cicatriz y mejora la inmunidad respecto al grupo control. Petersen27 obtiene un aumento en la síntesis de colágeno y en la presión de rotura de las anastomosis cólicas con la administración de insulin-like growth factor.
Presión de rotura
En nuestro estudio determinamos la resistencia de la anastomosis cólica utilizado el método de la distensión de la luz intestinal in vitro28 (también aplicable in vivo29) puesto que refleja mejor la tensión en todos los puntos de la circunferencia de la pared intestinal (test multiaxial) que la fuerza por estiramiento (test uniaxial)30.
Realizamos la medición de la presión de rotura el séptimo día del postoperatorio y globalmente obtuvimos estallidos extraanastomóticos en el 69,4% de los casos. Nuestro grupo consideró significativa la diferencia de presión de rotura obtenida en favor del grupo C, puesto que al medir la resistencia de la pared cólica yuxtaanastomótica también obtenemos indirectamente la mayor o menor resistencia de la anastomosis. Es decir, mayor número de roturas extraanastomóticas indican más resistencia anastomótica.
De nuestros resultados puede deducirse que el efecto de la L-arginina no solamente produce un aumento tensil en la cicatriz de heridas cutáneas, sino también en la cicatriz del colon. El hecho de que en el grupo C, con mayor concentración de L-arginina, éstas estallen más por fuera de la anastomosis y que tenga una presión de rotura significativamente mayor respecto al grupo A puede explicarse por el aumento de la síntesis de hidroxiprolina que también es mayor en este grupo de forma significativa y en correlación con la presión de rotura, como se demuestra en el análisis de regresión multivariante. Estos hechos han sido observados también por otros autores, tanto con nuestro mismo método (multiaxial)7,31 como con metodología diferente (valorando la fuerza de rotura por estiramiento o test uniaxial)32,33.
Complicaciones de la anastomosis
El paso del bolo fecal por la anastomosis la somete a unos esfuerzos presivos que pueden ocasionar filtraciones entre los puntos de sutura y, como consecuencia, una reacción peritoneal local con formación de adherencias. Estas adherencias también pueden ser causa secundaria de una oclusión. La filtración anastomótica puede dar lugar a la formación de un absceso o, en ocasiones, si se produce una fuga importante e incontrolada provocar una peritonitis difusa.
Comprobamos que las adherencias de la zona anastomótica eran gruesas y de difícil separación, por lo que no fuimos excesivamente meticulosos en la liberación de alrededor de la línea de anastomosis con el fin de evitar la iatrogenia y reproducir más fielmente la resistencia anastomótica. A pesar de la extensión del cuadro adherencial no aparecieron cuadros oclusivos secundarios. La dilatación de colon proximal a la anastomosis que encontramos en dos animales pertenecientes a los grupos B y C, respectivamente, fue ocasionada por el edema producido al manipular los bordes de la anastomosis y por una cicatrización muy inflamatoria, pero no por el cuadro adherencial.
El efecto del bolo fecal en la anastomosis puede ser el responsable del mayor número de adherencias y complicaciones31,34,35. El análisis independiente de la obstrucción, dehiscencias, abscesos y peritonitis no alcanzó significación estadística, posiblemente porque a todos los animales se les realizó una limpieza preoperatoria del colon y fueron alimentados con nutrición parenteral en el postoperatorio inmediato, evitando la acción del bolo fecal en la anastomosis.
Histología
La mayor parte de los conceptos del proceso de cicatrización han derivado de las observaciones en heridas de piel, y parece ser que el patrón básico de cicatrización (inflamación, migración, proliferación y remodelación) es similar en todos los tejidos. En la anastomosis cólica, con el tiempo, la población de neutrófilos se sustituye gradualmente por macrófagos, que permanecen como la población celular predominante hasta ser sustituidos por los fibroblastos de la submucosa del borde de sección cólica, que pronto se dividen y migran al área lesionada. Botones capilares inician su desarrollo derivados de vasos preexistentes e invaden el tejido de granulación. Este proceso continúa hasta la unión de los dos márgenes de la herida, dejando una cicatriz conjuntiva bien vascularizada36.
Como hemos señalado, se observa mayor fibrosis en el grupo con mayor concentración de L-arginina y, sin embargo, no aparece una relación significativa entre los distintos grupos y la cantidad de fibroblastos en la cicatriz. En estudios ultraestructurales mediante microscopia electrónica en la cicatriz se han observado fibroblastos con diferentes estructuras citoplasmáticas en el tejido de granulación. Este hecho se interpretó como expresión de un relevo funcional de estas células en el proceso reparativo, coexistiendo células en reposo con células en actividad de síntesis proteica (ergastoplasma desarrollado) y otras que parecen poner de manifiesto un agotamiento funcional (vacuolización citoplásmica)36. Esto podría explicar cómo la mayor fibrosis encontrada en nuestro estudio no se correlaciona con un aumento significativo de los fibroblastos y podría ser un aumento funcional de los mismos la causa de la mayor síntesis de colágeno y, por tanto, de la fibrosis encontrada. Hay estudios que implican fuertemente al metabolismo de la arginina (óxido nítrico y ornitina) como un importante regulador de la síntesis de colágeno en el fibroblasto37 .
Al estudiar los neovasos y la epitelización mucosa observamos una relación significativa con la concentración de L-arginina. Este hallazgo histológico, junto con otros trabajos en los que se demuestra que la L-arginina no influye directamente en la epitelización3, apoyarían la teoría de que las anastomosis cólicas cicatrizan por segunda intención y que la mucosa crece sobre un tejido de granulación recién formado. Por consiguiente, hasta que no aparezca el tejido de granulación, la mucosa no epitelizará la lesión.
De nuestros resultados se desprende, por tanto, que la L-arginina estimula la cicatrización de una anastomosis cólica, por estímulo directo o indirecto de la angiogénesis y los fibroblastos.
Como comentario final podemos concluir que el suplemento de L-arginina en la nutrición parenteral de ratas Wistar mejora la cicatrización de las anastomosis cólicas al aumentar de forma significativa la síntesis de hidroxiprolina, la presión de rotura, la fibrosis, la angiogénesis y la epitelización de la anastomosis.