Introducción. La infección en presencia de materiales protésicos altera el proceso de integración y cicatrización tisular de los mismos, originando alteraciones importantes en el receptor que a veces condicionan el recambio obligado de la prótesis. El objetivo del presente trabajo ha sido estudiar el comportamiento in vitro de algunos gérmenes bacterianos: Staphylococcus aureus y Staphylococcus epidermidis en presencia de cultivos de fibroblastos y un biomaterial de polipropileno.
Material y métodos. Se emplearon fibroblastos procedentes de biopsias de piel de pacientes sometidos a procedimientos quirúrgicos reglados. Los fragmentos de piel, previa inclusión en MEM, fueron cortados en pequeños explantos y colocados en frascos Roux de cultivo de 25 cm2 que contenían 3 ml de medio Biomaf-2, e incubados a 37 °C en un ambiente con el 5% de CO2. Los fibroblastos fueron desprendidos de la superficie de cultivo mediante tratamiento enzimático con una solución de tripsina/EDTA al 1% en solución Hank's (HBSS) y subcultivados en placas de 4 pocillos a razón de 1 * 105 células/pocillo. Se diseñaron dos grupos de estudio. Grupo I: fibroblastos en cultivo, en contacto directo con un fragmento de polipropileno de 1 cm2, contaminando el cultivo con S. aureus y S. epidermidis. La carga microbiana empleada fue de 1 * 108 UFC/ml. Los cultivos fueron mantenidos en estas condiciones durante 7 días; grupo II: un fragmento de polipropileno en un medio contaminado con S. aureus y S. epidermidis, realizando el estudio de las muestras a 30 días, a microscopia óptica y electrónica de barrido (SEM).
Resultados. A los 7 días poscontaminación se observaron diferencias significativas en las curvas de crecimiento en la población sometida a presencia bacteriana. Sin embargo, entre las poblaciones de S. aureus y S. epidermidis se observó una mayor tasa de muerte celular para S. aureus, existien do una tasa de mortalidad en torno al 50% de la población total. Mientras que para S. epidermidis dicha tasa no superaba el 20%. En el grupo II, a los 30 días poscontaminación se observó presencia de bacterias en las zonas de entrecruzamiento de los filamentos de polipropileno, observando sobre ellas la formación de microcolonias y algunos biofilms.
t; face="Arial, Helvetica, sans-serif"> Conclusiones. De los estudios in vitro realizados podemos afirmar: a) la contaminación por S. aureus y S. epidermidis disminuye en presencia de polipropileno la curva de crecimiento de los fibroblastos; b) la mortalidad celular ha sido significativamente mayor en presencia de S. aureus, mientras que S. epidermidis inhibe la división celular, y c) no se observaron cambios estructurales en las prótesis de polipropileno por acción de los gérmenes.
Introduction. When infection develops in the presence of prosthetic materials, it alters the process of their integration and tissue repair, producing considerable changes in the recipient that may make it necessary to replace the prosthesis. The objective of the present report was to study the behavior in vitro of Staphylococcus aureus and S. epidermidis in the presence of cultured fibroblasts and the biomaterial polypropylene (PL).
Patients and methods. The fibroblasts were obtained from skin biopsies performed in patients undergoing elective surgery. The skin specimens were embedded in MEM, cut into small explants, placed into 25 cm2 tissue culture flasks containing 3 ml of Biomaf-2 medium and incubated at 37 ºC in a 5% CO2 atmosphere. The fibroblasts were detached from the culture surface enzymatically using a 1% trypsin/EDTA solution in Hanks' solution (HBSS) and subcultured on 4-well plates at a density of 1 * 105 cells/well. Two study groups were set up. Group I consisted of fibroblasts cultured in direct contact with a 1 cm2 fragment of PL in media contaminated with S. aureus or S. epidermidis at a bacterial load of 1 * 108 CFU/ml. The cultures were maintained under these conditions for 7 days. In group II, fragments of PL were cultured in media contaminated with S. aureus or S. epidermidis. The samples were studied 30 days later under light microscopy and scanning electron microscopy (SEM).
Results. Seven days after contamination, the growth curve of the population exposed to the bacteria showed significant differences. When the fibroblasts cultured in the presence of S. aureus and S. epidermidis were compared, the rate of cell death was greater in the former subgroup, where the mortality rate was approximately 50% of the total population versus a maximum of 20% in those exposed to S. epidermidis. In group II, the studies carried out 30 days after contamination revealed the presence of bacteria in the regions of crosslinking of the PL filaments. The formation of microcolonies and some biofilms on them was also observed.
Conclusions. These in vitro studies show that: a) in the presence of PL, contamination by S. aureus and S. epidermidis interfered with the growth of fibroblasts; b) the rate of cell death was significantly greater in the presence of S. aureus
Introducción
Uno de los problemas más importantes y de mayor trascendencia tras el implante de materiales protésicos es la aparición de infección como complicación postoperatoria. En procedimientos de cirugía limpia, como puede ser la colocación de una prótesis para la reparación de procesos herniarios en la pared abdominal, la incidencia actual de infección se sitúa en un 1-2% de todos los implantes1.
La infección en presencia de materiales protésicos altera el proceso de integración tisular de los mismos y, por ello, interfiere en los mecanismos de reparación tisular, originando alteraciones importantes en el receptor que a veces conducen a la recidiva herniaria y al recambio obligado de la prótesis.
La adhesión de las bacterias a la superficie de los biomateriales es un paso importante en la patogenia de la infección2.
Los mecanismos de adhesión bacteriana a los biomateriales son complejos y todavía no se conocen. Se sabe que existe una primera fase inicial física y reversible y una segunda fase celular y molecular que es irreversible3. Es en esta fase donde las reacciones moleculares entre estructuras de la superficie bacteriana y la superficie del biomaterial llegan a ser dominantes.
Dada la importancia de esta segunda fase, el propósito del presente trabajo ha sido estudiar el comportamiento in vitro de algunos gérmenes bacterianos de mayor prevalencia en cuanto a contaminación de materiales protésicos, Staphylococcus aureus y Staphylococcus epidermidis en presencia de cultivos de fibroblastos, por tener estas células un papel relevante en el proceso cicatrizal, y de uno de los biomateriales empleados con más frecuencia en la clínica humana, como es el polipropileno. Con ello hemos pretendido conocer los mecanismos íntimos de actuación de los gérmenes, primero sobre una población celular, y luego sobre el mencionado biomaterial.
Material y métodos
Obtención y cultivo de los fibroblastos
Se utilizaron muestras de piel de pacientes voluntarios sin ninguna enfermedad de base que fueron extraídas en el transcurso de procesos quirúrgicos reglados. Estas muestras fueron transportadas al laboratorio en condiciones de máxima esterilidad, sumergidas en Minimal Essential Medium (MEM) (Gibco) suplementado con un 10% de una solución de antibiótico/antifúngico. Los fragmentos de piel fueron cortados en pequeños explantos y colocados en la superficie de cultivo de frascos Roux de 25 cm2 que contenían 3 ml de medio BIOMAF-2 (Reactiva SA). Los cultivos celulares fueron incubados a 37 °C en un ambiente con un 5% de CO2. Tras la formación de una monocapa celular, las células fueron desprendidas de la superficie mediante tratamiento enzimático con una solución de tripsina/EDTA al 1% en solución de Hank's (HBSS) (Gibco) y subcultivada en placas de 4 pocillos a razón de 1 * 105 células/pocillo.
Biomateriales y contaminación bacteriana
A las 48 h de realizado el subcultivo celular, pequeños fragmentos de prótesis de 1 cm2 de superficie de polipropileno (Surgilene®) (B. Braun-Dexon) fueron puestos en contacto con la monocapa fibroblástica formada y mantenidos en esta situación durante 3 días.
Al cabo de este tiempo, los cultivos fueron contaminados con S. aureus y S. epidermidis. La carga microbiana utilizada fue de 1 * 108 UFC/ml. Los cultivos en esta situación fueron mantenidos durante 7 días.
En otro grupo, el polipropileno fue colocado desde un inicio en un medio contaminado con las mencionadas bacterias y mantenido durante 30 días con la finalidad de observar los efectos directos de los gérmenes sobre la estructura protésica.
Crecimiento y recuento celular
El control del crecimiento celular se llevó a cabo mediante sucesivos recuentos en cámara Neubauer. Para ello, y una vez desprendidas las células de la superficie del frasco, se centrifugaron a 200 g durante 7 min. El pellet celular se resuspendió en 1 ml de medio de cultivo. A continuación se tomó una alícuota de 20 µ l de suspensión celular y se mezcló bien con 180 µ l de azul tripán al 0,2%, pasando a realizar el recuento en una cámara Neubauer observando el número de células viables, que se expresan en número de células/ml. Estos recuentos se efectuaron diariamente con el fin de cuantificar la influencia de la infección microbiana sobre el crecimiento normal de los fibroblastos. A los 7 días se efectuó el último recuento determinando la tasa de mortalidad celular, que se expresó como el porcentaje de células muertas (teñidas de azul por acción del azul tripan) respecto al número total de células presentes en cada uno de los cultivos (células muertas + células vivas).
Estudio morfológico de las prótesis: microscopia óptica y electrónica de barrido
Para el estudio a microscopia óptica, las muestras fueron fijadas en formol al 10%, incluidas en parafina, y cortadas en secciones de 8 µ . Las tinciones empleadas fueron hematoxilina-eosina y tricrómico de Masson (variante Goldner-Gabe).
Para el estudio a microscopia electrónica de barrido (scanning), las piezas fueron fijadas en glutaraldehído al 3% y conservadas en tampón Milloning (pH 7,3), hasta ser deshidratadas mediante el paso por una serie de acetonas de gradación creciente. El punto crítico se realizó en un Polaron E-3000 con CO2, se metalizaron con oro paladio y fueron observadas en un microscopio electrónico de barrido Zeiss DSM-950.
Identificación bacteriana
Pequeños fragmentos de polipropileno contaminados fueron fijados al 10%, deshidratados en una serie gradual de alcoholes y embebidos en parafina. Se empleó una coloración de Gram para cortes histológicos4, tiñendo las muestras en pasos sucesivos con hematoxilina de Harris, violeta de genciana y clorhidrato de Rosanilina.
Diseño experimental (fig. 1)
Se establecieron dos grupos genéricos de estudio: grupo I y grupo II.
En el grupo I se pusieron en contacto los biomateriales con los cultivos de fibroblastos y los gérmenes bacterianos, estableciéndose así 4 subgrupos:
Ia: cultivo de fibroblastos.
Ib: cultivo de fibroblastos + polipropileno.
Ic: cultivo de fibroblastos + polipropileno + S. aureus.
Id: cultivo de fibroblastos + polipropileno + S. epidermidis.
Los tiempos de estudio para la realización de la curva de crecimiento fueron:
t0: realización del primer subcultivo para determinar el número inicial de células.
t48h: momento en el que se pone en contacto el material protésico con los fibroblastos.
t5d: contaminación de los medios de cultivo.
t12d: tiempo final de estudio, determinándose la tasa de mortalidad celular poscontaminación.
En el grupo II se colocaron los biomateriales en contacto directo con un medio ya contaminado, estableciéndose los siguientes subgrupos:
IIa: polipropileno + S. epidermidis.
IIb: polipropileno + S. aureus.
El tiempo de estudio de los biomateriales se efectuó a los 30 días.
Análisis estadístico
Las curvas de crecimiento, así como la tasa de mortalidad celular, fueron analizadas estadísticamente mediante la utilización del test de la U de Mann-Whitney para datos no apareados.
Resultados
Grupo I
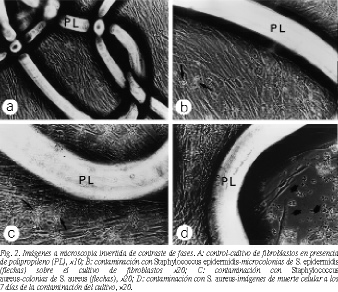
Cultivo de fibroblastos. El comportamiento de los fibroblastos en cultivo fue normal durante todo el tiempo de estudio, manteniendo una morfología típica de células alargadas con núcleos ovalados y centrados. No hubo cambios con la presencia de los biomateriales (fig. 2A).
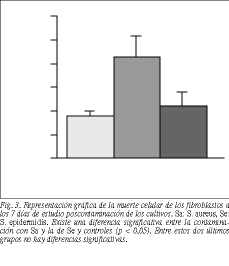
Tras la contaminación con S. aureus, a las 24 h comenzaron a aparecer pequeñas colonias en forma de racimo por toda la superficie de cultivo, sin que éstas llegaran a afectar al comportamiento y la morfología normales de los fibroblastos. Sin embargo, a las 48 h se observó un aumento tanto en el número como en el tamaño de las colonias, coincidiendo con la aparición de pequeñas zonas de muerte celular alternando con grandes áreas en las que la monocapa presentaba una morfología normal (figs. 2B y C). En los días siguientes este hecho se incrementó, y a los 7 días poscontaminación se observó que aproximadamente un 50% de la superficie de cultivo presentaba signos de muerte celular (fig. 2D). Cuando la contaminación se realizó con S. epidermidis la viabilidad de los fibroblastos no llegó a afectarse, apareciendo un 20% aproximadamente de mortalidad (fig. 3).
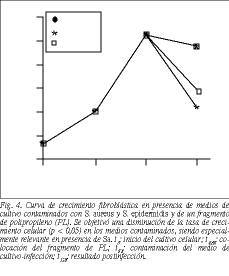
Curva de crecimiento. Hasta el momento de la contaminación no se observaron cambios en la curva de crecimiento. A los 7 días poscontaminación los cambios fueron muy evidentes. En comparación con la curva de inicio, los cultivos contaminados con S. aureus y S. epidermidis presentaron una disminución estadísticamente significativa (p < 0,05) en su crecimiento, siendo esta diferencia muy pronunciada cuando los cultivos estaban contaminados con S. aureus (fig. 4).
Grupo II
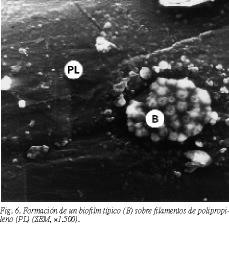
S. aureus se deposita en forma de microcolonias en las zonas de intersección de los filamentos del polipropileno. En ocasiones se observan las bacterias infiltradas en pequeñas muescas o hendiduras del biomaterial (fig. 5). También hemos observado, a veces, formación de biofilms sobre el filamento de la prótesis (fig. 6).
Discusión
La infección de los materiales protésicos es una grave complicación que conlleva una nada despreciable morbilidad, e incluso mortalidad cuando los implantes están por ejemplo en contacto con el territorio sanguíneo en forma de prótesis vasculares.
La ausencia de integración de un biomaterial en un receptor constituye en muchas ocasiones la alarma de presencia de infección en el lugar del implante. Los gérmenes interfieren dicha integración por la tendencia natural a adherirse a múltiples tipos de superficies como mecanismo de supervivencia.
En la primera parte de nuestro estudio hemos podido comprobar la patogenicidad de algunos microorganismos, como S. aureus, sobre poblaciones de fibroblastos en cultivo. En presencia de este germen, la mortalidad celular a los 7 días poscontaminación alcanzó el 50%. Sin embargo, cuando la contaminación procedía de S. epidermidis sólo se vio afectada la división celular, ya que la mortalidad fue significativamente inferior (un 20% aproximadamente). De acuerdo con Henke et al5, los parámetros de crecimiento y de mortalidad celular en presencia de biomateriales estaría, por tanto, desde este punto de vista correlacionado con algún producto bacteriano. El tipo de biomaterial no tendría ninguna influencia. Los mediadores bacterianos que interfieren en el crecimiento o provocan mortalidad celular son desconocidos. Se sabe, por estudios in vivo, que los componentes en forma de peptidoglicanos de la pared bacteriana pueden activar la respuesta en el receptor originando liberación de TNF * e IL-66,7.
Otro aspecto importante en relación con la estructura bacteriana es la adhesión bacteriana a los biomateriales generada a través de la formación de biofilms. Éstos consisten en microcolonias altamente organizadas y dotadas de heterogeneidad funcional8. Las bacterias se protegen con estos biofilms y escapan a la actuación de los macrófagos, haciéndose así resistentes a los antibióticos. Algunas bacterias dentro del biofilm pueden secretar un biofilm fenotípicamente distinto y protector, lo que puede actuar como una respuesta genéticamente reprogramada para crecer sobre una superficie. Aun en individuos con excelente respuesta inmunológica, las infecciones con biofilms raramente se resuelven por los propios mecanismos de defensa del receptor. La antibioterapia puede revertir síntomas de infección causados por las bacterias liberadas del biofilm, pero fracasa en la eliminación del mismo. Por esta razón, las infecciones típicas de biofilm se manifiestan con síntomas recurrentes después de ciclos de terapia antibiótica. La única forma de erradicar la infección en muchos de estos casos es la eliminación quirúrgica del biofilm, para lo que obviamente se hace necesario sustituir el implante9. Otro hecho importante es que el biofilm sirve también para que la bacteria permanezca en un estado silente, a la espera de que los mecanismos defensivos del receptor disminuyan, con lo que aparecerá una infección en el biomaterial. Esto explicaría la aparición tardía de algunas infecciones en pacientes portadores de biomateriales, con intervalos incluso de años después del implante10.
En el grupo II de nuestro estudio hemos corroborado la existencia de estos biofilms en presencia de prótesis de polipropileno. Sin embargo, estudios clínicos han demostrado la buena tolerancia de este biomaterial en presencia de infección11. En nuestro estudio a 30 días no hemos observado alteraciones en los propios filamentos de polipropileno. Por el contrario, con el empleo de otros biomateriales, como el politetrafluoroetileno expandido (PTFE), nuestro grupo ha demostrado, tras implantes clínicos y experimentales, que los cambios estructurales generados en las prótesis de PTFE son tan importantes que en la mayoría de los casos el recambio protésico es la norma12.
De los estudios in vitro realizados podemos concluir afirmando que: a) la contaminación por S. aureus y S. epidermidis disminuye, en presencia de polipropileno, la curva de crecimiento de los fibroblastos; b) la mortalidad celular ha sido significativamente mayor en presencia de S. aureus, mientras que la acción de S. epidermidis sería inhibir la división celular, y c) no hemos observado cambios estructurales en las prótesis de polipropileno por acción de los gérmenes.
Agradecimiento
Agradecemos a la empresa B. Braun-Dexon que nos facilitara las prótesis de polipropileno.