El empleo de materiales protésicos para tratar enfermedades de la pared abdominal y/o torácica ha resuelto, en gran medida, el problema creado por el defecto tisular y las complicaciones de recidiva. Clásicamente, el más empleado ha sido el polipropileno en forma de prótesis reticular. Este material, con una biocompatibilidad óptima, está sufriendo modificaciones, encaminadas a conseguir la mejor adaptación posible al tejido receptor y mantener las mejores propiedades funcionales en el lugar del implante. De esta forma, las prótesis clásicas denominadas de alta densidad están siendo sustituidas por otras más ligeras (de baja densidad), con una configuración espacial sencilla y un poro más amplio. Las prótesis de baja densidad mantienen su elasticidad, lo que genera menos fibrosis y rigidez tras el implante. De cualquier forma, son necesarios estudios que consigan una densidad de material y un tamaño de poro ideales, dos parámetros que condicionan el comportamiento de dichos biomateriales.
The use of a prosthetic material to treat abdominal and/or thoracic disease has, to a great extent, resolved the problem created by the tissue defect itself and complications of recurrence. The most commonly used of these materials has been polypropylene in the form of a reticular mesh. This biomaterial, which boasts optimal biocompatibility, has been the object of constant modification aimed at better adapting it to the functional needs of the host tissue. Hence, the classic prostheses, nowadays known as heavyweights, are being gradually replaced by lighter materials with a simple spatial configuration and, more importantly, with a larger pore size (lightweight prostheses). Lightweight meshes are able to preserve abdominal wall compliance by generating less post-implant fibrosis and rigidity. However, further studies are still needed to achieve the ideal balance between material density and pore size. These two factors will determine the behaviour of these new prosthetic designs.
Uno de los biomateriales más ampliamente utilizados para la reparación de defectos en la pared abdominal es el polipropileno, en forma de prótesis reticular o macroporosa. Su uso se remonta históricamente a la mitad del siglo pasado, cuando Usher1,2 lo empleó en las primeras reparaciones herniarias.
A lo largo del tiempo su utilización se ha ido generalizando, y es uno de los mejores biomateriales para tratar defectos de tejido/tejido, incluso cuando hay infección3,4. Es de los pocos materiales con el cual es posible el «rescate parcial» de la prótesis cuando surge esta complicación5,6. El único inconveniente que tiene el polipropileno es su mal comportamiento en la interfaz peritoneal. Así, se han descrito complicaciones, como fistulizaciones a intestino7 y emigraciones a órganos cavitarios8. Por ello, su empleo en esta interfaz debe evitarse.
Estudios efectuados in vitro9 han demostrado la bioestabilidad del polipropileno. In vivo, en muestras de implantes procedentes de pacientes intervenidos, recientemente se han descrito procesos de oxidación que pueden afectar a este material con una leve biodegradación, solamente visible con microscopia electrónica de barrido10. A pesar de ello, la resistencia mecánica del polipropileno permanece inalterable a lo largo de los años.
Actualmente, las prótesis reticulares de polipropileno clásicas tipo Marlex® (Bard, New Jersey, Estados Unidos) están sufriendo modificaciones, en el sentido de generar prótesis con menor cantidad de material, al crear poros mas amplios con una menor reordenación espacial de los filamentos. En la terminología empleada por el grupo de Schumpelick11, serían prótesis de poro amplio y, por ello, con menos material para su fabricación, también denominadas de baja densidad o bajo peso o, empleando la terminología anglosajona, tipo lightweight.
De esta forma, y según el parámetro g/m2 indicativo del peso protésico, las prótesis reticulares se clasifican en prótesis de alto peso (heavyweight) (HW) y de bajo peso o baja densidad (lightweight) (LW)12,13. Se consideran prótesis HW aquellas que se sitúan por encima de 80g/m2, y LW las que se encuentran por debajo de esta cifra. Recientemente se han incluido en la clasificación las prótesis de media densidad (mediumweight), cuyo peso se situaría entre 50 y 80g/m2; entonces las LW están entre 35 y 50g/m2, y un último tipo, denominado de muy baja densidad (ultra-lightweight), que estaría por debajo de 35g/m2 (fig. 1 y tabla 1).
A: prótesis de polipropileno convencional (HW), Surgipro® (Covidien, Mansfield, Estados Unidos), con una densidad de 84g/m2 y pequeño tamaño de poro (0,26±0,03mm2). B: Parietene® (Covidien, Mansfield, Estados Unidos) (LW), de 38g/m2 de densidad y un tamaño de poro de 1,15±0,05mm2. C: Optilene elastic® (B/Braun, Spangerwerg, Alemania) (LW), con una densidad de 48g/m2 y amplio tamaño de poro (7,64±0,32mm2). D: prótesis parcialmente absorbible, Ultrapro® (Ethicon, Johnson & Johnson, Somerville, Estados Unidos) (LW), formada por polipropileno y filamentos de poliglecaprona-25 con una densidad de 28g/m2 y un tamaño de poro 3,45±0,19mm2. E: prótesis con filamentos absorbibles de poliglactina, Vypro II® (Ethicon, Johnson & Johnson, Somerville, Estados Unidos) (LW) con una densidad de 35g/m2 y un tamaño de poro de 4,04±0,54mm2.
Clasificación del material protésico según su densidad
| Heavyweight >80g/m2 |
| Mediumweight, 50–80g/m2 |
| Lightweight, 35–50g/m2 |
| Ultralightweight <35g/m2 |
Modificado de Earle et al13.
Algo que hay que tener en cuenta es que, a veces, el peso protésico es independiente del tamaño del poro. Ello es debido a que hay prótesis con un diseño de poro pequeño, con una estructura espacial y un anudado o entrecruzamiento simples y, a su vez, un filamento fino; se considera que éstas son de baja densidad por tener, en su conjunto, un peso bajo en g/m2.
Este último aspecto es importante ya que, de acuerdo con la escuela alemana14,15, nosotros consideramos que el tamaño de poro protésico es el principal parámetro para catalogar una prótesis como de alto o bajo peso o, lo que es lo mismo, como de alta o baja densidad. Según este concepto, las prótesis de baja densidad tendrían que tener siempre un poro amplio.
Otra modificación a la cual han sido sometidas las prótesis reticulares de polipropileno ha sido la creación de prótesis híbridas o parcialmente degradables16,17. Éstas, además del polipropileno en su estructura, llevan elementos poliméricos biodegradables. Estas prótesis, todas ellas de baja densidad, se caracterizan porque parte de sus componentes se degradan a medio/largo plazo, y queda una menor cantidad de material residual en el tejido receptor.
Por lo tanto, de una forma genérica, las prótesis de bajo peso o baja densidad podrían estar formadas solamente por polipropileno o bien por este polímero y otro biodegradable.
Objetivos de las prótesis de baja densidad y posibles ventajas de su empleoSon, fundamentalmente, reducir la cantidad de material extraño que queda implantado en el huésped y generar la menor fibrosis posible de los tejidos receptores, sin que por ello se produzca un deterioro de la resistencia mecánica.
Aunque hay variaciones individuales en cuanto al proceso reparativo tras el implante de este tipo de materiales18, no cabe duda de que la fibrosis generada por las prótesis convencionales de alta densidad se vería disminuida con el implante de prótesis de baja densidad. No debemos olvidar que la pared abdominal funciona como un sistema dinámico, y está sometida a cambios agudos de presión (tos, vómito, etc.) o mantenidos (obesidad, embarazo, etc.)19,20. Por todo ello, después de la colocación de un material protésico, debe quedar una cierta distensibilidad que permita una movilidad no restrictiva de la pared14,21, en una palabra, la pared abdominal después de un implante debe mantener una función lo más fisiológica posible.
Experiencia investigadoraInvestigación experimentalLos primeros ensayos experimentales fueron realizados por Klinge et al22, en 1998, con una prótesis híbrida de polipropileno y poliglactin, que posteriormente saldría comercializada con el nombre de Vypro® (Ethicon, Johnson & Johnson, Somerville, Estados Unidos). En este primer bioensayo, estos autores demostraron una menor reacción inflamatoria en los implantes, así como una mejor integración elástica.
Esto producía una mejor adaptación a la pared abdominal, ya que permitía mantener su distensibilidad. En este trabajo inicial, se puso en evidencia que las prótesis LW debían tener, además de poco material, un tamaño de poro amplio.
En 2001, Greca et al23, con el empleo del perro, como animal de experimentación, pudieron demostrar que una prótesis de amplio poro, diseñada por ellos mismos, inducía un depósito de colágeno I superior al implante de una prótesis de polipropileno convencional. Desde el punto de vista biomecánico, no encontraron diferencias entre ambas.
Posteriores trabajos, también de la escuela alemana15,16, demuestran que el poro grande evita el denominado fenómeno «bridging effect», que se produce en prótesis de pequeño poro (<1mm). Este comportamiento es la causa de la fibrosis y la rigidez cicatrizal que puede encontrarse tras el implante de este tipo de prótesis. Algunas prótesis consideradas como LW con poro pequeño, ya que tiene un peso bajo en g/m2, se comportan, desde un punto de vista de integración tisular, como prótesis HW. Realmente, y de acuerdo con Klinge24, este tipo de prótesis produce confusión en el concepto de baja y alta densidad. Así, en algunos trabajos25, ha dado lugar a que, debido a este comportamiento peculiar, no se hayan valorado los implantes de prótesis LW de una forma ventajosa respecto a implantes efectuados con prótesis convencionales HW.
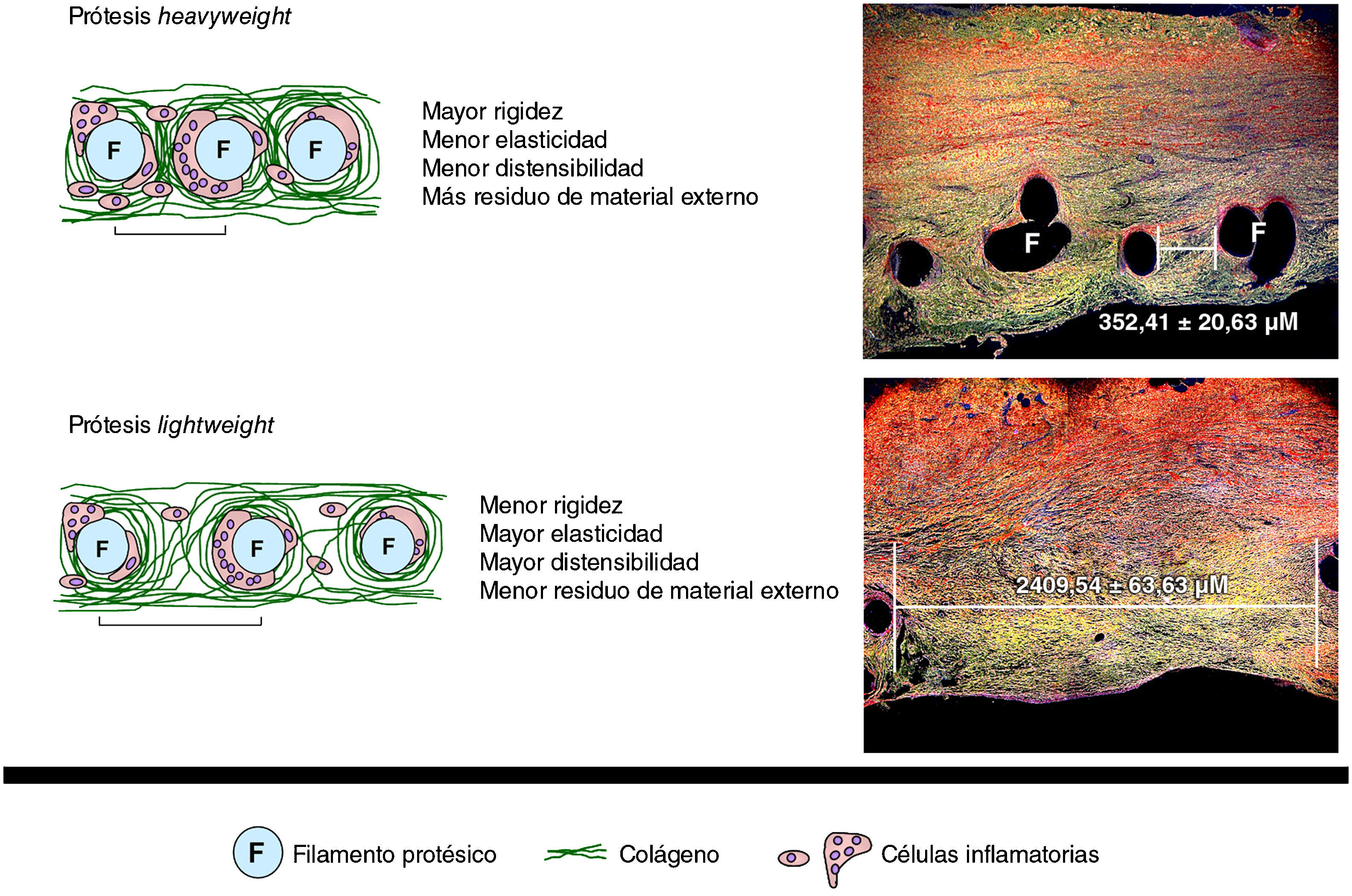
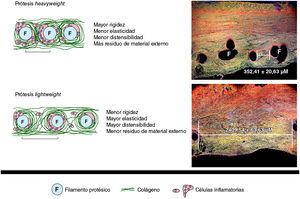
Trabajos experimentales desarrollados por nuestro grupo han podido demostrar un similar comportamiento biomecánico al comparar prótesis HW y LW parcialmente absorbibles26. De acuerdo con otros autores17, el comportamiento biológico de estas prótesis parcialmente absorbibles es excelente. También recientemente hemos demostrado27, tras el empleo de técnicas de biología molecular, el depósito precoz de colágeno en prótesis LW, sin modificaciones en el comportamiento biomecánico respecto a prótesis HW (fig. 2).
Representación esquemática del proceso de cicatrización en las prótesis HW y LW. A: proceso de cicatrización en una prótesis de tipo HW, con pequeña distancia entre los filamentos protésicos (F) tras 14 días del implante (rojo sirio, ×50). B: prótesis LW, en la que puede apreciarse una mayor distancia entre los filamentos, al mismo tiempo de estudio (rojo sirio, ×50).
El empleo de prótesis LW en clínica todavía no ha superado el tiempo suficiente de seguimiento que requieren estos implantes. De hecho, hay discrepancias en cuanto a resultados. Algunos estudios retrospectivos28 han señalado las ventajas de estas prótesis, aunque otros estudios de tipo prospectivo, con seguimiento corto (1 año, aproximadamente)29,30, han señalado una mayor incidencia de recidivas tras el empleo de este tipo de material protésico.
Akolekar et al31, aunque no encuentran diferencias en cuanto a la aparición de recidivas con el empleo de HW y LW, sí recomiendan la fijación de las prótesis LW sobrepasando ampliamente los márgenes del defecto. Probablemente, la fijación de las prótesis LW con poros muy amplios a los bordes del defecto requiera un cuidado especial, ya que es necesario sobrepasar ampliamente dichos bordes. En este sentido, es interesante un reciente trabajo experimental publicado por Binnebösel et al32, que demuestran, en un modelo in vitro, la necesidad de sobrepasar con la prótesis, por lo menos, 3cm el borde del defecto.
Otros autores28,33–37 relacionan los resultados clínicos de las prótesis LW con el bienestar del paciente y el dolor postoperatorio. Éste parece ser menor en los pacientes con implantes LW, especialmente si son del tipo parcialmente absorbibles (Ultrapro®, Ethicon, Johnson & Johnson, Somerville, Estados Unidos).
Los ensayos clínicos que emplean prótesis LW pretratadas con titanio38 no han mostrado diferencias, en cuanto a recidivas, con relación a prótesis convencionales de polipropileno, si bien el seguimiento no superó el año.
Por este motivo, los resultados clínicos deberían ser evaluados a más largo plazo, con el fin de establecer las ventajas finales de las prótesis tipo LW.
¿Hay razones biomecánicas para defender el uso de prótesis de baja densidad?Considerando la cavidad abdominal como un cilindro, y según el principio de hidrostática de Pascal, la máxima carga para su rotura estaría entre 11N/cm y 27N/cm. Las presiones abdominales oscilan entre 8 y 150mmHg19. Klinge et al39 demostraron que las prótesis de alta densidad pueden soportar hasta 10 veces más estas tensiones de rotura. Por ello, las prótesis HW están muy por encima de la propia resistencia de la pared abdominal. Ello podría explicar que después de su implante hubiera menos elasticidad en el tejido natural, ya que la incorporación del tejido a la propia prótesis crearía una incongruencia de resistencias entre el tejido receptor y el biomaterial integrado en él. Desde el punto de vista mecánico, sería innecesario el implante de un material que tuviera que soportar cargas de rotura muy por encima de las exigibles. Por ello, sería más razonable el implante de materiales con una menor resistencia a la rotura y con una mayor elasticidad40. Este parámetro lo cumplen las prótesis LW. En trabajos experimentales tras el implante de prótesis LW, frente a HW, hemos podido determinar que no hay diferencias de resistencia mecánica a la rotura a los 90 días del implante entre LW y HW, incluso en prótesis LW parcialmente absorbibles26.
Perspectivas de futuroAun siendo el polipropileno uno de los polímeros con mejor biocompatibilidad, integración tisular, tolerancia a la infección y resistencia mecánica, todavía faltan estudios que, de alguna forma, consigan la prótesis ideal de polipropileno, es decir, aquella que, con la menor cantidad de residuo, obtenga finalmente la mejor resistencia mecánica. Probablemente la solución óptima se obtenga determinando el tamaño de poro idóneo, con una correcta disposición espacial de los filamentos y, de esta forma, conseguir la prótesis que mejor se adapte a las necesidades de los pacientes. No debemos olvidar que la pared del abdomen funciona como una estructura dinámica y que el objetivo final en el proceso reparativo será conseguir una adaptación total de la prótesis al tejido receptor.
Conflicto de interesesEl autor declara no tener ninguna clase de afiliación o intereses de carácter económico con ninguna de las organizaciones comerciales proveedoras de los biomateriales descritos en esta revisión.