El hamartoma pancreático (HP) constituye menos del 1% de todos los hamartomas. Está compuesto por células acinares, insulares y ductales desorganizadas1,2. Dada su escasa incidencia es complicado diferenciarlo de otros tumores benignos o malignos de bajo grado, siendo necesario el estudio anatomopatológico e inmunohistoquímico de la pieza quirúrgica para el diagnóstico definitivo2. Presentamos el primer caso de HP descrito en España.
Un varón de 41 años fue valorado en nuestro centro por el hallazgo incidental en una resonancia magnética (RM) abdominal de una masa pancreática de 17×12×15mm. Los niveles en sangre de amilasa, bilirrubina, antígeno carcinoembrionario, Ca 19-9, gastrina y enolasa neuronal-específica fueron normales, así como los niveles de ácido 5-hidroxiindolacético.
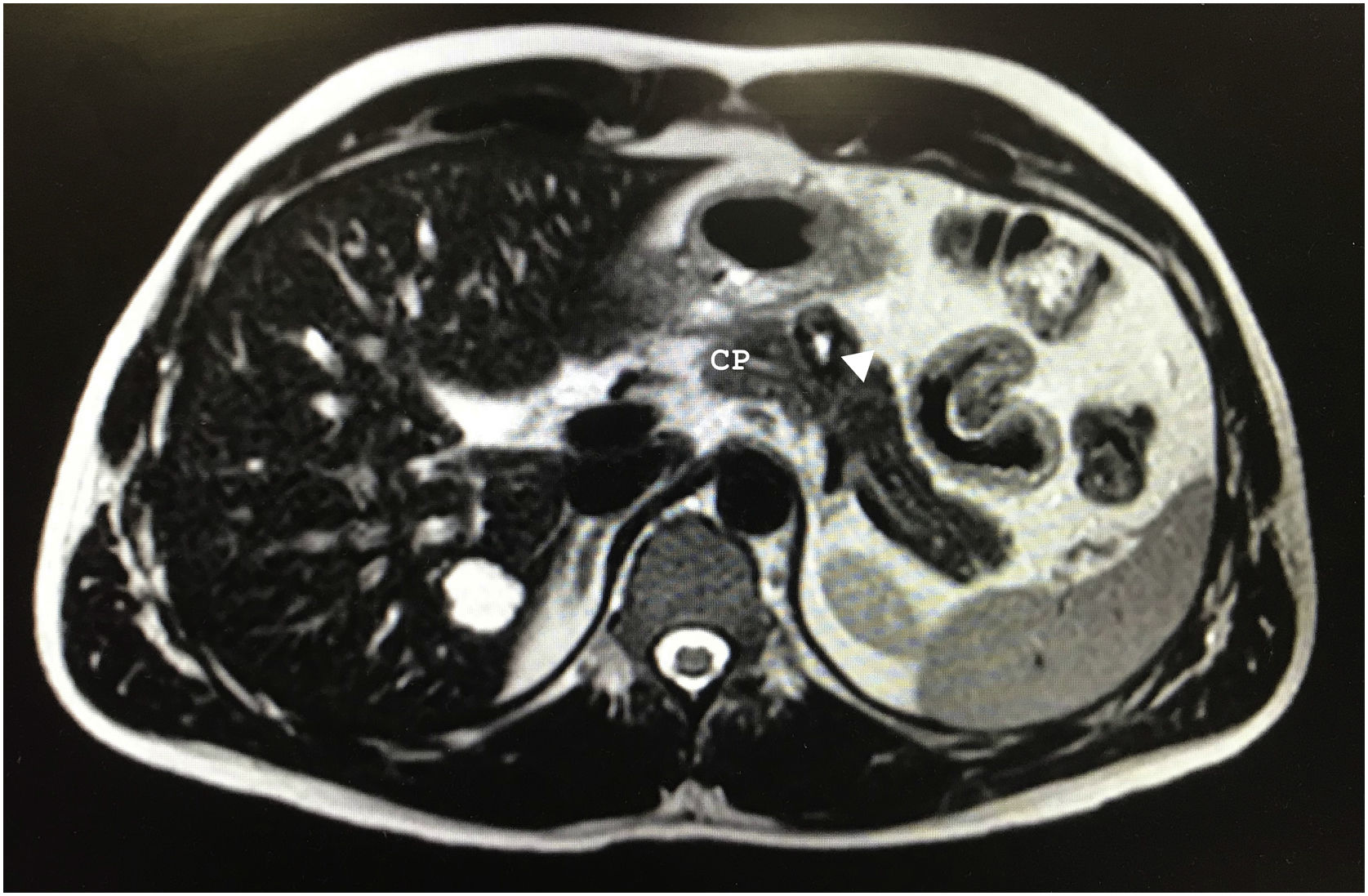
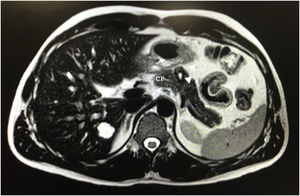
Tras 10 meses de seguimiento, en la RM abdominal se objetivó una lesión en el cuerpo pancreático de 20×18×17mm, hiperintensa en T2, sugestivo de componente cístico vs. necrosis central, con una discreta hipointensidad en la periferia con realce progresivo en la fase portal y tardía (fig. 1). Dada la presencia de componente sólido no se podía descartar malignidad. Sospechando un tumor neuroendocrino se solicitó un Octreoscan que resultó normal.
La ecoendoscopia reveló una lesión de 19mm en el cuerpo pancreático, hipoecogénica, bien definida, sólida con algún área cística central. La punción-aspiración con aguja fina mostró un epitelio columnar con células mucinosas, sin atipia. Fue diagnosticado inicialmente de tumor mucinoso (no tumor papilar mucinoso intraductal), descartando tumor sólido pseudopapilar (TSP) o un tumor neuroendocrino.
Dada la edad del paciente, el discreto crecimiento de la lesión y la imposibilidad de esclarecer su naturaleza se realizó una pancreatectomía distal (PD) abierta con preservación esplénica. Macroscópicamente se trataba de una masa firme blanquecina de 1,8×1,8cm. Microscópicamente consistía en estructuras ductales, acinares y neuroendocrinas distribuidas al azar embebidas en un estroma fibrocelular, sin infiltrados inflamatorios significativos. Inmunohistoquímicamente el estroma fue positivo para ß-catenina. Fue negativo para IgG, IgG4, sinaptofisina, cromogranina, actina, CD34, S100 y Bcl2. Finalmente fue diagnosticado de HP.
El paciente desarrolló una fístula pancreática tipo A, tratada de manera conservadora, siendo dado de alta al séptimo día postoperatorio con un drenaje pancreático, que se retiró el décimo día postoperatorio. Tras 5 meses de seguimiento no ha presentado recurrencia de la enfermedad.
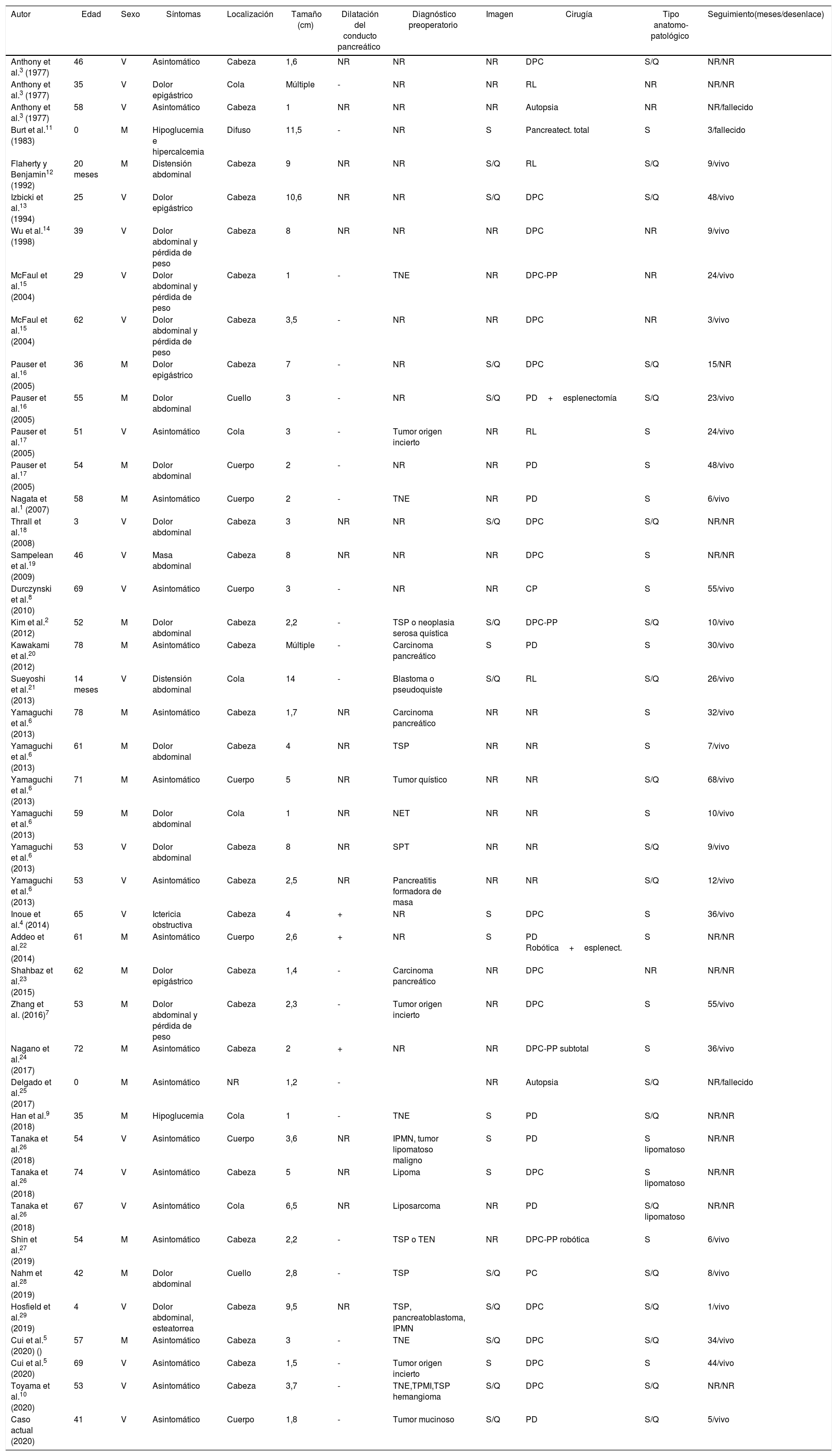
Los HP son extremadamente raros, con 43 casos publicados, incluyendo el presente (tabla 1), describiéndose por primera vez en 1977 por Anthony et al.3. Pueden aparecer a cualquier edad, siendo la media de 40-60 años. No existe predilección por ningún sexo. La mayoría se diagnostican de forma incidental, o se presentan con signos y síntomas inespecíficos, como dolor abdominal o pérdida de peso. Solo se ha descrito un caso que comenzó con ictericia obstructiva4. El HP puede aparecer en cualquier parte del páncreas, más frecuentemente en la cabeza, entre 1,0-14,0cm de tamaño5.
Características clinicopatológicas de los hamartomas pancreáticos descritos en la literatura (n=43)
| Autor | Edad | Sexo | Síntomas | Localización | Tamaño (cm) | Dilatación del conducto pancreático | Diagnóstico preoperatorio | Imagen | Cirugía | Tipo anatomo-patológico | Seguimiento(meses/desenlace) |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Anthony et al.3 (1977) | 46 | V | Asintomático | Cabeza | 1,6 | NR | NR | NR | DPC | S/Q | NR/NR |
| Anthony et al.3 (1977) | 35 | V | Dolor epigástrico | Cola | Múltiple | - | NR | NR | RL | NR | NR/NR |
| Anthony et al.3 (1977) | 58 | V | Asintomático | Cabeza | 1 | NR | NR | NR | Autopsia | NR | NR/fallecido |
| Burt et al.11 (1983) | 0 | M | Hipoglucemia e hipercalcemia | Difuso | 11,5 | - | NR | S | Pancreatect. total | S | 3/fallecido |
| Flaherty y Benjamin12 (1992) | 20 meses | M | Distensión abdominal | Cabeza | 9 | NR | NR | S/Q | RL | S/Q | 9/vivo |
| Izbicki et al.13 (1994) | 25 | V | Dolor epigástrico | Cabeza | 10,6 | NR | NR | S/Q | DPC | S/Q | 48/vivo |
| Wu et al.14 (1998) | 39 | V | Dolor abdominal y pérdida de peso | Cabeza | 8 | NR | NR | NR | DPC | NR | 9/vivo |
| McFaul et al.15 (2004) | 29 | V | Dolor abdominal y pérdida de peso | Cabeza | 1 | - | TNE | NR | DPC-PP | NR | 24/vivo |
| McFaul et al.15 (2004) | 62 | V | Dolor abdominal y pérdida de peso | Cabeza | 3,5 | - | NR | NR | DPC | NR | 3/vivo |
| Pauser et al.16 (2005) | 36 | M | Dolor epigástrico | Cabeza | 7 | - | NR | S/Q | DPC | S/Q | 15/NR |
| Pauser et al.16 (2005) | 55 | M | Dolor abdominal | Cuello | 3 | - | NR | S/Q | PD+esplenectomía | S/Q | 23/vivo |
| Pauser et al.17 (2005) | 51 | V | Asintomático | Cola | 3 | - | Tumor origen incierto | NR | RL | S | 24/vivo |
| Pauser et al.17 (2005) | 54 | M | Dolor abdominal | Cuerpo | 2 | - | NR | NR | PD | S | 48/vivo |
| Nagata et al.1 (2007) | 58 | M | Asintomático | Cuerpo | 2 | - | TNE | NR | PD | S | 6/vivo |
| Thrall et al.18 (2008) | 3 | V | Dolor abdominal | Cabeza | 3 | NR | NR | S/Q | DPC | S/Q | NR/NR |
| Sampelean et al.19 (2009) | 46 | V | Masa abdominal | Cabeza | 8 | NR | NR | NR | DPC | S | NR/NR |
| Durczynski et al.8 (2010) | 69 | V | Asintomático | Cuerpo | 3 | - | NR | NR | CP | S | 55/vivo |
| Kim et al.2 (2012) | 52 | M | Dolor abdominal | Cabeza | 2,2 | - | TSP o neoplasia serosa quística | S/Q | DPC-PP | S/Q | 10/vivo |
| Kawakami et al.20 (2012) | 78 | M | Asintomático | Cabeza | Múltiple | - | Carcinoma pancreático | S | PD | S | 30/vivo |
| Sueyoshi et al.21 (2013) | 14 meses | V | Distensión abdominal | Cola | 14 | - | Blastoma o pseudoquiste | S/Q | RL | S/Q | 26/vivo |
| Yamaguchi et al.6 (2013) | 78 | M | Asintomático | Cabeza | 1,7 | NR | Carcinoma pancreático | NR | NR | S | 32/vivo |
| Yamaguchi et al.6 (2013) | 61 | M | Dolor abdominal | Cabeza | 4 | NR | TSP | NR | NR | S | 7/vivo |
| Yamaguchi et al.6 (2013) | 71 | M | Asintomático | Cuerpo | 5 | NR | Tumor quístico | NR | NR | S/Q | 68/vivo |
| Yamaguchi et al.6 (2013) | 59 | M | Dolor abdominal | Cola | 1 | NR | NET | NR | NR | S | 10/vivo |
| Yamaguchi et al.6 (2013) | 53 | V | Dolor abdominal | Cabeza | 8 | NR | SPT | NR | NR | S/Q | 9/vivo |
| Yamaguchi et al.6 (2013) | 53 | V | Asintomático | Cabeza | 2,5 | NR | Pancreatitis formadora de masa | NR | NR | S/Q | 12/vivo |
| Inoue et al.4 (2014) | 65 | V | Ictericia obstructiva | Cabeza | 4 | + | NR | S | DPC | S | 36/vivo |
| Addeo et al.22 (2014) | 61 | M | Asintomático | Cuerpo | 2,6 | + | NR | S | PD Robótica+esplenect. | S | NR/NR |
| Shahbaz et al.23 (2015) | 62 | M | Dolor epigástrico | Cabeza | 1,4 | - | Carcinoma pancreático | NR | DPC | NR | NR/NR |
| Zhang et al. (2016)7 | 53 | M | Dolor abdominal y pérdida de peso | Cabeza | 2,3 | - | Tumor origen incierto | NR | DPC | S | 55/vivo |
| Nagano et al.24 (2017) | 72 | M | Asintomático | Cabeza | 2 | + | NR | NR | DPC-PP subtotal | S | 36/vivo |
| Delgado et al.25 (2017) | 0 | M | Asintomático | NR | 1,2 | - | NR | Autopsia | S/Q | NR/fallecido | |
| Han et al.9 (2018) | 35 | M | Hipoglucemia | Cola | 1 | - | TNE | S | PD | S/Q | NR/NR |
| Tanaka et al.26 (2018) | 54 | V | Asintomático | Cuerpo | 3,6 | NR | IPMN, tumor lipomatoso maligno | S | PD | S lipomatoso | NR/NR |
| Tanaka et al.26 (2018) | 74 | V | Asintomático | Cabeza | 5 | NR | Lipoma | S | DPC | S lipomatoso | NR/NR |
| Tanaka et al.26 (2018) | 67 | V | Asintomático | Cola | 6,5 | NR | Liposarcoma | NR | PD | S/Q lipomatoso | NR/NR |
| Shin et al.27 (2019) | 54 | M | Asintomático | Cabeza | 2,2 | - | TSP o TEN | NR | DPC-PP robótica | S | 6/vivo |
| Nahm et al.28 (2019) | 42 | M | Dolor abdominal | Cuello | 2,8 | - | TSP | S/Q | PC | S/Q | 8/vivo |
| Hosfield et al.29 (2019) | 4 | V | Dolor abdominal, esteatorrea | Cabeza | 9,5 | NR | TSP, pancreatoblastoma, IPMN | S/Q | DPC | S/Q | 1/vivo |
| Cui et al.5 (2020) () | 57 | M | Asintomático | Cabeza | 3 | - | TNE | S/Q | DPC | S/Q | 34/vivo |
| Cui et al.5 (2020) | 69 | V | Asintomático | Cabeza | 1,5 | - | Tumor origen incierto | S | DPC | S | 44/vivo |
| Toyama et al.10 (2020) | 53 | V | Asintomático | Cabeza | 3,7 | - | TNE,TPMI,TSP hemangioma | S/Q | DPC | S/Q | NR/NR |
| Caso actual (2020) | 41 | V | Asintomático | Cuerpo | 1,8 | - | Tumor mucinoso | S/Q | PD | S/Q | 5/vivo |
DPC: duodenopancreatectomía cefálica; DPC-PP: DPC preservadora de píloro; M: mujer; NR: no reportado; PC: pancreatectomía central; PD: pancreatectomía distal; RL: resección local; S: sólido; S/Q: sólido y quístico; TNE: tumor neuroendocrino; TPMI: tumor papilar mucinoso intraductal; TSP: tumor sólido pseudopapilar; V: varón.
11 Pediatr Radiol. 1983;13:287-9.
12 Hum Pathol. 1992;23:1309-12.
13 Am J Gastroenterol. 1994;89:1261-2.
14 Histopathology. 1998;33:485-7.
15 Pancreatology. 2004;4:533-8.
16 Am J Surg Pathol. 2005;29:797-800.
17 Mod Pathol. 2005;18:1211-6.
18 Pediatr Dev Pathol. 2008;11:314-20.
19 J Gastrointest Liver Dis. 2009;18:483-486.
20 World J Gastrointest Oncol. 2012;4:202.
21 Int J Surg Case Rep. 2013;4:98-100.
22 Surg (United States). 2014;156:1284-5.
23 Am J Gastroenterol. 2015;110:S109.
24 BMC Gastroenterol. 2017;17(1):146.
25 Autops Case Reports. 2017;7(4):26-29.
26 Am J Surg Pathol. 2018;42(7):891-7.
27 Ann Hepato-Biliary-Pancreatic Surg. 2019;23:286.
28 ANZ J Surg. 2019;89:E265-E267.
29 J Pediatr Surg Case Reports. 2019;48:101258.
Se distinguen 2 tipos de HP según los hallazgos macroscópicos: tipo sólido y tipo sólido-quístico6. Ecográficamente se presentan como masas hipoecogénicas con límites bien definidos4,5,7,8.
En la tomografía computarizada habitualmente están bien definidos, con una densidad en las lesiones sólidas ligeramente desigual, hipo- o isodensa y con realce heterogéneo progresivo en fases tardías. Los bordes son típicamente bien definidos tras el realce con contraste1,2,5,9. En contraposición, el adenocarcinoma pancreático se caracteriza por un escaso realce y por la presencia de invasión de estructuras adyacentes, mientras que los TNE presentan un claro realce en las fases iniciales tras el contraste5,9. El TSP es similar, pero suele presentar encapsulación y calcificaciones periféricas10. Por tanto, el HP debería ser tenido en cuenta en el diagnóstico diferencial del incidentaloma pancreático.
En RM el contorno es regular, con límites bien definidos en T2. La intensidad del interior de la lesión es ligeramente heterogénea, hipointensa en T1 e iso o hiperintensa en T25,7,9.
Microscópicamente está compuesto por una proporción variable de células acinares, ductales y endocrinas dispuestas de forma desorganizada, por lo que la punción-aspiración con aguja fina no es rentable. El componente sólido consiste en tejido fibroadiposo, mientras que el quístico lo componen ductos pancreáticos dilatados. Presentan células acinares diferenciadas, sin formar lobulillos bien organizados1,6,7. Característicamente carecen de 3 estructuras: fibras elásticas concéntricas alrededor de los conductos pancreáticos, nervios periféricos e islotes de Langerhans bien formados. Esto los distingue de la pancreatitis crónica y el hamartoma del ducto pancreático, donde estas 3 estructuras están bien conservadas6.
A pesar de que el HP es una enfermedad benigna, la mayoría de los pacientes son sometidos a resección quirúrgica por la imposibilidad de descartar malignidad. Dada la mayor frecuencia de malignidad o premalignidad en los incidentalomas pancreáticos, la cirugía es el tratamiento indicado, ya sea duodenopancreatectomía cefálica, PD o cirugía conservadora (pancreatectomía central o enucleación), incluso aunque pueda ser demasiado agresiva en caso de tumores benignos8.
Algunos autores sugieren que se debería realizar cirugía conservadora para preservar la integridad del tracto gastrointestinal y la función endocrina y exocrina del páncreas, así como la esplénica, por la naturaleza indolente de este tumor7. Nosotros optamos por PD con preservación esplénica debido a la sospecha inicial, desaconsejando la realización de cirugía preservadora de parénquima por el riesgo de fístula, dada la relación de vecindad del tumor con el conducto pancreático principal (fig. 1).