La biopsia selectiva del ganglio centinela (BSGC) puede completar el estudio preoperatorio detectando adenopatías no visibles ecográficamente. De este modo, se puede estadificar a los pacientes y estratificar el riesgo de recidiva de forma más precisa y, por tanto, ayudar a definir el tipo de tratamiento tanto quirúrgico como con 131I que debemos realizar. El objetivo fue validar la BSGC para su utilización en el diagnóstico de la metástasis ganglionar por cáncer papilar de tiroides.
MétodosEstudio observacional prospectivo de cohortes que incluye a 55 pacientes intervenidos por cáncer papilar de tiroides sin sospecha de afectación ganglionar clínica o radiológica, desde febrero de 2012 hasta febrero de 2015, con un seguimiento de entre 6 y 8 años. Se utilizó 99Tc con nanocoloide intratumoral y una sonda portátil de la gammacámara para la detección de los ganglios centinelas. Variables: edad, género, histológicas, analíticas y estadificación preoperatoria y postoperatoria. Se calculó la sensibilidad, la especificidad y los valores predictivos de la técnica. La validación se determinó calculando la detectabilidad y los falsos negativos de la prueba.
ResultadosEn 53 de los 55 (96,36%) pacientes hubo detección del ganglio centinela. Los falsos negativos fueron 4 (7,5%) pacientes. Del resto, tras aplicar la BSGC, 24 (48,9%) se mantuvieron como N0, 14 (28,5%) pasaron a ser N1a y 11 (22,4%) se clasificaron como N1b. Las diferencias observadas en el estudio fueron significativas (p<0,05). La sensibilidad fue del 86,21%, la especificidad del 100%, el VPP del 100% y el VPN del 85,71%. La precisión diagnóstica fue del 92,45%.
ConclusionesLa BSGC es una técnica válida para su utilización en los pacientes afectos de cáncer papilar de tiroides, con una alta precisión diagnóstica.
The presence of lymph nodes metastasis in papillary thyroid cancer modifies the type of surgical resection as well as the indication of the treatment with 131I in the postoperative period. This therapeutic approach is based on the results of the diagnostic tests, like the cervical ultrasonography. Currently other methods of diagnostic are tested as selective sentinel lymph node biopsy (SLNB). It can complement to the ultrasound results. The aim was to validate the SLNB for use in the diagnosis of lymph node metastasis by papillary thyroid cancer.
MethodsObservational prospective cohort study of 55 patients who underwent papillary thyroid cancer without suspicion of lymph node involvement clinical or radiological, since February 2012 through February 2015, with a follow-up between 6 and 8 years. It was used 99Tc with intratumoral nanocoloid and a portable tube of the gamma camera for the detection of the sentinel node. Variables: age, gender, histological, analytical and preoperative and postoperative staging. The sensitivity, specificity and predictive values of technique was calculated. The validation was determined by calculating the detectability and the false negative results of the test.
ResultsIn 53 of the 55 patients (96.36%) there was the sentinel node detection. The false negative were 4 patients (7.5%). Of the rest, after applying the SLNB, 24 (48.9%) were kept as N0, 14 (28.5%) became N1a and 11 (22.4%) were classified as N1b. The differences observed in the study were significant (P<.05). The sensitivity was 86.21%, the specificity of 100%, the PPV was 100% and the NPV of 85.71%. The diagnostic accuracy was 92.45%.
ConclusionsThe SLNB is a valid technique for use in patients suffering from papillary thyroid cancer with a high diagnostic accuracy.
El tratamiento quirúrgico del cáncer papilar de tiroides (CPT) debe abarcar, además de la tiroidectomía, la linfadenectomía de los grupos ganglionares afectados.
La valoración ganglionar preoperatoria se realiza básicamente con la ecografía cervical. Sin embargo, debido a la sensibilidad y especificidad de esta prueba, especialmente para el compartimento central del cuello, un grupo de pacientes puede quedar infraestadificado.
La biopsia selectiva del ganglio centinela (BSGC) puede completar el estudio preoperatorio detectando adenopatías no visibles ecográficamente. De este modo, se puede estadificar a los pacientes y estratificar el riesgo de recidiva de forma más precisa y, por tanto, ayudar a definir el tipo de tratamiento tanto quirúrgico como con 131I que debemos realizar.
El objetivo de este estudio es validar la técnica del ganglio centinela (GC) para su utilización en el CPT.
MétodosSe realizó un estudio observacional prospectivo de cohortes que incluyó 55 pacientes intervenidos por CPT con ausencia clínica y radiológica de afectación ganglionar, desde febrero de 2012 hasta febrero de 2015 y con un seguimiento de entre 6 y 8 años.
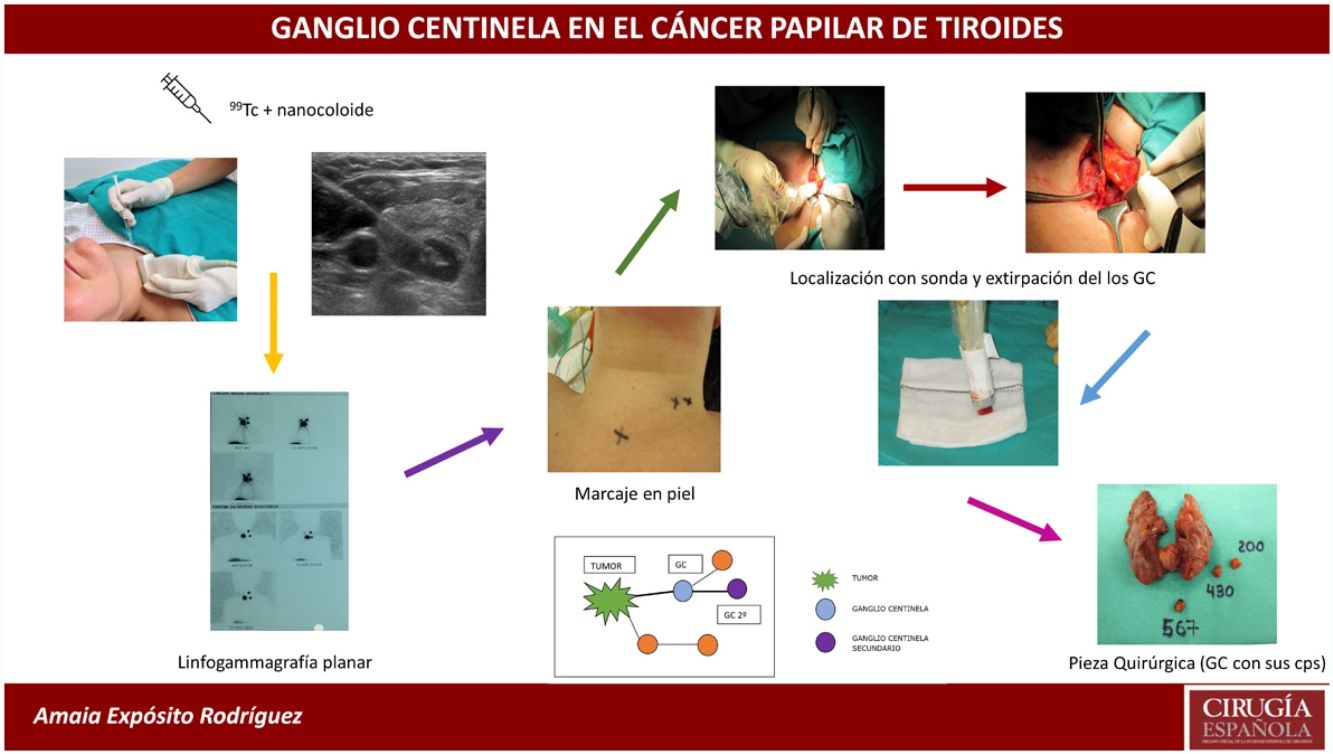
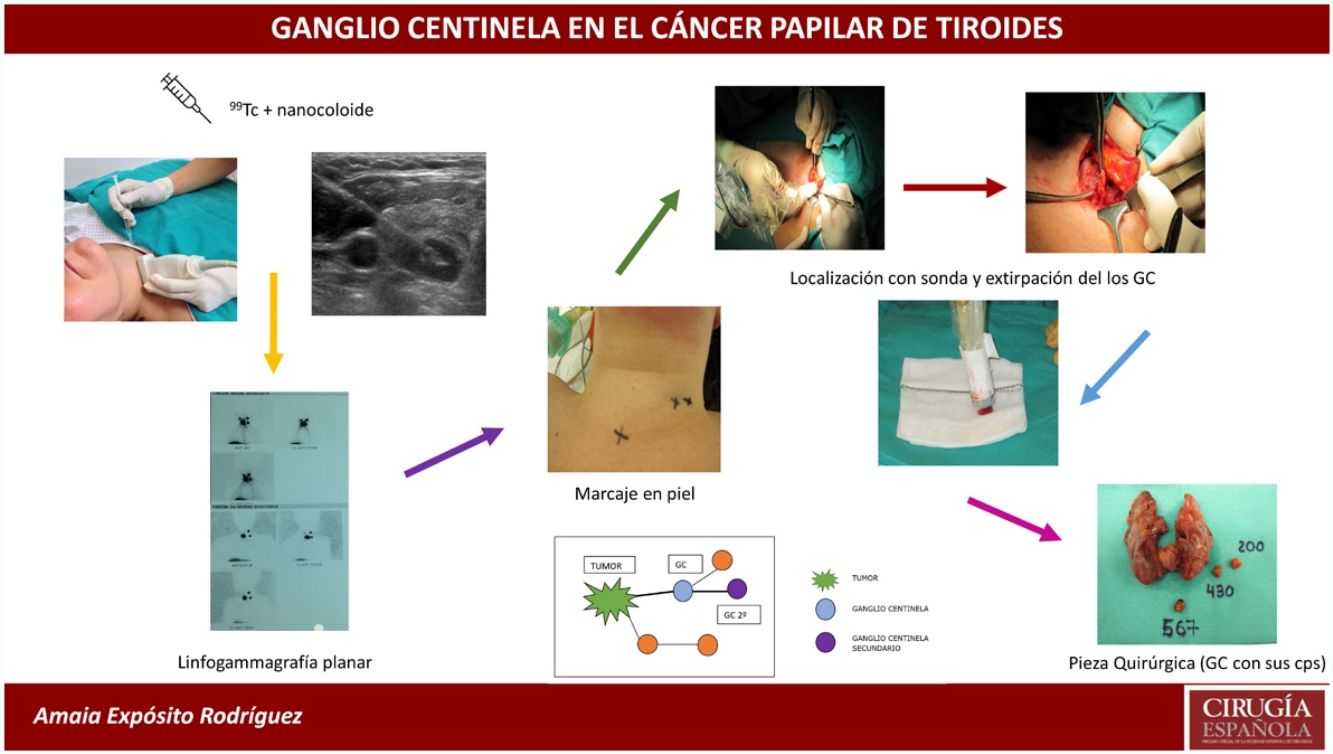
La BSGC se realizó con la inyección intratumoral del radiofármaco (0,2ml de 4mCi de 99mTc) con nanocoloide (Nanocoll®), con control ecográfico 24h antes de la intervención quirúrgica.
Antes de la intervención, se localizaron los GC a través de una linfogammagrafía planar para proceder a su marcaje en piel con tinta indeleble. Posteriormente se realizó primero la tiroidectomía total en todos los casos (para evitar las interferencias de la radioactividad emitida por la glándula tiroides) y después se rastrearon con la sonda portátil de la gammacámara (neo2000® Gamma Detection System) todos los compartimentos ganglionares cervicales de forma sistemática. Se localizaron los GC y se enviaron en fresco para su estudio intraoperatorio por congelación. Seguidamente se completó la cirugía con la realización de la disección del compartimento central (DCC) y en los casos en los que el GC correspondiente al compartimento lateral del cuello fue positivo, se completó la disección ganglionar lateral del lado afecto (niveles ii, iii y iv). El procedimiento de extracción de los GC alargó la intervención una media de 20min.
Las principales variables analizadas fueron: edad, género, número de GC, localización, porcentaje de positividad, relación con los hallazgos del estudio anatomopatológico final, resultados del seguimiento, sensibilidad y especificidad, valores predictivos y detectabilidad de la prueba. Se determinó la supervivencia y el porcentaje de recidiva en un periodo de seguimiento de entre 6 y 8 años.
Análisis estadísticosLos análisis se realizaron mediante el programa SAS® for Windows statistical software, versión 9.2 (SAS Institute, Inc., Carey, NC, EE. UU.).
Para todos los análisis se consideró un resultado estadísticamente significativo para p<0,05. El resultado de la técnica del GC se determinó mediante la estimación de la sensibilidad, la especificidad, el valor predictivo positivo y el valor predictivo negativo.
ResultadosCuarenta y siete (85,4%) pacientes fueron mujeres y 8 (14,6%) hombres.
La edad media fue de 49,3 años, con una desviación estándar (DE) de 15.
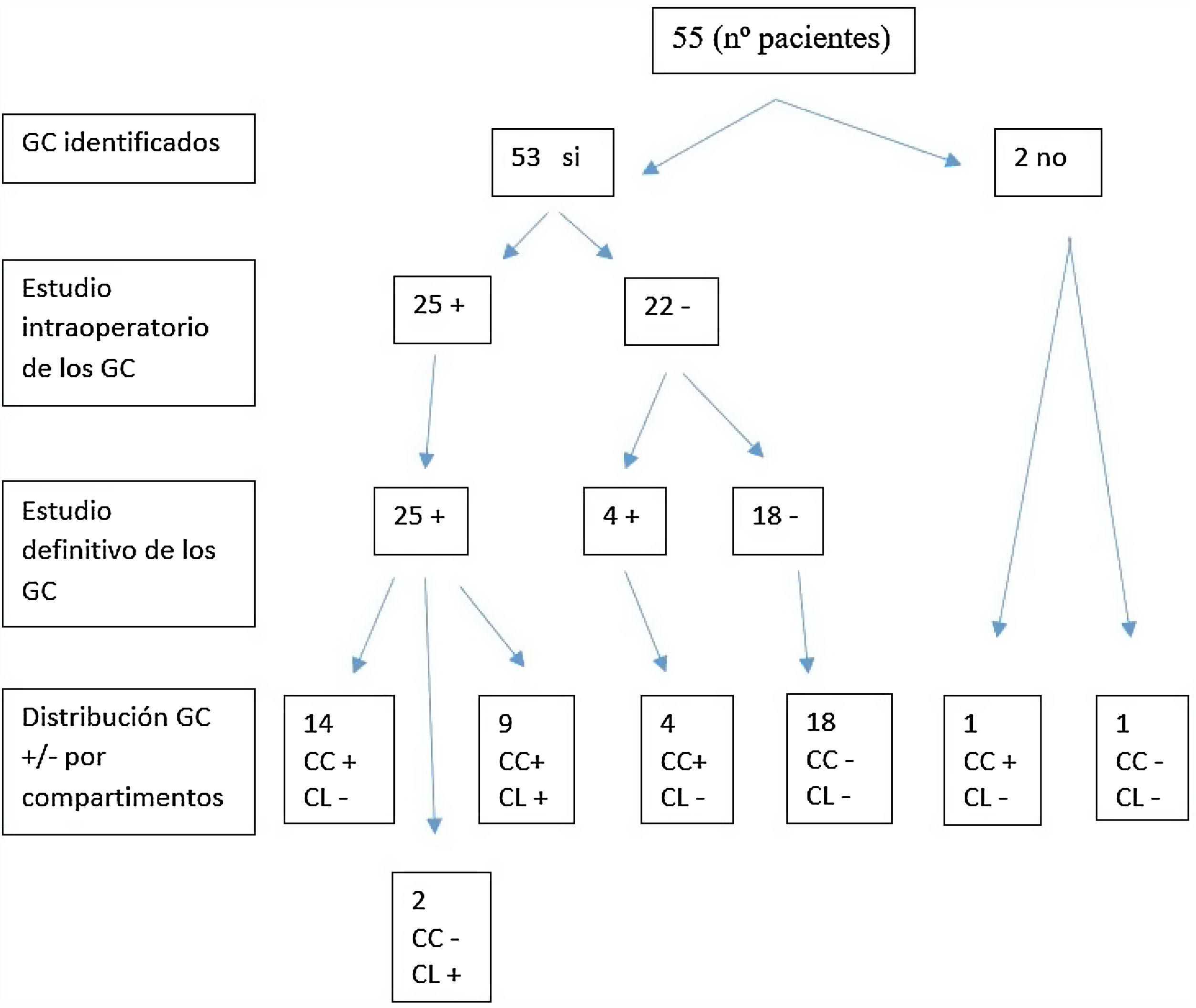
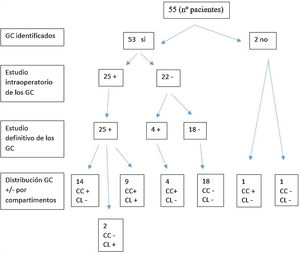
Se aislaron un total de 237 GC en los 53 pacientes en los que hubo drenaje. La media de GC fue de 4,5.
El tamaño medio de los GC fue de 7,1mm (DE de 3,3).
En 51 (96,23%) pacientes se localizaron GC en el compartimento central frente a 2 (3,77%) en los que no se obtuvo drenaje en dicho compartimento.
Treinta y dos (60,38%) pacientes presentaron drenaje en el compartimento lateral, mientras que en 21 (39,62%) no hubo drenaje en dicho compartimento. Treinta (50,60%) pacientes tuvieron drenaje tanto en el compartimento central como en el lateral, mientras que en solo 2 (3,7%) drenó en el compartimento lateral sin localizar ningún GC en el compartimento central. La tasa de GC con fenómeno «skip» o salto metastásico en nuestro estudio fue del 3,7%.
Todos los GC positivos en la biopsia intraoperatoria lo fueron en el estudio definitivo (no hubo falsos positivos). En el 52,38% de los pacientes con GC positivos localizados en el compartimento central, estos fueron los únicos ganglios positivos de la disección central, y en el 75% de los GC positivos en el compartimento lateral, estos fueron los únicos positivos en la disección de dicho compartimento. La positividad de los ganglios fue debida a la presencia de macrometástasis, mientras que los falsos negativos (FN) se debieron a micrometástasis que no pudieron ser detectadas en el estudio intraoperatorio por congelación. El total de FN fue del 7,5% (4 pacientes). No se obtuvo drenaje en 2 (3,6%) casos, por lo que la detectabilidad de la prueba fue del 96,36%.
En la figura 1 se detalla la correlación entre los hallazgos intraoperatorios y el estudio anatomopatológico final del GC tras la disección central y lateral.
No hubo ninguna complicación en relación con la aplicación de la técnica del GC, ni existió mortalidad en nuestra serie.
La sensibilidad de la técnica del GC en nuestro estudio fue del 86,21%, la especificidad del 100%, el VPP del 100% y el VPN del 85,71%. La precisión diagnóstica fue del 92,45% (tabla 1).
Tras realizar la técnica del GC, la N (según la clasificación TNM 7.ª edición) se modificó. En el preoperatorio todos los pacientes eran N0, mientras que después de localizar y analizar los GC, un 48,98% se mantuvo como N0, el 28,57% pasó a ser N1a y el 22,45% se transformó en N1b. Las diferencias observadas en el estudio fueron significativas (p<0,05). Excluyendo los FN, un 48,98% de los pacientes presentaron concordancia entre la estadificación preoperatoria y la postoperatoria, mientras que un 51,02% no la presentaron (tabla 2).
La estadificación tumoral (TNM) se modificó tras la realización de la BSGC. En el estudio preoperatorio, 46 (86,8%) pacientes se clasificaron como estadio i y 7 (13,2%) como estadio ii, mientras que en el postoperatorio, 32 (60,4%) se incluyeron en el estadio i, 5 (9,4%) en el estadio ii y 16 (30,2%) en el estadio iii (tabla 3).
Distribución en porcentajes de las variaciones en la estadificación pre y postoperatoria, respecto a la N (clasificación TNM)
| Estadio TNM | Estadificación preoperatorian (%) | Estadificación postoperatorian (%) |
|---|---|---|
| Estadio I | 46 (86,8) | 32 (60,38) |
| Estadio II | 7 (13,2) | 5 (9,43) |
| Estadio III | 0 (0) | 16 (30,19) |
El tamaño medio tumoral fue de 16,7mm (DE de 12,2). El 31,6% correspondieron a microcarcinomas.
Los tumores fueron multicéntricos en el 50,9% de los casos y bilaterales en el 43,7%.
Respecto al seguimiento, el 88,6% de los pacientes tuvieron una respuesta excelente. El 5,7% presentaron una respuesta bioquímica incompleta sin hallazgos estructurales y el 5,7% restante recidivaron. Las recidivas fueron en 3 pacientes: una metástasis pulmonar en un caso; una variante esclerosante difusa que recidivó en ambos compartimentos laterales y que tras la disección de estos se encuentra libre de enfermedad en otra paciente; el tercer caso de recidiva se dio en el compartimento lateral derecho, fue una variante clásica que presentaba 3 focos tumorales derechos y otro en el istmo y en la que solo se colocó el isótopo en el tumor descrito en la ecografía. Tras la disección del compartimento afecto, la paciente se encuentra también libre de enfermedad. Los 3 pacientes que recidivaron presentaron GC positivos únicamente en el compartimento central.
La supervivencia de nuestra serie fue del 100%.
DiscusiónConsideramos de interés abordar si el tratamiento quirúrgico que realizamos en el CPT es el adecuado a cada paciente. Podemos estar aplicando un sobretratamiento cuando realizamos la DCC profiláctica, con el consiguiente aumento de morbilidad que este tipo de disección implica. Por el contrario, el hecho de no realizar dicha disección puede llevarnos a no extirpar todo el tejido tumoral, lo cual puede afectar a la recidiva, la persistencia de la enfermedad, el pronóstico y/o la supervivencia.
La BSGC puede determinar el tipo de disección ganglionar a realizar, orientando dichas disecciones solo a aquellas que tengan finalidad terapéutica.
El GC se define como la primera estación de drenaje linfático de un tumor1. Su interés radica en que su detección y estudio intraoperatorio permitirá conocer la existencia o no de metástasis linfáticas. Sin embargo, por las razones que discutiremos más adelante, no todos los autores2,3 se ponen de acuerdo sobre su utilidad en el CPT.
Algunos de los factores de riesgo en el CPT van a ser descritos con el estudio de la pieza quirúrgica y por tanto podrán ayudar a la indicación del tratamiento ablativo con 131I. Sin embargo, otros, como la presencia de adenopatías locorregionales, se basan en los estudios preoperatorios, donde la prueba diagnóstica más utilizada y aceptada es la ecografía cervical. No obstante, la sensibilidad y especificidad de esta, en el diagnóstico de las metástasis ganglionares en el compartimento central, es del 30 y el 86,8%, respectivamente, y en el compartimento lateral, del 93,8 y el 80%4.
Es aceptado que en torno a un 50% (25-90% según la serie) de los pacientes con CPT pueden presentar metástasis linfáticas5.
Autores como Hughes et al.6 describen sobre un total de 931 pacientes un aumento de la recurrencia en los mayores de 45 años con afectación ganglionar, aunque sin diferencias significativas en la supervivencia.
Por el contrario, Lundgren et al.7 publican en 2006 un estudio de casos y controles con 5.123 pacientes donde sí encuentran una mayor mortalidad en aquellos con adenopatías metastásicas. En nuestra experiencia, la BSGC detectó en el 51,02% de los pacientes la presencia de adenopatías metastásicas que no se habían localizado en la ecografía preoperatoria.
Respecto a la disección ganglionar, las guías internacionales coinciden en la necesidad de realizarla cuando es terapéutica, así como en no considerar indicada la disección profiláctica del compartimento lateral8–10. Respecto a la DCC profiláctica (niveles vi-vii), no hay consenso.
La European Thyroid Association10 y la National Comprehensive Cancer Network11 no aconsejan la realización de la DCC profiláctica, aunque reconocen que contribuye a una mejor estadificación y facilita un correcto seguimiento.
La American Thyroid Association8 recomienda realizarla en tumores avanzados (T3-T4) y la British Thyroid Association9 en aquellos pacientes considerados de alto riesgo, siempre y cuando sea realizada por cirujanos expertos para evitar un aumento de la morbilidad.
A este respecto, la BSGC es una prueba diagnóstica peroperatoria que puede ayudar a definir si es necesaria o no la realización de la disección ganglionar. Además, en caso de que los GC sean negativos, se evita dicha disección y, por tanto, la morbilidad que este tipo de cirugía implica.
Consecuentemente, la realización de la linfadenectomía cervical siempre se indicará con finalidad terapéutica, evitando la controversia de realizar o no la disección ganglionar profiláctica. Además, refrendamos la utilidad de esta técnica respecto a que nos define en la mayoría de los pacientes (92,5%) la indicación del tipo de disección que debemos realizar.
En este sentido, según nuestro estudio, la BSGC nos habría permitido evitar la realización de un sobretratamiento al 48,98% de los pacientes, ya que la presencia de GC negativos tendría que habernos llevado a no realizar la DCC. Circunstancia también defendida por Garau et al.12, que promueven la utilización de la BSGC ante la evidencia publicada y como sistema para evitar las DCC profilácticas.
Sin embargo, en el 51,02% restante sí se localizaron GC positivos, por lo que en este grupo de pacientes estaba justificada la realización de la disección ganglionar.
Estos hechos condicionaron sensibles cambios en la clasificación TNM de los pacientes, de modo que se pudo ajustar la indicación del tratamiento ablativo con 131I, así como el seguimiento.
En 2009 Pelizzo et al.13 publicaron una serie de 99 pacientes a los que se les aplicó la técnica con radioisótopo (99Tc nanocoloide), con una detectabilidad del 99%, localizando GC metastásicos en el 49% de los pacientes.
En 2011, Balasubramanian y Harrison14 publicaron un metaanálisis donde se valoraron 24 estudios, definiendo una detectabilidad del 98,4%. Concluía que con la utilización de la BSGC se podrían haber evitado un 57% de las linfadenectomías profilácticas.
Larrad Jiménez et al.15 presentaron en 2012 sus resultados preliminares sobre 23 pacientes utilizando el colorante azul de metileno con una detectabilidad del 91,3% y un 7,1% de FN. La sensibilidad obtenida fue del 87,5% y la especificidad del 100%.
En nuestro estudio, el porcentaje de FN fue del 7,5% y la precisión diagnóstica del 92,5%. Se detectaron GC en 53 de los 55 pacientes, por lo que la detectabilidad fue del 96,36%.
En la interpretación de estos datos debemos tener en cuenta que los estudios publicados son en su mayoría series pequeñas.
A este hecho hay que añadir la variabilidad metodológica de las distintas técnicas existentes, lo cual limita su interpretación. Aun así, en la mayoría de ellos, los resultados de sensibilidad y especificidad son similares, así como la detectabilidad y el porcentaje de FN13,16–19.
Según nuestra experiencia, corroboramos que la BSGC es una técnica fácilmente reproducible y segura, ya que no hubo ninguna complicación relacionada con el procedimiento5.
Sin embargo, no todos los autores3 defienden los beneficios de la BSGC; así, autores como Huang et al.2 publicaron en 2007, un estudio prospectivo con 90 mujeres afectas de CPT de bajo riesgo, con un elevado porcentaje de FN (14,3%). Defendieron la realización de la DCC profiláctica, ya que en el 38,1% de las pacientes dicho compartimento se encontraba afectado. Pese al elevado porcentaje de FN, sí concluyen que el estudio molecular de los ganglios (OSNA) podría reducir dicho porcentaje. A este respecto, Iglesias Felip et al.20 publican un estudio donde concluyen que el OSNA ayuda a mejorar el diagnóstico de los GC y por tanto a personalizar el tratamiento quirúrgico de los pacientes con CPT. Así mismo, en un metaanálisis publicado en 2019, Garau et al.21 apoyan el uso de la SPECT/TAC en el diagnóstico de los GC fuera del compartimento central.
Con relación a la respuesta indeterminada (3 pacientes) y recidiva tumoral (3 pacientes) descrita en el estudio, debemos considerar que la validación de la BSGC se determina con los parámetros de FN y detectabilidad22. No es objeto para validar la técnica la ausencia de recidivas, ya que cualquier procedimiento quirúrgico implicará inevitablemente un porcentaje de estas, es decir, no podremos conseguir un 100% de curación solo por realizar esta técnica, ya que esto depende de muchos factores. La BSGC pretende ayudar a detectar todo el tejido tumoral posible, que nos ayudará tras su extirpación a estadificar y estratificar el riesgo de recidiva de modo más exacto y, consecuentemente, a ajustar la indicación del tratamiento posterior con radioyodo.
Como cualquier prueba diagnóstica, la BSGC tiene sus limitaciones y plantea ciertos problemas que debemos considerar, como: la ausencia de drenaje/paso a sangre del radiotrazador, el número de GC, los FN en el estudio intraoperatorio, la bilateralidad y multicentricidad, y la presencia de micrometástasis.
Si comparamos los beneficios obtenidos (correcta estadificación e indicación personalizada del tratamiento quirúrgico y ablativo) respecto a los problemas o posibles complicaciones de la BSGC, consideramos que sin duda es una técnica que puede ser aplicada en el CPT y complementar las pruebas diagnósticas habitualmente empleadas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.