La enfermedad tromboembólica venosa (ETV) representa una grave complicación tras la cirugía oncológica. Recientes estudios revelan que el riesgo de ETV postoperatoria se extiende durante varias semanas. Este estudio analiza la forma y momento de presentación de la ETV tras cirugía oncológica abdominal.
MétodosEstudio observacional, prospectivo y multicéntrico, que analiza los datos de un registro internacional (RIETE) que incluye pacientes consecutivos con ETV sintomática. Se evalúa la forma y momento de presentación de la ETV, así como su pronóstico, en pacientes operados por cáncer abdominopélvico en las 8 semanas previas a la ETV. Se identifican las variables que se asocian con la presentación de la ETV tras el alta.
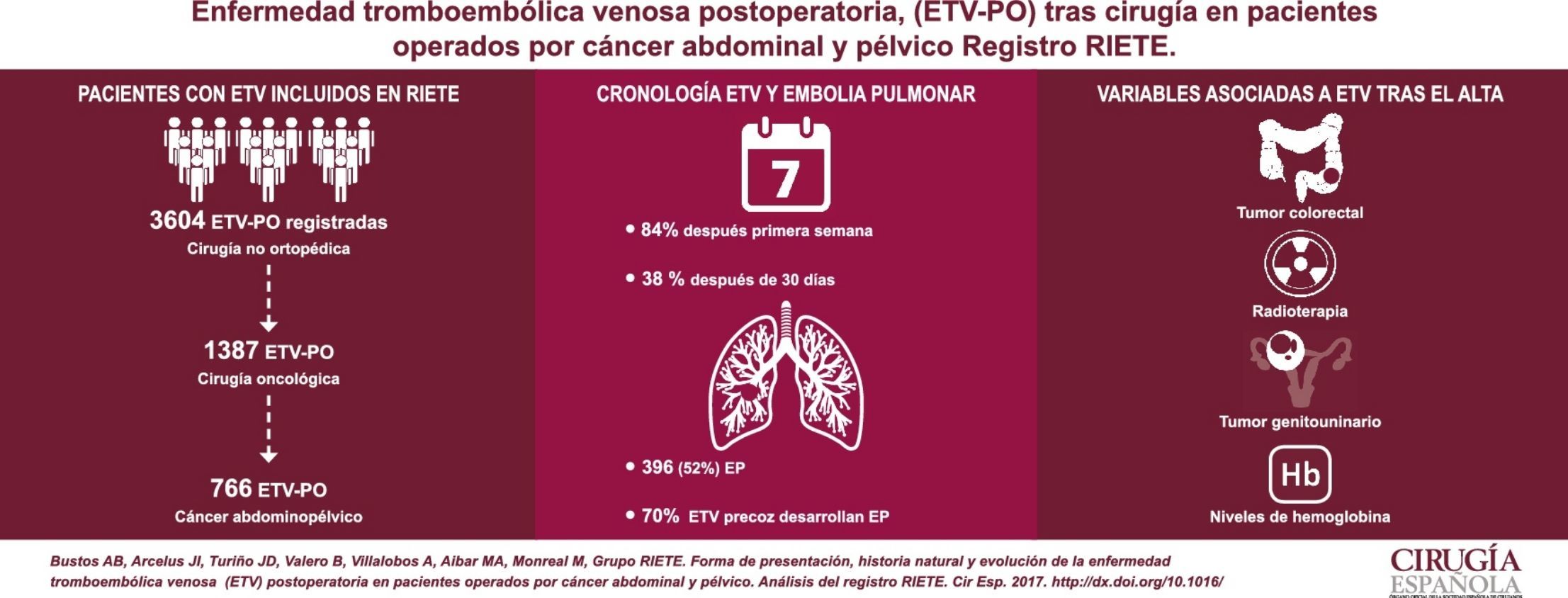
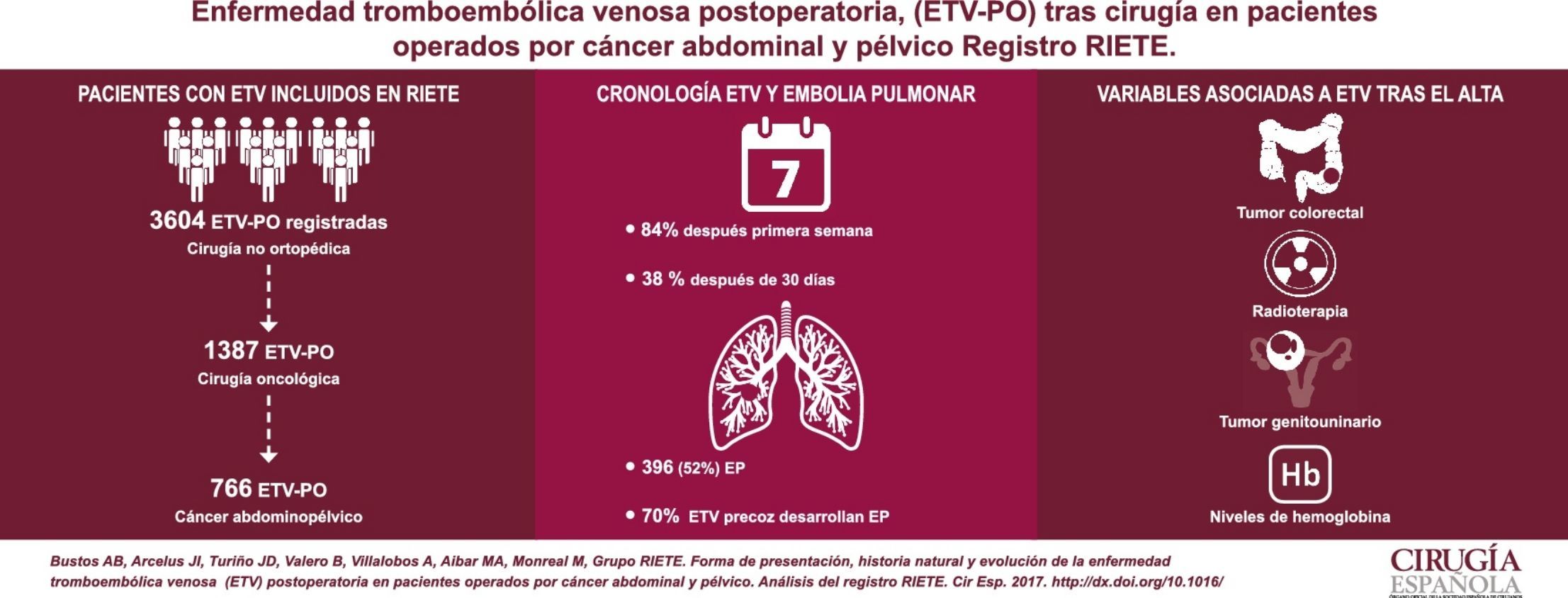
ResultadosEntre los 766 pacientes analizados, 396 (52%) presentaron embolia pulmonar (EP). La mayoría (84%) de los casos de ETV se presentaron después de la primera semana de la intervención y un 38% pasado un mes. El 70% de los pacientes con ETV precoz presentaron EP. El 54% de los casos desarrollaron ETV tras el alta. Los tumores colorrectales y genitourinarios, el uso de radioterapia y los niveles de hemoglobina resultaron variables independientes de ETV tras el alta. El 34% de los pacientes con ETV antes del alta tuvieron complicaciones (recidiva, hemorragia y defunción), frente al 24% con ETV tras el alta (p<0,01).
ConclusionesLa ETV se presenta tras el alta en la mayoría de los pacientes, especialmente en aquellos con cáncer colorrectal y genitourinario. La EP es más frecuente en los pacientes con ETV precoz que, además, tienen peor pronóstico.
Venous thromboembolism (VTE) represents a serious complication after oncologic surgery. Recent studies have shown that the risk of VTE persists several weeks after surgery. This study assesses the form of presentation and time course of VTE after abdominal and pelvic cancer surgery.
MethodsProspective, multicenter, observational study that analyzes data from an international registry (RIETE) that includes consecutive patients with symptomatic VTE. Our study assesses the form and time of presentation of postoperative VTE, as well as main outcomes, in patients operated for abdominopelvic cancer 8 weeks prior to VTE diagnosis. Variables related to the presentation of VTE after hospital discharge are identified.
ResultsOut of the 766 analyzed patients with VTE, 395 (52%) presented pulmonary embolism (PE). Most VTE cases (84%) were detected after the first postoperative week, and 38% after one month. Among patients with VTE in the first postoperative week, 70% presented PE. VTE presented after hospital discharge in 54% of cases. Colorectal, urologic, and gynecologic tumors, the use of radiotherapy, and blood hemoglobin levels were independently associated with VTE diagnosis after hospital discharge. Complications (thrombosis recurrence, bleeding, and death) occurred in 34% of patients with VTE detected before hospital discharge, compared to 24% in VTE after hospital discharge (P<0.01).
ConclusionsVTE occurs after hospital discharge in most patients, particularly in those operated for colorectal, urologic, and gynecologic cancer. Pulmonary embolism is more frequent in patients who develop early VTE, who also have worse prognosis.
La enfermedad tromboembólica venosa (ETV) postoperatoria, que incluye la trombosis venosa profunda (TVP) y la embolia pulmonar (EP), representa una frecuente y potencialmente grave complicación en los pacientes quirúrgicos oncológicos1,2. De hecho, la EP fue la primera causa de mortalidad en el primer mes tras cirugía oncológica en un estudio multicéntrico italiano3. Posteriormente, una revisión estadounidense de más de 2millones y medio de pacientes intervenidos por cáncer ha puesto de manifiesto que la probabilidad de fallecer en el postoperatorio inmediato es 5veces mayor en los que presentan ETV sintomática4.
La evidencia disponible sobre la historia natural y forma de presentación de la ETV en pacientes quirúrgicos oncológicos proviene fundamentalmente de ensayos clínicos controlados que incluyeron a pacientes seleccionados, que no reflejan necesariamente la práctica clínica habitual. Para poder estimar el impacto real de la ETV postoperatoria hay que analizar series de casos consecutivos no seleccionados y prolongar el seguimiento durante al menos 3meses5. Un mejor conocimiento de la historia natural de esta complicación es esencial, dado que existe controversia acerca de la duración más adecuada de la profilaxis antitrombótica en cirugía oncológica. Así, mientras algunas guías de práctica clínica recomiendan mantener la profilaxis con heparina de bajo peso molecular (HBPM) durante un mes tras cirugía por cáncer abdominal y pélvico6,7, otras son más selectivas en función de las características del paciente y de la presencia de factores de riesgo8,9.
El propósito fundamental de este estudio es evaluar la forma y momento de presentación de la ETV sintomática en pacientes operados por cáncer abdominal y pélvico, así como su evolución en los 3primeros meses de tratamiento. Para ello se analizarán los datos del mayor registro prospectivo observacional sobre ETV en el mundo10. La información obtenida nos permitirá conocer mejor la historia natural y la evolución de esta complicación prevenible en nuestro medio e identificar qué variables relacionadas con los pacientes y con la localización del tumor se correlacionan con el momento y forma de presentación de la ETV tras cirugía oncológica abdominal y pélvica, así como su pronóstico a corto plazo.
MétodosSe diseñó como un estudio observacional en el que se analizarán los datos del Registro Informatizado de pacientes con Enfermedad TromboEmbólica venosa (RIETE), un registro activo, prospectivo, multicéntrico, internacional que incluye a pacientes consecutivos con ETV sintomática confirmada por pruebas diagnósticas con un periodo mínimo de seguimiento de 3meses. Actualmente en dicho registro colaboran 245 centros correspondientes a 18 países.
Se analizarán los datos correspondientes a la población estudiada: pacientes incluidos en RIETE, durante un periodo de 12 años.
Los criterios de inclusión fueron: pacientes con ETV sintomática, con presentación en forma de TVP o EP, confirmada por pruebas objetivas, incluidos en RIETE y que hubiesen sido intervenidos por cáncer abdominal y pélvico en las 8 semanas previas al diagnóstico de la ETV. Todos los pacientes fueron seguidos por los investigadores de los hospitales participantes durante un mínimo de 3 meses para recoger cualquier complicación o evento clínico relevante.
Se excluyó a los pacientes que participaran en ensayos clínicos terapéuticos y a aquellos en los que no se considerara viable un seguimiento a 3 meses.
Las variables analizadas fueron las características demográficas de los pacientes en el momento del diagnóstico de la ETV (género, edad, estatura, peso) y presencia de comorbilidades y otros factores de riesgo; la profilaxis farmacológica recibida durante el periodo perioperatorio: fármaco, dosis y duración; la forma de presentación de la ETV: TVP (proximal o distal, unilateral o bilateral) o EP (aislada o asociada a TVP): el momento de presentación de la ETV tras la cirugía; el tratamiento recibido en fase aguda y durante los 3primeros meses y las complicaciones tras la instauración del tratamiento inicial, fundamentalmente hemorragias, recidiva trombótica y mortalidad.
Los datos se recogieron cuando los pacientes otorgaron su consentimiento explícito para participar en el Registro RIETE, de acuerdo con los requisitos de cada hospitaly tras haber obtenido la aprobación del estudio en los respectivos comités éticos.
Los investigadores locales del proyecto RIETE registran las variables de los pacientes incluidos de forma consecutiva, utilizando la aplicación informática en red. Las identidades de los pacientes permanecen ocultas y cada caso se identifica por una clave numérica única asignada por el centro coordinador.
Análisis estadísticoSe ha realizado un análisis descriptivo calculando medidas de tendencia central y dispersión para las variables numéricas. Las variables que siguen una distribución normal se expresan como media y desviación típica. Las variables no normales, como mediana y percentiles. Las variables categóricas se expresan como frecuencias absolutas y relativas. Para comprobar la normalidad de las variables se utilizó el test de Kolmogorov-Smirnov.
Para las variables categóricas se utilizó el test de chi-cuadrado de Pearson o Fisher, dependiendo de las condiciones de aplicabilidad. Para las variables numéricas se aplicó el test de la t de Student para muestras independientes o de Mann-Whitney en los casos de no normalidad. Se realizó un análisis bivariante y multivariante para estudiar las variables que se relacionaban con el tiempo de aparición de la ETV como variable dicotomizada (detección antes o después del alta). Los datos se han analizado mediante el software IBM SPSS Statistics 19.
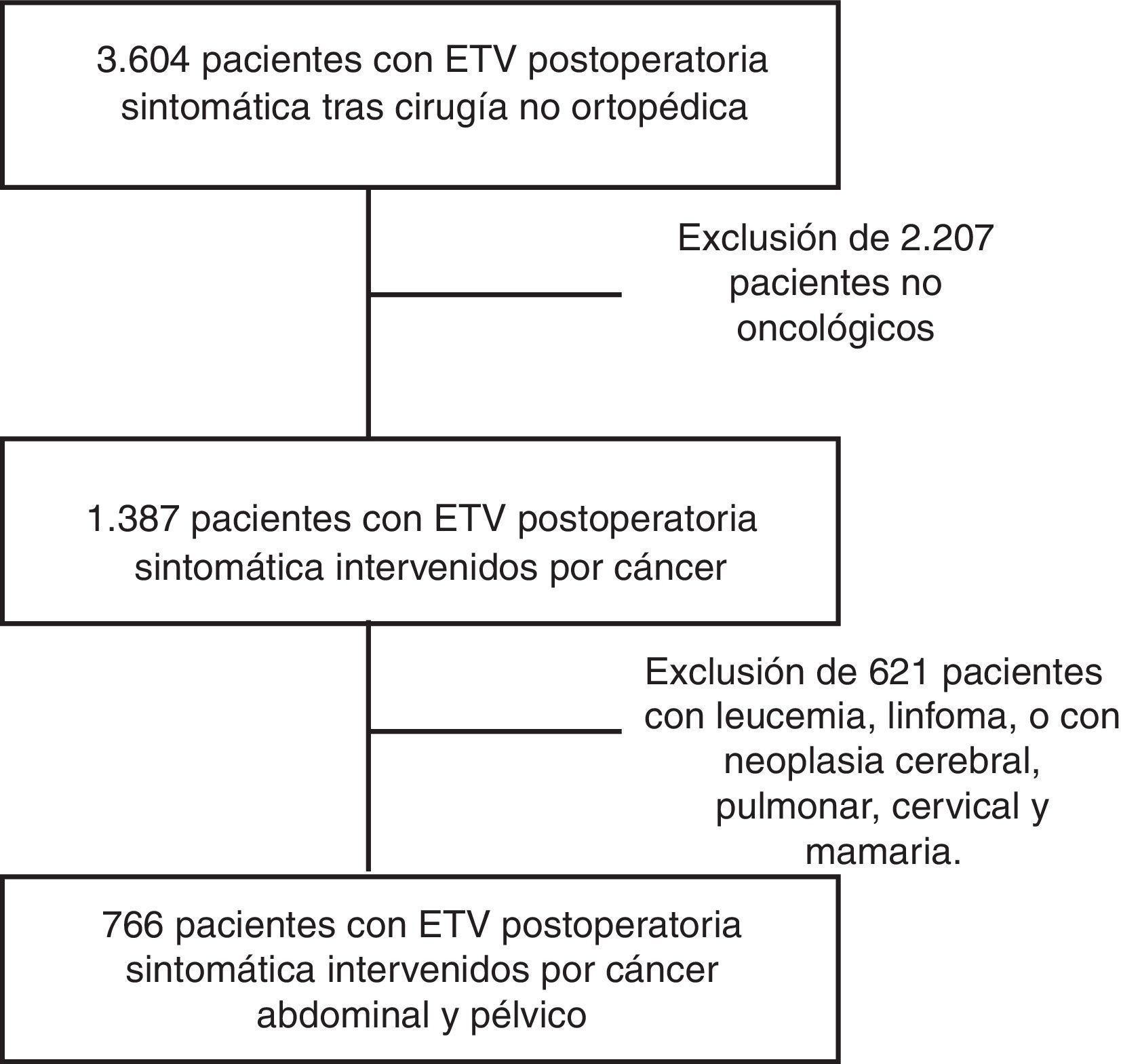
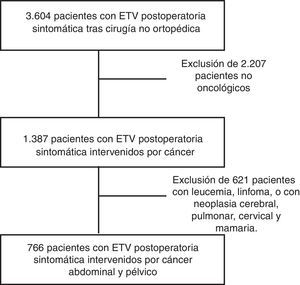
ResultadosRespecto a las características de los pacientes, durante un periodo de 12 años, se incluyó en RIETE a 3.604 pacientes con ETV tras cirugía no ortopédica ni traumatológica, de los cuales 766 presentaron esta complicación tras una cirugía oncológica abdominal y pélvica (fig. 1).
La edad media (± desviación típica) de los pacientes fue 66±11 años, y el rango se situó entre 22 y 94 años. La tabla 1 detalla la localización agrupada de los tumores por los que se intervino a los pacientes. Los tumores digestivos representan el 54% del total, seguidos de los tumores urológicos (30%) y ginecológicos (12,5%). Con respecto al estadio tumoral, el 68% de los pacientes presentaba metástasis y el 47 y el 8% habían recibido quimioterapia y radioterapia, respectivamente.
Número de casos de ETV, momento de presentación y forma de presentación de acuerdo con la localización del cáncer
| Localización del tumor | Número (%) | Intervalo entre cirugía y ETV Días±desviación típica (IC 95%)* | ETV tras el alta** N (%) | TVP aislada*** N (%) | EP aislada*** N (%) |
|---|---|---|---|---|---|
| Esofagogástrico e intestinal | 88 (12) | 28±18 (24-32) | 29 (33) | 54 (62) | 34 (38) |
| Hepático, biliar o pancreático | 55 (7,5) | 22±16 (17-26) | 20 (36) | 30 (54) | 25 (46) |
| Colorrectal | 268 (36,5) | 28±19 (26-30) | 146 (55) | 150 (56) | 118(44) |
| Urológico | 227 (31) | 24±17 (22-26) | 134 (59) | 120 (53) | 107(47) |
| Ginecológico | 96 (13) | 24±19 (21-28) | 58 (60) | 52 (54) | 44 (46) |
Recibieron profilaxis antitrombótica con fármacos anticoagulantes 575 pacientes (75%). Los métodos más empleados fueron las HBPM en el 96% de los casos, con una dosis media de 4.000±2.300 UI. La duración media de la profilaxis fue de 13±9 días.
En cuanto a la forma de presentación de la ETV postoperatoria, desarrollaron TVP aislada 370 pacientes (48%), 288 pacientes (38%) EP aislada y 108 EP asociada a TVP (14%). En definitiva, el 48% presentaban TVP sin embolia y el 52% EP con o sin TVP asociada. La trombosis afectó al miembro inferior derecho en 203 pacientes (41%), al izquierdo en 237 (49%) y fue bilateral en 49 (10%). A su vez, 272 (78%) TVP de los miembros inferiores se localizaban en sectores venosos proximales a la rodilla. De los 61 casos con trombosis en los miembros superiores, en 48 (80%) esta se asoció a la presencia de catéter venoso central.
Aunque las diferencias no fueron estadísticamente significativas (p=0,07), el porcentaje de pacientes con ETV que presentaron EP aislada fue mayor en los 119/283 (42%) con sobrepeso u obesidad, que en los 57/146 (39%) pacientes con peso normal o los 8/36 (22%) de bajo peso.
Entre los pacientes que recibieron profilaxis farmacológica y desarrollaron ETV, el 43% presentó EP aislada frente al 46% de los que no la habían recibido, sin que estas diferencias fueran estadísticamente significativas (p=0,38).
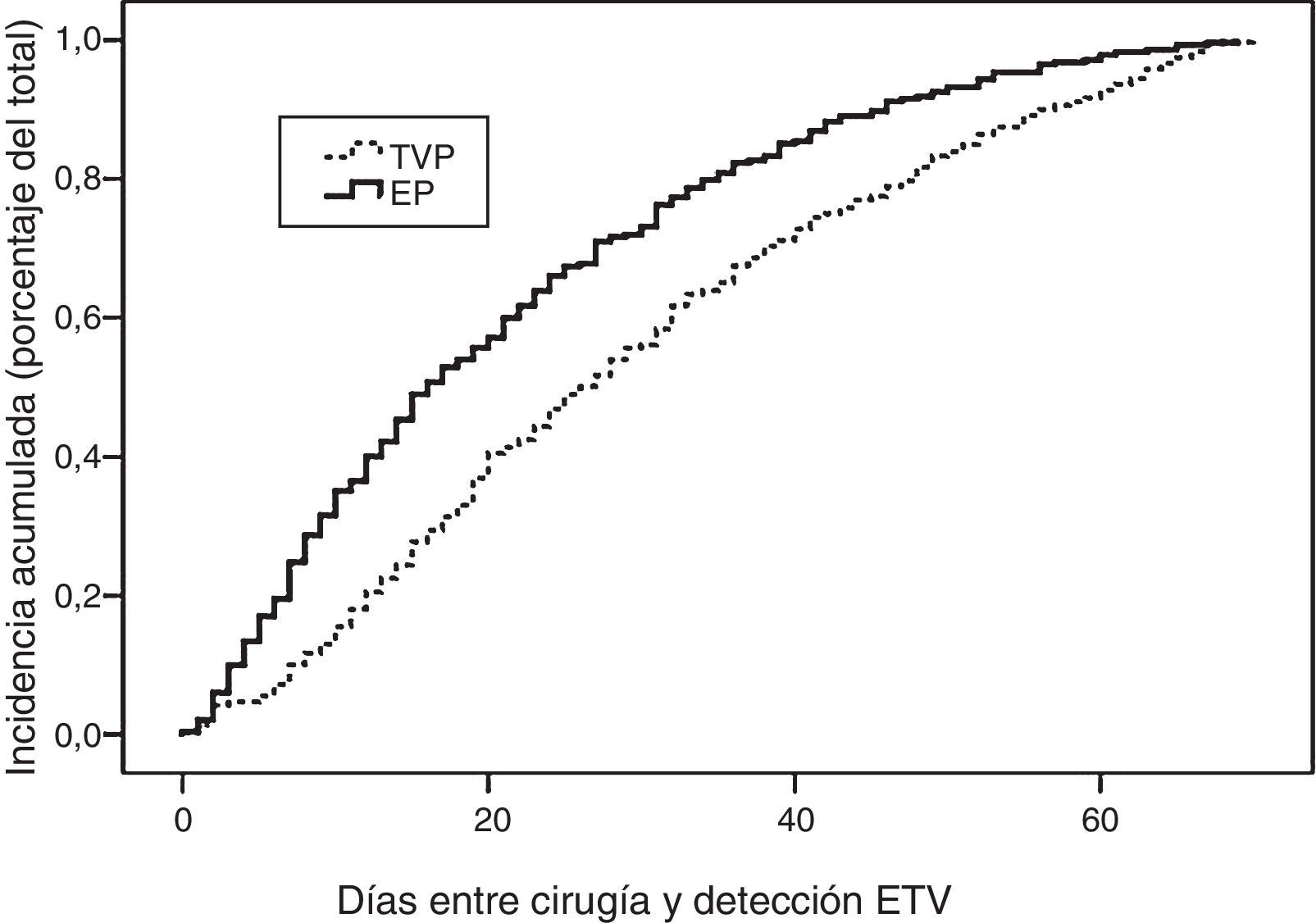
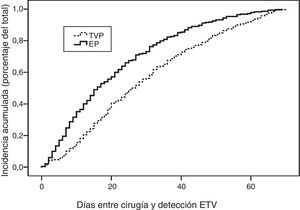
Con relación al momento de aparición, presentaron ETV en los primeros 7 días tras la intervención 123 pacientes (16%), entre el 8.° y el 30.° día postoperatorio 353 (46%) y pasados 30 días 290 casos, es decir el 38%. Por lo que se refiere a la forma de presentación de la ETV como TVP o EP±TVP (EP con o sin TVP asociada) y su momento de presentación, como se aprecia en la tabla 2, la mayoría de los pacientes con ETV precoz (<1 semana) desarrollaron EP±TVP (70%), mientras que casi el 60% de los pacientes con ETV de presentación tardía (>30 días), desarrollaron TVP aislada (p<0,001).
Tiempo transcurrido entre cirugía y diagnóstico de la ETV de acuerdo con su forma de presentación
| Forma de presentación | Intervalo entre cirugía y diagnóstico ETV* | ||
|---|---|---|---|
| ≤7 días | 7-30 días | ≥30 días | |
| TVP n (%) | 36 (30) | 168 (48) | 166 (57) |
| EP±TVP n (%) | 87 (70) | 185 (52) | 124 (43) |
El intervalo medio (±desviación típica) expresado en días entre la intervención y el diagnóstico de la ETV ascendió a 26,4±18 días. Por su parte, en función de la forma de presentación, transcurrieron de media 29,8±18 días en los casos que presentaron TVP y 21,4±17 días para la EP (p<0,05). No hubo diferencias significativas en el intervalo entre cirugía y diagnóstico de la ETV, que fue de 25,8±2 días en los pacientes que habían recibido profilaxis y de 26,2±2 en los que no (p=0,9).
El análisis de estos intervalos (tabla 1) según la localización del cáncer muestra que la ETV se presentó de forma más precoz tras cirugía hepatobiliopancreática en comparación con los cánceres colorrectales o esofagogástricos e intestinales, con diferencias estadísticamente significativas (p<0,05). La figura 2 muestra la curva actuarial del porcentaje de presentación en distintos intervalos tras la cirugía de los casos con TVP y EP.
En la serie total, la ETV se presentó después del alta en 408 (54%) casos. Respecto a la forma de presentación, entre los pacientes que experimentaron ETV tras el alta, 194 (47,5%) desarrollaron EP±TVP y 214 (52,5%) TVP aislada, diferencias que son significativas (p<0,05). En la tabla 1, que detalla el porcentaje de presentación de la ETV antes o después del alta, se observa que la mayoría de los cánceres de localización colorrectal y genitourinaria se diagnosticaron tras el alta, en contraste con los de localización esofagogástrica-intestinal o hepatobiliopancreática, en los que casi 2/3 se presentaron antes (p<0,001).
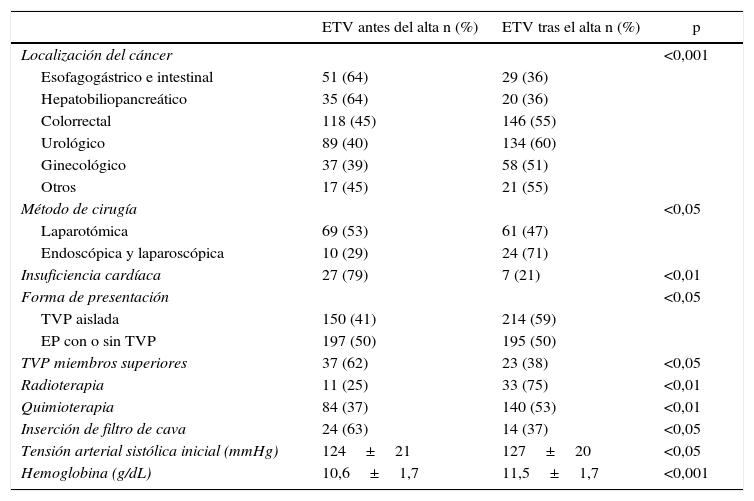
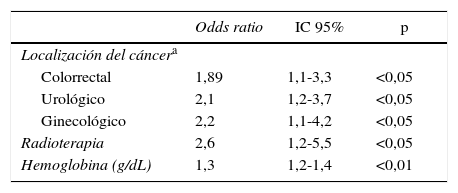
La tabla 3 muestra las variables que se asociaron de forma significativa mediante análisis bivariante con la presentación clínica de la ETV tras el alta hospitalaria. A su vez, la tabla 4 muestra las variables predictoras de presentación tras el alta, mediante análisis multivariante. El área bajo curva del modelo receiver operator characterisitics (ROC) es de 0,672.
Análisis bivariante de las variables que se correlacionan de forma significativa con la detección de la ETV tras el alta hospitalaria
| ETV antes del alta n (%) | ETV tras el alta n (%) | p | |
|---|---|---|---|
| Localización del cáncer | <0,001 | ||
| Esofagogástrico e intestinal | 51 (64) | 29 (36) | |
| Hepatobiliopancreático | 35 (64) | 20 (36) | |
| Colorrectal | 118 (45) | 146 (55) | |
| Urológico | 89 (40) | 134 (60) | |
| Ginecológico | 37 (39) | 58 (51) | |
| Otros | 17 (45) | 21 (55) | |
| Método de cirugía | <0,05 | ||
| Laparotómica | 69 (53) | 61 (47) | |
| Endoscópica y laparoscópica | 10 (29) | 24 (71) | |
| Insuficiencia cardíaca | 27 (79) | 7 (21) | <0,01 |
| Forma de presentación | <0,05 | ||
| TVP aislada | 150 (41) | 214 (59) | |
| EP con o sin TVP | 197 (50) | 195 (50) | |
| TVP miembros superiores | 37 (62) | 23 (38) | <0,05 |
| Radioterapia | 11 (25) | 33 (75) | <0,01 |
| Quimioterapia | 84 (37) | 140 (53) | <0,01 |
| Inserción de filtro de cava | 24 (63) | 14 (37) | <0,05 |
| Tensión arterial sistólica inicial (mmHg) | 124±21 | 127±20 | <0,05 |
| Hemoglobina (g/dL) | 10,6±1,7 | 11,5±1,7 | <0,001 |
Análisis multivariante de las variables predictoras de detección de la ETV tras el alta hospitalaria
| Odds ratio | IC 95% | p | |
|---|---|---|---|
| Localización del cáncera | |||
| Colorrectal | 1,89 | 1,1-3,3 | <0,05 |
| Urológico | 2,1 | 1,2-3,7 | <0,05 |
| Ginecológico | 2,2 | 1,1-4,2 | <0,05 |
| Radioterapia | 2,6 | 1,2-5,5 | <0,05 |
| Hemoglobina (g/dL) | 1,3 | 1,2-1,4 | <0,01 |
En cuanto al tratamiento recibido y a la evolución en los 3 primeros meses, diremos que en la fase inicial de tratamiento, 680 (90%) pacientes recibieron HBPM terapéutica a dosis plenas (12.524±3.288 UI diarias) y 75 (10%) heparina no fraccionada a dosis medias diarias de 25.402±9.637 UI, mientras que en la fase extendida del tratamiento, recibieron HBPM 409 (56%) y 305 (42%) recibieron fármacos antivitamina K orales. La duración media del tratamiento inicial en fase aguda fue de 13±5 días y la de la fase crónica 180±130 días.
Se recomendó reposo absoluto a 335 (46%) pacientes y no se restringió nada la movilidad en 117 (17%). Entre los 351 pacientes con TVP aislada de miembros inferiores, se recomendó reposo absoluto a 116 (33%), frente a 157 (60%) de los 260 con EP (p<0,01). Se recomendó el uso de medias elásticas a 191 (58%) de los pacientes con TVP aislada y a 45 (18%) con EP sin trombosis (p<0,001).
En los 3primeros meses de seguimiento, presentaron recidiva de la ETV 37 pacientes (4,8%). Dicha recidiva fue como TVP en 20 casos (54%) y como EP en 17 (46%). Por su parte, 68 pacientes (9%) presentaron complicaciones hemorrágicas, el 53% de las cuales se consideraron graves. Su localización más frecuente fue el tracto gastrointestinal (34%) y urinario (25%). En total, fallecieron 157 pacientes (20%), por las siguientes causas: atribuidas a la neoplasia en 86 casos (59%), a las hemorragias en 7 (4,8%) y a la embolia pulmonar en 6 casos (4%). En 6 pacientes (4%) se consideró que la muerte se debió a insuficiencia respiratoria, en 3 (2%) a insuficiencia cardíaca, y en 19 (12%) la causa fue desconocida. La ETV precoz tuvo peor pronóstico, ya que 117 (34%) de los 347 pacientes con ETV antes del alta experimentaron mala evolución (hemorragia, recidiva o muerte) frente a 98 (24%) de los 408 que tuvieron ETV tras el alta (p=0,004).
Tras el alta, tuvieron que reingresar 268 pacientes, que representan el 77% de los 348 pacientes dados de alta en los que consta esta información. El porcentaje de reingreso fue mayor en caso de EP (127 casos; 93%) que de TVP aislada (141; 66%) (p<0,05).
DiscusiónEste estudio demuestra que, en los pacientes que presentan ETV sintomática tras cirugía por cáncer abdominopélvico, esta aparece pasada una semana en casi el 80% de los casos y pasado un mes en más de 1/3. La ETV se presenta tras el alta en la mayoría de los pacientes, especialmente en aquellos operados por cáncer colorrectal y genitourinario, mientras que la mayoría de los tumores hepatobiliopancreáticos se presentan antes de ella. Por su parte, la EP es más frecuente en los pacientes con ETV precoz, que, además, tienen peor pronóstico.
Nuestros resultados ponen de manifiesto la importancia de seguir estos casos durante al menos 3meses ya que, si hubiésemos restringido el seguimiento a un mes, no hubiéramos detectado el 38% de los casos. Algunos estudios sobre historia natural de la ETV postoperatoria en otros grupos de pacientes quirúrgicos restringen el seguimiento a un mes3,11–13 y detectan que el 18-28% de las ETV se presentan tras el alta; sin embargo, los que aumentan este seguimiento a 3 meses como mínimo detectan el 40-50% de las ETV tras el alta14–18, lo que coincide con nuestros hallazgos.
Aunque la mayoría de las guías recientes de práctica clínica recomiendan prolongar la profilaxis durante 4 semanas tras cirugía oncológica abdominopélvica6,7,19–22, otras restringen esta recomendación a pacientes con ciertos factores de riesgo8,9. En nuestra serie, la duración media de la profilaxis, de 13 días, nos parece insuficiente, teniendo en cuenta que la ETV se detectó una media de 26 días tras la intervención. El hecho de que la mayoría de las ETV se presenten tras el alta puede explicar que muchos cirujanos subestimen la incidencia y el impacto real de la ETV postoperatoria y, por tanto, no extiendan la profilaxis tras el alta. Los registros prospectivos, como RIETE, con un seguimiento durante 3 meses permiten detectar estos casos tardíos23.
Aunque la elevada mortalidad en los 3primeros meses, en torno al 20%, estuvo relacionada con el cáncer en la mitad de los casos, es de destacar que la hemorragia —lógicamente relacionada con el tratamiento anticoagulante— y la EP ocasionaron cerca del 10% de las muertes. En general, la ETV tuvo peor pronóstico cuando se produjo antes del alta, lo que complicó el curso postoperatorio inicial.
Entre las limitaciones de nuestro estudio cabe destacar que solo se analizan pacientes con ETV sintomática confirmada y que desconocemos la evolución de los casos sin esta complicación. Otra de las limitaciones encontradas se deriva del hecho de que en el RIETE no se recogen las complicaciones postoperatorias de dichos pacientes. Además, no se puede descartar cierto sesgo de selección relacionado con los hospitales que participan en RIETE, aunque el hecho de que participen un elevado número de hospitales, que incluyen a pacientes consecutivos no seleccionados, podría reducir esa posibilidad. Entre las ventajas, podemos destacar el carácter prospectivo del registro, la inclusión de casos consecutivos no seleccionados, la exhaustividad de los datos recogidos, y especialmente, que haya un seguimiento clínico de 3meses.
En conclusión, la ETV se presenta tras el alta en la mayoría de los pacientes intervenidos mediante cirugía oncológica abdominopélvica, especialmente con cáncer colorrectal y genitourinario, y en los que reciben radioterapia. Sin embargo, la EP es de aparición más precoz que la TVP.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Nuestro agradecimiento a Sanofi España por el apoyo que ha brindado a este registro con una beca educacional sin restricciones. Asimismo, nuestro agradecimiento a Bayer Pharma AG por el apoyo brindado a este registro. El apoyo de Bayer Pharma AG se ha limitado a la parte internacional del RIETE, que representa un 24,26% del total de los pacientes incluidos en él. También queremos agradecer al Centro Coordinador del Registro RIETE, S & H Medical Science Service, por su control de calidad de los datos y por su apoyo logístico y administrativo. Por último, a Manuela Expósito, por su inestimable ayuda en el análisis estadístico e interpretación de los datos.
Coordinador del proyecto RIETE: Dr. Manuel Monreal (España).
Miembros del Comité Directivo RIETE: Dr. Hervè Decousus (Francia), Dr. Paolo Prandoni (Italia), Dr. Benjamin Brenner (Israel).
Coordinadora Nacional RIETE España: Dra. Raquel Barba (España).
Centro Coordinador del Registro RIETE: S & H Medical Science Service.
Miembros del Grupo RIETE en España:
Adarraga M.D., Aibar M.A., Alfonso M., Arcelus J.I., Ballaz A., Baños P., Barba R., Barrón M., Barrón-Andrés B., Bascuñana J., Blanco-Molina A., Camón A.M., Cruz AJ., de Miguel J., del Pozo R., del Toro J., Díaz-Pedroche M.C., Díaz-Peromingo J.A., Falgá C., Fernández-Capitán C., Fernández-Muixi J., Fidalgo M.A., Font C., Font L., Furest I., García M.A., García-Bragado F., García-Morillo M., García-Raso A., Garnés C.M., Gavín O., Gómez C., Gómez V., González J., Grau E., Guijarro R., Gutiérrez J., Hernández-Blasco L., Hernando E., Isern V., Jara-Palomares L., Jaras M.J., Jiménez D., Jiménez R., Jiménez S., Joya M.D., Lecumberri R., Lima J., Llamas P., Lobo J.L., López-Jiménez L., López-Reyes R., López-Sáez J.B., Lorente M.A., Lorenzo A., Loring M., Lumbierres M., Madridano O., Maestre A., Manrique-Abos I., Marchena P.J., Martín M., Martín-Martos F., Monreal M., Morales M.V., Nieto J.A., Nieto S., Núñez M.J., Odriozola M., Olivares M.C., Otalora S., Otero R., Pedrajas J.M., Pellejero G., Pérez-Ductor C., Peris M.L., Pons I., Porras J.A., Ramírez L., Reyes R., Riera-Mestre A., Rivas A., Rodríguez-Dávila M.A., Rosa V., Rubio C.M., Ruiz-Artacho P., Sáez M.T., Sahuquillo J.C., Sala-Sainz M.C., Sampériz A., Sánchez-Martínez R., Sancho T., Soler S., Soto M.J., Suriñach J.M., Tolosa C., Torres M.I., Troya J., Trujillo-Santos J., Uresandi F., Usandizaga E., Valero B., Valle R., Vela J., Vicente M.P., Vidal G., Villalobos A. y Xifre B.