Introducción. Las neoplasias malignas de apéndice vermiforme son entidades infrecuentes con marcadas diferencias de comportamiento, dependiendo de su tipo y subtipo histológico, de su tamaño y de su componente mucoide. Es preciso realizar un diagnóstico exhaustivo que permita un tratamiento específico.
Casos clínicos. Presentamos cuatro casos con estudio clínico, histológico, histoquímico, tratamiento y evolución: adenocarcinoide (goblet cell), carcinoide tubular, cistoadenocarcinoma y cistoadenoma mucinoso.
Discusión. La presentación clínica del tumor apendicular maligno, suele ser en forma de una masa apendicular descubierta en el curso de una apendicectomía por apendicitis o electiva en el curso de otro procedimiento abdominal, siendo infrecuente la clínica por sustancias vasoactivas por la escasa masa tumoral. En los carcinoides, el tamaño y subtipo histológico determinan la agresividad. Adenocarcinoma, adenocarcinoide y mixto son tumores agresivos que exigen terapias ra dicales. La posibilidad de producción de un seudomixoma peritoneal a partir de un tumor mucinoso ha acotado el concepto de tumor mucinoso de potencial maligno indeterminado y de un tratamiento específico; este término incluiría tumores de histología benigna, como el cistoadenoma.
Conclusión. La presentación clínica más frecuente de un tumor apendicular maligno es en forma de una masa apendicular inesperada en el curso de una apendicectomía. Siempre que sea posible, la resección apendicular y el tratamiento definitivo electivo, después de completado el estudio histológico, de extensión y preparado el colon, es la opción ideal.
Introduction. Malignant neoplasm of the vermiform appendix is an uncommon lesion that varies widely in behavior depending on the histological type or subtype, its size and mucin content. A comprehensive diagnosis that indicates a specific treatment is essential.
Patients and methods. We present the clinical, histological and histochemical findings in four lesions diagnosed, respectively, as goblet cell and tubular carcinoid tumors, cystadenocarcinoma and mucinous cystadenoma. The treatment and outcome are also reported.
Discussion. The malignant tumor of the appendix usually presents as an appendiceal mass discovered during the course of appendectomy to treat appendicitis or elective appendectomy performed during some other surgical procedure involving the abdomen. Symptoms due to vasoactive substances are not common because of the small tumor mass. In carcinoids, the size and histological subtype determine their aggressiveness; adenocarcinoma, adenocarcinoid and mixed carcinoid are aggressive tumors that require radical therapies. The chance of a mucinous tumor becoming a pseudomyxoma peritonei has opened to argument the concept of the mucinous tumor of uncertain malignant potential (UMP) and the possibility of a specific treatment strategy since this term would include benign tumors such as cystadenoma.
Conclusion. The most common clinical presentation of a malignant appendiceal tumor is in the form of a mass in the vermiform appendix encountered unexpectedly during the course of appendectomy. The treatment of choice, whenever possible, is resection of the appendix followed by elective definitive treatment after completion of the histological study, assessment of the extension of the lesion and colon preparation.
Introducción
La infrecuencia de aparición de tumores en el apéndice vermiforme1 es posiblemente el reflejo del pequeño tamaño del órgano; los cuatro tipos más frecuentemente descritos son: carcinoides, adenomas, adenocarcinomas y miscelánea2.
El diferente comportamiento biológico de los distintos tipos y hasta subtipos histológicos exige un diagnóstico adecuado histológico, clínico y de extensión para decidir una acción terapéutica, tanto quirúrgica como quimioterápica, si hubiere lugar, específica.Presentamos 4 casos, con estudio clínico, histológico e histoquímico. Así mismo, exponemos y razonamos la opción terapéutica elegida y la evolución, comparando nuestros resultados con los descritos en la literatura científica reciente al respecto.
Casos clínicos
Caso 1
Mujer de 35 años que ingresó con un cuadro, clínica, analítica y radiológicamente compatible con apendicitis aguda. Fue sometida a apendicectomía mediante un abordaje de McBurney, encontrándose una apendicitis localizada por lo que se efectuaron apendicectomía y lavado.
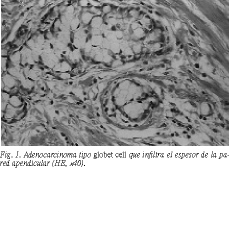
El informe anatomopatológico describió, macroscópicamente, un apéndice cecal de 8 cm, con engrosamiento de los dos tercios distales y signos flemonosos. Microscópicamente se apreció una infiltración de las capas musculares, lámina propia y serosa, por células PAS+, dispuestas en nidos sólidos y ocasionalmente formando luces glandulares. En el extremo proximal y en la pared del ciego se observaban zonas de patrón tubular (fig. 1). El diámetro máximo de la neoplasia fue de 2,8 cm. Los datos de la histoquímica se exponen en la tabla 1.
Con diagnóstico de tumor adenocarcinoide de apéndice tipo goblet cell, la paciente fue sometida a un estudio se extensión que fue negativo. Fue intervenida en un segundo tiempo mediante colectomía radical derecha, encontrándose un tumor en el muñón apendicular, sin invasión del ciego ni de las 21 adenopatías aisladas.
La paciente fue sometida a quimioterapia con 5-fluorouracilo y ácido fólico. Al tercer año desde el diagnóstico presentó carcinomatosis peritoneal con ascitis progresiva, emangiación y muerte.
Caso 2
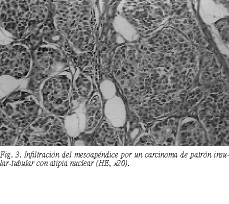
Mujer de 49 años, sometida a histerectomía total ampliada de forma electiva, con diagnóstico de tumoración intramural mesenquimal benigna del útero. En el curso de la intervención se encontró un apéndice cecal cuya punta engrosada era coalescente con la pared peritoneal supravesical, efectuándose una apendicectomía reglada. En el estudio anatomicopatológico se halló un fibroleiomioma uterino y se describió macroscópicamente un apéndice cecal de 7 cm de longitud, con un engrosamiento en la punta de 2 * 1 cm, de color amarillento al corte (fig. 2). Los datos de la microscopia pusieron de manifiesto, en su extremo distal, una proliferación celular que adoptaba fundamentalmente un patrón sólido insular, infiltrando de manera difusa todo el espesor del apéndice, y que se extendía con un crecimiento fundamentalmente periapendicular a la grasa con afectación del borde de resección. Con tinción de PAS, se observó escasa positividad, sobre todo en las luces tubulares, sin que se apreciara material mucoide PAS positivo intracelular. En el resto del apéndice, hasta su borde cecal, no se observaron alteraciones histológicas significativas (fig. 3). La histoquímica se distribuye según se expone en la tabla 2.
Con diagnóstico de tumor carcinoide mixto insular-tubular de 2 * 1 cm que se extendía a la grasa periapendicular y con el borde de resección distal afectado, efectuamos una nueva exploración laparotómica, realizando resección del lecho supravesical y de la cicatriz anterior en todo el espesor de la pared. En el estudio histológico no se encontró tumor residual. Tras 4 meses, la enferma no ha manifestado alteraciones, y se encuentra pendiente de una exploración laparoscópica (second look) al año.
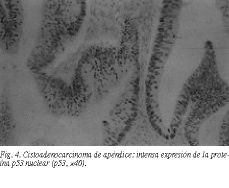
Caso 3Varón de 66 años, operado 4 años antes, en otro centro de adenocarcinoma moderadamente diferenciado de sigma, en estadio B de Duckes, T2N0M0. No nos constaba que hubiera recibido quimioterapia, y la última revisión fue realizada 2 años antes, e informada como libre de enfermedad. Ingresó por presentar un cuadro de 6 h de evolución sospechoso de peritonitis localizada en el cuadrante inferoderecho abdominal. La radiología simple y la ecografía orientaban hacia una colección séptica en la fosa ilíaca derecha. Fue intervenido con el diagnóstico de apendicitis, encontrando un absceso periapendicular que se drenó y un apéndice engrosado en su tercio proximal y con una perforación en la base que afectaba a la pared del ciego. Se realizó una biopsia peroperatoria de un borde de la perforación, que se informó como cistoadenocarcinoma apendicular. Se llevó a cabo una colectomía radical derecha con anastomosis instrumental terminolateral y drenaje del cabo distal del colon transverso sobre sonda de Pezzer al flanco. La anatomía patológica definitiva encontró, macroscópicamente, una tumoración exofítica granular desde la porción apendicular media hasta la pared del ciego, con un diámetro máximo de 3 cm. Se aislaron 16 ganglios. Microscópicamente se describió una proliferación de inicio en la mucosa, con un patrón glandulopapilar por zonas y extensas áreas de diferenciación coloide, con células aisladas incluidas en abundante material mucoso, que penetraban en profundidad en las capas musculares, infiltrando hasta la grasa mesentérica y con extensión en continuidad con la pared del ciego. Dos de las 16 formaciones ganglionares eran metastásicas. En la histoquímica se apreció una intensa positividad a la proteína p53 (fig. 4). El diagnóstico final fue de cistoadenocarcinoma mucinoso de apéndice con infiltración hasta la grasa mesentérica y pared cecal, T3N1M02. La determinación de CEA postoperatoria fue de 14 ng/ml, bajando al cabo de un mes a 2 ng/ml. Fue sometido a una pauta de quimioterapia de 5-fluorouracilo más ácido fólico. A los 2 años presentó una tasa de CEA de 17 ng/ml y metástasis diseminada bilobular hepática con emangiación progresiva y muerte.
Caso 4
Varón de 65 años diagnosticado de adenocarcinoma de próstata de grado 4 de Gleasson. En el estudio de extensión y durante la TAC abdominal se encontró una masa prerrectal, de paredes lisas y contenido líquido denso, de 25 cm de diámetro máximo, que se informó como intraperitoneal y no se encontraba dependiente de ningún órgano concreto. Al no llegar a ninguna conclusión diagnóstica planteamos el estudio laparoscópico, encontrando una masa lisa prerrectal con movilidad y que, al desplazarse al lateral izquierdo, se comprobó que estaba basada en el ciego. Con la sospecha de tumor apendicular mucinoso de potencial maligno desconocido y ante el riesgo de rotura y diseminación en el manejo endoscópico, se decidió su exéresis por laparotomía, efectuando un estudio histológico peroperatorio confirmatorio. La anatomía patológica describió, macroscópicamente, una masa quística de 25 * 10 cm con un contenido de aspecto mucoide, siendo la superficie interna en general lisa, con masas mucoides adheridas. Microscópicamente destacaban extensas áreas de aplanamiento del epitelio de revestimiento o la ausencia del mismo, con una pared de tejido fibromuscular; se apreciaban masas de material mucoide y, en las zonas que conservaban epitelio, éste era cilíndrico y ocasionalmente pseudoestratificado o papilar, con ausencia de mitosis y atipias. El paciente se mantiene libre de enfermedad 2 años después, en seguimiento y tratamiento hormonal de su neoplasia de próstata.
Resultados
Describimos 4 casos representativos de las variedades histológicas más frecuentes, entre las neoplasias de apéndice vermiforme1,2. El comportamiento clínico fue, en 2 casos, el de un proceso apendicular agudo, en otro un hallazgo peroperatorio en el curso de una intervención abdominal ginecológica y en el cuarto el de una masa intraabdominal descubierta en el estudio de extensión de una neoplasia prostática.
El diagnóstico definitivo se consiguió después de un estudio histológico e histoquímico electivo y la opción terapéutica se eligió según el tipo histológico, el tamaño (en las dos variedades con patrón carcinoide) y su contenido mucoso. La progresión neoplásica fue hacia la carcinomatosis en un adenocarcinoide tipo goblet cell de diámetro superior a 2 cm, hacia la enfermedad metastásica masiva en un cistoadenoma mucinoso estadio T3N1M0, encontrándose libre de enfermedad y pendiente de second look una paciente con un carcinoide tubular de 2 cm y libre de enfermedad, y en seguimiento un paciente con cistoadenoma mucinoso que pudo ser extirpado sin rotura ni diseminación de material mucoso.
Discusión
Los tumores apendiculares se dividen en carcinoides, adenomas, adenocarcinomas y mixtos. Los carcinoides suponen el 85% de las neoplasias apendiculares, apareciendo entre el 0,02 y el 1,5% de las apendectomías2,3. El tumor carcinoide es una neoplasia, por lo general de bajo grado, derivada del sistema endocrino difuso gastrointestinal, con células de estirpe endodérmica, enterocromafín y endocrinas específicas. Un número sustancial de estos tumores producen neuropolipéptidos que pueden evidenciarse con técnicas histoquímicas4. El sitio más común de asiento del tumor carcinoide es el tracto gastrointestinal (78% de los casos), con la máxima frecuencia de aparición en el intestino delgado (28%), seguido del apéndice (18%)5. Con respecto a la patogenia de estos tumores, se describe una expresión de oncogenes c-myc, bel-2, c-erbB2 y c-jun6.
La mayoría de los casos de ubicación apendicular son diagnosticados en el curso de una apendicectomía electiva durante otro procedimiento quirúrgico abdominal, o por una apendicectomía por apendicitis aguda2,3,7, siendo la clínica debida a la secreción de péptidos vasoactivos, excepcional, debido a la escasa masa tumoral2.
La división histológica más frecuente de los carcinoides es entre argentafines, no argentafines y el denominado adenocarcinoide, goblet cell o carcinoma de células crípticas2. Con un comportamiento biológico similar en argentafines y no argentafines, sin embargo, el comportamiento del adenocarcinoide es francamente agresivo. Se han descrito porcentajes de supervivencia a los 5 años próximos a cero en tumores con alto grado histológico, tamaño superior a 2,5 cm o con diseminación linfática, cecal o transcelómica en el momento del diagnóstico2,3,8,9. Como en nuestros 2 casos, el aspecto macroscópico y la clínica de ambos tumores es semejante.
Las dos variedades que describimos en este trabajo, ambas argirófilas, son incluidas frecuentemente en la variedad adenocarcinoide10 como procedentes de las células de la base criptal de la mucosa apendicular4,10. Sin embargo, el comportamiento biológico es opuesto, describiéndose el carcinoide tubular como de especial buen pronóstico10,11, mientras que al goblet cell se le atribuye un comportamiento entre el del carcinoide y el del adenocarcinoma2,8,9,12. La resección quirúrgica necesaria, el tratamiento complementario y el seguimiento de uno y otro son diferentes13; en nuestra opinión, en el tratamiento de una lesión sospechosa sería deseable, si técnicamente es posible, efectuar una apendicectomía reglada, un estudio histológico e histoquímico completo, siendo opcional en la actualidad el estudio molecular6. Y en caso necesario, una cirugía de ampliación con un colon preparado y una estrategia quirúrgica definida1,7.
La diferencia entre estas dos variedades, posiblemente relacionadas histogénicamente, se encuentra en la histología, que en el goblet cell, como en el caso presentado, se describe integrada por células PAS + que infiltran el espesor de la pared, repletas de material mucoide, formando nidos, con aparición ocasional de estructuras glandulares y acumulaciones mucoides extracelulares, existiendo evidente actividad mitótica9. Mientras que los carcinomas tubulares, generalmente más localizados, por lo común como masas del ápex apendicular10, están formados por células de escaso contenido mucoide, poca o nula actividad mitótica y agrupadas formando estructuras tubulares2,9.
Sus respectivos paneles histoquímicos10 se comparan en la tabla 3.
La existencia de áreas de patrón tubular es normal dentro de un tumor con histología fundamental de goblet cell, y viceversa. También se ha descrito en la clasificación histológica de la OMS el carcinoma mixto o carcinoide-adenocarcinoma11, con predominio del crecimiento carcinomatoso y áreas de goblet cell u otros tipos de carcinoides. Este tipo histológico presenta un comportamiento especialmente agresivo12.
El tratamiento propuesto para el carcinoide típico y el tubular es la apendicectomía reglada para tumores menores de 1 cm y la colectomía derecha para aquellos mayores de 2 cm13; se propone realizar un second look al año para casos entre 1 y 2 cm y casos, en que como el presentado, muestran infiltración extrapendicular7. En nuestro caso, la presencia en el estudio patológico electivo de afectación del borde parietal del apéndice nos llevó a una ampliación de bordes, con inclusión de la cicatriz de la pared abdominal, sitio que, por su gran actividad fibroblástica, sería de riesgo de recidiva14. Al año, efectuaremos una resonancia magnética nuclear de la zona y un second look, si es posible laparoscópico.
El adenocarcinoide y el mixto son neoplasias de un comportamiento biológico agresivo y, en casos con un patrón carcinomatoso de más del 50%, con más de dos mitosis/HPF o con infiltración de órganos del entorno o ciego suelen ocasionar extensión peritoneal, hepática y a órganos pélvicos, con un corto período de supervivencia9,15,16. Se indican en todos los casos la colectomía y posterior quimioterapia con pautas de 5-fluorouracilo-ácido fólico15 y recientemente oxaliplatino.
El cistoadenocarcinoma apendicular (caso 3), se diferenciaría del carcinoide mucinoso o goblet cell por presentar una mayor afectación mucosa, más atipia, un patrón infiltrativo más complejo e irregular y ausencia de caracteres de diferenciación neuroendocrina, evidenciables histoquímica o ultraestructuralmente17,18. La presencia de patrón celular en anillo de sello exige descartar un origen metastásico desde el estómago o la mama17. Los carcinomas de origen apendicular se estadifican y tratan según la estrategia adoptada para el adenocarcinoma colónico19.
El cistoadenocarcinoma, al igual que el cistoadenoma (caso 4), así como otros tumores mucinosos de ovario y páncreas, tienen la posibilidad de producir el fenómeno denominado seudomixoma peritoneal, consistente en la ocupación perito neal masiva por masas mucosas producidas por implante peritoneal de material celular mucosecretor, vertido por la rotura de una de estas neoplasias quisticomucosas13,20, aunque también se menciona en la bibliografía la posibilidad de transformación del mesotelio peritoneal en tejido mucosecretor21. El seudomixoma tiene un difícil tratamiento por su alta frecuencia de recidiva, indicándose la cirugía reductora y la quimioterapia intraperitoneal con cisplatino22.
La posibilidad del seudomixoma por lesión nos lleva, como en el tratamiento del caso 4, a proscribir absolutamente el tratamiento endoscópico de las lesiones quísticas apendiculares. El estudio histológico de estas lesiones debe ser exhaustivo, al describirse asociación de goblet cell y cistoadenoma23.
Actualmente se acepta el concepto de tumor mucinoso de potencial maligno incierto con el acrónimo inglés de UMP17,23, que incluye tumores de histología benigna como cistoadenomas, junto a entidades malignas caracterizadas todas por su naturaleza quística y por la producción de moco.
Conclusión
Los tumores malignos de apéndice cecal se manifiestan, fundamentalmente, como masas apendiculares, descubiertos en el curso de otro procedimiento como apendicitis agudas y sólo de manera excepcional por clínica vasoactiva.
La disparidad de tipos histológicos y de comportamientos biológicos aconsejan, siempre que sea posible, realizar una apendicectomía simple como primer tratamiento, efectuando, si se precisa, un segundo tiempo quirúrgico con un diagnóstico adecuado y una preparación de colon completa.
La presencia de una lesión apendicular clasificable como tumor mucinoso de potencial maligno incierto (UMP) exige una manipulación cuidadosa en previsión de rotura.
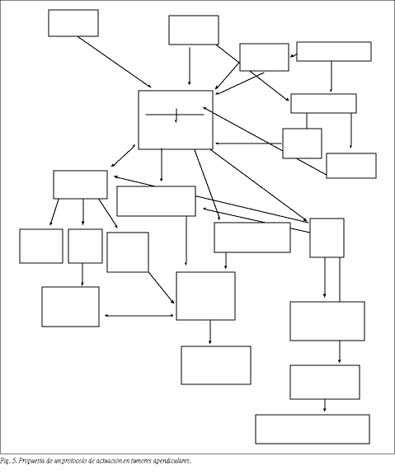
Proponemos el protocolo de actuación para el manejo de tumores apendiculares, cuyo diagrama se presenta en la figura 5.