Objective. The objective of this report is to present our experience with self-expanding esophageal endoprostheses with regard to the short-term and long-term complications, comparing coated and uncoated prostheses in terms of their primary and secondary permeability.
Patients and method. Sixty-two Wallstent metallic esophageal endoprostheses (42 uncoated and 20 coated) were implanted into 44 patients with inoperable carcinoma. The patients underwent peroral stent placement under fluoroscopic control, requiring a 24-hour hospital stay. Kaplan-Meier actuarial analysis was used to study the permeability of the prostheses.
Results. Five patients required the placement of two stents because of the extensive length of the stenosis. The immediate complications included obstruction of the mesh by a very soft tumor in one patient and postprocedure hematemesis in another. Forty-five percent of the patients with coated prostheses and 19% of those with uncoated prostheses complained of considerable retrosternal pain. Among the late complications, there were two cases of aspiration pneumonia, two cases of hematemesis and one case of late migration of two coaxial prostheses 8 months after implantation.
The study of primary permeability revealed no significant differences between the two types of stents (median: 92 and 90 days). Eight patients who developed late obstruction due to tumor underwent prosthesis replacement; they had a mean survival of 160 days.
Conclusions. The incidence of retrosternal pain is greater with the coated prostheses. There are no differences between the two types of stents with respect to permeability. If the prosthesis becomes obstructed by tumor tissue, its replacement should be considered.
Introducción
En el momento del diagnóstico, la mayoría de pacientes con carcinoma de esófago o de la unión esofagogástrica presentan una enfermedad incurable, siendo la supervivencia a los 5 años menor del 5%, por lo que el objetivo principal del tratamiento es conseguir una paliación de la sintomatología cada vez más efectiva1,2. La disfagia es con frecuencia la manifestación inicial de la enfermedad y se convierte en el síntoma más invalidante para estos pacientes.
La reciente introducción de las prótesis metálicas autoexpandibles de colocación peroral para el tratamiento de la disfagia maligna ha supuesto un gran avance y un cambio en el tratamiento de estos pacientes3-8. La colocación de prótesis esofágicas con control fluoroscópico no está exenta de riesgos, y se han descrito complicaciones tanto durante la manipulación de las prótesis como a medio y a largo plazo9,10.
Presentamos nuestra casuística en cuanto al implante y seguimiento de las prótesis esofágicas de Wallstent, recubiertas y no recubiertas, y estudiamos las complicaciones en relación con el procedimiento y los resultados de permeabilidad, analizando si existen diferencias significativas entre ambos tipos de prótesis.
Pacientes y método
Entre noviembre de 1994 y diciembre de 1998 hemos colocado 62 prótesis metálicas esofágicas de Wallstent (42 no recubiertas y 20 recubiertas) en 44 pacientes con carcinoma inope rable o irresecable que afectaba al esófago, siguiendo su evolución hasta diciembre de 1998. Los pacientes fueron 5 mujeres y 39 varones, con una media de edad de 71 ± 11 años. Se dividieron según el grado de disfagia, presentando grado IV 18 pacientes, grado III 22 pacientes y grado II 4 pacientes (tabla 1).
El estudio anatomopatológico demostró 16 adenocarcinomas (nueve con afectación de la unión esofagogástrica), 22 carcinomas epidermoides de esófago y 6 carcinomas de pulmón con infiltración esofágica. En 10 pacientes se observó la existencia de fístula o de invasión traqueobronquial.
Protocolo de actuación
El diagnóstico y las indicaciones del tratamiento se estudiaron en conjunto con el servicio de oncología médica y cirugía digestiva de nuestro hospital.
Ante la sospecha clínica se realizó en primer lugar un estudio esofagogástrico con administración de papilla de bario, que puso de manifiesto la estenosis; posteriormente, se efectuó una endoscopia del tracto digestivo superior con toma de biopsias y un estudio de tomografía computarizada toracoabdominal, sin y con administración de contraste intravenoso, para determinar el estadio tumoral. La broncoscopia se realizó en los pacientes con neoplasias del tercio superior y medio del esófago, ya que la invasión tumoral de la membrana posterior de la tráquea o la existencia de fístula traqueoesofágica hacen que sea irresecable. Si el tumor es locamente resecable se procede a realizar tratamiento quirúrgico.
Indicaciones de colocación de endoprótesis
La colocación de una endoprótesis de esófago está indicada ante la existencia de estenosis maligna de esófago inoperable o irresecable, ya sea por la lesión en sí o por extensión de ésta a otros órganos. Se colocará una prótesis recubierta ante la presencia de fístula esofagotraqueal o bronquial, la existencia de invasión de la pared traqueal por el tumor, o cuando el tumor sea muy blando y pueda introducirse rápidamente a través de la malla. Se indica la colocación de una prótesis no recubierta en todos los casos con afectación de la unión esofagogástrica, debido a la frecuente migración de las prótesis recubiertas en esta topografía6.
Contraindicaciones para la colocación de prótesis
1. Estenosis maligna que alcanza el esfínter esofágico superior.
2. Supervivencia estimada del paciente menor de 30 días.
3. Presencia de varices esofágicas.
4. Alteración muy severa de la coagulación: recuento plaquetario < 30.000 plaquetas, índice de Quick < 40%.
Diseño de la prótesis de Wallstent esofágica
La prótesis esofágica de Wallstent (Placehit) es una próte sis autoexpandible construida por monofilamentos biomédicos trenzados elaborados con una aleación de cobalto, que en principio fue diseñada como prótesis biliar (fig. 1) y posteriormente como prótesis vascular y esofágica. En estos últimos años ha aparecido en el mercado la prótesis parcialmente cubierta (Telestep) con un recubrimiento de poliuretano en su zona medial y con un sistema de largaje diferente al de la prótesis no recubierta (fig. 2). Ambas prótesis pueden ser reposicionadas parcialmente desplegadas, incluso con un 75% de liberación de la malla de la endoprótesis hacia delante o hacia atrás, lo que asegura prácticamente su correcta colocación.
Descripción del procedimiento
El paciente ingresó en el hospital el mismo día del procedimiento, se le pautó ranitidina i.v. (100 mg/8 h) y se instauró sedación ligera si el paciente lo requería.
La colocación de las prótesis se realizó en una sala de radiología vascular, dotada de un arco vascular con control fluoroscópico y con monitorización electrocardiográfica de los pacientes.
Se colocó un mordedor de endoscopia y se introdujo un catéter vascular (de tipo multipropósito o cobra 2) y una guía hidrofílica, con los que se franqueó la zona de estenosis en el esófago. Cuando se alcanzó con el catéter la cavidad gástrica se sustituyó la guía hidrofílica por una rígida de intercambio (tipo superstiff). Se colocaron marcas radiopacas en la piel del paciente delimitando la zona estenótica y se eligió una prótesis cuya longitud cubriera sobradamente la zona obstruida. En el supuesto de que la estenosis fuera muy larga se colocaron dos prótesis coaxiales.
Sobre la guía rígida se pasó el sistema de la prótesis, que dispone de marcas radiopacas en los extremos y una marca central. Una vez asegurada su posición se inició su liberación de la malla, retirando la prótesis de su funda. Se comprobó la expansión inmediata, así como su resultado en cuanto a la posición y, si era adecuado, retiramos la guía.
Seguimiento de los pacientes
Durante las primeras 24 h tras la colocación de la endoprótesis se realizaron controles clínicos (dolor, presencia de vómitos, disnea, hemorragia, fiebre, etc.), radiografía de tórax y un hemograma. El paciente permanecía en ayuno absoluto y con la misma pauta de ranitidina y, en caso necesario, se le administró metoclopramida (1 ampolla cada 8 h) o analgesia. Si el procedimiento había sido laborioso o existía fistulización, se instauraba una cobertura antibiótica.
Al día siguiente se realizó un esofagograma, incluyendo radiografía de tórax con contraste en el esófago en proyección posteroanterior y lateral. Si la prótesis era permeable y se evidenciaba una correcta expansión de la malla, el paciente comenzaba con la ingesta, primero de líquidos para pasar progresivamente a semisólidos y sólidos, dependiendo de su tolerancia. Si no aparecían complicaciones era dado de alta durante ese mismo día.
Si en algún momento de la evolución aparecía nuevamente la disfagia se le practicaba un esofagograma y una endoscopia con toma de biopsia y se revaluaba al paciente por si era necesaria la colocación de una segunda prótesis.
Análisis estadístico
El estudio de la permeabilidad de las prótesis se realizó con el test actuarial de Kaplan-Meier, comparando la permeabilidad entre las prótesis recubiertas y las no cubiertas (test de Mantel-Haenzel).
Resultados
Una vez realizado el tratamiento, todos los pacientes mejoraron su disfagia en mayor o menor medida durante la evolución de su enfermedad. En 10 pacientes se consiguió la desaparición total de su disfagia (grado 0), 28 pacientes presentaban una disfagia grado I y 6 pacientes referían disfagia grado II. Todos los casos con fístulas esofagotraqueales o bronquiales se resolvieron inmediatamente tras la colocación del stent recubierto.
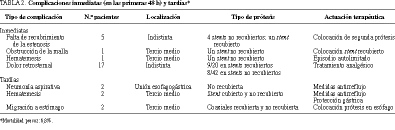
Complicaciones inmediatas (primeras 48 h)
En ningún caso aparecieron complicaciones técnicas debidas a un fallo en el sistema de la endoprótesis. En 5 pacientes, la estenosis era tan larga que requirió la colocación de 2 prótesis coaxiales para conseguir un total recubrimiento de la lesión. En un paciente se colocó una prótesis no recubierta, que se obstruyó a las 24 h por presentar un tejido tumoral extremadamente blando que se introdujo por los agujeros de la malla y que requirió la colocación de una prótesis coaxial recubierta, consiguiendo una adecuada luz esofágica. Un paciente afectado de un carcinoma de tercio medio del esófago presentó una hematemesis leve tras la colocación de una prótesis no recubierta, cediendo espontáneamente a las 24 h. La complicación clínica más frecuente fue el dolor retrosternal, sobre todo tras la colocación de la prótesis recubierta, con un 45% de pacientes (9 de 20 casos) que refirieron un dolor muy importante que precisó analgésicos opiáceos durante las primeras 24-72 h. En el caso de las prótesis no cubiertas, 8 de 42 pacientes (19%) refirieron dolor retrosternal, aunque de menor intensidad, ya que cedió con analgésicos convencionales.
Complicaciones tardías
Durante el seguimiento, 3 pacientes fallecieron en los primeros 30 días por deterioro importante y progresión de su enfermedad (mortalidad precoz de 6,8%).
Se registraron 2 casos de neumonía aspirativa en sendos pacientes en los que se había implantado una prótesis no recubierta en la unión esofagogástrica. La neumonía aconteció a los 4 y 5 meses, respectivamente (falleciendo, uno de ellos, a consecuencia de las complicaciones derivadas del cuadro infeccioso). Otros 2 pacientes presentaron hematemesis tardía (a los 3 y 4 meses de implantación) después de una historia de pirosis, que cedió con medidas antirreflujo y protección gástrica convencional.
En un paciente en el que se colocó una prótesis no recubierta apareció obstrucción tumoral a los 60 días, colocándose otra prótesis recubierta, coaxial a la primera, que restauró la per meabilidad. El paciente permaneció asintomático durante 8 meses, tras los cuales comenzó con disfagia, demostrándose la migración de las 2 prótesis al estómago y la obstrucción completa de la luz esofágica, que se resolvió con la colocación de otra prótesis no cubierta que le permitió ingerir alimentos hasta 3 meses después; a partir de ese momento su estado general empeoró y la enfermedad evolucionó, falleciendo posteriormente.
Las complicaciones se encuentran resumidas en la tabla 2.
Las complicaciones por obstrucción de la prótesis se reflejan mediante el estudio de permeabilidad.
Estudio de la permeabilidad
Por el método de Kaplan-Meier, la permeabilidad para las prótesis no recubiertas mostraba una mediana de 92 días (p = 50) y para las recubiertas de 90 días (p = 50), sin existir entre ambas diferencias significativas tras calcular el test de Mantel-Haenszel.
Dos pacientes (uno portador de una prótesis cubierta a los 2 meses y otro con prótesis no recubierta a los 3 meses) presentaron impactación de bolo alimentario que se resolvió mediante su extracción por endoscopia.
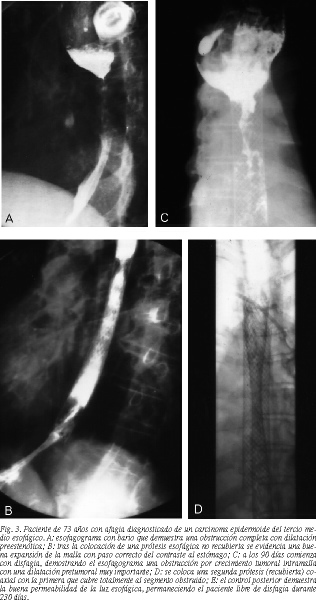
En 8 pacientes existió una obstrucción tumoral tardía (fig. 3 A-E) y se colocó una segunda prótesis, alcanzando una media de supervivencia (estudio de la permeabilidad secundaria) de 260 días, con un rango entre 70 y 401 días. El resumen de estos pacientes en los que se trató la obstrucción tumoral está expuesto en la tabla 3.
Discusión
La causa más frecuente de estenosis maligna esofágica es el carcinoma de células escamosas si la estenosis afecta la tercio medio o proximal del esófago; cuando la estenosis es del ter-cio inferior, la causa más frecuente es el adenocarcinoma gástrico. La neoplasia de esófago presenta una supervivencia muy baja, ya que en el momento del diagnóstico la mayoría de los casos son inoperables. El síntoma predominante es la disfagia, que conlleva una importante malnutrición y con frecuencia se acompaña de dolor torácico. También existe dificultad para tragar saliva, con el riesgo de aspiraciones que se pueden producir en las fases más avanzadas de la enfermedad1,11,12.
Debido a la gran distensibilidad de las paredes del esófago, la dificultad para tragar no se acusa hasta que el diámetro esofágico es menor de 13 mm. Ocasionalmente, el comienzo de la disfagia es repentino, pero en la mayoría de las ocasiones presenta una dificultad vaga de 3 a 6 meses de evolución. La odinofagia aparece en alrededor de la mitad de los pacientes1,2.
El tratamiento paliativo de la disfagia se ha convertido en el problema clínico fundamental de este tipo de pacientes, tanto en los tumores irresecables como en las recidivas tumorales de las anastomosis posteriores al tratamiento quirúrgico. Se han utilizado múltiples métodos para conseguir este objetivo y ninguno de ellos ha resultado totalmente eficaz; ejemplo de ello han sido las dilataciones esofágicas repetidas, la inserción de prótesis de plástico, tanto endoscópicas como quirúrgicas, la cirugía con láser, la radioterapia, la gastrostomía o el bypass quirúrgico13-16.
La inserción de las prótesis de plástico por vía endoscópica se realiza con anestesia general, y se han descrito diversas complicaciones, como la perforación esofágica, la sensación de cuerpo extraño, la impactación de comida y la migración del tubo en un número de casos no despreciable (20% de los pacientes)17,18. Füger et al13 estudiaron a 95 pacientes tratados con prótesis de plástico, encontrando complicaciones en un 36% de los casos, con una mortalidad del 16%. Otros autores describen hasta un 40% de complicaciones, y ninguno de los pacientes incluidos en el estudio consiguen ingerir alimentos sólidos19.
El tratamiento de la disfagia introduciendo un stent metálico fue sugerido por primera vez en 1983 por Frimberger20 y este sistema se fue modificando hasta conseguir las endoprótesis de las que disponemos en la actualidad.
Nosotros hemos utilizado prótesis de Wallstent porque consideramos que son de fácil implantación, ya que el bajo perfil y la gran fuerza expansiva radial que presenta la malla hacen innecesarias las dilataciones con balón antes y/o después del procedimiento. La aparición reciente de las prótesis de Wallstent recubiertas resuelve el problema, al menos en teoría, del cierre de trayectos fistulosos esofagobronquiales, y existen numerosas publicaciones que defienden esta indicación21-24.
Aunque las prótesis metálicas autoexpandibles de implantación peroral cumplen debidamente la misión de paliar la disfagia, no están exentas de riesgo. Se han citado hasta un 25% de complicaciones globales que, si bien es un porcentaje muy alto, es debido a que incluye tanto las complicaciones mayores como las menores, además de las obstrucciones tumorales10. Las complicaciones mayores son raras, sobre todo si se comparan con las que se producían tras la implantación de las prótesis rígidas de plástico, donde se han descrito perforaciones esofágicas hasta en un 18% de los casos25. Tras la colocación de prótesis metálicas es extraordinariamente rara la perforación esofágica, aunque recientemente se ha publicado un caso tras la implantación de una prótesis de Gianturco que se descubrió en la autopsia y que no se relacionó con la muerte del paciente, y 2 casos tras la colocación de prótesis recubierta de tipo Wallstent26,27. En nuestros pacientes no se demostró perforación en ningún caso. En cambio, coincidimos con los demás autores en que el dolor retrosternal es la complicación más frecuente, requiriendo analgesia con opiáceos en un 5% de los pacientes tratados10, y apareciendo con más frecuencia tras la colocación de prótesis largas y menos flexibles. En nuestro estudio, el dolor retrosternal apareció con más frecuencia e intensidad tras la implantación de prótesis recubiertas, que poseen una mayor rigidez. En cambio, el dolor a largo plazo es muy poco frecuente y en nuestros pacientes no se refirió en ningún caso. La mortalidad relacionada con el stent está descrita en el 0-6% de los casos y es secundaria a neumonías por aspiración o por hemorragia masiva debida a la erosión por la malla metálica de un vaso importante10. En nuestra casuística, las hematemesis fueron de poca cuantía y se resolvieron tras medidas convencionales, pero en cambio sí que tuvimos un caso de neumonía por aspiración que condujo a la muerte del paciente 5 meses después de la colocación de una prótesis en la unión esofagogástrica.
Las complicaciones menores incluyen la migración del stent, descritas en un 0-30% según las series, la impactación de bolo alimenticio en un 6% de casos referidos, así como la aparición de síntomas de reflujo en los casos de afectación del cardias9,28,29. Entre nuestros pacientes, en un caso migraron dos prótesis colocadas coaxiales, una no recubierta y sobre ésta una recubierta, que se desplazaron al estómago tras 9 meses sin relación con ninguna causa desencadenante (como, por ejemplo, tras un tratamiento con radioterapia); el paciente presentó nuevamente disfagia y se colocó una nueva prótesis, paliando los síntomas durante 3 meses. No conocemos la causa de esta migración, si bien desconocemos la evolución de estos pacientes a largo plazo, ya que la mayoría fallecen antes de los 6 meses. Disponemos de estudios de pacientes con estenosis benignas a los que se han implantado prótesis metálicas, y la evolución ha sido la migración al estómago en el 100% de los casos29.
Por otro lado, si los pacientes sobreviven el tiempo suficiente, a medio y largo plazo se producirá la obstrucción de la prótesis por el tumor, ya sea por crecimiento intramalla como a través de los extremos3-9. Aunque en estos casos la realización de un esofagograma nos ayudará a diferenciar la impactación de un bolo alimentario de la obstrucción tumoral, consideramos obligatorio el estudio endoscópico con toma de biopsia y la nueva valoración del paciente para decidir si precisa o no una nueva prótesis. La obstrucción tumoral de la malla metálica es un problema todavía no resuelto que obliga a evaluar y tratar nuevamente a estos pacientes. En nuestro estudio no hemos obtenido diferencias significativas entre la permeabilidad de las prótesis no recubiertas comparadas con las recubiertas, presentando ambas una permeabilidad muy similar. En cambio, en los 8 pacientes a los que se ha colocado una segunda prótesis por obstrucción tumoral hemos observado una supervivencia y una permeabilidad secundaria ostensiblemente más alta (media de 260 días). Creemos que esta cifra es debida a que, en estos pacientes, el crecimiento del tumor y su agresividad ha sido menor, consiguiendo una supervivencia global más prolongada que ha permitido un segundo tratamiento.
Consideramos efectivo el tratamiento con prótesis recubiertas en los casos de fístula esofagotraqueal o bronquial, en los que la colocación de este tipo de malla ha permitido el cierre de la fístula, hecho que coincide con otros autores20,21.
En resumen, consideramos que el tratamiento paliativo de la disfagia maligna con prótesis metálicas de Wallstent es útil, aunque no está exento de complicaciones que deben tenerse en cuenta, así como conocer su manejo para disminuirlas lo máximo posible. Las prótesis recubiertas producen mucho más dolor retrosternal al tener un diseño más rígido, y un 50% de los pacientes precisan analgesia potente tras el implante. No existen diferencias significativas entre las prótesis cubiertas y las no recubiertas en cuanto a la invasión tumoral; en cambio, las recubiertas están indicadas en los pacientes afectados de fístulas traqueales o bronquiales. Consideramos de utilidad la revaluación de los pacientes y, si se considera, la colocación de una segunda prótesis tras la recidiva de la disfagia por invasión del tumor, ya que mejora mucho la supervivencia.