El estudio de la calidad de vida relacionada con la salud en pacientes con cáncer digestivo y, de modo especial, en aquellos con tumores del esófago y del estómago, proporciona una información útil para seleccionar la opción terapéutica más adecuada y, asimismo, predecir el impacto de la enfermedad y, de sus posibles tratamientos, sobre la condición física, emocional y social del paciente.
En las últimas décadas se han desarrollado y validado diversos instrumentos que miden la calidad de vida de los pacientes de forma sensible y fiable; la utilización de cuestionarios ha facilitado el intercambio de esta valiosa información entre el paciente y el médico. Las variaciones pre y postoperatorias de la calidad de vida en pacientes con cáncer esófago-gástrico poseen valor pronóstico sobre la evolución de la enfermedad.
Por todas estas razones, la calidad de vida relacionada con la salud se considera hoy en día, junto con la supervivencia libre de enfermedad y la ausencia de recidivas, uno de los parámetros más importantes para poder evaluar el impacto de un determinado tratamiento oncológico sobre los pacientes.
El propósito de este artículo es revisar el papel de la valoración de la calidad de vida relacionada con la salud, así como los diversos instrumentos de los que se dispone para medirla, en los pacientes con cáncer esófago-gástrico.
The study of the health related quality of life in patients with digestive tract cancer, and particularly in those with tumours of the oesophagus and stomach, provides useful information for selecting the most suitable therapeutic option. It may also be used to predict the impact of the disease and its possible treatments on the physical, emotional and social condition of the patient.
Various sensitive and reliable tools have been developed over the past decades that are capable of measuring the quality of life of patients; the use of questionnaires has made it easier to exchange information between the patient and the doctor. The pre- and post-operative variations in the quality of life in patients with oesophageal-gastric cancer are of prognostic value on the outcome of the disease.
For all these reasons, the health related quality of life is currently considered, along with disease free survival and absence of recurrences, one of the most important parameters in order to assess the impact on the patients of a particular oncological treatment.
The aim of this article is to review the role of the health related quality of life assessment, as well as the various tools which are available to measure it in patients with oesophageal-gastric cancer.
Desde que, en 1948, se definió la salud como «…un estado de completo bienestar físico, mental y social, y no solamente la ausencia de enfermedad»1, el estudio de la Calidad de Vida Relacionada con la Salud (CVRS) ha experimentado un crecimiento exponencial2; de modo especial en pacientes oncológicos, como los que presentan neoplasias gastro-esofágicas, cuyos tratamientos pueden ocasionar efectos secundarios indeseables, para conseguir, a veces, un incremento muy limitado de la supervivencia3–5.
Es muy importante que el cirujano que trata a este tipo de pacientes les haga saber con claridad los efectos del tratamiento sobre su supervivencia y, de modo especial, sobre su calidad de vida. El paciente debe participar en la toma de decisión y ser conciente de la repercusión del tratamiento sobre la calidad de su vida cotidiana6. En pacientes candidatos a un tratamiento curativo o paliativo de neoplasias esofágicas y gástricas es importante el valor pronóstico de algunos parámetros básales de la CVRS y de sus variaciones en el tiempo4,6–10. Aceptada la importancia de la valoración de la calidad de vida mediante estudios bien diseñados que utilizan instrumentos con alta sensibilidad y validez3,4, es importante que el médico sea capaz de darla a conocer al paciente de manera comprensible6,11,12.
Nuestro objetivo es definir la CVRS y analizar los instrumentos que son utilizados para su evaluación, todo ello con especial atención a los pacientes con cáncer esofágico y gástrico.
Definición de CVRSEl término CVRS se refiere a una «construcción» multidimensional que mide la percepción que tienen los pacientes de los aspectos positivos y negativos relacionados con su enfermedad y con su tratamiento, al menos en 4 dimensiones: física, emocional, psicológica, así como la relacionada con el tratamiento2,4,13,14.
Una definición más escueta es la propuesta por Shipper et al15 quienes la definen como «las consecuencias funcionales de una enfermedad y de su tratamiento, tal y como las percibe el paciente».
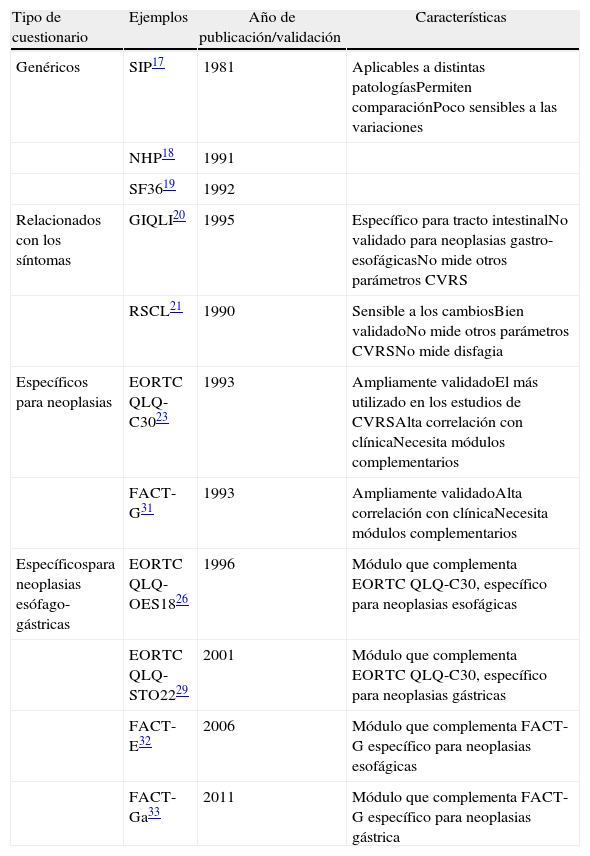
Instrumentos de medición de la CVRSEn la actualidad los instrumentos utilizados con mayor frecuencia para medir la CVRS son los cuestionarios auto-administrados4, dado que los pacientes son la fuente más apropiada de información sobre su propia CVRS4,6,16 (tabla 1).
Cuestionarios utilizados para el estudio de la CVRS en pacientes afectos por neoplasias esófago-gástricas.
| Tipo de cuestionario | Ejemplos | Año de publicación/validación | Características |
| Genéricos | SIP17 | 1981 | Aplicables a distintas patologíasPermiten comparaciónPoco sensibles a las variaciones |
| NHP18 | 1991 | ||
| SF3619 | 1992 | ||
| Relacionados con los síntomas | GIQLI20 | 1995 | Específico para tracto intestinalNo validado para neoplasias gastro-esofágicasNo mide otros parámetros CVRS |
| RSCL21 | 1990 | Sensible a los cambiosBien validadoNo mide otros parámetros CVRSNo mide disfagia | |
| Específicos para neoplasias | EORTC QLQ-C3023 | 1993 | Ampliamente validadoEl más utilizado en los estudios de CVRSAlta correlación con clínicaNecesita módulos complementarios |
| FACT-G31 | 1993 | Ampliamente validadoAlta correlación con clínicaNecesita módulos complementarios | |
| Específicospara neoplasias esófago-gástricas | EORTC QLQ-OES1826 | 1996 | Módulo que complementa EORTC QLQ-C30, específico para neoplasias esofágicas |
| EORTC QLQ-STO2229 | 2001 | Módulo que complementa EORTC QLQ-C30, específico para neoplasias gástricas | |
| FACT-E32 | 2006 | Módulo que complementa FACT-G específico para neoplasias esofágicas | |
| FACT-Ga33 | 2011 | Módulo que complementa FACT-G específico para neoplasias gástrica |
EORTC QLQ: European Organization for Research and Treatment QoL Questionnaire; FACT: Functional Assessment of Cancer Therapy; GIQLI: Gastrointestinal Quality of Life Index; NHP: Nottingham Health Profile; RSCL: Rotterdam Symptom Checklist; SF-36: Medical Outcomes Study 36-Item Short Form Health Survey; SIP: Sickness Impact Profile.
Estos instrumentos deben cumplir tres propiedades metodológicas: fiabilidad, validez y sensibilidad a los cambios (reliability, validity y responsiveness)2,13 y se dividen en genéricos, relacionados con los síntomas, y específicos del cáncer (complementados mediante módulos específicos para cada tipo de neoplasia)4,13.
Instrumentos genéricosSe basan en escalas creadas para ser utilizadas en un tipo de población afectada por diferentes tipos de enfermedades4. Ejemplos de estos instrumentos son el Sickness Impact Profile (SIP)17, el Nottingham Health Profile (NHP)18 y el Medical Outcomes Study 36-Items Short Form Health Survey (SF36)19. Permiten la comparación de la CVRS entre pacientes afectos por distintas patologías, aunque son poco sensibles a las variaciones individuales de los parámetros de CVRS4.
Instrumentos relacionados con los síntomasSe basan en la medición de los síntomas percibidos por el paciente sin tener en cuenta otros parámetros de la CVRS13. El Gastrointestinal Quality of Life Index (GIQLI) es un cuestionario que consta de 36 dominios, diseñado especialmente para la medición de los síntomas relacionados con enfermedades del tracto digestivo20. El Rotterdam Symptom Checklist (RSCL) es un cuestionario basado en 38 dominios y una pregunta genérica sobre el estado de la CVRS21, que ha sido adaptado, posteriormente, para incluir una escala de disfagia en pacientes con neoplasia esofágica22.
Instrumentos específicos del cáncerEn la actualidad los más utilizados son el European Organization for Research and Treatment (EORTC) Quality of Life Questionnaire (QLQ) C30 y el Functional Assessment of Cancer Therapy-General (FACT-G).
El EORTC QLQ-C30 es un cuestionario auto-administrado, especifico para pacientes con enfermedad oncológica, que mide 5 escalas funcionales (física, de rol, cognitiva, emocional y social), 3 escalas de síntomas (fatiga, dolor, nausea/vomito) y una escala sobre el estado global de la CVRS, a las que se añaden 5 preguntas únicas sobre síntomas concretos (disnea, pérdida de apetito, alteraciones del sueño, constipación y diarrea)23. Todos los parámetros analizados se miden con una puntuación entre 0 y 100 cuya variación entre 5 y 10 puntos se considera clínicamente significativa4,24. Este cuestionario, general para cáncer, ha sido complementado con módulos específicos para cada neoplasia, lo que permite mantener un grado aceptable de generalidad, útil en la comparación entre diferentes estudios, y también añadir una alta sensibilidad, necesaria para detectar pequeñas, pero clínicamente importantes variaciones en la CVRS de los pacientes4,13,25.
El módulo específico de la EORTC para cáncer de esófago (EORTC QLQ-OES18) se desarrolló en 199626 y se validó más tarde en un estudio multicéntrico sobre 491 pacientes27. De la misma manera se desarrolló y validó clínicamente el módulo específico para la neoplasia gástrica (EORTC QLQ-STO22)28,29. Recientemente ha sido validado un nuevo módulo (EORTC QLQ-OG25) que combina los dominios medidos en los módulos OES18 y STO22, para ser utilizado en pacientes afectos por neoplasias gástricas, esofágicas o de la unión esófago-gástrica30.
El FACT-G es un cuestionario que consta de 27 cuestiones sobre la CVRS, que incluyen 4 dominios (físico, social/familiar, emocional y funcional)31. Del mismo modo, y con los mismos objetivos que los cuestionarios QLQ-STO22 y QLQ-OES18, han sido creados y validados los módulos específicos para cáncer gástrico y esofágico asociados al cuestionario FACT-G (FATC-Ga y FACT-E)32,33.
Medición de la CVRS en pacientes con cáncer esofágicoEl impacto de la esofagectomía sobre la CVRS de los pacientes ha sido estudiado, en la última década, mediante estudios prospectivos, que utilizan instrumentos de medición ampliamente validados4,5,34.
La mayoría de los aspectos de la CVRS, tanto en las escalas funcionales como en las de los síntomas, resultan deteriorados significativamente durante los primeros meses después de la intervención quirúrgica, independientemente de la técnica quirúrgica utilizada4,5,34–38, a excepción del componente emocional que mejora en el periodo post-operatorio inmediato4,5,34,35,38, debido probablemente al alivio que percibe el paciente tras haber sobrepasado la operación4.
Tras el empeoramiento post-operatorio inicial de la CVRS, en algunos parámetros se observa una progresiva mejoría, hasta el punto de recuperar los niveles preoperatorios4,34, mientras otros, como la disnea, el reflujo o la diarrea, nunca llegan a volver a los valores previos a la cirugía34. Una excepción es la disfagia, que ha demostrado mantenerse estable o mejorar después de la cirugía4,5,35.
Cuando se compara la CVRS de pacientes intervenidos por cáncer esofágico con la población general, se pone en evidencia un empeoramiento casi global de los parámetros de la CVRS a los 6 meses de la intervención quirúrgica, con una recuperación tan solo parcial de éstos en los que sobreviven a los 3 años36. En un estudio prospectivo sobre 47 pacientes con una supervivencia mínima de 3 años, Lagergren et al34 observaron un deterioro de la mayoría de los parámetros de CVRS durante el periodo postoperatorio inmediato y su recuperación a largo plazo, a excepción de la función respiratoria, el reflujo y la diarrea que mantuvieron la tendencia a empeorar. Otros estudios confirman la persistencia de síntomas como el reflujo y el dolor en pacientes con supervivencia prolongada4.
En los pacientes con una neoplasia localizada en la unión gastro-esofágica (UEG), la gastrectomía total proporciona una mejor CVRS a los 6 meses del periodo post-operatorio cuando se compara con la esofagectomía transtorácica, por lo que podría considerarse como un procedimiento aconsejable para este subgrupo de pacientes39.
Otros factores, como las dehiscencias de anastomosis, las infecciones, las complicaciones cardiovasculares u otras complicaciones relacionadas con la técnica quirúrgica, así como la presencia de otras enfermedades previas a la intervención, los estadios tumorales avanzados (III y IV) y la localización del tumor en el tercio superior del esófago, son predictores de una peor CVRS postoperatoria40–42.
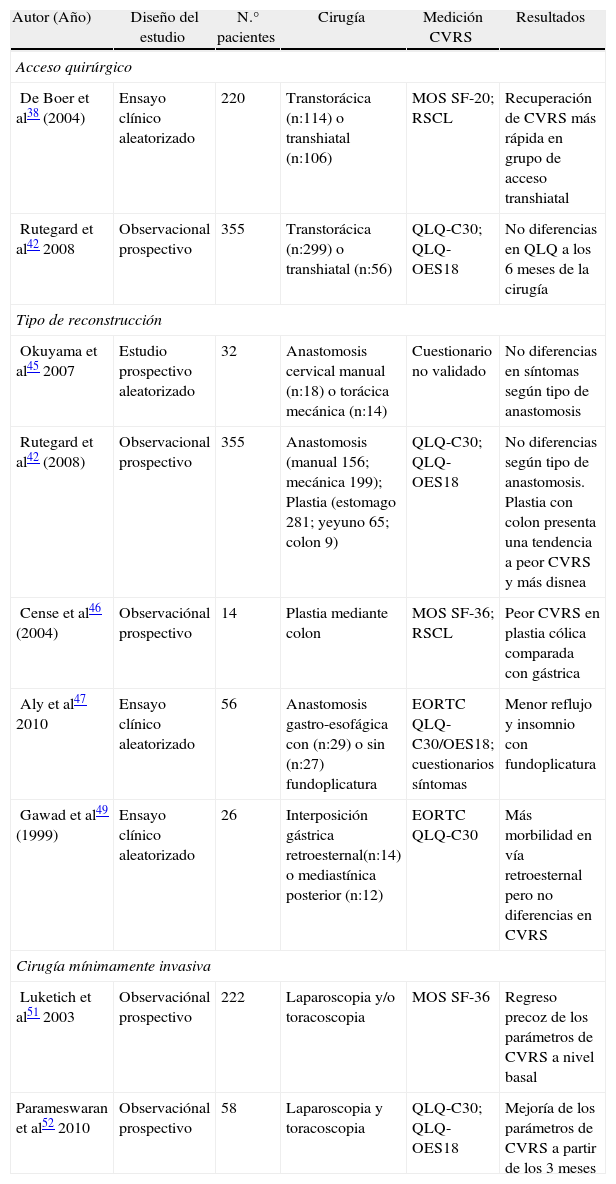
Factores relacionados con la técnica quirúrgica como la vía de acceso, el tipo de reconstrucción o el empleo de la cirugía mínimamente invasiva, pueden tener repercusión sobre la CVRS y merecen una especial atención (tabla 2).
Ejemplos de estudios que miden el impacto de la cirugía esofágica sobre la CVRS.
| Autor (Año) | Diseño del estudio | N.° pacientes | Cirugía | Medición CVRS | Resultados |
| Acceso quirúrgico | |||||
| De Boer et al38 (2004) | Ensayo clínico aleatorizado | 220 | Transtorácica (n:114) o transhiatal (n:106) | MOS SF-20; RSCL | Recuperación de CVRS más rápida en grupo de acceso transhiatal |
| Rutegard et al42 2008 | Observacional prospectivo | 355 | Transtorácica (n:299) o transhiatal (n:56) | QLQ-C30; QLQ-OES18 | No diferencias en QLQ a los 6 meses de la cirugía |
| Tipo de reconstrucción | |||||
| Okuyama et al45 2007 | Estudio prospectivo aleatorizado | 32 | Anastomosis cervical manual (n:18) o torácica mecánica (n:14) | Cuestionario no validado | No diferencias en síntomas según tipo de anastomosis |
| Rutegard et al42 (2008) | Observacional prospectivo | 355 | Anastomosis (manual 156; mecánica 199); Plastia (estomago 281; yeyuno 65; colon 9) | QLQ-C30; QLQ-OES18 | No diferencias según tipo de anastomosis. Plastia con colon presenta una tendencia a peor CVRS y más disnea |
| Cense et al46 (2004) | Observaciónal prospectivo | 14 | Plastia mediante colon | MOS SF-36; RSCL | Peor CVRS en plastia cólica comparada con gástrica |
| Aly et al47 2010 | Ensayo clínico aleatorizado | 56 | Anastomosis gastro-esofágica con (n:29) o sin (n:27) fundoplicatura | EORTC QLQ-C30/OES18; cuestionarios síntomas | Menor reflujo y insomnio con fundoplicatura |
| Gawad et al49 (1999) | Ensayo clínico aleatorizado | 26 | Interposición gástrica retroesternal(n:14) o mediastínica posterior (n:12) | EORTC QLQ-C30 | Más morbilidad en vía retroesternal pero no diferencias en CVRS |
| Cirugía mínimamente invasiva | |||||
| Luketich et al51 2003 | Observaciónal prospectivo | 222 | Laparoscopia y/o toracoscopia | MOS SF-36 | Regreso precoz de los parámetros de CVRS a nivel basal |
| Parameswaran et al52 2010 | Observaciónal prospectivo | 58 | Laparoscopia y toracoscopia | QLQ-C30; QLQ-OES18 | Mejoría de los parámetros de CVRS a partir de los 3 meses |
EORTC QLQ: European Organization for Research and Treatment QoL Questionnaire; MOF SF-20/36: Medical outcomes study short form 20/36; RSCL: Rotterdam Symptom Checklist.
Solo un ensayo clínico aleatorizado ha evaluado el efecto del acceso quirúrgico sobre la CVRS postoperatoria de los pacientes, utilizando instrumentos validados previamente38,43. En los pacientes intervenidos mediante acceso transtorácico se observó un aumento de los síntomas relacionados con la intervención quirúrgica y una disminución del nivel de actividad durante el primer año postoperatorio cuando se comparó con los del grupo de pacientes en los que se utilizó el acceso transhiatal38, sin un claro aumento de la supervivencia43. Recientemente, Rutegard et al42 no encontraron diferencias significativas en los valores de CVRS, dependiendo del tipo de acceso quirúrgico, en un estudio transversal efectuado sobre 355 pacientes, seis meses tras la realización de esofagectomía.
Tipo de reconstrucciónEl tipo de anastomosis, el tipo de reconstrucción que se utiliza para restablecer la continuidad del tubo digestivo y su situación en el tórax o en la región cervical, pueden tener importantes repercusiones sobre la CVRS.
En un estudio transversal sobre 46 pacientes, Schmidt et al44 observaron un empeoramiento, sobre todo en el reflujo y en el insomnio relacionado con éste, en pacientes a los que se había realizado una anastomosis intratorácica, comparados con los pacientes en los que se efectuó una anastomosis a nivel cervical. Okuyama et al45 no encontraron diferencias significativas en los síntomas postoperatorios cuando compararon la anastomosis cervical manual o intratorácica mecánica, en un estudio prospectivo aleatorizado sobre 32 pacientes, en los que se utilizó un cuestionario no validado.
Rutegard et al42 no evidenciaron diferencias significativas en los parámetros de CVRS, medidos mediante EORTC QLQ-C30 y OES18, según la técnica de anastomosis (manual o mecánica) ni el tipo de reconstrucción (estómago, colon o yeyuno).
Cense et al46 observaron un empeoramiento global de la CVRS y un aumento de los síntomas específicos, 21 meses tras realizar una reconstrucción mediante interposición cólica, comparando con la interposición gástrica.
En un reciente estudio prospectivo aleatorizado realizado sobre 56 pacientes, Aly et al47 observaron una significativa disminución de los síntomas postoperatorios relacionados sobre todo con el reflujo y el ardor, en los pacientes a los que se realizó una anastomosis esófago-gástrica con fundoplicatura asociada como técnica antireflujo, comparados con pacientes con anastomosis esófago-gástrica tradicional.
Finalmente dos estudios han analizado la CVRS de los pacientes según la colocación de la plastia y de la anastomosis. Nakajima et al48 compararon la anastomosis torácica superior en el mediastino posterior con la anastomosis cervical con interposición por vía retroesternal o mediastínica posterior, concluyendo que la primera tenía un menor impacto sobre la CVRS postoperatoria. Gawad et al49 realizaron un estudio prospectivo aleatorizado comparando la reconstrucción gástrica por vía mediastínica posterior con la retroesternal sin observar variaciones en la CVRS a pesar de una tasa más elevada de morbididad y mortalidad en el grupo con la reconstrucción por vía retroesternal.
Cirugía mínimamente invasivaEl estudio de la repercusión de este tipo de técnica quirúrgica sobre la CVRS ha experimentado un rápido crecimiento sobre todo en los últimos cinco años50–53.
En una amplia serie de casos, Luketich et al51 evidenciaron una recuperación precoz de la mayoría de los parámetros de CVRS a niveles basales, durante el periodo postoperatorio de la esofagectomía mínimamente invasiva (EMI), aunque el seguimiento de los pacientes no se realizó mediante instrumentos específicos para la neoplasia de esófago4. Parameswaran et al52 observaron un deterioro casi global de la CVRS a las 6 semanas de la realización de EMI, con una recuperación precoz entre los 3 y 6 meses del periodo postoperatorio, que se mantuvo en el control realizado al año.
Tratamiento paliativo del cáncer de esófagoRecientemente numerosos trabajos han incluido la medición de la CVRS entre los parámetros que deben tenerse en cuenta a la hora de escoger entre diferentes tratamientos paliativos del cáncer esofágico, desafortunadamente no siempre realizada mediante métodos validados6,54–56.
Algunos ejemplos de estudios prospectivos aleatorizados en los que se utilizan instrumentos de medición de la CVRS sensibles, son el trabajo de Homs et al57, en el que se compararan las prótesis metálicas autoexpandibles con la braquiterapia en dosis única, el trabajo de Shenfine et al58, donde se comparan las prótesis autoexpandibles con otros tratamientos endoscópicos y no endoscópicos y el trabajo de Dallal et al56, que evalúa la CVRS tras tratamiento paliativo mediante termoablación o prótesis autoexpandibles. Actualmente la colocación de prótesis autoexpandibles, la braquiterapia y la termoablación son las técnicas paliativas más utilizadas en el tratamiento de las estenosis esofágicas malignas porque consiguen una mejor paliación de la disfagia, una mejor CVRS y una menor tasa de complicaciones cuando se comparan con otros métodos de paliación como la cirugía, la quimioterapia o las prótesis rígidas54–57. La colocación de prótesis autoexpandibles consigue un alivio más rápido de los síntomas cuando se compara con la braquiterapia endoluminal, pero esta última permite una mejoría mantenida en el tiempo de la CVRS, por lo que es aconsejable en pacientes en los que se prevé una supervivencia más prolongada (3-6 meses)54,55,57. La termoabalación consigue a su vez una paliación de los síntomas y mejoría en la CVRS comparable con las dos técnicas anteriores, pero necesita para ello un mayor número de procedimientos repetidos54–56.
Medición de la CVRS en pacientes con cáncer gástricoA pesar de la reconocida importancia del estudio de la CVRS en pacientes afectos por neoplasia gástrica, en una reciente revisión sistemática de 87 estudios aleatorizados sobre técnica quirúrgica en el tratamiento de esta patología, solo 11 incluían algún método de medición de la CVRS y solo 7 utilizaban un instrumento específico3.
En general los pacientes que presentan cáncer gástrico, refieren un mayor número de síntomas preoperatorios, como insomnio, disminución de la actividad sexual y pérdida de apetito, comparados con la población general59.
Tras el tratamiento quirúrgico curativo mediante gastrectomía total (GT) o subtotal (GST), los pacientes presentan un empeoramiento inicial de las escalas funcionales que se recupera paulatinamente entre los 3 y 6 meses del periodo postoperatorio60–62, a excepción de las escalas emocional y social que, tal y como vimos en los pacientes intervenidos de esofagectomía, no varían o mejoran precozmente4,5,34,35,38. Esta mejoría progresiva tan clara no se observa en los síntomas gastrointestinales, como las restricciones a la alimentación, la pérdida de apetito y la diarrea, que persisten elevados a los 6 meses60 y al año62 de la intervención quirúrgica.
En un estudio transversal realizado en pacientes con una supervivencia mínima de 5 años tras GT, Tyrvainen et al63 observaron que éstos diferían de la población general únicamente en alteraciones del sueño, estrés y disturbios de la función miccional. Algunos factores no quirúrgicos que parecen tener influencia sobre los parámetros postoperatorios de la CVRS son la pérdida de peso pre y postoperatoria64,65, la enfermedad recurrente4, el número de enfermedades asociadas61, el tabaquismo61, el sexo femenino61 y un menor nivel de educación61.
El efecto de algunos factores relacionados con la técnica quirúrgica sobre la CVRS merece una revisión más detallada.
Tipo de linfadenectomíaLa extensión de la linfadenectomía realizada no parece influenciar la CVRS postoperatoria, de acuerdo con la literatura revisada66,67. Estos resultados han sido confirmados en un estudio aleatorizado realizado sobre 214 pacientes en los que se realizó linfadenectomía D1 o D3, que utilizó el cuestionario Spitzer Index y un cuestionario ad hoc para la medición de la CVRS68.
Tipo de resecciónUn único estudio aleatorizado comparó la CVRS postoperatoria en pacientes intervenidos mediante GT o GST69. A pesar de no utilizar instrumentos específicos ni autoadministrados para medir la CVRS, el estudio coincide en sus conclusiones con el resto de trabajos de la literatura, observando una mejor CVRS global en los pacientes intervenidos mediante GST4,62,69–73.
Tras gastrectomía total los pacientes presentan un mayor deterioro en la función física4,62, necesitan un mayor número de comidas diarias72, realizan un mayor número de deposiciones72, pierden más peso72 y presentan más nauseas, pérdida de apetito62,73 y restricciones en la alimentación62.
Siempre que sea posible, y manteniendo unos márgenes de resección apropiados, la GST proporciona una mejor CVRS postoperatoria y es el tratamiento de elección para los tumores distales del estomago4,62,69–73. Es necesario un estudio aleatorizado que compare las dos técnicas utilizando instrumentos validados de medición de la CVRS.
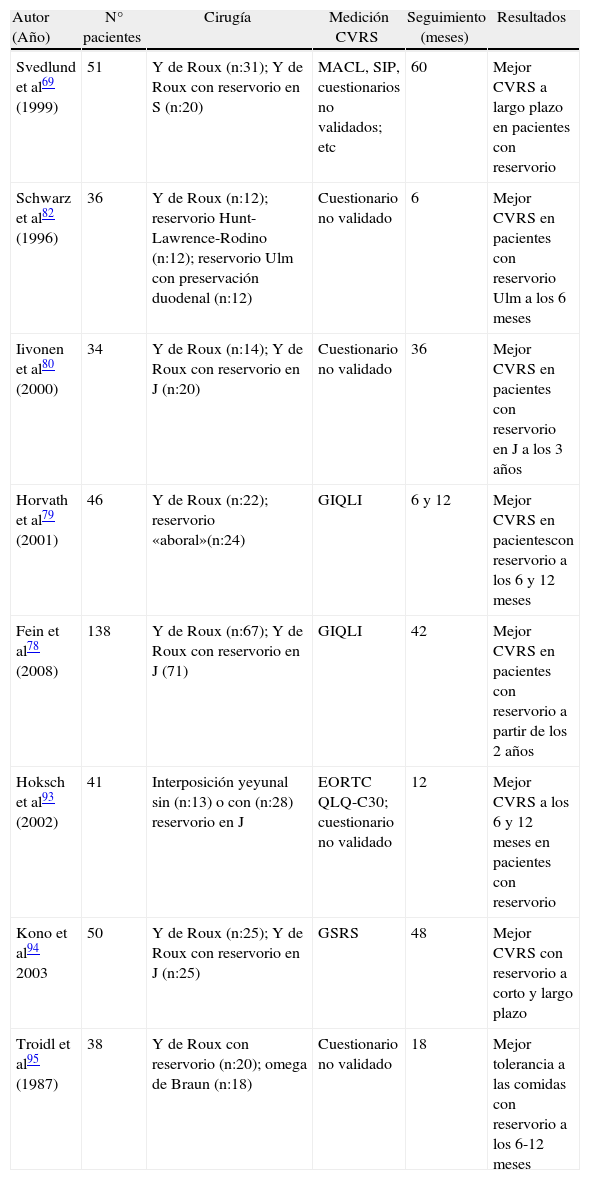
Tipo de reconstrucciónEl tipo de reconstrucción que debe ser utilizado después de una gastrectomía total, la necesidad de la preservación del paso duodenal, la importancia de realizar un reservorio y su tamaño son motivo de gran controversia en la literatura quirúrgica y son los aspectos técnicos más estudiados en relación a la CVRS4,74–78 (tabla 3). La revisión de estos estudios, realizados mediante instrumentos diferentes y no validados, no permite extraer conclusiones clínicas relevantes.
Estudios prospectivos aleatorizadoss que evalúan la CVRS post-operatoria en pacientes intervenidos de gastrectomía con o sin reconstrucción mediante reservorio.
| Autor (Año) | N° pacientes | Cirugía | Medición CVRS | Seguimiento (meses) | Resultados |
| Svedlund et al69 (1999) | 51 | Y de Roux (n:31); Y de Roux con reservorio en S (n:20) | MACL, SIP, cuestionarios no validados; etc | 60 | Mejor CVRS a largo plazo en pacientes con reservorio |
| Schwarz et al82 (1996) | 36 | Y de Roux (n:12); reservorio Hunt-Lawrence-Rodino (n:12); reservorio Ulm con preservación duodenal (n:12) | Cuestionario no validado | 6 | Mejor CVRS en pacientes con reservorio Ulm a los 6 meses |
| Iivonen et al80 (2000) | 34 | Y de Roux (n:14); Y de Roux con reservorio en J (n:20) | Cuestionario no validado | 36 | Mejor CVRS en pacientes con reservorio en J a los 3 años |
| Horvath et al79 (2001) | 46 | Y de Roux (n:22); reservorio «aboral»(n:24) | GIQLI | 6 y 12 | Mejor CVRS en pacientescon reservorio a los 6 y 12 meses |
| Fein et al78 (2008) | 138 | Y de Roux (n:67); Y de Roux con reservorio en J (71) | GIQLI | 42 | Mejor CVRS en pacientes con reservorio a partir de los 2 años |
| Hoksch et al93 (2002) | 41 | Interposición yeyunal sin (n:13) o con (n:28) reservorio en J | EORTC QLQ-C30; cuestionario no validado | 12 | Mejor CVRS a los 6 y 12 meses en pacientes con reservorio |
| Kono et al94 2003 | 50 | Y de Roux (n:25); Y de Roux con reservorio en J (n:25) | GSRS | 48 | Mejor CVRS con reservorio a corto y largo plazo |
| Troidl et al95 (1987) | 38 | Y de Roux con reservorio (n:20); omega de Braun (n:18) | Cuestionario no validado | 18 | Mejor tolerancia a las comidas con reservorio a los 6-12 meses |
GIQLI: Gastrointestinal Quality of Life Index; GSRS: Gastrointestinal Symptom Rating Score; MACL: Mood Adjective Check List; SIP: Sickness Impact Profile.
En un reciente metaanálisis de 21 estudios aleatorizados que evaluaba la influencia de la realización de un reservorio yeyunal en la reconstrucción del tránsito tras gastrectomía, la mayoría no medía la CVRS de los pacientes o lo hacían mediante cuestionarios no validados77. Dos estudios que comunicaban la CVRS postoperatoria mediante el cuestionario GIQLI coincidieron en afirmar que los pacientes reconstruidos con reservorio presentan una mejor CVRS a partir de los 2 años posteriores a la intervención78,79. La reconstrucción mediante reservorio yeyunal parece también permitir unas comidas de mayor volumen y menos fraccionadas80,81. Por lo tanto, la realización de un reservorio está justificada en pacientes en los que se prevé una larga supervivencia77–79.
Algunos autores defienden la preservación del tránsito duodenal porque parece asociarse a una mejor CVRS, menor pérdida de peso y mejor regulación hormonal de la motilidad intestinal a los 6 meses de la cirugía82. Estos resultados no han sido confirmados por estudios con seguimiento a largo plazo83.
En resumen, las conclusiones que se pueden extraer de cada estudio, por separado, son escasas, aunque, en conjunto, parecen favorecer la realización de un reservorio en los pacientes con una expectativa de vida más prolongada77,78,81. Son necesarios nuevos estudios que apliquen instrumentos sensibles de medición de la CVRS, que permitan una mejor comparación de los resultados.
Cirugía mínimamente invasivaRecientemente, Kim et al84 publicaron un estudio aleatorizado comparando la CVRS durante los primeros 3 meses del periodo postoperatorio, en pacientes intervenidos mediante gastrectomía subtotal, laparoscópica o abierta, utilizando EORTC QLQ-C30 y STO22. El grupo de cirugía mínimamente invasiva presentaba resultados significativamente mejores en las escalas de rol, física, social y emocional, así como una reducción de la puntuación en 10 escalas de síntomas.
Otros estudios no aleatorizados confirman la inicial ventaja que proporciona la cirugía laparoscópica en los parámetros de CVRS, y la progresiva disminución de las diferencias entre las dos técnicas con el paso del tiempo62.
Tratamiento paliativo del cáncer gástricoA pesar de que la importancia del estudio de la CVRS en los pacientes sometidos a tratamiento paliativo de cáncer gástrico sea hoy universalmente aceptada4,6, sorprende que, en una reciente revisión sistemática sobre tratamiento quimioterápico paliativo de la neoplasia gástrica, Wagner et al85 constatan la falta de medición de parámetros de CVRS en la mayoría de los estudios incluidos.
La quimioterapia ha demostrado no solamente un aumento de la supervivencia si no también una mejoría de la CVRS de los pacientes cuando se compara con la abstención terapéutica (best supportive care)4,6,85. Aunque la quimioterapia combinada haya demostrado un aumento de la supervivencia cuando se compara con la quimioterapia con un solo fármaco85, la primera opción presenta también un aumento en la toxicidad relacionada con el tratamiento, sin una clara mejoría en la CVRS85,86.
La asociación de 5-FU con irinotecan ha demostrado mínimas mejorías de la CVRS cuando se compara con la asociación de 5-FU con cisplatino6,87,88, así como las triple terapias que contienen docetaxel6,89.
Los estudios que comparan el uso de prótesis metálicas autoexpandibles con la realización de gastro-yeyunostomías quirúrgicas para la paliación de la obstrucción mecánica producida por un cáncer gástrico distal parecen favorecer la terapia endoscópica en los pacientes con una expectativa de vida reducida (< de 2 meses) y la quirúrgica en los pacientes en los que se prevé una supervivencia más prolongada90–92. Estos resultados han sido confirmados por un reciente estudio aleatorizado91.
ConclusionesLa CVRS de los pacientes es hoy uno de los parámetros principales que deben ser evaluados en los estudios de los resultados de la cirugía oncológica esófago-gástrica. La creación de instrumentos específicos de medición de la CVRS permite no solamente conocer la variación en su salud, percibida por nuestros pacientes, de manera sensible y exacta, si no también comparar los resultados de nuestra práctica clínica con el resto de grupos del mundo. Esta medición cobra una importancia fundamental en los pacientes con una esperanza de vida reducida, y en los que van a ser sometidos a un tratamiento quirúrgico agresivo. La variación de la CVRS que se producirá después de un determinado tratamiento es una información que el cirujano debe conocer y comunicar al paciente cuando le ofrece varias opciones terapéuticas. Estudios recientes demuestran la capacidad pronostica de las variaciones en los parámetros de CVRS lo que apoya la importancia práctica, para el paciente y cirujano, de su conocimiento y medición.
Por último, son necesarios estudios prospectivos que incluyan la medición de la CVRS basal y de la posterior al tratamiento, mediante instrumentos validados como el EORTC QLQ o el FACT-G, en todas la áreas de la cirugía oncológica esófago-gástrica.