Las lesiones traumáticas retroperitoneales constituyen un desafío para el cirujano de traumatología. Ocurren generalmente en el contexto de un paciente politraumatizado, con múltiples lesiones asociadas y en el que los procedimientos invasivos tienen un rol preponderante en el diagnóstico de estas lesiones. El retroperitoneo es la región anatómica que presenta mayores tasas de mortalidad, por lo que el diagnóstico precoz y tratamiento de estas lesiones adquiere especial relevancia. El objetivo de este trabajo es presentar la evidencia científica publicada hasta el momento en cuanto a su prevalencia, mecanismo lesional, métodos diagnósticos y tratamiento mediante una revisión de la literatura internacional de los últimos 70 años. Como conclusión, en esta revisión sistemática se pone de manifiesto una creciente tendencia al manejo no quirúrgico de las lesiones que afectan el retroperitoneo.
Traumatic retroperitoneal injuries constitute a challenge for trauma surgeons. They usually occur in the context of a trauma patient with multiple associated injuries, in whom invasive procedures have an important role in the diagnosis of these injuries. The retroperitoneum is the anatomical region with the highest mortality rates, therefore early diagnosis and treatment of these lesions acquire special relevance. The aim of this study is to present current published scientific evidence regarding incidence, mechanism of injury, diagnostic methods and treatment through a review of the international literature from the last 70 years. In conclusion, this systematic review showed an increasing trend towards non-surgical management of retroperitoneal injuries.
El traumatismo abdominal, tanto contuso como penetrante, se presenta con una frecuencia aproximada al 10% de los traumatismos del torso1. El mecanismo lesional varía en función del país y su estado socioeconómico y cultural, siendo una de las principales causas de morbimortalidad en cualquier franja de edad.
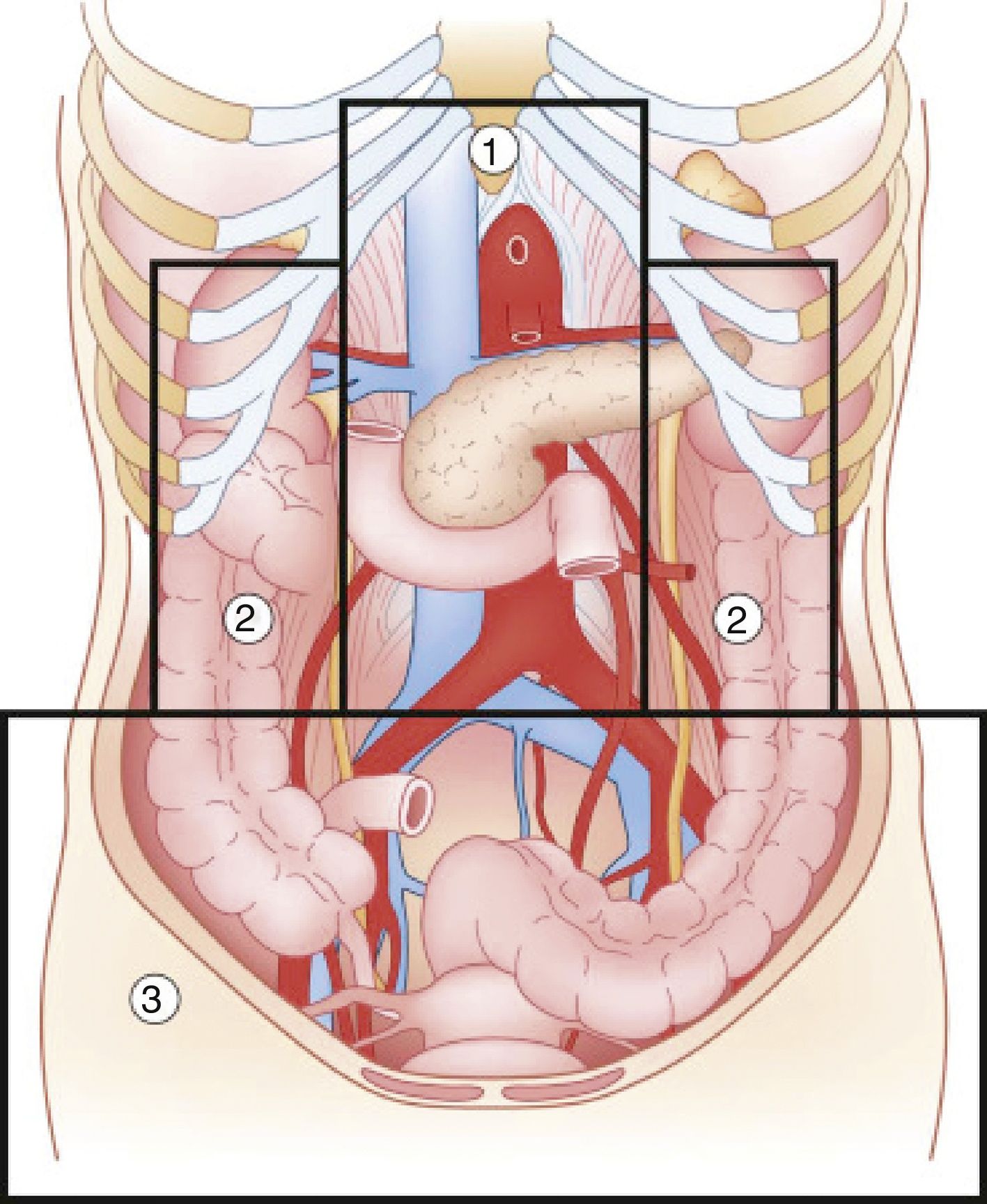
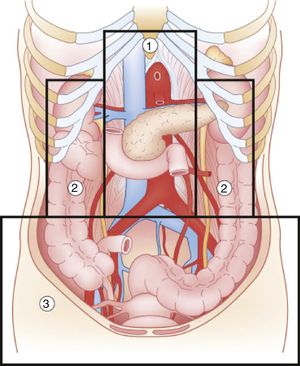
El compartimento retroperitoneal es el que presenta mayores tasas de mortalidad1. Teniendo en cuenta su compleja anatomía, el manejo de las lesiones retroperitoneales puede variar ampliamente (fig. 1)2. El objetivo de este trabajo es realizar una revisión de la literatura sobre las lesiones retroperitoneales, con énfasis sobre su prevalencia, diagnóstico y manejo.
División esquemática del retroperitoneo. Fuente: Martin et al.2.
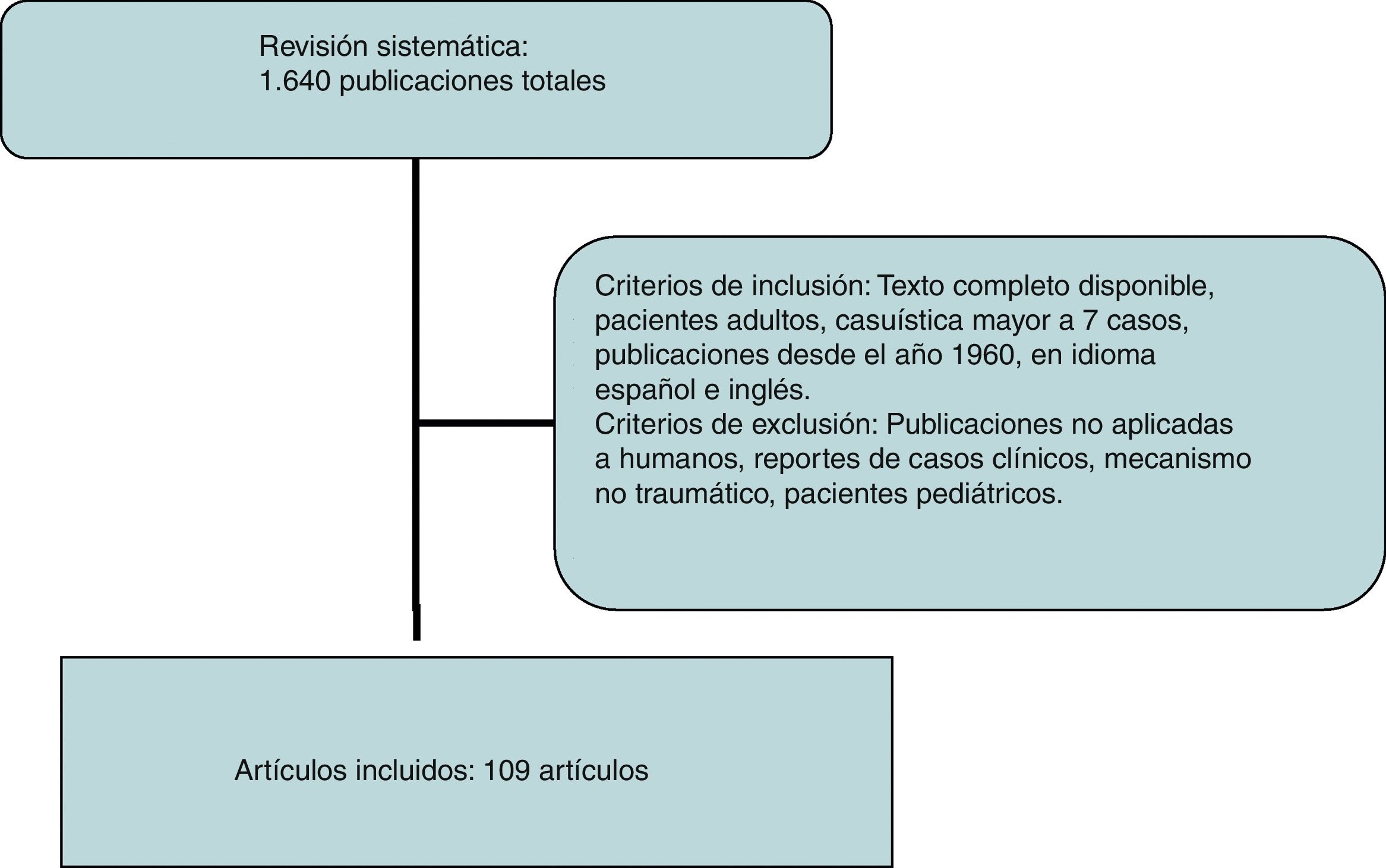
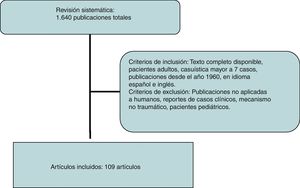
Se realizó una revisión sistemática de la literatura empleando la base de datos SCOPUS bajo los criterios que establecen sus revisores, realizando búsquedas específicas por órgano empleando las siguientes palabras clave: abdominal aorta, inferior vena cava, dudodenum, páncreas, renal vessels, kidney, suprarrenal glands, ureters, e iliac vessels, asociado a traumatic, incluyendo todas las publicaciones en inglés y español. Posteriormente se realizó una revisión manual excluyendo las publicaciones no aplicadas a humanos, reportes de casos clínicos o revisiones de la literatura, mecanismos no tráumaticos y pacientes en edad pediátrica, realizando una revisión exhaustiva desde 1960 hasta la fecha (fig. 2).
PrevalenciaLa incidencia de afectación del retroperitoneo en la literatura es variable. En un estudio1 realizado sobre más de 6.000 pacientes admitidos en una unidad especializada, el 15% presentaba afectación abdominal, de los cuales el 15% implicaba al retroperitoneo. A su vez, se reporta una incidencia del 12%3 en traumatismos abdominales cerrados en pacientes hemodinámicamente estables mediante tomografía axial computarizada (TAC). Se ha descrito al riñón como el órgano retroperitoneal más frecuentemente afectado (18%), seguido por el páncreas (3,7%) y la aorta (1%), predominando el mecanismo contuso sobre el penetrante1.
Por otro lado, y con una incidencia variable, los órganos abdominales más frecuentemente afectados por traumatismo penetrante son el hígado y el colon, seguido por las lesiones vasculares y el páncreas4.
Zona 1La zona 1 o central, se encuentra delimitada superiormente por el diafragma, e inferiormente alcanza la bifurcación aórtica. Incluye la aorta, el origen de los grandes vasos, el duodeno y el páncreas. El traumatismo contuso en esta región afecta en mayor medida al duodeno y al páncreas, siendo las lesiones vasculares menos frecuentes. La mayoría de las series analizadas describen un porcentaje de lesión duodenal que no supera el 12%4–9. Las lesiones pancreáticas presentan una incidencia que oscila entre el 1% y el 12% de los traumatismos penetrantes, y el 5% de los contusos10. La mortalidad oscila entre el 10% al 46%, siendo el daño ductal un importante predictor de morbimortalidad10.
En cuanto a la mortalidad por lesión duodenal, algunas series refieren rangos que oscilan entre el 15% al 47%, aumentando este porcentaje hasta el 67% con siete o más órganos asociados lesionados4. La complicación más frecuente es la fístula o dehiscencia duodenal.
Dentro de las lesiones vasculares destaca la lesión de la vena cava inferior, constituyendo del 30 al 40% de las lesiones vasculares abdominales. Su mortalidad global varía del 34% al 70%, siendo los factores de morbimortalidad tanto el nivel de la lesión, como la existencia de sangrado activo o de otras lesiones asociadas11. La mortalidad por lesión suprahepática y retrohepática varía entre el 78% y el 100% mientras que la lesión suprarrenal oscila entre el 33% al 66% frente al 25% de mortalidad en la afectación de la vena cava infrarrenal11,12. Se describe una mortalidad prehospitalaria que oscila entre 30 y 50%, cifras que se mantienen tras la admisión hospitalaria12.
Las lesiones aórticas abdominales se sitúan alrededor del 0,2%13, siendo su elevada mortalidad inmediata la segunda causa más común de muerte en traumatismos cerrados. Se estima que el 80% de los pacientes mueren antes de la asistencia hospitalaria, y entre 50% y 78% lo hacen posteriormente14,15.
Zona 2La zona 2, o lateral, comprende el área situada entre el diafragma y la bifurcación aórtica, limitando medialmente con los vasos renales y lateralmente con la fascia de Toldt, por lo que engloba las glándulas suprarrenales, los riñones, vasos renales, los uréteres, y una porción de colon ascendente y descendente.
Destaca en esta región anatómica la incidencia de lesiones renales de aproximadamente 1,2%16. Pocas lesiones urológicas ponen en peligro la vida, aunque representan algunas de las complicaciones más frecuentes. Sin embargo, las lesiones adrenales presentan una menor incidencia, situándose en torno al 0,4%17. Las lesiones vasculares renales, por otro lado, ocurren en menos de un 5% de los traumatismos cerrados.
La mortalidad asociada al traumatismo renal se sitúa entre el 5%18 y el 11%,16 mientras que la secundaria a lesiones arteriales alcanza el 20% en algunas series19. La mortalidad asociada a la glándula suprarrenal es muy variable, oscilando entre el 8%20 y el 32%. Destaca en algunas series que la mortalidad asociada a la lesión unilateral es nula17,21.
Zona 3La zona 3, o pélvica, se encuentra delimitada por la bifurcación aórtica superiormente. Incluye los vasos ilíacos, los uréteres distales, el colon sigmoide distal y el recto.
La incidencia de lesiones de los vasos ilíacos es menor del 1%. En concreto, constituye entre un 2% y un 6,5% de las lesiones vasculares22. Presenta una mortalidad que oscila entre el 25% y el 42% aunque en algunas series esta cifra puede alcanzar el 62%, presentando mayores tasas de mortalidad en traumatismos penetrantes. Dentro de este grupo la mortalidad se incrementa en aquellas lesiones combinadas arteriales y venosas (43-62%) frente a las lesiones venosas aisladas (6-45%)22,23.
Mecanismo lesionalZona 1El traumatismo penetrante es el más frecuentemente asociado a las lesiones aórticas según los datos obtenidos de la revisión de la literatura. Las lesiones vasculares asociadas más frecuentes afectan a la vena cava inferior, y únicamente un 2% de los casos presentan lesión vascular aislada15. La lesión aórtica más frecuente es la disrupción de la íntima que puede ser parcial o involucrar la totalidad de la circunferencia aórtica, pudiendo asociar trombosis y/o disección. Si el espesor completo está afecto puede dar lugar a la formación de un aneurisma o la rotura y consiguiente muerte por exsanguinación. La aorta infrarrenal representa el 50% de los casos, sin embargo, esta región es la que presenta menores tasas de mortalidad15.
De la misma manera las lesiones de vena cava se presentan en más de un 80% de los casos en el traumatismo penetrante, destacando las heridas por arma de fuego como mecanismo principal12. Con mayor frecuencia la región suprarrenal es la más afectada, mientras que en el traumatismo contuso existe un aumento de lesiones retrohepáticas11.
En la revisión de 13 series publicadas el mecanismo de lesión duodenal más frecuente fue el penetrante, con 1.550 casos (90,7%) de un total de 1.709 pacientes4–9,24–30. Destaca la incidencia de heridas por arma de fuego sobre las heridas por arma blanca. En los traumatismos duodenales cerrados aumenta la asociación con lesiones pancreáticas disminuyendo las hepáticas y cólicas25. Predominan dentro de este grupo los accidentes de tráfico sobre las caídas. Subyace bajo estas lesiones el mecanismo de cizallamiento entre las porciones fijas y móviles, así como fuerzas compresivas contra la columna vertebral31. El traumatismo pancreático de tipo penetrante se presenta de forma aislada en el 11% de los casos.
La segunda porción duodenal es la más frecuentemente afectada con una incidencia variable del 35% al 62,5%, seguido por la 3.ª y 4.ª porción (12-28%), siendo la primera porción duodenal la más respetada5–8,25,28,30,31. La lesión pancreática más encontrada es la que afecta al cuerpo y la cola, frente a la cabeza y el cuello de la glándula. La Asociación Americana de Cirugía del Trauma (American Association for the Surgery of Trauma) propone la clasificación según 5 grados de lesión tanto duodenal como pancreática32.
Zona 2En Estados Unidos entre el 80% y el 95% de los traumatismos renales se producen por accidentes de tráfico, caídas o asaltos18. En todas las series analizadas la tasa de traumatismos penetrantes es menor, siendo variable la proporción de lesiones por arma de fuego frente a lesiones por arma blanca. Lo más frecuente es la presencia de contusiones, seguido de laceraciones, rupturas renales y lesiones del pedículo vascular. En las lesiones adrenales se plantea un aumento de la presión en la vena cava inferior, lo cual explicaría el predominio de lesiones derechas17,20,33–36. Otros mecanismos descriptos son la desaceleración que afecta a las arteriolas suprarrenales y el aplastamiento entre la columna vertebral y los órganos vecinos, relacionándose con una mayor probabilidad de lesiones ipsilaterales asociadas20,37. Las lesiones ureterales son poco comunes, representando solo el 17% de los traumatismos urológicos penetrantes, siendo el mecanismo contuso una causa rara de lesión38.
Zona 3El traumatismo penetrante constituye la principal causa de lesión, siendo más frecuente la lesión venosa aislada (41%)22, seguida por la lesión arterial aislada (33%) frente a la combinación de ambas (25,5%). En el 73% de los traumatismos contusos se destaca su asociación con fracturas de pelvis, aumentando la probabilidad de lesiones genitourinarias e intestinales. Se describe una incidencia de lesión vascular del 3,5% en las fracturas pélvicas complejas, que asciende al 7% en las fracturas severas39.
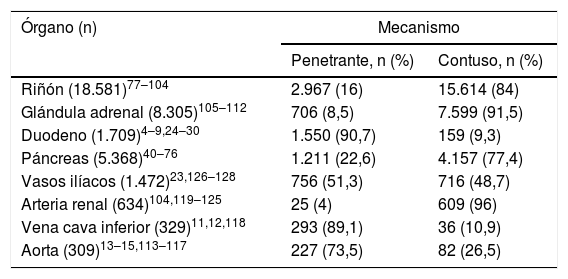
En la tabla 1 se presentan los órganos más frecuentemente afectados según los mecanismos de lesión y el rango de edades.
Órganos afectados según mecanismo de lesión
| Órgano (n) | Mecanismo | |
|---|---|---|
| Penetrante, n (%) | Contuso, n (%) | |
| Riñón (18.581)77–104 | 2.967 (16) | 15.614 (84) |
| Glándula adrenal (8.305)105–112 | 706 (8,5) | 7.599 (91,5) |
| Duodeno (1.709)4–9,24–30 | 1.550 (90,7) | 159 (9,3) |
| Páncreas (5.368)40–76 | 1.211 (22,6) | 4.157 (77,4) |
| Vasos ilíacos (1.472)23,126–128 | 756 (51,3) | 716 (48,7) |
| Arteria renal (634)104,119–125 | 25 (4) | 609 (96) |
| Vena cava inferior (329)11,12,118 | 293 (89,1) | 36 (10,9) |
| Aorta (309)13–15,113–117 | 227 (73,5) | 82 (26,5) |
La localización retroperitoneal permite enmascarar los signos clínicos tempranos encontrados en el diagnóstico de las lesiones habituales31. Algunos de los síntomas más frecuentes son el dolor y la distensión abdominal, aunque hasta un 8% de pacientes permanecen asintomáticos130.
Tanto la punción lavado peritoneal como la ecografía abdominal focalizada (Focused Abdominal Sonography for Trauma) pueden ser positivos, aunque podrían dar lugar tanto a falsos negativos como falsos positivos25,26. En pacientes hemodinámicamente estables destaca el empleo de la TAC con contraste oral e intravenoso, con elevada sensibilidad y especificidad, aunque en el 40% de los casos de traumatismo pancreático precoz esta prueba puede ser normal.
Como la mayoría de las lesiones duodenales se producen en el contexto de un traumatismo penetrante su diagnóstico se realiza durante la laparotomía exploradora. Los hallazgos que sugieren lesión duodenal son la presencia de bilis, crepitación en la fascia duodenal y la presencia de hematoma retroperitoneal o perirrenal31 así como necrosis de la grasa peritoneal y edema peripancreático30,130. Estos últimos hallazgos también se relacionan con lesiones pancreáticas ductales junto a la presencia de líquido transparente en el lecho.
En el diagnóstico de lesiones vasculares, además, puede destacar la presencia de una masa pulsátil, disminución o ausencia de pulsos femorales, frialdad, cianosis o debilidad de las extremidades inferiores13. Se describen síntomas neurológicos en torno al 70% de los pacientes que presentan lesión aórtica, y tasas de shock de hasta el 82% en la serie más amplia publicada15.
La presencia de hematuria tanto macro- como microscópica varía entre 66%39 y 96% de los pacientes según algunas series aunque se pueden constatar otros signos indirectos como dolor en el flanco afecto o signos de inestabilidad hemodinámica.
Ante la sospecha de lesión renal el método diagnóstico más empleado en el paciente hemodinámicamente estable es la TAC con contraste intravenoso, lo que permite la clasificación de las lesiones y descartar la extravasación de contraste129. Esta no solo demuestra hemorragia activa, también se relaciona con una mayor energía cinética y por tanto es un indicador de la severidad de las lesiones asociadas20. En las lesiones adrenales el hallazgo más frecuente es un hematoma ovalado de unos 2-3cm 37, y presentan más de un 90% de lesiones asociadas.
Además del empleo de la TAC y la angiografía, se recomienda el uso de la uretrografía ante la presencia de hematomas perineales o disrupciones del anillo pélvico.
TratamientoLa evaluación inicial y manejo del paciente que presenta un traumatismo abdominal se basan en las indicaciones establecidas por el Advanced Trauma Life Support (ATLS®) del American College of Surgeons.
El objetivo inicial del manejo quirúrgico se basa en 3 puntos: el control del foco hemorrágico, el control de la contaminación gastrointestinal y la revisión de la cavidad abdominal con fines diagnósticos.
Las lesiones vasculares aisladas y sin indicación urgente de laparotomía pueden beneficiarse del manejo no operatorio, incluyendo la terapia intravascular, mientras que la cirugía está indicada en caso de sangrado o trombosis arterial. En la serie de Lopez-Viego et al.15 el procedimiento más empleado fue la arteriorrafia (53%). Para el abordaje de la región supramesocólica se emplea la maniobra de Mattox que implica la movilización medial del riñón y colon izquierdo junto al bazo y la cola de páncreas. Como alternativa se utiliza la maniobra de Kocher, aunque es posible su evaluación a través del omento menor. Por el contrario, para el abordaje de la región inframesocólica se moviliza el intestino delgado y el colon derecho en dirección cefálica y medial, conocido como la maniobra de Cattle-Braasch (movilización cefálica y medial del intestinto delgado y colon derecho) que facilita la evaluación de la vena porta y la cava inferior.
Es imperioso el control vascular proximal y distal del vaso lesionado, incluso el control proximal a nivel supracelíaco de la aorta en el hiato esofágico. En los casos infructuosos o cuando ello no sea posible, se procederá a realizar una toracotomía izquierda con clampaje de aorta torácica o colocación de un balón de oclusión intravascular (Resuscitative Endovascular Balloon Occlusion of the Aorta)130. Recientes estudios sugieren que este dispositivo es un método efectivo para el tratamiento de hemorragias en las que no es posible la compresión directa, permitiendo la oclusión aórtica temporal y conduciendo a un control temporal de la hemorragia con aumento de la presión sanguínea media. En las lesiones venosas se recomienda la realización de una venorrafia lateral independientemente de su localización y cuando sea posible, incluyendo las lesiones de las venas mesentéricas y cava inferior siempre que al realizarla no ponga en riesgo la vida del paciente, si bien la ligadura de la cava inferior en la zona 1ha sido descrita como último recurso131.
La técnica más empleada en la reparación de las lesiones de arteria ilíaca es la arteriorrafia primaria, seguida por el bypass. Mientras que en las lesiones venosas prevalece la ligadura frente a la venorrafia23. En la serie más amplia publicada destaca un mayor empleo de técnicas intravasculares en el traumatismo contuso. La embolización de la arteria ilíaca interna no se asocia con mayores tasas de complicaciones a corto plazo, aunque a largo plazo se objetiva un aumento en la incidencia de parestesias128.
En cuanto al duodeno, cuando la situación hemodinámica y la ausencia de lesiones asociadas lo permiten, es adecuado plantear un tratamiento conservador, fundamentalmente en aquellas que mantienen la integridad de la pared duodenal9,129.
Para una correcta exploración de las 4 porciones duodenales en su cara anterior y posterior, es necesario realizar la maniobra de Kocher, la maniobra de Cattell-Braasch o ambas, pudiendo asociar la sección del ligamento de Treitz6,31.
Se han empleado múltiples técnicas quirúrgicas que incluyen desde el cierre primario hasta la técnica de Whipple. Todos los autores coinciden en la recomendación del cierre primario como técnica de elección inicial con éxito hasta en un 85% de los pacientes, preferiblemente en sentido transversal y sin tensión, reservando procedimientos más complejos para las lesiones más severas5–9,25. Si no es posible se puede plantear la resección con realización de anastomosis término-terminal primaria o la anastomosis de un asa de yeyuno sobre el propio defecto.
En las lesiones pancreáticas grado I o II se recomienda inicialmente optar por un tratamiento conservador, incluso cuando el hallazgo es intraoperatorio. En aquellas lesiones de grado III o IV es conveniente el abordaje quirúrgico, para lo cual se han planteado varias alternativas, desde la rafia simple hasta la resección segmentaria, siendo una decisión individualizada en cada caso teniendo en cuenta tanto el alcance de la lesión como la experiencia del cirujano. La hemostasia y el desbridamiento del tejido necrótico constituyen la primera maniobra, pudiendo necesitarse la realización de pancreaticoyeyunostomía o pancreaticogastrostomía para evitar la insuficiencia pancreática. Se reserva la técnica de Whipple para lesiones irreconstruibles, con grandes pérdidas de tejido o con lesiones severas duodenales o de la cabeza pancreática, o en los casos de transección del conducto de Wirsung proximal en el cuello del páncreas, evitando resecar el bazo y la cola pancréatica y preservar su función endocrina y exocrina9,25,26,31,132. Por otro lado, el riesgo de fuga anastomótica y morbilidad es significativo, así como la curva de aprendizaje de la técnica que resulta más compleja que la resección133.
En el traumatismo renal se aboga por el tratamiento conservador en pacientes hemodinámicamente estables sin otra indicación quirúrgica82, con una tasa de éxito que supera el 90% para los grados I a IV, y hasta 35% en el grado V88. Destaca un aumento en el empleo de la embolización, con índices de fracaso menores del 15%. No se ha constatado que un retraso en la indicación quirúrgica se asocie a una mayor incidencia de complicaciones en las series más actuales86.
El tratamiento conservador del riñón dañado pero perfundido en pacientes seleccionados da lugar a menos morbilidad frente a la nefrectomía. El tratamiento no quirúrgico de las laceraciones renales por traumatismo cerrado asociado a extravasación se asocia con menores complicaciones, que generalmente se pueden tratar mediante métodos endourológicos o percutáneos. En las laceraciones por traumatismo penetrante se puede plantear el tratamiento no quirúrgico en pacientes estables, sin lesiones asociadas y correctamente estadificados, contando con un alto índice de sospecha para evitar lesiones ureterales. El éxito del tratamiento no quirúrgico puede mejorar mediante el uso de la angioembolización18,82,83.
El tratamiento quirúrgico varía desde el empleo de nefrorrafias a la nefrectomía, con una tasa variable entre series (13-38%)94,96, pudiendo ser parcial o total. Se describen casos que precisan nefrectomía diferida por complicaciones postraumáticas. Existe una asociación entre el grado de lesión renal de la American Association for the Surgery of Trauma y la disminución de la función renal postraumática significativa a partir del grado III92.
En el manejo de las avulsiones y laceraciones renales se propone la embolización como una alternativa segura al tratamiento quirúrgico citándose tasas de éxito mayores del 94%19,121. Se plantea la posibilidad de realizar una angioembolización para evitar la nefrectomía y la pérdida de tejido renal posteriormente a otros gestos quirúrgicos.
En las lesiones vasculares renales se observa un aumento en la tendencia al manejo conservador, el porcentaje de nefrectomías es variable, mayor del 30% en algunas series frente a porcentajes en torno al 18% en las publicaciones más recientes. En la serie de Sanghtong et al.120, solo en el 27% del total de pacientes se llevó a cabo una exploración quirúrgica de la arteria renal, de los cuales el 67% se sometió a nefrectomía frente al 32% de reconstrucciones vasculares. El uso de la reconstrucción vascular es controvertido, citándose porcentajes de nefrectomías tardías de hasta el 35%, mientras que en la actualidad no se emplea en presencia de un riñón contralateral funcionante19.
La mayoría de las publicaciones de lesiones ureterales están compuestas por informes de casos y pequeñas series, por lo que no existe un consenso en su manejo. Parece claro que la presencia de shock al ingreso o lesión colónica severa que requiera colectomía imposibilita la reparación ureteral, por lo que se propone la derivación o la nefrectomía primaria en estas circunstancias.
En cuanto al manejo del traumatismo suprarrenal, dependerá de la extensión de la lesión, el estado de la glándula contralateral, el estado hemodinámico y las lesiones asociadas33,35,37. El tratamiento conservador es el más ampliamente aceptado, condicionando el tratamiento quirúrgico a la presencia de lesiones asociadas o inestabilidad hemodinámica20,33,36,37. Ante extravasación activa de contraste mediante angiografía y estabilidad se ha propuesto la embolización como una alternativa segura y equiparable a la cirugía33. La compleja vascularización adrenal permite que una embolización selectiva de lugar a un infarto localizado que no conduce a la insuficiencia glandular. En la serie más amplia hasta la fecha se estima que en torno al 1% de las lesiones adrenales precisan adrenalectomía17. Otros procedimientos descritos para conseguir la hemostasia además de la excisión son la sutura de la glándula afecta o la aplicación de agentes hemostáticos y el empaquetamiento.
Por último, en el manejo de la lesión ósea, el objetivo principal es lograr la hemostasia así como restaurar la integridad y estabilidad del anillo pélvico antes de la estabilización definitiva134. En las lesiones pélvicas menores, ante estabilidad mecánica y hemodinámica, se puede plantear un manejo no operatorio. Frente a ello, en las lesiones moderadas (con estabilidad hemodinámica e inestabilidad mecánica), y tras el diagnóstico radiológico, se puede plantear de manera individualizada la posibilidad de embolización frente al tratamiento quirúrgico o el manejo conservador. Las lesiones pélvicas severas se caracterizan por la inestabilidad hemodinámica independientemente del mecanismo lesional según la clasificación de la World Society of Emergency Surgery134. En estos casos se debe considerar la posibilidad de realizar medidas de estabilización temporales (faja de compresión pélvica), el empaquetamiento preperitoneal, la colocación de un balón de oclusión intravascular y la angioembolización, además del abordaje quirúrgico134.
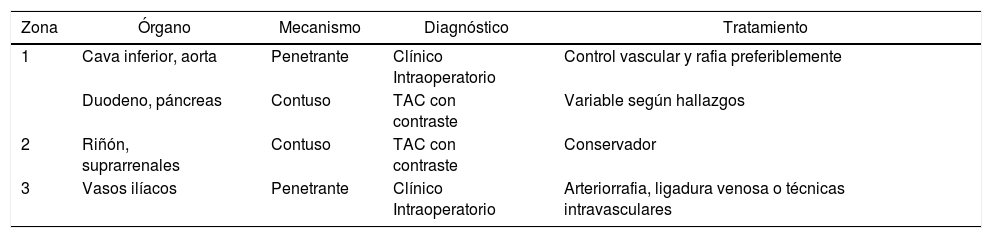
En la tabla 2 se describen los órganos afectados con mayor frecuencia, estadificado por zonas, mecanismo de lesión, modalidad diagnóstica y tratamiento.
Órganos afectados con más frecuencia y su abordaje correspondiente
| Zona | Órgano | Mecanismo | Diagnóstico | Tratamiento |
|---|---|---|---|---|
| 1 | Cava inferior, aorta | Penetrante | Clínico Intraoperatorio | Control vascular y rafia preferiblemente |
| Duodeno, páncreas | Contuso | TAC con contraste | Variable según hallazgos | |
| 2 | Riñón, suprarrenales | Contuso | TAC con contraste | Conservador |
| 3 | Vasos ilíacos | Penetrante | Clínico Intraoperatorio | Arteriorrafia, ligadura venosa o técnicas intravasculares |
- -
La mayor mortalidad se relaciona con la lesión de grandes vasos por lo que es imprescindible su sospecha diagnóstica.
- -
La lesión aórtica más frecuente es de localización infrarrenal, mientras que la lesión de la vena cava ocurre predominantemente a nivel suprarrenal.
- -
Los objetivos terapéuticos se basan en el control de la hemostasia, de la contaminación y la valoración de las lesiones.
- -
Ante estabilidad hemodinámica y ausencia de contraindicación se debe plantear inicialmente un manejo conservador, incluyendo la angioembolización. De lo contrario, es preferible el empleo de rafias frente a maniobras más complejas.
- -
El tratamiento conservador es el más ampliamente aceptado, condicionando la cirugía a la presencia de lesiones asociadas o inestabilidad. Dentro del abordaje quirúrgico destacan las maniobras conservadoras frente a la nefrectomía o la suprarrenalectomía.
- -
Es necesario un alto índice de sospecha de lesiones ureterales.
- -
La reconstrucción vascular se reserva para anomalías del riñón contralateral.
- -
Prevalecen las lesiones de los vasos ilíacos por su elevada mortalidad asociada.
- -
Destaca la realización de arteriorrafia y ligadura venosa, junto a un aumento del empleo de técnicas intravasculares.
- -
El manejo de la lesión ósea se basa en el abordaje multidisciplinar e individualizado en cada caso.
Los autores declaran no tener ningún conflicto de intereses.