El tratamiento del melanoma cutáneo ha sido, históricamente, esencialmente quirúrgico. Muchos progresos se han hecho en esta área: se han establecido los márgenes de resección con base en la profundidad del tumor y, se han identificado pacientes candidatos a linfadenectomía, evitando así la morbilidad del procedimiento en pacientes que no la requieren. Pero en el tratamiento sistémico se han hecho escasos progresos: desde los años setenta se introdujo el uso de la dacarbazina para el tratamiento de los pacientes con progresión tumoral o metástasis sistémicas, pero los resultados han sido decepcionantes; a pesar de ello, la dacarbazina ha sido la droga más utilizada hasta la actualidad.
Hace 3 años, 2 nuevas drogas fueron introducidas, una de ellas basada en la terapia blanco y la otra en la inmunoterapia, ofreciendo una alternativa en el tratamiento del melanoma cutáneo.
Los objetivos de este manuscrito son: mostrar las vías de acción de estos medicamentos. Describir cuál es el papel actual que tiene la cirugía en el tratamiento del melanoma cutáneo con la llegada de estas drogas, y conocer qué alternativas terapéuticas están surgiendo para el tratamiento sistémico del melanoma cutáneo con base en la evidencia científica.
The treatment of cutaneous melanoma has historically been essentially surgical. Much progress has been made in this area, and the resection margins have been established based on tumour depth. Candidates are also identified for lymphadenectomy, avoiding the morbidity of the procedure in patients who do not require it. But little progress has been made in systemic treatment, since the 70's when the use of dacarbazine was introduced for the treatment of patients with tumour progression or distant metastasis, with disappointing results. Despite this, Dacarbazine has been the most used drug to the present.
Three years ago, two new drugs were introduced, one of them based on the target therapy and other one in the immunotherapy, offering, with the obtained results, an alternative in the treatment of cutaneous melanoma
The objectives of this article are to show the pathways of these drugs, to describe the current role of surgery in cutaneous melanoma, with the arrival of these drugs, as well as to know the therapeutic alternatives that are emerging for the cutaneous melanoma based on scientific evidence.
La dacarbazina ha sido, desde 1971, el tratamiento estándar de los pacientes con metástasis sistémicas e inoperables de melanoma maligno1. Produce respuestas globales en aproximadamente el 15% de los pacientes, pero solo en el 4% la enfermedad desaparece, y en aquellos que tienen respuesta completa el intervalo libre de enfermedad es muy corto; la media de recurrencia es de 3 a 6meses.
Recientemente han surgido una gran variedad de drogas efectivas para el tratamiento del cáncer broncogénico, del cáncer de mama, del cáncer colorrectal y de otros tumores, convirtiendo al tratamiento de estas neoplasias en un ejercicio multidisciplinario; mientras que en el melanoma cutáneo el tratamiento sigue siendo terreno de una sola disciplina, la cirugía.
El progreso en el tratamiento de otras neoplasias ha rebasado con mucho al del melanoma. El melanoma cutáneo ha mostrado ser, más que otras neoplasias, insensible a las diversas terapias sistémicas y a la radioterapia. La razón podría ser que las células de las cuales el melanoma se origina están diseñadas para proteger al organismo en contra de los daños del ADN producidos por el sol, y se localizan en la piel, en donde están expuestas al daño que los rayos ultravioleta producen al ADN. Estas células parece ser que tienen la capacidad de defenderse cuando son expuestas a drogas citotóxicas, en forma parecida a como lo hacen en el medio hostil en el que normalmente se desarrollan.
Esto no quiere decir que no haya habido progresos en la terapéutica del melanoma cutáneo; se han logrado progresos sustanciales en la comprensión del comportamiento de esta neoplasia y en su tratamiento quirúrgico. Los márgenes de resección fueron reducidos sustancialmente basados en evidencia científica sólida; se probó que la disección ganglionar profiláctica y que la perfusión regional no eran útiles y fueron abandonadas; se introdujo el mapeo linfático con biopsia del ganglio centinela, y se demostró que mejoraba la estadificación, que ofrecía información valiosa del pronóstico, que en pacientes seleccionados evitaba la morbilidad innecesaria que la disección ganglionar causa, y que mejoraba la supervivencia de los pacientes con ganglio centinela positivo2.
En la estadificación y el diagnóstico, se demostró que la tomografía por emisión de positrones mejoraba la estadificación de los pacientes con enfermedad avanzada. Como resultado de estos progresos, el tratamiento del melanoma maligno se hizo más individualizado y los rangos de supervivencia mejoraron; sin embargo, los expertos en melanoma aún esperan una droga realmente efectiva para el tratamiento sistémico de los pacientes con enfermedad sistémica.
Los cambios llegaron en 2010, en que hubo 2 desarrollos relevantes en la terapia sistémica: la terapia blanco y la inmunoterapia.
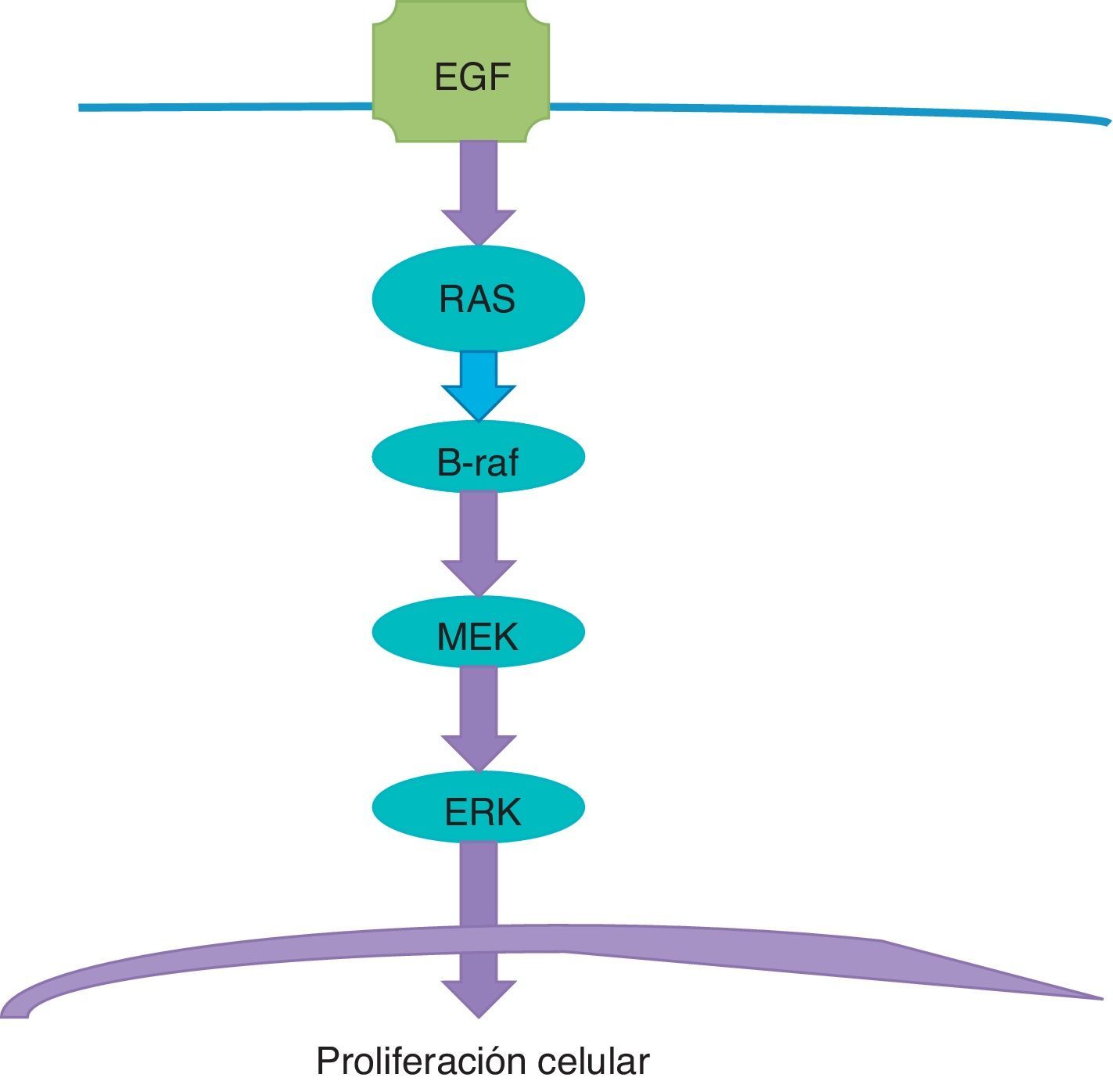
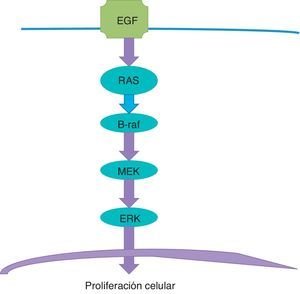
Terapia blancoLa terapia blanco se relaciona con la vía de la tirosina-cinasa, también conocida como la vía de la MAPcinasa o la vía de señalización MAPK (fig. 1). Esta vía se inicia en la membrana celular y sigue diversos pasos hasta el núcleo. El receptor del factor de desarrollo epitelial recibe la señal para estimular el desarrollo y activa la proteína RAS. La proteína RAS activa a la proteína B-Raf, la cual a su vez activa a la proteína MEK (también conocida como MAPK), la cual hace que el ERK estimule en el núcleo a los genes que son responsables del desarrollo y de la proliferacióncelular. Este es un proceso fisiológico que es el responsable de la proliferación celular cuando esta es necesaria, y que se detiene cuando ya no lo es.
El problema surge cuando ocurre una mutación en el gen que es el responsable de producir la proteína B-Raf. En la cadena de ADN, una adenina es remplazada por una tiamina; como consecuencia de esto, un aminoácido valina de la secuencia proteica B-Raf es remplazado por ácido glutámico en el codón aminoácido600; he aquí el porqué del nombre de la mutación V600E. El resultado es una proteína B-Raf aberrante que pierde la capacidad de «apagarse» o «detenerse», y esto se traduce en que la estimulación de MEK persiste y este, a su vez, continúa estimulando al ERK, el cual estimula a los genes que perpetúan la proliferación celular; el resultado final es una célula cancerosa que continúa dividiéndose. La mutación del gen BRAF está presente en la mitad de todos los melanomas.
Una pequeña molécula llamada vemurafenib se une a la proteína maliciosa B-Raf V600E y la hace inefectiva, la proliferación celular se detiene y las células tumorales entran en apoptosis.
Varios estudios han demostrado que esta molécula es efectiva en contra del melanoma cutáneo; un ensayo clínico faseiii que incluyó a 675 pacientes con melanoma irresecable en etapas iiiC y iv que tenían mutación B-Raf V600E y se comparó vemurafenib con dacarbazina; un análisis intermedio se publicó después de un seguimiento medio de 3.8meses para los pacientes en el grupo vemurafenib3. La respuesta fue impresionante en el grupo de vemurafenib+dacarbazina vs. dacarbazina sola: 48% vs. 5% (p<0.001).
Las respuestas al vemurafenib ocurren muy rápido, y algunos pacientes sienten mejoría pocos días después de iniciado el tratamiento. En este estudio, 2 pacientes tuvieron respuesta completa (0.9%), con una media de supervivencia de 9.2 meses en el brazo experimental y de 7.4 meses en el brazo control; los pacientes obtenían mejoría en supervivencia global de 7semanas.
Desafortunadamente, las respuestas no son durables; la media de duración de la respuesta es de 6meses, y con rara excepción todos los pacientes eventualmente recaen o progresan.
En el Instituto Holandés de Cáncer más de 100 pacientes recibieron este tratamiento, y solo uno tuvo un intervalo libre de enfermedad de 1.5años.
El problema radica en que el melanoma rápidamente se hace resistente al vemurafenib y desarrolla diversas vías para bloquear su efecto.
El vemurafenib se asocia a importante morbilidad, como fotosensibilidad, artralgia, rash, fatiga, alopecia y una mayor facilidad para desarrollar neoplasias dérmicas, principalmente queratoacantoma y carcinoma epidermoide. Los efectos colaterales extensos del vemurafenib muestran que no solo afecta a las células neoplásicas y que la connotación «terapia blanco» podría ser una exageración; en México, falta que los resultados con el tratamiento de pacientes con melanoma cutáneo con vemurafenib sean reportados; en Estados Unidos de América el costo del tratamiento con este medicamento es de US$9,400 mensuales.
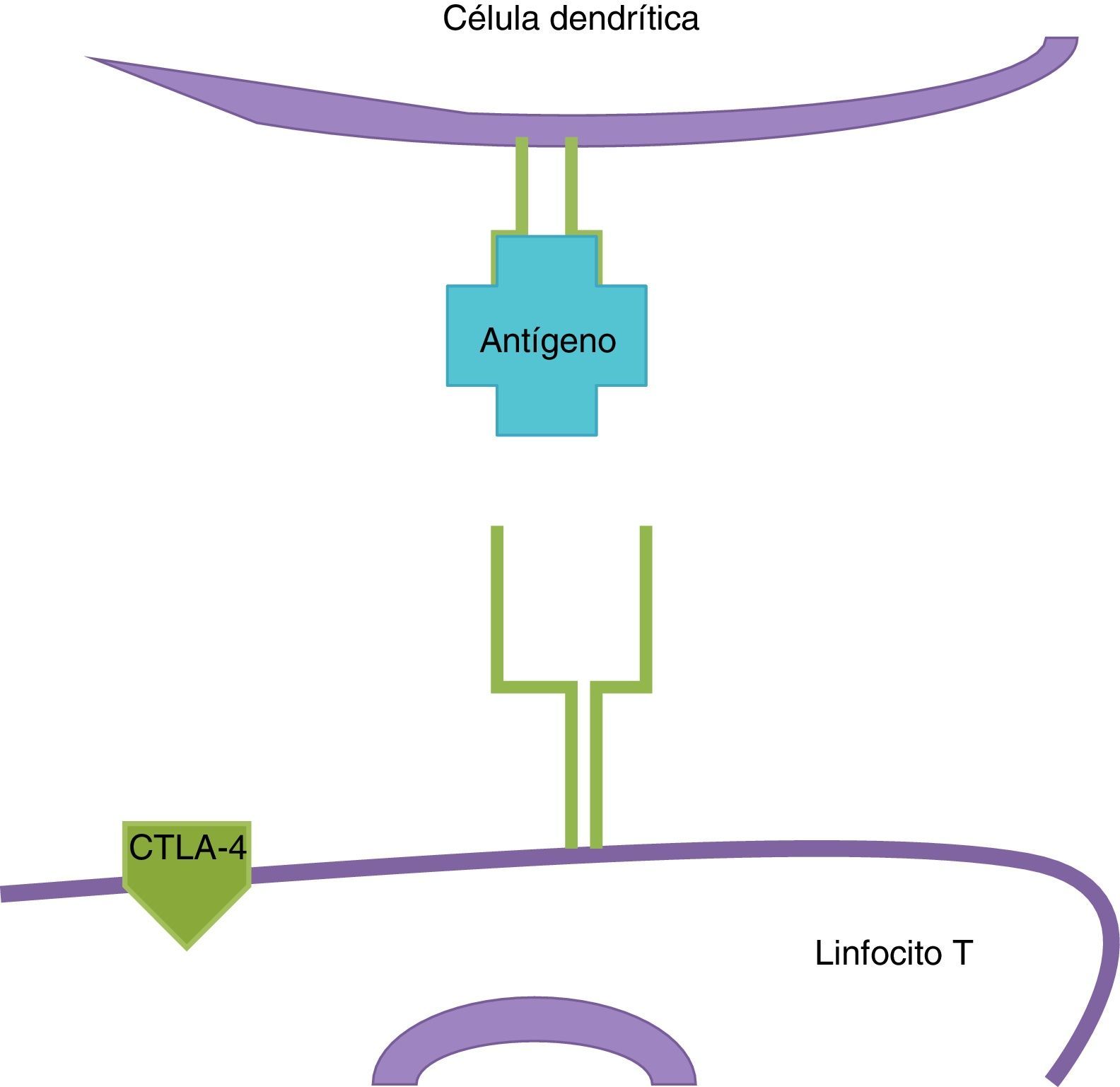
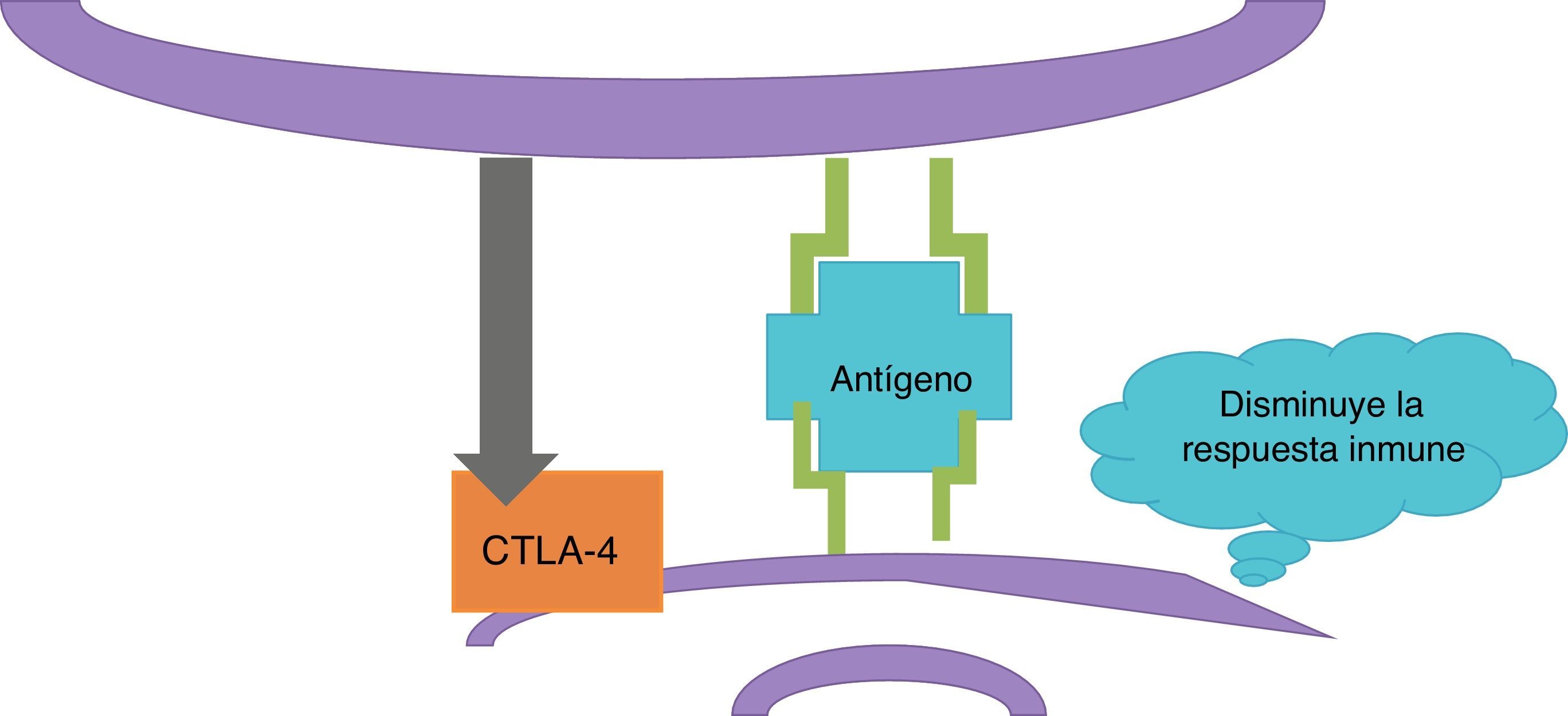
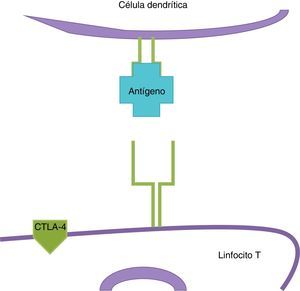
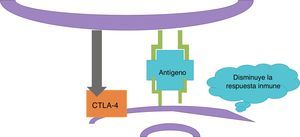
InmunoterapiaLas células dendríticas presentan el antígeno del melanoma a los linfocitosT (fig. 2); estos llegan al tumor y matan a las células neoplásicas. Una vez que la respuesta inmune está activada, las células dendríticas activan a los linfocitosT citotóxicos asociados al antígeno4 (CTLA-4, por sus siglas en inglés); estos tienen el papel de regular la actividad de la respuesta inmune en el sentido que disminuyen la actividad de las célulasT y su proliferación (fig. 3). Este es un mecanismo fisiológico que evita que la respuesta inmune esté sobreactivada y previene que el sistema inmune ataque a los propios tejidos del organismo; los CTLA-4 crean un balance en la actividad de la respuesta inmune.
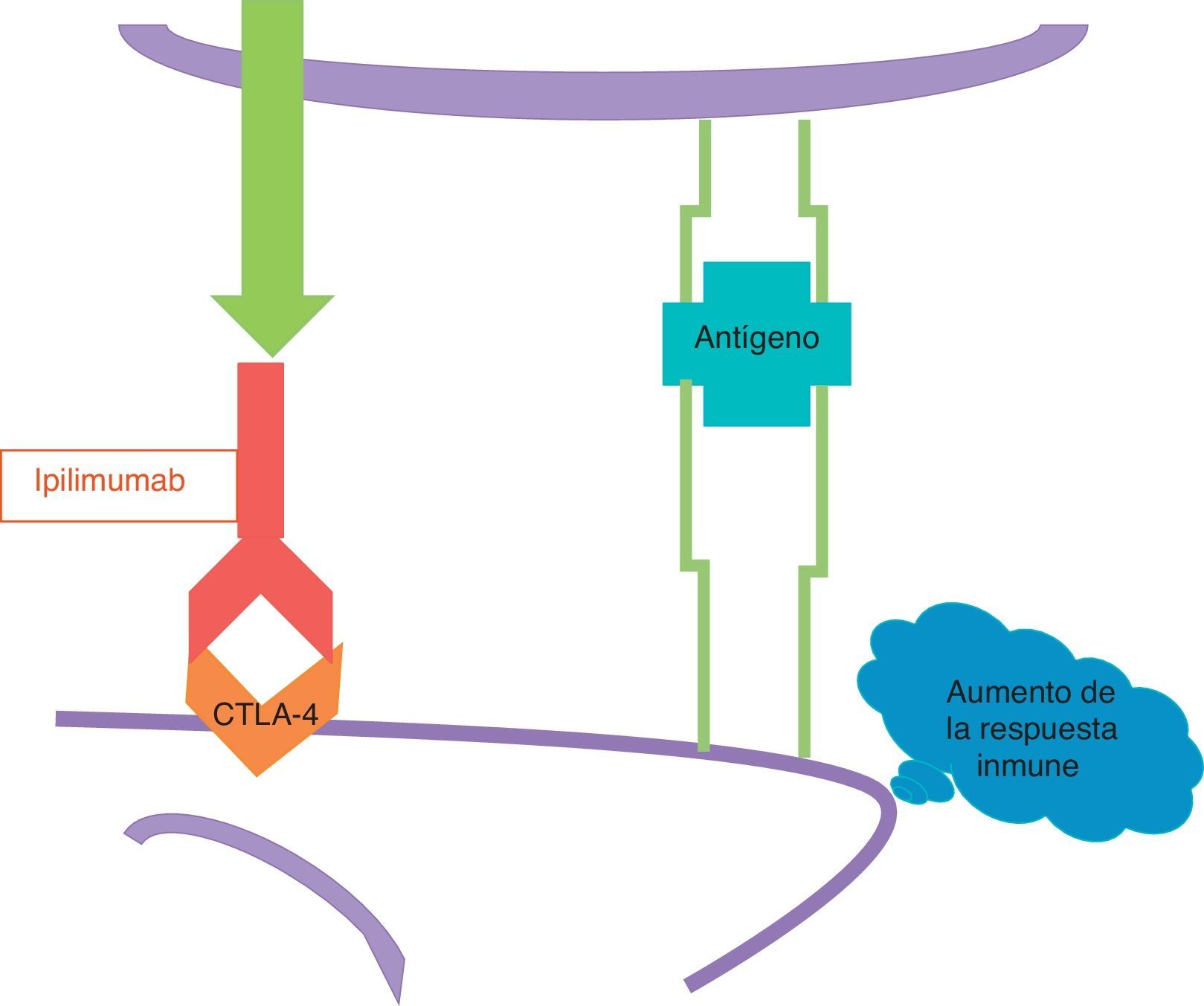
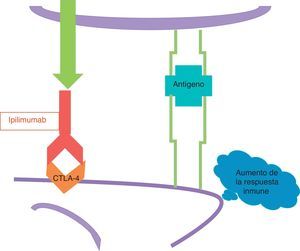
La otra nueva droga es el ipilimumab, que es un anticuerpo monoclonal humano que se fija a los CTLA-4. El Ipilimumab bloquea los CTLA-4 y evita que sean activados (fig. 4); dicho de otra manera, quita el freno de mano que un CTLA-4 activado aplica a la respuesta inmune, y como resultado de esta acción la respuesta inmune se desplaza a una mayor velocidad.
Ipilimumab no ataca a las células del melanoma directamente, por lo que no es una terapia blanco como lo es el vemurafenib, sino que estimula la respuesta inmune en general, incluyendo la respuesta inmune existente en contra del melanoma.
En un estudio faseiii4 se aleatorizaron 52pacientes con melanoma metastásico irresecable en etapasiii y iv en 2 grupos; uno recibió ipilimumab más dacarbazina, y el otro dacarbazina más placebo. La respuesta fue del 15% en el grupo de ipilimumab y del 10% en el grupo control; esta diferencia no fue significativa.
En contraste con el vemurafenib, que actúa rápidamente, la respuesta al ipilimumab es lenta, tarda aproximadamente 3meses para hacerse evidente; puede inclusive haber un período en el que el tumor incremente su tamaño, y esto ocurre cuando los linfocitosT infiltran al tumor.
En el estudio señalado, 4 pacientes en el grupo de ipilimumab tuvieron respuesta completa (1.6%) y 2 en el grupo control (0.8%), la supervivencia global fue significativamente mejor en el grupo que recibió ipilimumab más dacarbazina que en el grupo que recibió dacarbazina más placebo a los 3 años: 21% vs 12% (p<0.001); el ipilimumab aumentó la supervivencia en 9semanas.
Este tratamiento causa morbilidad seria, especialmente en el tracto digestivo; el 56% de los pacientes tratados con ipilimumab más dacarbazina presentaron toxicidad grado3 o 4 relacionada con la respuesta inmune; no hubo muertes relacionadas con el tratamiento o perforaciones gastrointestinales en el grupo experimental, pero un estudio previo5 había reportado previamente perforaciones intestinales y un 2.1% de mortalidad asociada al tratamiento; en Estados Unidos de América la droga tiene un precio de $120,000dólares por 4 dosis.
DiscusiónVemurafenib e ipilimumab lógicamente han hecho que los profesionales dedicados al melanoma en todo el mundo estén expectantes. ¿Son estas 2 novedosas drogas, el gran avance por el que hemos estado esperando por muchos años?
En nuestra opinión la respuesta es ambigua: sí y no; estaríamos tentados a decir que no porque estos 2 medicamentos no son, necesariamente, el gran avance que se ha estado esperando; ni los pacientes ni sus médicos se emocionan demasiado cuando se les dice que los rangos de respuesta completa están entre 0.9 y 1.6%, o cuando se les dice que la supervivencia se puede incrementar en unos pocos meses a costa de considerable morbilidad.
Hagamos que estos porcentajes sean familiares en una perspectiva con la que los cirujanos estamos más familiarizados: el mapeo linfático con biopsia del ganglio centinela, con la subsecuente disección ganglionar en caso de ganglio centinela positivo, mejora la respuesta completa en el 19% y por al menos 10años, porcentaje de una magnitud diferente a la ofrecida por los medicamentos.
Vemurafenib e ipilimumab no deben ser vistos con la misma suspicacia con la que vimos a drogas previas que fueron impulsadas y promovidas como el gran avance en el tratamiento del melanoma, debido a que estas 2 nuevas drogas son revolucionarias a nivel de ciencia básica.
Vemurafenib actúa cerca de la mutación genética, que es la base de la alteración en la célula neoplásica; desafortunadamente, la corrección del defecto en un solo gen aberrante no es suficiente para detener la proliferación del melanoma por más tiempo que unos cuantos meses. Hay más de 30,000 mutaciones genéticas en la célula del melanoma. ¿Existen acaso patrones de mutaciones y aberraciones genéticas que podamos bloquear? Los investigadores están trabajando en nuevas drogas que actúan en diferentes niveles de la vía de la tirosina-cinasa, la combinación de dabrafenib y trametinib actúa tanto en B-Raf como en MEK; este parece ser el abordaje más prometedor.
En el pasado, el 35% de los pacientes con melanoma en etapasiii y iv tenían supervivencia de un año. Este porcentaje ha mejorado al 76% con el régimen combinado6; tal vez esta combinación podría tener el efecto sostenido que al vemurafenib le falta y podría evitar que el melanoma se volviese resistente tan rápidamente.
Relación de la cirugía metastásica y el vemurafenibEsta droga es de gran relevancia e importancia para los cirujanos. La respuesta que causa ofrece una interesante oportunidad en pacientes que tienen crecimiento importante de tumores metastásicos no resecables con mutación de V600BRAF: la mitad de los pacientes responden, y aunque la mayoría no tiene respuesta completa y esta no es durable, la velocidad de la respuesta puede ofrecer una ventana en el tiempo para operar y resecar un tumor inicialmente irresecable pero que, por la respuesta al tratamiento, puede ser removido antes de que se haga resistente y empiece nuevamente a crecer; este fenómeno de downstaging parece ser una opción atractiva en pacientes que presentan tumores inoperables al inicio del tratamiento, y podría ser una alternativa para mejorar la supervivencia en pacientes con melanoma metastásico, principalmente en etapas M1A y M1B.
El punto débil del ipilimumab es que no es específico para el melanoma y estimula la respuesta inmune en general. La verdadera importancia del ipilimumab radica en el beneficio a largo plazo que tienen los pacientes que muestran respuesta o estabilidad de la enfermedad. El seguimiento de cohortes de pacientes ha mostrado que la respuesta completa puede continuar en algunos pacientes más allá de 6años. La impresión que existe es que la supervivencia a 5años podría ser del 20%. Muchos pacientes podrían tener metástasis estables y coexistir por algún tiempo con su enfermedad metastásica; esto es tener una enfermedad oncológica «crónica».
ConclusionesEl melanoma cutáneo siempre ha sido una enfermedad quirúrgica y unidisciplinaria. Es cuando el paciente presenta metástasis a distancia que es enviado a tratamiento sistémico, se le administra dacarbazina, y el médico inicialmente tratante nunca vuelve a ver al paciente. Esto ha cambiado, actualmente hay terapia blanco, inmunoterapia, tratamientos adyuvantes y cirugía de rescate después de tratamientos sistémicos exitosos; existe actualmente una interacción directa entre el oncólogo médico y el quirúrgico. El tratamiento del melanoma se ha hecho, pues, multidisciplinario.
¿Cambiarán los nuevos tratamientos nuestra estrategia quirúrgica en melanoma cutáneo? Lo primero que debemos hacer es esperar los resultados a largo plazo que nos permitan conocer el valor real de estos medicamentos; todavía recordamos estudios de nuevas drogas que mostraron mejoría al inicio para ver desaparecer dicho beneficio con el seguimiento a largo plazo7-9. También debemos esperar para conocer los potenciales efectos adversos que podrían ser vistos con mayor tiempo de seguimiento.
¿Qué pasaría si estas exitosas nuevas drogas son probadas en etapas tempranas del melanoma? En forma adyuvante posterior a disección ganglionar por enfermedad palpable, por ejemplo, pero también —y ¿por qué no?— en los casos de pacientes con ganglio centinela metastásico, y aún más en pacientes que tienen enfermedad localizada pero sabemos que tienen mal pronóstico, como melanomas gruesos y ulcerados, que son los que más frecuentemente son diagnosticados en México; estudios que requieren, sin duda, el soporte quirúrgico.
Muchos cirujanos se preguntan si los pacientes con melanoma cutáneo serán tratados en un futuro cercano con terapia sistémica en lugar de cirugía. Esto lo consideramos poco probable, y continuaremos operando pacientes con melanoma en etapasiii y iv con lesiones resecables; después de todo, ningún melanoma es resistente al formol.
El tratamiento quirúrgico de los pacientes con melanomas operables en etapasiiiy iv ofrece una supervivencia a 10años del 35%, sustancialmente mejor que cualquier supervivencia optimista que pudiésemos lograr con cualquier medicamento. Las nuevas drogas podrían, inclusive, generar pacientes candidatos a cirugía que al momento del diagnóstico no lo eran, como los pacientes con melanomas metastásicos inicialmente irresecables, que se hacen resecables después de terapia sistémica neoadyuvante, y pacientes en etapaiv que requieren que se les haga cirugía de limpieza o tumorectomías, después de tratamiento sistémico exitoso; así que el tratamiento multidisciplinario podría hacer crecer el número de pacientes con melanoma que requieran cirugía.
Estos son tiempos interesantes para los profesionales interesados en el melanoma cutáneo. El advenimiento de la terapia blanco y de la inmunoterapia mejoró la supervivencia de los pacientes con enfermedad avanzada. Aunque las respuestas completas son raras, estos pacientes deben ser evaluados ya en forma multidisciplinaria. Y la base de las nuevas drogas parece no ser muy impresionante; sin embargo, una mejor comprensión de la biología molecular del tumor y del sistema inmune permite el desarrollo de drogas aún más innovadoras dirigidas específicamente al tumor o que estimulan el sistema inmune en contra de la neoplasia.
El futuro nunca había sido tan brillante en el panorama terapéutico del melanoma cutáneo, y debemos estar preparados para ver la sucesión de cosas sorprendentes y maravillosas en los próximos años.
Los cirujanos podemos y jugaremos un rol importante en el tratamiento futuro del melanoma y en la investigación. Los cirujanos de todo el mundo deben ser estimulados a participar en estudios para hacer avanzar el campo del tratamiento del melanoma y aprovechar los progresos que se han hecho hasta el momento actual.
Conflicto de interesesDeclaramos que no existe conflicto de intereses, apoyo económico externo ni interés comercial.