El edema macular clínicamente significativo presenta características asociadas con mayor riesgo de pérdida visual: engrosamiento que involucra el centro de la mácula, el campo 7 o baja visual inicial; sin embargo, se desconoce la relación entre estas características y la extensión del engrosamiento retiniano.
Material y métodosEstudio observacional, analítico, prospectivo, transversal y abierto. La muestra se dividió en función de la capacidad visual inicial ≥o<0.5, grosor del campo central, del punto central, campo 7 y volumen macular >2 desviaciones estándar del promedio reportado en ojos sin retinopatía. La extensión se determinó mediante el número de equivalentes de área del campo central engrosados, y se comparó con las características mediante la t de Student para medias independientes.
ResultadosCiento noventa y nueve ojos incluidos. En ojos con capacidad visual≥0.5 el promedio de extensión fue 2.88±1.68 y 3.2±1.63 equivalentes de área en ojos con < 0.5 (p=0.12). El promedio de extensión, en ojos con menos de 2 desviaciones estándar del grosor del campo central, punto central, campo 7 y volumen macular fue significativamente menor a los ojos con más de 2 desviaciones estándar (1.9±0.93 vs. 4.07±1.49, 2.44±1.47 vs. 3.94±1.52, 1.79±1.07 vs. 3.61±1.57 y 1.6±0.9 vs. 3.9±1.4, respectivamente, p<0.001).
ConclusiónLa extensión del engrosamiento retiniano se relaciona con las características anatómicas reportadas con mayor riesgo de pérdida visual, pero no se relaciona con la baja visual inicial.
Clinically significant macular edema has features that are associated with a major risk of visual loss, with thickening that involves the centre of the macula, field 7 or visual deficiency, although it is unknown if these features are related to retinal thickness extension.
Material and methodsAn observational, analytical, prospective, cross-sectional and open study was conducted. The sample was divided into initial visual acuity ≥0.5, central field thickness, center point thickness, field 7 and macular volume more than the reported 2 standard deviation mean value in eyes without retinopathy. The extension was determined by the number of the central field area equivalent thickening and these features were compared with by Student's t test for independent samples.
ResultsA total of 199 eyes were included. In eyes with visual acuity of ≥0.5, the mean extension was 2.88±1.68 and 3.2±1.63 in area equivalent in eyes with visual acuity <0.5 (p=0.12). The mean extension in eyes with less than 2 standard deviation of central field thickness, center point thickness, field 7 and macular volume was significantly lower than in eyes with more than 2 standard deviations (1.9±0.93 vs. 4.07±1.49, 2.44±1.47 vs. 3.94±1.52, 1.79±1.07 vs. 3.61±1.57 and 1.6±0.9 vs. 3.9±1.4, respectively, p<0.001).
ConclusionsThe extension of retinal thickness is related with the anatomical features reported with a greater risk of visual loss, but is not related to initial visual deficiency.
El diagnóstico del edema macular clínicamente significativo se basa en características que se relacionan con mayor riesgo de desarrollar pérdida visual moderada, independiente del grado de retinopatía con que se cuente en el momento del diagnóstico1. La prevalencia de edema macular clínicamente significativo es aproximadamente del 23% en población mexicana2.
Estas características descritas por el estudio temprano de retinopatía diabética (Early Treatment Diabetic Retinopathy Study [ETDRS]) son: engrosamiento retiniano en el centro de la mácula o en las 500 micras de la retina adyacente; exudados en el centro de la mácula o en las 500 micras de la retina adyacente, si están asociadas con engrosamiento de la retina contigua; o la presencia de una zona (o zonas) de engrosamiento retiniano mayor de un área de disco, que se encuentre a un diámetro de disco o menos del centro de la mácula3.
Otras características que no incluyó el ETDRS, pero que se han reportado que están asociadas con mayor riesgo de presentar pérdida visual, es el engrosamiento que involucra o se aproxima al centro de la fóvea4 y que el campo temporal perifoveal esté afectado5.
Diversos estudios han reportado la relación que existe entre las características anatómicas, como el grosor del punto central o el volumen macular, y funcionales como la capacidad visual, determinando que la correlación entre ellas es muy variable6–9. Sin embargo, los estudios no han tenido en cuenta la extensión del edema que se presenta en estos pacientes. El empleo de la tomografía de coherencia óptica ha permitido evaluar de una manera objetiva el patrón del edema (focal o difuso)10 e incluso poder determinar la cantidad de campos afectados por el engrosamiento11.
Basados en la tomografía de coherencia óptica y el volumen de la mácula se calculó el área de afección antes de la fotocoagulación, y si esta está relacionada con las características relacionadas con riesgo de pérdida visual; para así poder identificar si la variabilidad de resultados se relaciona con la extensión del edema y no únicamente con las características.
Material y métodosSe realizó un estudio observacional, analítico, prospectivo, transversal y abierto, en pacientes diabéticos tipo 2 con edema macular clínicamente significativo de la ciudad de México y su área metropolitana; la muestra se obtuvo de los pacientes atendidos en el Hospital Juárez de México, del 1 de mayo de 2008 al 31 de julio del 2014; el estudio se desarrolló del 1 de enero al 31 de agosto de 2014, fue aprobado por los comités de investigación y ética en investigación del hospital donde se realizó; todos los pacientes autorizaron participar en el estudio mediante la firma del consentimiento informado.
Se incluyeron pacientes diabéticos tipo 2, con edad de 40 a 80 años, de cualquier género, con cualquier grado de retinopatía diabética y edema macular clínicamente significativo focal, que contaran con un mapa rápido macular y registro de la agudeza visual mejor corregida el día del tratamiento.
Se excluyeron los ojos con opacidad de medios que limitara la función visual per se (catarata, hemorragia prerretiniana), vítreo posterior engrosado, isquemia en la angiografía con fluoresceína, otra maculopatía o retinopatía, ojos tratados previamente con fotocoagulación focal y errores de medición en el mapa rápido macular (cualquier desviación de la línea de la tomografía de coherencia óptica respecto al límite real de la retina).
Un solo investigador diagnosticó el edema macular clínicamente significativo, de acuerdo con los criterios del ETDRS; la agudeza visual mejor corregida se midió bajo refracción, con cartillas de visión del ETDRS. Todos los mapas rápidos maculares se obtuvieron bajo midriasis ≥6mm, con el equipo de tomografía de coherencia óptica Stratus® (Carl Zeiss Meditec, Inc., Dublin, California, EE. UU., versión de software 4.01), mediante el siguiente procedimiento estandarizado: inclusión del equivalente esférico, identificación del plano retiniano con una alerta acústica, rastreo para ojo oscuro y optimización de la polarización y del eje z. Los mapas se obtuvieron con flash, entre las 9:00 y las 11:00a.m.12,13, para asegurar que estuvieran centrados se verificó que la zona más delgada estuviera dentro del círculo central, y que la relación entre la desviación estándar del grosor del punto central y el grosor del punto central fuera menor al 10%14.
La muestra se dividió de acuerdo a las características que se han identificado como asociadas con pérdida visual: agudeza visual mejor corregida <20/40, engrosamiento del campo central, engrosamiento del campo temporal perifoveal y el volumen. La definición de engrosamiento central, temporal perifoveal y volumen fue por el valor de cada una que superará por más de 2 desviaciones estándar a la media encontrada en ese valor en ojos sin retinopatía.
La variable en estudio fue la extensión total del engrosamiento, que se definió de acuerdo al número de campos engrosados de la siguiente manera: se identificó cada campo de la tomografía de coherencia óptica con engrosamiento (valor de cada campo que superará por más de 2 desviaciones estándar a la media del grosor retiniano encontrada en ojos sin retinopatía del mapa rápido macular). Se realizó la conversión de áreas equivalentes al campo central (1.000 micras de diámetro), con la siguiente correspondencia: campo 1 —un área de campo central—, campo 2, 3, 4 y 5 —0.5 áreas de campo central—, campo 6, 7, 8 y 9 —0.75 áreas de campo central—. Se sumaron cada una de las áreas equivalentes para obtener la extensión total del engrosamiento.
Se compararon entre cada una de las características relacionadas la media de extensión total mediante la prueba t de Student para medias independientes.
Se consideró significativa a una p<0.05; los datos se capturaron y analizaron con el programa Minitab versión 16.
ResultadosSe evaluaron 199 ojos de 154 pacientes diabéticos tipo 2, con edad entre los 41 y 78 años (promedio 58.47, desviación estándar [DE]±9.28), 119 ojos pertenecían al género femenino (59.8%). La evolución de la diabetes tuvo un recorrido de uno a 30 años (promedio 14.56 DE±6.78), 86 con tratamiento a base de hipoglucemiantes orales (55.9%) y 34 con insulina (22%). La glucemia en ayunas tuvo un promedio de 176.81DE±87.05mg/dl, la hemoglobina glucosilada tuvo un promedio de 10.8DE±4.04%, el colesterol tuvo un promedio de 206.4DE±62.01 mg/dl, los triglicéridos tuvieron un promedio de 172.08DE±93.4 mg/dl, la depuración de creatinina tuvo un promedio de 46.9DE±30.78 mg/dl. La tensión arterial sistólica tuvo un promedio de 140.8DE±21.6mmHg, la tensión arterial diastólica de 84.46DE±12.15mmHg y la tensión arterial media de 103.03DE±14.58mmHg.
Setenta pacientes padecían hipertensión arterial (44.4%); 48 de ellos estaban tratados con inhibidores de la enzima convertidora de angiotensina (31.1%). En el grado de retinopatía 14 presentaron no proliferativa leve (7%), 107 no proliferativa moderada (53.8%), 12 no proliferativa severa (6%) y 66 proliferativa (33.2%). Ciento veinticuatro presentaron tipo de edema monofocal (62.3%) y 75 multifocal (37.7%). No hubo diferencias entre los diferentes grados de retinopatía y la extensión del engrosamiento, la baja visual inicial, el grosor del campo central y del punto central (p>0.5).
La localización del edema fue superotemporal en 103 ojos (28.9%), inferior en 102 ojos (28.6%), temporal en 30 ojos (8.4%), superior en 27 ojos (7.6%), nasal en 27 ojos (7.6%), superonasal en 24 ojos (6.7%), inferotemporal en 9 ojos (2.5%) e inferonasal en 8 ojos (2.2%).
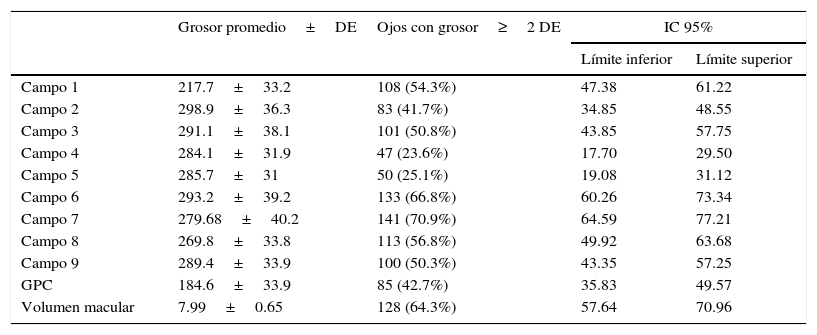
La capacidad visual inicial tuvo un recorrido de 0.15 a 1.00 en equivalente decimal, con un promedio de 0.46±0.26. El campo central tuvo un promedio de 217.7μm±33.2, el grosor del punto central 184.6 μm±33.9 y el volumen macular promedio fue 7.99 mm3±0.65.
La extensión total tuvo un recorrido desde 0.5 hasta 6 equivalentes de área con un promedio 3.08±1.66. En los ojos con capacidad visual≥0.5 (≥20/40, n=92) el promedio de extensión fue de 2.88±1.68 equivalentes de área, mientras que ojos con capacidad visual<0.5 (<20/40), el promedio de extensión fue 3.2±1.63 equivalentes de área. (p=0.12). El grosor del campo central con menos de 2DE (n=91) presentó una extensión promedio de 1.9±0.93 en equivalentes de área, mientras que el grosor del campo central con más de 2DE (n=108) tuvo una extensión promedio de 4.07±1.49 equivalentes de área (p<0.001).
El grosor del punto central con menos de 2DE (n=114) tuvo un promedio de extensión de 2.44±1.47, el grosor del punto central con más de 2DE (n=85) tuvo una extensión promedio 3.94±1.52 en equivalentes de área (p<0.001).
El campo 7 con menos de 2DE (n=58) tuvo una extensión promedio de 1.79±1.07, mientras el campo 7 con más de 2DE (n=141) tuvo una extensión promedio 3.61±1.57 en equivalentes de área (p<0.001).
El volumen macular en parámetros normales (n=71) tuvo una extensión promedio 1.6±0.9 en equivalente de área y el volumen macular con más de 2DE (n=128) tuvo un promedio de extensión 3.9±1.4 en equivalentes de área (p<0.001).
En cuanto a la extensión solo del campo 1 existieron 108 ojos con engrosamiento mayor a 2DE (54.3%), el anillo interno estuvo afectado en 135 casos (67.8%) en uno o más de los campos correspondientes, y el anillo externo estuvo afectado en 186 casos (93.5%) en uno o más de los campos (tabla 1).
Distribución de los campos con engrosamiento mayor a 2 desviaciones estándar en cada campo de la tomografía de coherencia óptica
| Grosor promedio±DE | Ojos con grosor≥2 DE | IC 95% | ||
|---|---|---|---|---|
| Límite inferior | Límite superior | |||
| Campo 1 | 217.7±33.2 | 108 (54.3%) | 47.38 | 61.22 |
| Campo 2 | 298.9±36.3 | 83 (41.7%) | 34.85 | 48.55 |
| Campo 3 | 291.1±38.1 | 101 (50.8%) | 43.85 | 57.75 |
| Campo 4 | 284.1±31.9 | 47 (23.6%) | 17.70 | 29.50 |
| Campo 5 | 285.7±31 | 50 (25.1%) | 19.08 | 31.12 |
| Campo 6 | 293.2±39.2 | 133 (66.8%) | 60.26 | 73.34 |
| Campo 7 | 279.68±40.2 | 141 (70.9%) | 64.59 | 77.21 |
| Campo 8 | 269.8±33.8 | 113 (56.8%) | 49.92 | 63.68 |
| Campo 9 | 289.4±33.9 | 100 (50.3%) | 43.35 | 57.25 |
| GPC | 184.6±33.9 | 85 (42.7%) | 35.83 | 49.57 |
| Volumen macular | 7.99±0.65 | 128 (64.3%) | 57.64 | 70.96 |
DE: desviación estándar; GPC: grosor del punto central; IC 95%: intervalos de confianza del 95%.
La extensión del engrosamiento no se relacionó con la pérdida visual antes del tratamiento (p<0.05); algunos estudios han demostrado que aunque la agudeza visual es el estándar para la evaluación funcional en los pacientes con retinopatía diabética, podría no ser la mejor herramienta para evaluarla en estos pacientes, ya que su correlación con los cambios anatómicos es modesta6,15–17. Existen otras herramientas que colaboran a la evaluación de la función visual como la microperimetría17,18 o la electrorretinografía19,20, para lo cual se requiere de estudios posteriores donde se analice la asociación entre la extensión del edema y la disfunción visual que presentan estos pacientes.
Las características anatómicas que han demostrado estar asociadas con mayor riesgo de pérdida visual son áreas con mayor grosor como: el campo central1, el campo temporal perifoveal (campo 7)5, el punto central y el volumen macular21; en este estudio estas características se asociaron significativamente con una mayor extensión de engrosamiento al presentar casi el doble de la extensión al estar involucradas. El grupo de investigación clínica en retinopatía diabética (Diabetic Retinopathy Clinical Research Network) encontró una correlación baja entre el número de campos engrosados antes del tratamiento con la agudeza visual (r=0.38), y una correlación buena entre el número de campos engrosados con el campo central y el volumen macular (0.64 y 0.77, respectivamente)22.
Browning et al.10 han referido la necesidad de identificar aquellas características del edema macular más allá de la clasificación estandarizada, como es la extensión y la localización del engrosamiento, el involucramiento o no del centro de la mácula, entre otros. Determinar la extensión del engrosamiento y la relación con las características que favorecen la pérdida visual establece un punto de corte para conocer el estado en el que se encuentra el ojo involucrado, sin embargo la extensión no logra por sí sola justificar el estado funcional del ojo.
Se ha reportado que la disfunción retiniana se presenta antes de que aparezcan los cambios anatómicos y la disminución de la agudeza visual, por lo que existen otros factores que pueden estar participando en la disfunción neural y no solo la presencia del engrosamiento23,24.
La tomografía de coherencia óptica sigue siendo una herramienta útil para evaluar el estado y seguimiento de los pacientes con edema macular25, el poder identificar las zonas de engrosamiento y la extensión del mismo permitiría identificar características que podrían estar participando en el pronóstico de los pacientes. Conocer la extensión del engrosamiento y las modificaciones posteriores al tratamiento de este podría explicar los diferentes desenlaces que se presentan en los pacientes, y así poder identificar las características que se relacionan con peor pronóstico.
ConclusionesLa extensión del engrosamiento retiniano se relaciona con las características anatómicas reportadas con mayor riesgo de pérdida visual en los pacientes con edema macular; sin embargo, la extensión no explica por sí sola la presencia de baja agudeza visual en el momento del tratamiento.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.