El índice leucoglucémico (ILG) ha mostrado ser un buen marcador pronóstico en diversos escenarios de la medicina crítica. Sin embargo, existe escasa evidencia respecto a su valor predictivo en el postoperatorio de cirugía cardíaca. El objetivo de este estudio fue analizar el valor pronóstico del ILG en pacientes cursando el posoperatorio de cirugía cardíaca.
MétodosSe analizó retrospectivamente la base de datos de cirugía cardíaca, completada prospectivamente entre 2010 y 2015. Se evaluó el ILG en cuartiles y se utilizó curva de ROC para determinar un valor de corte. El objetivo final primario analizado fue un combinado de mortalidad intrahospitalaria o bajo gasto. Como objetivos finales secundarios se evaluaron la incidencia de mortalidad intrahospitalaria, la fibrilación auricular, el bajo gasto (BGC), la insuficiencia renal aguda (IRA), la necesidad de diálisis y la duración de estancia hospitalaria.
ResultadosSe analizó a 2.743 pacientes a los que se les realizó cirugía cardíaca. La media de edad fue de 66 años (DE 11,8). El objetivo final primario en los diferentes cuartiles analizados fue significativamente creciente (el 5,4, el 7,1, el 7,7 y el 10,1%, respectivamente; p: 0,025). Respecto a los objetivos finales secundarios, el ILG fue predictor de BGC, IRA y necesidad de diálisis. El mejor valor de corte pronóstico del ILG para el objetivo final primario fue de 2.000. En un modelo de regresión logística, el ILG se asoció independientemente a mayor tasa de mortalidad intrahospitalaria y/o bajo gasto (OR: 1,40, IC del 95%, 1,01-1,94, p: 0,03).
ConclusionesEL ILG demostró ser un predictor de peor evolución en pacientes durante el postoperatorio de cirugía cardíaca.
The leuko-glycaemic index (LGI) has been associated with a poor prognosis in many critical care settings. However there is no evidence regarding the prognostic value in postoperative cardiac surgery. The aim of this study was to analyse the prognostic value of LGI in postoperative cardiac surgery.
MethodsA study was performed using the Cardiac Surgery database, prospectively completed between 2010 and 2015. The LGI was analysed in quartiles according to 25, 50, and 75 percentile values. The ROC curve was used to determine a cut-off value. The primary endpoint was in-hospital death or low cardiac output (LCO). Secondary endpoints included in-hospital death, atrial fibrillation (AF), LCO, acute kidney injury (AKI), dialysis requirement, and length of hospital stay.
ResultsThe study evaluated 2743 patients undergoing cardiac surgery. The mean age was 66 (SD 11.8). Presence of the primary endpoint significantly increased per LGI quartile (5.4%, 7.1%, 7.7% and 10.1%; P=.025). The LGI was also associated with an increased occurrence of LCO, AKI and dyalisis requirement. The best prognostic cut-off value for the primary endpoint was 2000. In a multivariate logistic regression model, LGI was independently associated with in-hospital death or LCO (OR: 1.40, 95% CI; 1.01-1.94, P=.03).
ConclusionThe LGI was an independent predictor of adverse outcomes in postoperative of cardiac surgery.
Los scores utilizados actualmente para la estratificación del riesgo quirúrgico en cirugía cardíaca, como el EuroSCORE o el STS score, utilizan variables recogidas o evaluadas de manera preoperatoria1,2.
Existen, además, otros biomarcadores postoperatorios con valor pronóstico, como el ácido láctico y la saturación venosa de oxígeno3. Por otro lado, la hiperglucemia en el postoperatorio inmediato se asocia a una morbimortalidad aumentada4-6. En relación con las citocinas inflamatorias, existe evidencia de que tras el uso de la bomba de circulación extracorpórea (CEC) aumenta la concentración plasmática de mediadores leucocitarios, que contribuyen al síndrome de respuesta inflamatoria sistémica (SRIS) y peor pronóstico posquirúrgico7,8. A su vez, el índice leucoglucémico (ILG), al relacionar la glucemia con el recuento leucocitario, podría brindar información pronóstica en el postoperatorio. Dicho índice ya mostró ser un buen predictor de eventos en diversos escenarios de la medicina crítica, como el infarto agudo de miocardio y el accidente cerebrovascular9-11. Sin embargo, no hay trabajos que lo evalúen en el ámbito de la cirugía cardíaca.
El objetivo de este trabajo es determinar el valor pronóstico del ILG en el postoperatorio inmediato de cirugía cardíaca.
MétodosSe analizó, de forma retrospectiva, la base de datos informatizada del servicio de cirugía cardíaca del Instituto Cardiovascular de Buenos Aires, completada prospectivamente. Se incluyó a todos los pacientes a los que se les realizó cirugía cardíaca, en el período comprendido entre 2010 y 2015. Se tomaron los valores de glucemia y recuento leucocitario del postoperatorio inmediato, y se calculó el ILG multiplicando el valor de glucemia (mg/dl) por el número de leucocitos en miles (leucocitos/1.000). La muestra sanguínea para obtener el ILG en cada paciente fue única y se obtuvo al ingreso a la unidad de terapia intensiva, dentro de los 10 min de la salida de quirófano. El objetivo final primario analizado fue un combinado de mortalidad intrahospitalaria o bajo gasto cardíaco (BGC). El BGC se definió por medio del método de termodilución por Swan-Ganz como índice cardíaco menor a 2,2 l/min×m2, asociado a presión de enclavamiento pulmonar mayor de 18mm de mercurio y con requerimiento de fármacos vasopresores. Como objetivos finales secundarios, se evaluó la incidencia de mortalidad intrahospitalaria aislada, fibrilación auricular, BGC aislado, insuficiencia renal aguda (IRA), necesidad de diálisis y la duración de estancia hospitalaria. La IRA se definió como creatinina sérica mayor o igual a 2mg/dl, asociada a un aumento de al menos el 100% del valor basal.
Análisis estadísticoLa distribución paramétrica o no paramétrica de las variables continuas se evaluó mediante la prueba de Kolmogorov-Smirnov. Se analizó el ILG en cuartiles según los valores de los percentiles 25, 50 y 75. Los pacientes fueron divididos según los cuartiles de ILG y se realizó un análisis descriptivo de las características de los mismos mediante proporciones o medias y desviación estándar, según correspondiera el tipo de variable categórica o continua.
Se llevaron a cabo pruebas de tendencia para los cuartiles de ILG, para las medias y las proporciones. En el caso de medias, la hipótesis de tendencia se contrastó mediante un modelo lineal generalizado, y en caso de proporciones, usando el test de Cochran-Armitage.
Por medio de la comparación de curvas ROC, se identificó el mejor punto de corte del ILG para predecir el evento combinado: muerte intrahospitalaria o BGC. Luego, a partir del mejor punto de corte hallado, la variable ILG se categorizó en 2 grupos y fue utilizada para evaluar asociaciones con los objetivos finales primario y secundarios, ajustando por variables de interés mediante modelos de regresión logística. Se realizó inicialmente un análisis univariante, incluyendo las variables clínicas pronósticas clásicas del postoperatorio de cirugía cardíaca, y aquellas que resultaban estadísticamente diferentes tras el análisis de tendencia entre los diferentes cuartiles de la distribución de valores del ILG. Se incluyeron en dicho análisis la edad, el sexo, la electividad de la cirugía, la disfunción ventricular severa, el EuroScore, antecedente de diabetes, de hipertensión arterial previa, insuficiencia renal crónica, historia de infarto agudo de miocardio, presencia de fibrilación auricular postoperatoria y necesidad de reoperación. Las variables con p<0,05 en el análisis univariante fueron incluidas en el modelo multivariable. Se presentaron razones de odds e intervalo de confianza del 95% para las variables incluidas en los modelos. Se consideró un error alfa a 2 colas del 5% como valor estadísticamente significativo.
Todos los análisis estadísticos fueron realizados utilizando IBM SPSS Statistics versión 19.0
Consideraciones éticasEl protocolo de estudio fue aprobado por el Comité de bioética del Instituto Cardiovascular de Buenos Aires, excluyendo la solicitud de consentimiento informado por no requerir datos sensibles ni seguimiento clínico (ajustándose a la Ley 25.326 de Hábeas Data sobre protección de datos personales).
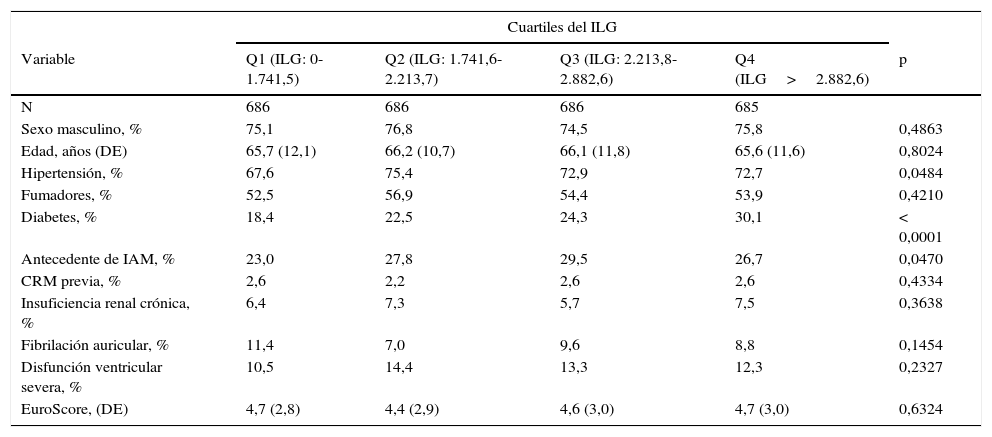
ResultadosSe analizó a 2.743 pacientes a los que se les realizó cirugía cardíaca. De ellos, el 47% correspondió a cirugía de revascularización miocárdica (CRM), el 24% a cirugía valvular, el 15% a combinada (cirugía valvular asociada a CRM) y el 14% a otro tipo de cirugía (cualquier cirugía de aorta torácica con preservación de válvula, trasplante cardíaco, cierre de comunicación interauricular, cierre de comunicación interventricular, otra corrección de cardiopatía congénita o miectomía septal). La media de edad de la población global fue de 65,5 años (DE: 11), siendo la mayoría de sexo masculino (75%). Respecto a los factores de riesgo cardiovascular, el 72% eran hipertensos, el 23% diabéticos y el 54% fumadores. Si bien el 27% tenía antecedentes de infarto agudo de miocardio previo, solo el 2.5% presentaba revascularización quirúrgica. En relación con la presencia de otras comorbilidades, el 9% presentaba antecedente de fibrilación auricular, el 12% disfunción ventricular severa y un 7% insuficiencia renal crónica. El EuroScore promedio fue de 4,6. Al realizar un análisis según cuartiles del ILG, las características basales de la población fueron similares en cada uno de los 4 cuartiles, excepto por el mayor porcentaje de hipertensión arterial, diabetes e infarto agudo de miocardio en los cuartiles más altos. Sin embargo, el EuroScore fue similar en todos ellos (tabla 1).
Características basales de la población según cuartiles del índice leucoglucémico
| Cuartiles del ILG | |||||
|---|---|---|---|---|---|
| Variable | Q1 (ILG: 0-1.741,5) | Q2 (ILG: 1.741,6-2.213,7) | Q3 (ILG: 2.213,8-2.882,6) | Q4 (ILG>2.882,6) | p |
| N | 686 | 686 | 686 | 685 | |
| Sexo masculino, % | 75,1 | 76,8 | 74,5 | 75,8 | 0,4863 |
| Edad, años (DE) | 65,7 (12,1) | 66,2 (10,7) | 66,1 (11,8) | 65,6 (11,6) | 0,8024 |
| Hipertensión, % | 67,6 | 75,4 | 72,9 | 72,7 | 0,0484 |
| Fumadores, % | 52,5 | 56,9 | 54,4 | 53,9 | 0,4210 |
| Diabetes, % | 18,4 | 22,5 | 24,3 | 30,1 | < 0,0001 |
| Antecedente de IAM, % | 23,0 | 27,8 | 29,5 | 26,7 | 0,0470 |
| CRM previa, % | 2,6 | 2,2 | 2,6 | 2,6 | 0,4334 |
| Insuficiencia renal crónica, % | 6,4 | 7,3 | 5,7 | 7,5 | 0,3638 |
| Fibrilación auricular, % | 11,4 | 7,0 | 9,6 | 8,8 | 0,1454 |
| Disfunción ventricular severa, % | 10,5 | 14,4 | 13,3 | 12,3 | 0,2327 |
| EuroScore, (DE) | 4,7 (2,8) | 4,4 (2,9) | 4,6 (3,0) | 4,7 (3,0) | 0,6324 |
Las variables categóricas se expresan mediante porcentajes, y las continuas como media +/- desviación estándar (DE).
CRM: cirugía de revascularización miocárdica; DE: desviación estándar, IAM: infarto agudo de miocardio; ILG: índice leucoglucémico; Q: cuartil.
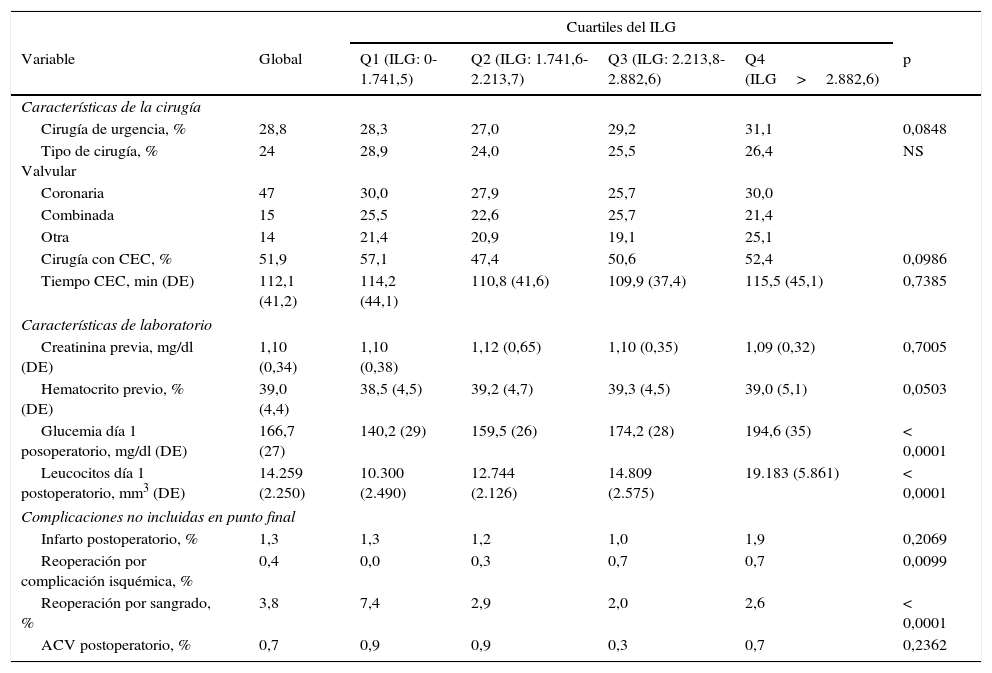
Respecto a la cirugía realizada en los pacientes de los distintos cuartiles, no hubo diferencias en el tipo de cirugía, en la utilización de bomba de CEC ni en el tiempo de CEC. En cuanto a las complicaciones postoperatorias no incluidas en los objetivos finales, tuvieron similares tasas de infarto periprocedimiento y accidente cerebrovascular, pero diferenciándose significativamente en la causa de reoperación (los pacientes de cuartiles más altos se reintervinieron principalmente por causa isquémica, mientras que los de cuartiles más bajos fue debido a sangrado). En relación con las características de laboratorio, los pacientes presentaron valores basales de hematocrito y creatininemia similares, diferenciándose únicamente por la glucemia y el recuento leucocitario del postoperatorio inmediato (lógicamente, estas 2 variables fueron mayores en los pacientes con ILG mayor) (tabla 2). La mediana del ILG fue de 2.213,7, mientras que los percentiles 25 y 75 fueron de 1.741,5 y 2.882,6, respectivamente.
Características de la cirugía y laboratorio de la población según cuartiles del índice leucoglucémico
| Cuartiles del ILG | ||||||
|---|---|---|---|---|---|---|
| Variable | Global | Q1 (ILG: 0-1.741,5) | Q2 (ILG: 1.741,6-2.213,7) | Q3 (ILG: 2.213,8-2.882,6) | Q4 (ILG>2.882,6) | p |
| Características de la cirugía | ||||||
| Cirugía de urgencia, % | 28,8 | 28,3 | 27,0 | 29,2 | 31,1 | 0,0848 |
| Tipo de cirugía, % Valvular | 24 | 28,9 | 24,0 | 25,5 | 26,4 | NS |
| Coronaria | 47 | 30,0 | 27,9 | 25,7 | 30,0 | |
| Combinada | 15 | 25,5 | 22,6 | 25,7 | 21,4 | |
| Otra | 14 | 21,4 | 20,9 | 19,1 | 25,1 | |
| Cirugía con CEC, % | 51,9 | 57,1 | 47,4 | 50,6 | 52,4 | 0,0986 |
| Tiempo CEC, min (DE) | 112,1 (41,2) | 114,2 (44,1) | 110,8 (41,6) | 109,9 (37,4) | 115,5 (45,1) | 0,7385 |
| Características de laboratorio | ||||||
| Creatinina previa, mg/dl (DE) | 1,10 (0,34) | 1,10 (0,38) | 1,12 (0,65) | 1,10 (0,35) | 1,09 (0,32) | 0,7005 |
| Hematocrito previo, % (DE) | 39,0 (4,4) | 38,5 (4,5) | 39,2 (4,7) | 39,3 (4,5) | 39,0 (5,1) | 0,0503 |
| Glucemia día 1 posoperatorio, mg/dl (DE) | 166,7 (27) | 140,2 (29) | 159,5 (26) | 174,2 (28) | 194,6 (35) | < 0,0001 |
| Leucocitos día 1 postoperatorio, mm3 (DE) | 14.259 (2.250) | 10.300 (2.490) | 12.744 (2.126) | 14.809 (2.575) | 19.183 (5.861) | < 0,0001 |
| Complicaciones no incluidas en punto final | ||||||
| Infarto postoperatorio, % | 1,3 | 1,3 | 1,2 | 1,0 | 1,9 | 0,2069 |
| Reoperación por complicación isquémica, % | 0,4 | 0,0 | 0,3 | 0,7 | 0,7 | 0,0099 |
| Reoperación por sangrado, % | 3,8 | 7,4 | 2,9 | 2,0 | 2,6 | < 0,0001 |
| ACV postoperatorio, % | 0,7 | 0,9 | 0,9 | 0,3 | 0,7 | 0,2362 |
Las variables categóricas se expresan mediante porcentajes, y las continuas como media +/- desviación estándar (DE).
CEC: circulación extracorpórea; DE: desviación estándar; ILG: índice leucoglucémico; Q: cuartil.
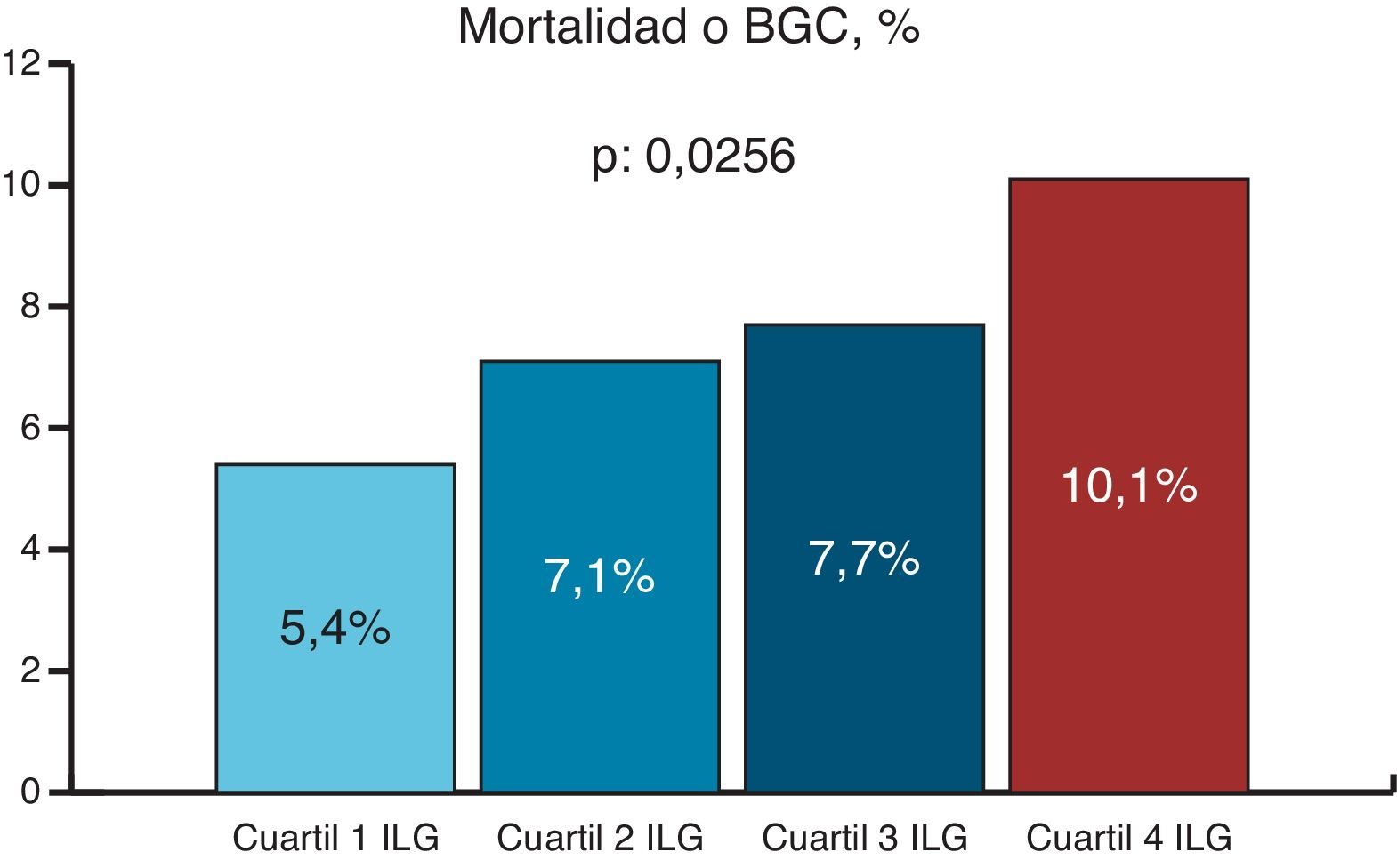
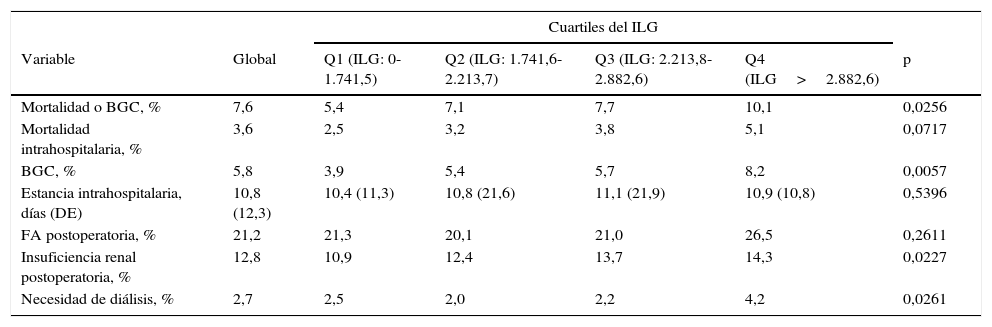
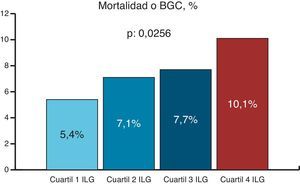
La incidencia del objetivo final primario analizado (mortalidad intrahospitalaria o BGC) fue del 7,6% (n: 208), siendo significativamente creciente por cuartiles de ILG: el 5,4, el 7,1, el 7,7 y el 10,1%, respectivamente (p: 0,0256) (fig. 1). En cuanto a los objetivos finales secundarios, el ILG también fue predictor de mayor incidencia de BGC, IRA y necesidad de diálisis postoperatoria. Por el contrario, no se asoció a mayor incidencia de fibrilación auricular ni a mayor mortalidad, si bien hubo una tendencia a aumentar esta última en los cuartiles más altos. El tiempo de estancia intrahospitalaria fue similar en todos los grupos (tabla 3).
Objetivos finales primario y secundarios según cuartiles del índice leucoglucémico
| Cuartiles del ILG | ||||||
|---|---|---|---|---|---|---|
| Variable | Global | Q1 (ILG: 0-1.741,5) | Q2 (ILG: 1.741,6-2.213,7) | Q3 (ILG: 2.213,8-2.882,6) | Q4 (ILG>2.882,6) | p |
| Mortalidad o BGC, % | 7,6 | 5,4 | 7,1 | 7,7 | 10,1 | 0,0256 |
| Mortalidad intrahospitalaria, % | 3,6 | 2,5 | 3,2 | 3,8 | 5,1 | 0,0717 |
| BGC, % | 5,8 | 3,9 | 5,4 | 5,7 | 8,2 | 0,0057 |
| Estancia intrahospitalaria, días (DE) | 10,8 (12,3) | 10,4 (11,3) | 10,8 (21,6) | 11,1 (21,9) | 10,9 (10,8) | 0,5396 |
| FA postoperatoria, % | 21,2 | 21,3 | 20,1 | 21,0 | 26,5 | 0,2611 |
| Insuficiencia renal postoperatoria, % | 12,8 | 10,9 | 12,4 | 13,7 | 14,3 | 0,0227 |
| Necesidad de diálisis, % | 2,7 | 2,5 | 2,0 | 2,2 | 4,2 | 0,0261 |
Las variables categóricas se expresan mediante porcentajes, y las continuas como media +/- desviación estándar (DE).
BGC: bajo gasto cardíaco; DE: desviación estándar; FA: fibrilación auricular; ILG: índice leucoglucémico; Q: cuartil.
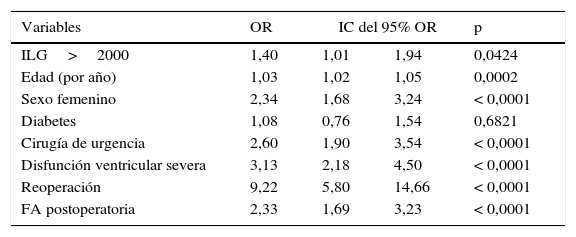
El área bajo la curva ROC fue de 0,61. El mejor valor de corte del ILG para el objetivo final primario fue de 2.000. En un modelo de regresión logística multivariado, en el cual se ajustó a diversas variables (edad, sexo, diabetes, disfunción ventricular, electividad de la cirugía, reoperación y fibrilación auricular postoperatoria), el ILG elevado se asoció independientemente a mayor tasa de mortalidad intrahospitalaria o bajo gasto (OR: 1,40, IC del 95%, 1,01-1,94; p: 0,0424) (tabla 4).
Análisis de regresión logística multivariado para mortalidad y/o bajo gasto cardíaco
| Variables | OR | IC del 95% OR | p | |
|---|---|---|---|---|
| ILG>2000 | 1,40 | 1,01 | 1,94 | 0,0424 |
| Edad (por año) | 1,03 | 1,02 | 1,05 | 0,0002 |
| Sexo femenino | 2,34 | 1,68 | 3,24 | < 0,0001 |
| Diabetes | 1,08 | 0,76 | 1,54 | 0,6821 |
| Cirugía de urgencia | 2,60 | 1,90 | 3,54 | < 0,0001 |
| Disfunción ventricular severa | 3,13 | 2,18 | 4,50 | < 0,0001 |
| Reoperación | 9,22 | 5,80 | 14,66 | < 0,0001 |
| FA postoperatoria | 2,33 | 1,69 | 3,23 | < 0,0001 |
FA: fibrilación auricular; IC: intervalo de confianza; ILG: índice leucoglucémico; OR: odds ratio.
En nuestro estudio, la presencia de ILG elevado en los pacientes cursando postoperatorio de cirugía cardíaca demostró ser un predictor de mala evolución, al asociarse independientemente a mayor tasa de BGC o mortalidad.
Como se describió hace varios años, la hiperglucemia es muy frecuente en el postoperatorio de cirugía cardíaca, afectando aproximadamente a 1 de cada 3 pacientes, ya sean diabéticos o no12. Ascione demostró que la mayoría de los pacientes que presentan hiperglucemia de estrés en el postoperatorio de cirugía cardíaca no tienen diagnóstico previo de diabetes, describiendo una prevalencia tan solo del 38%13. A su vez, los pacientes que están críticamente enfermos, cursando un postoperatorio de cirugía cardíaca o un infarto agudo de miocardio, son especialmente sensibles al daño agudo por hiperglucemia14. Múltiples trabajos evidenciaron que valores elevados de glucemia en internación se asocian a peor evolución intrahospitalaria, principalmente a expensas de mayor mortalidad5,6. Fish et al. demostraron que presentar una glucemia mayor de 250mg/dl en el postoperatorio inmediato se asoció a un riesgo de muerte intrahospitalaria 10 veces mayor15.
La leucocitosis también es un hallazgo muy frecuente en los pacientes que se someten a cirugía cardíaca, principalmente en aquellos en los que se utiliza bomba de CEC, ya que genera un SRIS, con la consecuente liberación de múltiples citocinas7,8. Como evidenciaron McGuinness et al., las interleucinas 6, 8 y el factor de necrosis tumoral alfa presentan picos plasmáticos entre las 2 y las 4 h de haber salido de CEC, alcanzando casi valores normales más allá de las 24 h del postoperatorio16. El SRIS luego de cirugía cardíaca, a su vez, se asocia a falla multiorgánica y complicaciones mayores8,17.
Más allá del valor pronóstico de ambos de manera individual, la hiperglucemia y la leucocitosis en conjunto, como ILG, no habían sido evaluadas previamente en el ámbito de la cirugía cardíaca.
Si analizamos en otros contextos clínicos, el ILG fue utilizado como predictor de eventos en otros escenarios de la medicina crítica, principalmente en el infarto agudo de miocardio. Hace 10 años, Ishihara et al. fueron de los primeros en demostrar el valor pronóstico asociado de la glucemia y la leucocitosis utilizando la combinación de ambas variables, pero no como índice18. Más tarde, Quiroga Castro et al. describieron el ILG como predictor pronóstico en el infarto agudo de miocardio. A diferencia de nuestro estudio, más allá de ser otro escenario clínico, ellos analizaron tan solo 101 pacientes, mientras que en nuestra experiencia el número fue de 2.7439. El mejor valor de corte obtenido por curva ROC para predecir eventos también fue menor, siendo de 1.600, en contraste con el nuestro de 2.000. Posteriormente, Hirschson Prado et al., de manera similar, demostraron que el ILG se asoció a peor pronóstico en el infarto, evaluando un objetivo final primario similar al nuestro de mortalidad o Killip Kimball 3-4 (analogando el 4 al BGC). Al igual que en nuestro trabajo, analizaron el ILG según cuartiles, pero a diferencia de nuestro estudio obtuvieron un valor de corte por curva de ROC de 1.000 (aún más bajo que en el trabajo de Quiroga Castro et al.), pero con mayor área bajo la curva (0,77)10. De manera similar, León Aliz et al. estudiaron el ILG también en el infarto agudo de miocardio, obteniendo un valor de corte de 1.150 para predecir eventos cardiovasculares, siempre menores al obtenido en nuestro trabajo19. Probablemente esto se explique porque la cirugía cardíaca genera normalmente mayor inflamación y disbalance de hormonas contrarreguladoras que en el infarto, por lo que el valor de ILG debería ser mayor para predecir eventos.
En otro escenario clínico de estrés, como es el accidente cerebrovascular, Caldas et al. también evaluaron el ILG como factor pronóstico. A diferencia de nuestro trabajo, no utilizaron curva de ROC para determinar el mejor valor de corte, sino que utilizaron un ILG de 1.600, como en el estudio de Quiroga Castro et al. Si bien se evaluó solo a 50 pacientes, el ILG fue un buen predictor de mortalidad11.
Volviendo al ámbito de la cirugía cardíaca, nuestro trabajo es el primero en demostrar la utilidad del ILG como factor pronóstico. Es lógico pensar que un ILG elevado se acompañe de peor evolución intrahospitalaria, ya que como remarcamos previamente la hiperglucemia y el SRIS aumentan la morbimortalidad postoperatoria. Si bien el ILG mayor de 2.000 se asoció a mayor incidencia del objetivo final combinado de mortalidad y BGC, no se pudo demostrar un aumento de la mortalidad (si bien hubo una tendencia a aumentarla). De todas maneras, la misma se evaluó como punto final secundario. Probablemente, si hubiéramos hecho un análisis por separado de los distintos componentes del ILG, hubiéramos advertido cuál de los 2 modificaría más el objetivo final combinado. Siguiendo la lógica, de manera hipotética, la HG podría haber tenido efecto directo principalmente sobre la mortalidad, mientras que tanto la HG como la leucocitosis (marcador de SRIS) podrían ser tóxicos sobre el miocardio, habiendo colaborado ambos de manera similar con el BGC.
Respecto al aumento de incidencia de IRA y la necesidad de diálisis en los pacientes con mayor ILG, estos resultados también ratificaron lo que demuestra la evidencia, ya que tanto la hiperglucemia de estrés como el SIRS son buenos predictores de IRA en pacientes hospitalizados20,21. Contrariamente, nos sorprendió que el ILG no haya sido buen predictor de fibrilación auricular, ya que la respuesta inflamatoria inducida por el traumatismo quirúrgico se asocia a mayor desarrollo de dicha arritmia22.
Como implicancia clínica, el ILG, al ser un índice simple, sencillo de calcular y de bajo costo, podría ser una herramienta pronóstica valiosa para estratificar a pacientes que estén cursando el postoperatorio inmediato de cirugía cardíaca. A su vez, en aquellos pacientes que presenten valores de ILG mayores de 2000 en el postoperatorio inmediato se podrían implementar medidas terapéuticas de manera precoz para prevenir el BGC y la IRA.
LimitacionesCabe mencionar, como una limitación del estudio, que fue retrospectivo, con los consecuentes sesgos que ello acarrea. Otra limitación que se debe considerar es que fue unicéntrico, si bien el número de la muestra fue amplio.
ConclusionesEL ILG demostró ser un predictor independiente de peor evolución en pacientes cursando el postoperatorio de cirugía cardíaca, al asociarse a mayor incidencia de BGC o mortalidad, principalmente a expensas del BGC. También se asoció a mayor tasa de IRA y necesidad de diálisis.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran que no presentan conflicto de intereses.