El tratamiento de las taquicardias provocadas por vías accesorias es, en la actualidad, por ablación con catéter. Las indicaciones quirúrgicas actuales se reducen a los casos con fracaso en la ablación, bien a complicación de procedimiento percutáneo, o cuando se requiera tratamiento quirúrgico de otra cardiopatía estructural, fundamentalmente congénita. Es recomendable que sigan existiendo grupos quirúrgicos expertos en el tratamiento de las vías accesorias, a fin de poder ofrecer solución quirúrgica a este grupo de enfermos. Los tratamientos por vía endocárdica han sido los que han ofrecido los mejores resultados.
Treatment of tachycardia caused by accessory pathways is nowadays catheter ablation. The current surgical indications are limited to cases with ablation failure, namely complication of percutaneous or when surgical treatment is required as in the case of structural heart disease, mainly congenital. It is recommended that expert surgical groups should be able to handle the treatment of accessory pathways in order to offer surgical solution to this group of patients. The endocardial approach has offered the best results.
En este trabajo revisamos el estado actual de las técnicas quirúrgicas para el tratamiento de las arritmias por vías accesorias, de las que el paradigma es el síndrome de Wolff-Parkinson-White (WPW). La presencia de vías accesorias que conectan eléctricamente aurícula y ventrículo es un trastorno congénito que da lugar a diversos tipos de taquicardias en función de las propiedades electrofisiológicas de las vías accesorias. La primera aportación fue en 1893, cuando Kent1 identificó en corazones de mamíferos la presencia de conexiones musculares entre aurículas y ventrículos y, de forma errónea, concluyó que representaban las vías normales de la conducción auriculoventricular (AV). A pesar de este error, su nombre ha servido como epónimo para las vías accesorias AV responsables del síndrome de WPW (fibras de Kent). En 1930, L. Wolff, J. Parkinson y P. White describieron en 12 personas jóvenes la presencia de crisis de palpitaciones asociadas a un patrón electro-cardiográfico (ECG) con un «bloqueo de rama funcional» y un intervalo PR corto. Sin embargo, estos autores no explicaron la presencia de la preexcitación ni las crisis de taquicardia. Fue en 1933 cuando C. Wolferth y F. Wood sugirieron que las anomalías del ECG eran secundarias a vías accesorias entre aurículas y ventrículos, como las descritas previamente por Kent.
El primer intento quirúrgico para eliminar definitivamente una vía accesoria fue en 1968, cuando Sealy, et al.2 realizaron la primera intervención con éxito seccionando quirúrgicamente una vía accesoria. Para ello abordaron el surco AV derecho, desde la parte externa del corazón, por lo que dicha técnica quirúrgica pasó a denominarse como la vía epicárdica. Dicha vía requería una disección compleja, especialmente por las dificultades de exposición y hemostasia, por lo que se buscaron nuevas aproximaciones.
En 1975, Iwa3 abordó el surco AV desde interior de las aurículas, efectuando una incisión paralela y próxima al anillo valvular, creando lo que se denominaría la vía endocárdica. Dicha técnica se desarrollaría posteriormente con modificaciones efectuadas fundamentalmente por Sealy4 y Cox5, logrando alcanzar una gran efectividad en la localización y sección de las diversas vías accesorias.
En 1982, Guiraudon, et al.6 reintrodujeron de nuevo el abordaje epicárdico simplificando la complejidad técnica de la disección del surco, mediante la asociación de crioablación. Se hizo hincapié en que con ello se evitaba, en la mayoría de los casos, la utilización de la circulación extracorpórea (CEC) y una cardiotomía, pudiendo además monitorizar y verificar inmediatamente la eficacia de la intervención7.
Los resultados obtenidos mediante la sección quirúrgica de las vías accesorias, tanto por la vía endocárdica como por la epicárdica, demostraron ser excelentes, con efectividades entre el 96-100%8–10. Esta experiencia quirúrgica, a su vez, aportó gran información para el desarrollo de la ablación percutánea, que se iniciaría en la década de 198011,12. Con el progresivo desarrollo tecnológico de las técnicas percutáneas, así como de las diferentes fuentes de energía (radiofrecuencia, crioablación, etc.) para la ablación con catéter, se han alcanzado unos resultados igualmente satisfactorios, con una morbilidad claramente inferior. De esta forma las indicaciones quirúrgicas han sido desplazadas progresivamente, hasta el extremo de que, en la actualidad, la ablación por catéter se considera como la primera opción en el tratamiento de las vías accesorias13,14.
Sin embargo, en un número escaso de pacientes (< 3%) la ablación percutánea no es eficaz15, debido a diversas causas como la presencia de vías accesorias múltiples, o complicaciones graves en la ablación16 (< 1%), por ejemplo la oclusión arterial coronaria, perforación cardíaca o afectación de las válvulas mitral o tricúspide. Otro caso, aunque menos frecuente, sería la presencia de un mixoma auricular izquierdo asociado a WPW con vía accesoria izquierda, el cual supondría una contraindicación para la ablación por catéter10. Por otra parte, la presencia de una vía accesoria puede asociarse a una cardiopatía congénita, siendo la más frecuente la anomalía de Ebstein17, además de la transposición de grandes vasos y las anomalías venosas del seno coronario.
Las vías accesorias que presentan conducción anterógrada se conocen como vías accesorias «manifiestas», y dan lugar a preexcitación en el ECG. Sin embargo, las vías accesorias con conducción retrógrada exclusiva se conocen como vías «ocultas», y se ponen de manifiesto en el ECG al participar en una taquicardia por reentrada AV. El síndrome de WPW incluye la presencia de preexcitación en el ECG junto con crisis recurrentes de taquicardia. Los pacientes con preexcitación en el ECG pero sin crisis de palpitaciones deberían considerarse como pacientes con preexcitación asintomática y no como con síndrome de WPW. Por otro lado, los pacientes sintomáticos que no manifiestan una preexcitación en el ECG, pero que en un estudio electrofisiológico se les diagnostica una vía accesoria con conducción retrógrada exclusiva (vías accesorias ocultas), son frecuente y erróneamente diagnosticados de síndrome de WPW.
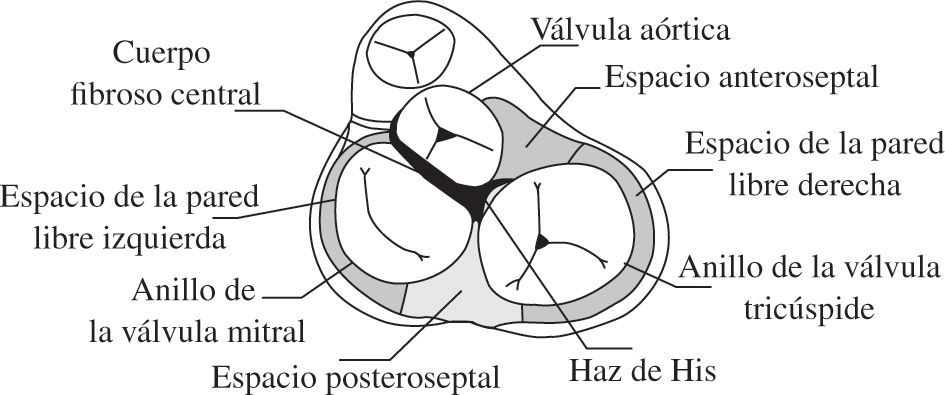
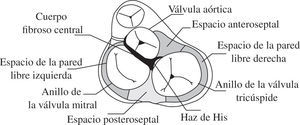
Tratamiento quirúrgico de las vías accesoriasConsideraciones anatomicoquirúrgicasLa unión anatómica entre aurículas y ventrículos se halla conformada por un anillo fibroso donde se insertan dichas cavidades musculares por su parte superior e inferior, respectivamente. No obstante, en el área de confluencia de la valva septal de la mitral con la válvula aórtica, denominada cuerpo fibroso central, no se inserta músculo auricular ni ventricular. El cuerpo fibroso central supone, por lo tanto, la zona entre el trígono fibroso izquierdo y el trígono fibroso derecho, donde se yuxtaponen el anillo de la válvula mitral y el de la válvula aórtica. Por ello, sólo se han descrito las diferentes localizaciones de las vías accesorias en el área del anillo fibroso, y ninguna en el cuerpo fibroso central18,19.
Con esta base anatómica (Fig. 1), desde el punto de vista quirúrgico, las diferentes vías accesorias pueden clasificarse en cuatro zonas bien diferenciadas, según cuál sea su localización anatómica en el perímetro del anillo fibroso:
- –
Pared ventricular izquierda libre (WPW tipo A).
- –
Región posteroseptal.
- –
Pared ventricular derecha libre (WPW tipo B).
- –
Región anteroseptal.
Vías anatómicas que rodean al cuerpo fibroso central25.
Durante el estudio electrofisiológico preoperatorio, así como en el intraoperatorio, se evaluarán las propiedades electrofisiológicas de la vía accesoria, su participación en la taquicardia clínica del paciente y su localización precisa. Además, se determinará la posible presencia de vías accesorias múltiples (10-20% de casos20,21), hallazgo frecuente en las cardiopatías congénitas, en especial la anomalía de Ebstein.
Técnica quirúrgicaPodemos clasificar los procedimientos terapéuticos para el WPW en procedimientos fisiológicos (ablación percutánea por catéter y técnicas quirúrgicas epicárdicas) realizados en el corazón latiente y con mapeo inmediato. El otro tipo serían los procedimientos anatómicos (técnica endocárdica), realizados tras cardiotomía con el corazón parado y con disección directa de la vía accesoria. En equipos experimentados, esta segunda técnica alcanza un éxito del 99%, frente a un 95% de éxito en los procedimientos fisiológicos22.
La mayoría de casos en los que se remite un paciente para ablación quirúrgica de una vía accesoria es consecuencia del fallo de la ablación percutánea23. El fracaso de este procedimiento «fisiológico», y dado el mejor resultado del procedimiento quirúrgico anatómico, motiva su elección en un mayor tanto por ciento de casos.
El diagnóstico del paciente vendrá siempre acompañado de uno o varios estudios electrofisiológicos de precisión. Los actuales sistemas de mapeo y navegación electroanatómicos (Carto®, Navex®…) permiten estudios exhaustivos que dejan poca cabida al error en la localización de las vías accesorias, con mínima irradiación para el paciente. No obstante, el estudio intraoperatorio sigue siendo necesario y está dirigido básicamente a la confirmación de la localización anatómica de la vía accesoria y a la posterior confirmación de su ablación. Para ello, podremos emplear diferentes sistemas24 más o menos complejos que supondrán, en última instancia, uno o varios electrodos exploradores situados en el surco AV a fin de ubicar la zona de conducción anómala. Por otra parte, durante el estudio intraoperatorio es aconsejable tratar de inducir arritmias que permitan establecer la participación de la vía accesoria como parte del circuito de la taquicardia, así como excluir la presencia de otro tipo de arritmias como la taquicardia por reentrada nodal AV.
Como hemos descrito, existen dos técnicas para el abordaje y resección de las vías accesorias:
- –
Resección clásica por vía endocárdica. Tras practicar una esternotomía media se procede a efectuar el mapeo epicárdico a fin de confirmar la localización de la vía accesoria. La efectividad de la ablación quirúrgica dependerá fundamentalmente de la localización precisa durante el mapeo intraoperatorio de la vía accesoria. Por ello, es de gran importancia la colaboración y experiencia conjunta con el equipo de electrofisiología. La vía endocárdica requiere siempre la instauración de CEC, en general con canulación aórtica y de ambas venas cavas. No obstante, para la resección de las vías localizadas en la pared libre ventricular derecha y en la región septal, y para obtener una mejor exposición, puede ser útil la canulación de la vena femoral.
- •
Región de la pared ventricular izquierda libre. Tras efectuar parada cardiopléjica se practica una auriculotomía izquierda clásica para abordar la válvula mitral. Para acceder a la disección de surco AV, se practica una incisión supraanular paralela y próxima al anillo mitral, que se extiende desde el trígono fibroso izquierdo hasta el septo ventricular posterior. Se efectúa entonces una ablación quirúrgica extensa, con disección muy cuidadosa, hasta llegar en profundidad a la reflexión epicárdica ventricular. Dado que la vía accesoria no puede identificarse macroscópicamente, es recomendable extender la disección al menos unos 2 cm a cada lado de su localización probable. Tras finalizar dicho procedimiento se procede al cierre meticuloso de la incisión supraanular.
El abordaje quirúrgico de las otras tres zonas se realizará a través de la aurícula derecha. En todas ellas, tras iniciar la CEC, en condiciones de normotermia y antes de efectuar parada cardiopléjica, se efectuará el mapeo endocárdico de la aurícula derecha para confirmar los hallazgos del mapeo epicárdico y para localizar el haz de His.
- •
Región posteroseptal. Tras exponer adecuadamente el triángulo de Koch, se realiza el mapeo de la aurícula derecha (de preferencia durante una taquicardia reciprocante) a fin de confirmar los hallazgos. Se practica entonces una incisión supraanular próxima al anillo tricuspídeo, que se extiende desde la zona de la comisura posterior hacia el haz de His. La disección de esta zona se puede efectuar antes de inducir parada cardíaca a fin de localizar el haz de His y evitar lesionarlo. A continuación se induce la parada cardíaca para completar la disección cuidadosa de dicha zona.
- •
Región de la pared libre ventricular derecha. Después del mapeo endocárdico e inducir parada cardíaca, se efectúa también una incisión supraanular próxima al anillo tricuspídeo, que abarque toda la pared libre ventricular derecha, desde el septo anterior hasta el posterior. Se procede entonces a efectuar la disección y ablación, amplia y profunda, hasta llegar a alcanzar la reflexión epicárdica ventricular derecha.
- •
Región anteroseptal. Las vías accesorias de esta zona presentan un problema especial dado que la disección debe realizarse en el área del nodo AV y del haz de His. El mapeo endocárdico (durante la taquicardia reciprocante) resulta imprescindible a fin de localizar la vía anómala y el haz de His. Tras inducir la parada cardíaca, se inicia la incisión supraanular del anillo tricuspídeo, desde la porción anterior del haz de His hasta el espacio de la pared libre derecha. La disección de esta zona debe ser especialmente cuidadosa para evitar lesionar tanto el haz de His como la propia coronaria derecha.
Una vez finalizada la resección de la vía se procederá al cierre de la incisión supraanular y de la aurícula derecha. Cerradas las cavidades se procede a abandonar la CEC, procediéndose a un nuevo mapeo a fin de comprobar la efectividad del procedimiento.
- •
- –
Resección por vía epicárdica. Dicha vía demostró la posibilidad de su realización sin la necesidad de instaurar CEC6,7, favoreciendo una monitorización ECG continua. De esta forma se podría verificar de forma inmediata la eficacia del procedimiento, así como detectar precozmente posibles trastornos o lesiones del nodo AV25. No obstante, la menor tasa de éxito, así como su mayor dificultad técnica, han hecho que en la actualidad la vía epicárdica esté prácticamente abandonada en favor de la vía endocárdica, con la se ha alcanzado mayor experiencia y efectividad.
- •
Región de la pared ventricular libre izquierda. La disección de dicha zona desde el lado ventricular externo, según la técnica de Watanabe, et al.26, consiste en levantar el corazón sujetándolo con una gasa apoyada en la pared ventricular basal próxima al surco AV, hasta lograr progresivamente una estabilización hemodinámica. Se realiza entonces una incisión del epicardio sobre el surco AV, iniciando la disección de la zona protegiendo cuidadosamente las estructuras del seno coronario, de la circunfleja y sus colaterales. Cuando persiste la conducción anómala a través de las vías accesorias, se procede a efectuar una crioablación transmural en dicha zona.
- •
Región posterolateral septal. Esta zona se diseca igualmente desde el epicardio, completándose con la aplicación de crioablación. Si se objetivan trastornos en la conducción AV se suspende inmediatamente la crioablación.
- •
Región de la pared libre ventricular derecha. La técnica utilizada en esta zona es similar a la de la pared libre izquierda, sin embargo, su exposición puede resultar compleja, siendo necesaria una crioablación interna, lógicamente bajo CEC.
- •
Región anteroseptal. Para efectuar la ablación desde el epicardio en esta zona, es necesaria la disección de la fosa coronaria derecha y de la pared ventricular derecha, con la complejidad que ello pueda suponer. Dada la proximidad en esta localización de las vías accesorias al haz de His, puede ser necesaria la instauración de CEC y el abordaje a través de la aurícula derecha.
- •
Algunos grupos han propugnado el empleo de un procedimiento doble: endocárdico y epicárdico simultáneo27,28. No obstante, dado el escaso número de procedimientos, el equipo quirúrgico tendrá que ofrecer la técnica que con mayor comodidad y seguridad proporcione sus mejores resultados. Esto supone que en la mayoría de los casos la técnica seleccionada es la endocárdica.
Finalmente, hemos de tener en cuenta el momento quirúrgico. Algunos autores23,29 han advertido de la fragilidad de los tejidos en el área de disección, si el procedimiento se realiza en proximidad de la ablación por catéter. Resultaría, por lo tanto, más prudente separar temporalmente la cirugía del procedimiento percutáneo fallido, al menos algunas semanas.
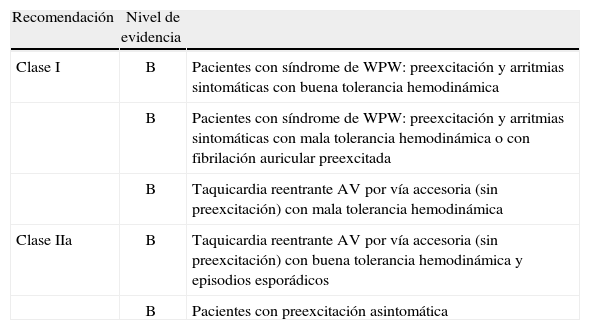
Indicaciones de la ablaciónSiguiendo las recomendaciones de la American Heart Association, el American College of Cardiology, y la European Society of Cardiology30 (Tabla I), podríamos sintetizar las indicaciones de ablación de vías accesorias en que «los pacientes con síndrome de WPW (sintomatología con preexcitación), particularmente aquellos con inestabilidad hemodinámica asociada a arritmia, deberían recibir una ablación por catéter como primera línea terapéutica. Aquellos pacientes asintomáticos, o con mínima sintomatología, podrían ser tratados por diversos medios».
Recomendaciones para la ablación de las vías accesorias por arritmias ventriculares según la ACC/AHA/ESC30
| Recomendación | Nivel de evidencia | |
| Clase I | B | Pacientes con síndrome de WPW: preexcitación y arritmias sintomáticas con buena tolerancia hemodinámica |
| B | Pacientes con síndrome de WPW: preexcitación y arritmias sintomáticas con mala tolerancia hemodinámica o con fibrilación auricular preexcitada | |
| B | Taquicardia reentrante AV por vía accesoria (sin preexcitación) con mala tolerancia hemodinámica | |
| Clase IIa | B | Taquicardia reentrante AV por vía accesoria (sin preexcitación) con buena tolerancia hemodinámica y episodios esporádicos |
| B | Pacientes con preexcitación asintomática |
WPW: Wolff-Parkinson-White; AV: auriculoventricular; AHA: American Heart Association; ACC: American College of Cardiology; ESC: European Society of Cardiology.
Paralelamente, podríamos simplificar la mayoría de las indicaciones en:
- –
Pacientes con síndrome de WPW, especialmente en los casos con crisis de taquicardia frecuentes y/o mal toleradas. También en los pacientes con síndrome de WPW y crisis de fibrilación auricular (indicación clase I).
- –
Pacientes con taquicardias por reentrada AV en las que participan una o varias vías accesorias (indicación clase I).
- –
En pacientes sin preexcitación, con vías accesorias ocultas y con crisis esporádicas y bien toleradas de taquicardia por reentrada AV, se podría plantear la ablación con catéter (indicación clase IIa).
- –
En pacientes asintomáticos con preexcitación, las guías aconsejan la ablación con catéter en función de las características individuales del sujeto: pacientes con actividades laborales de riesgo como conductores o pilotos, o en función de las características electrofisiológicas de la vía accesoria (indicación clase IIa). Aunque la indicación terapéutica en un paciente asintomático es motivo de controversia31,32, la decisión final deberá establecerse en función de una evaluación individualizada considerando las características concretas de cada paciente.
- –
En la anomalía de Ebstein la presencia de vías accesorias ocurre en el 25% de pacientes. Estas vías accesorias presentan una localización derecha, y con frecuencia son múltiples. El ECG de los pacientes con esta enfermedad muestra un bloqueo de rama derecha, por lo que la presencia de preexcitación ocultará el patrón ECG de bloqueo de rama derecha. La ablación con catéter de las vías accesorias en estos pacientes presenta peores resultados que en la población general, éxito del 75-89%, y a menudo requiere de varios procedimientos. En estos casos la colaboración entre los equipos de electrofisiología y cirugía es fundamental. Ante la presencia de vías accesorias el estudio electrofisiológico y ablación con catéter será la primera aproximación. El fallo de la ablación percutánea puede dar lugar a arritmias recurrentes e inestabilidad en el periodo perioperatorio. En estos casos, la ablación quirúrgica deberá ser considerada.
Podríamos recapitular diciendo que, en la actualidad, el abordaje quirúrgico suele ir asociado a la presencia de vías accesorias múltiples, o las vías asociadas a cardiopatías congénitas como la anomalía de Ebstein.
ConclusiónLos excelentes resultados en el tratamiento de las vías accesorias con las actuales técnicas percutáneas de ablación por catéter han desplazado por completo el tratamiento quirúrgico. Las posibles indicaciones del mismo se limitan a los casos esporádicos en los que la ablación por catéter es ineficaz o se asocia a complicaciones graves, y a los casos que requieran tratamiento simultáneo a corazón abierto de otras enfermedades, en especial las cardiopatías congénitas. En la actualidad el abordaje quirúrgico suele realizarse en los casos con presencia de vías accesorias múltiples, y en las vías asociadas a cardiopatías congénitas como la enfermedad de Ebstein.
Es recomendable que, dentro de algunos equipos de cirugía cardíaca, existan cirujanos expertos en el tratamiento quirúrgico de las arritmias, y específicamente en la ablación quirúrgica de las vías accesorias. Respecto a este último, la vía epicárdica ha sido prácticamente abandonada por la mayoría de grupos, prevaleciendo la vía endocárdica, con la que se han alcanzado mejores resultados.