La insuficiencia cardíaca (IC) es una patología cuya incidencia está aumentando en gran parte motivada por la mejora en la esperanza de vida. En los últimos años las estrategias para su tratamiento se han desarrollado considerablemente. Dentro de ellas ha cobrado una especial relevancia el uso de dispositivos. La terapia de resincronización cardíaca (TRC) se encuadra dentro de ellos, y estudios recientes han demostrado su beneficio tanto en la mejora clínica como en la supervivencia. En esta revisión actualizaremos la situación en la que el uso de la resincronización se encuentra analizando el concepto de resincronización, sus indicaciones, así como los principales ensayos clínicos publicados hasta el momento y las alternativas para su implantación.
Cardiac insufficiency is a pathology whose incidence has been increasing, largely due to an improvement in life expectancy. In recent years treatment strategies have developed considerably, with the use of devices having particular importance. Cardiac re-synchronisation therapy is one of these strategies and recent studies have shown its benefits both clinically and in terms of survival. In this review we will bring up to date the situation in which the use of re-synchronisation currently finds itself by analysing its concepts, its symptoms and also the principal clinical trials published to date and the alternatives for its use.
El fallo cardíaco grave supone un grave problema desde el punto de vista de asistencia y de salud pública, siendo en la actualidad uno de los mayores retos sanitarios en EE.UU. Aproximadamente, 5millones de personas en este país tiene IC y 550.000 casos nuevos son diagnosticados anualmente1,2. Se estima que el coste anual directo de la IC en EE.UU. es de 60billones de dólares3.
En el registro de la European Society of Cardiology (ESC) hay 15millones de personas con IC, afectando al 4% de la población (10-20% en mayores de 75 años). Es la segunda causa de muerte de origen cardiovascular, y en su atención se invierte el 4% del gasto sanitario, con las tres cuartas partes destinadas a los ingresos hospitalarios4,5.
Se trata de una de las patologías cardiovasculares cuya prevalencia y morbimortalidad permanece en aumento. Este aumento probablemente se deba al envejecimiento poblacional y al éxito relativo del tratamiento de otras patologías como el infarto agudo de miocardio. Se ha visto que su incidencia aumenta con la edad6. Los supervivientes a estos graves eventos pueden estar, sin embargo, expuestos a vivir con importantes limitaciones funcionales como el fallo cardíaco.
El tratamiento de la IC es complejo, y se encuadra dentro de un abordaje multidisciplinario en el que el cirujano cardiovascular suele desempeñar un papel importante en las fases avanzadas de la misma o en situaciones agudas descompensadas refractarias a tratamiento médico. Dichas opciones terapéuticas vendrán determinadas por la etiología de la IC, la situación funcional del paciente y la esperanza de vida, entre otras, así como por la experiencia del equipo. El abanico de posibilidades es amplio, y entre ellas se cuenta con la restauración ventricular, la asistencia mecánica circulatoria o la TRC. Este artículo es una revisión de la TRC.
Antecedentes. Estado actualLa asociación de bloqueo de rama izquierda (BRI) y fallo cardíaco es frecuente. Aproximadamente, el 30% de los pacientes con IC presentan trastornos de la conducción intraventricular que provocan la pérdida de la sincronía ventricular. Dentro de estos trastornos el más frecuente es el BRI, que si bien afecta al 1,5% de la población, en el caso de los pacientes con IC llega al 25%7–9.
Los pacientes que padecen fallo cardíaco y presentan BRI tienen un peor pronóstico a largo plazo10. El mecanismo fisiopatológico que lo explica se relaciona con la capacidad del BRI de provocar un latido cardíaco descoordinado entre los distintos segmentos del ventrículo izquierdo. Esto da lugar a un bamboleo ineficaz de sangre dentro de la cavidad ventricular izquierda y a un aumento del sufrimiento parietal capaz de hacer progresar el deterioro de la cardiopatía y/o causar arritmias graves. Esta desincronización de la contracción ventricular va a generar un retraso en la contracción de la pared ventricular en relación con el tabique, lo que genera una pérdida de función11,12. Estos mecanismos fisiopatológicos se agrupan bajo el término de asincronía13.
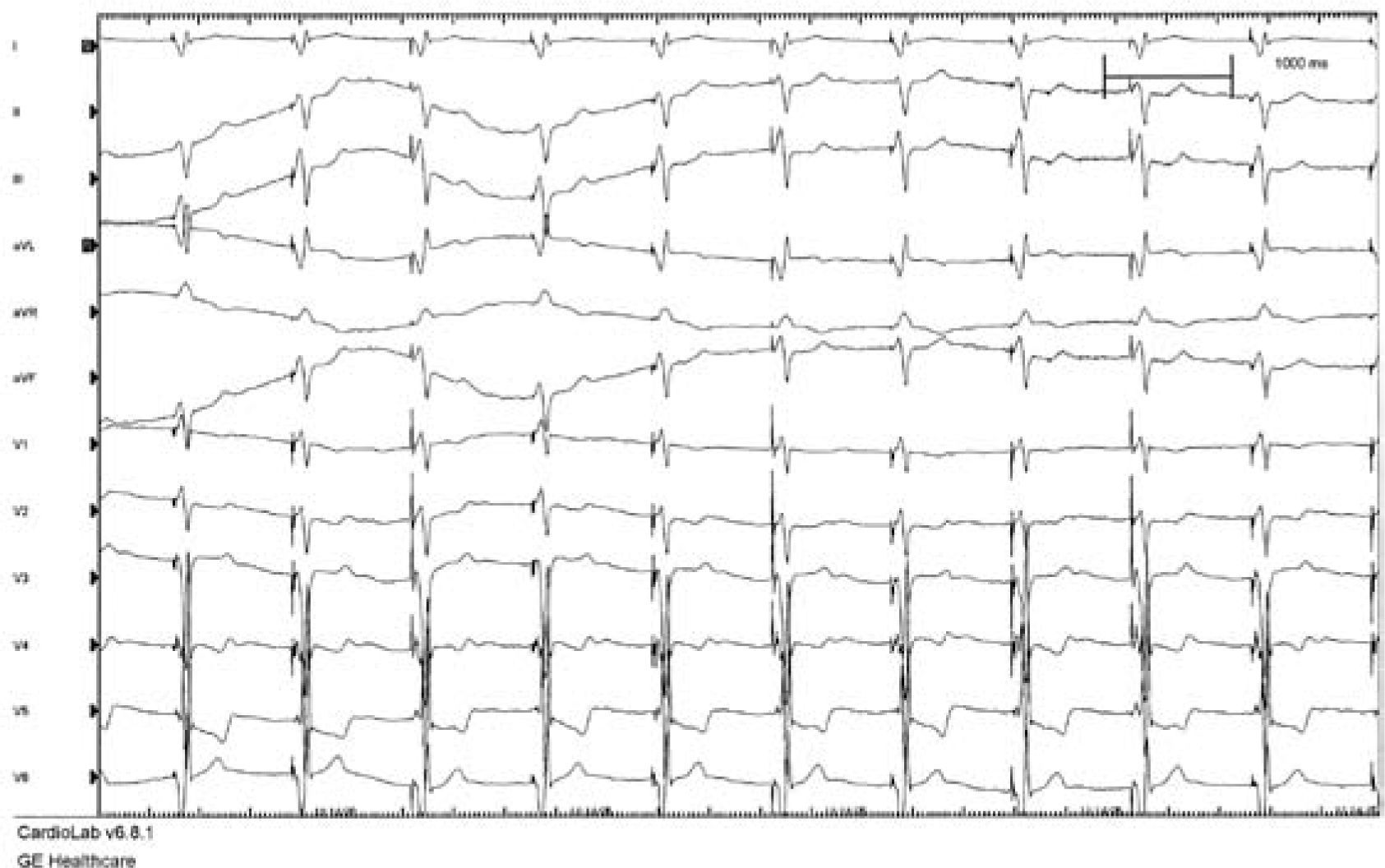
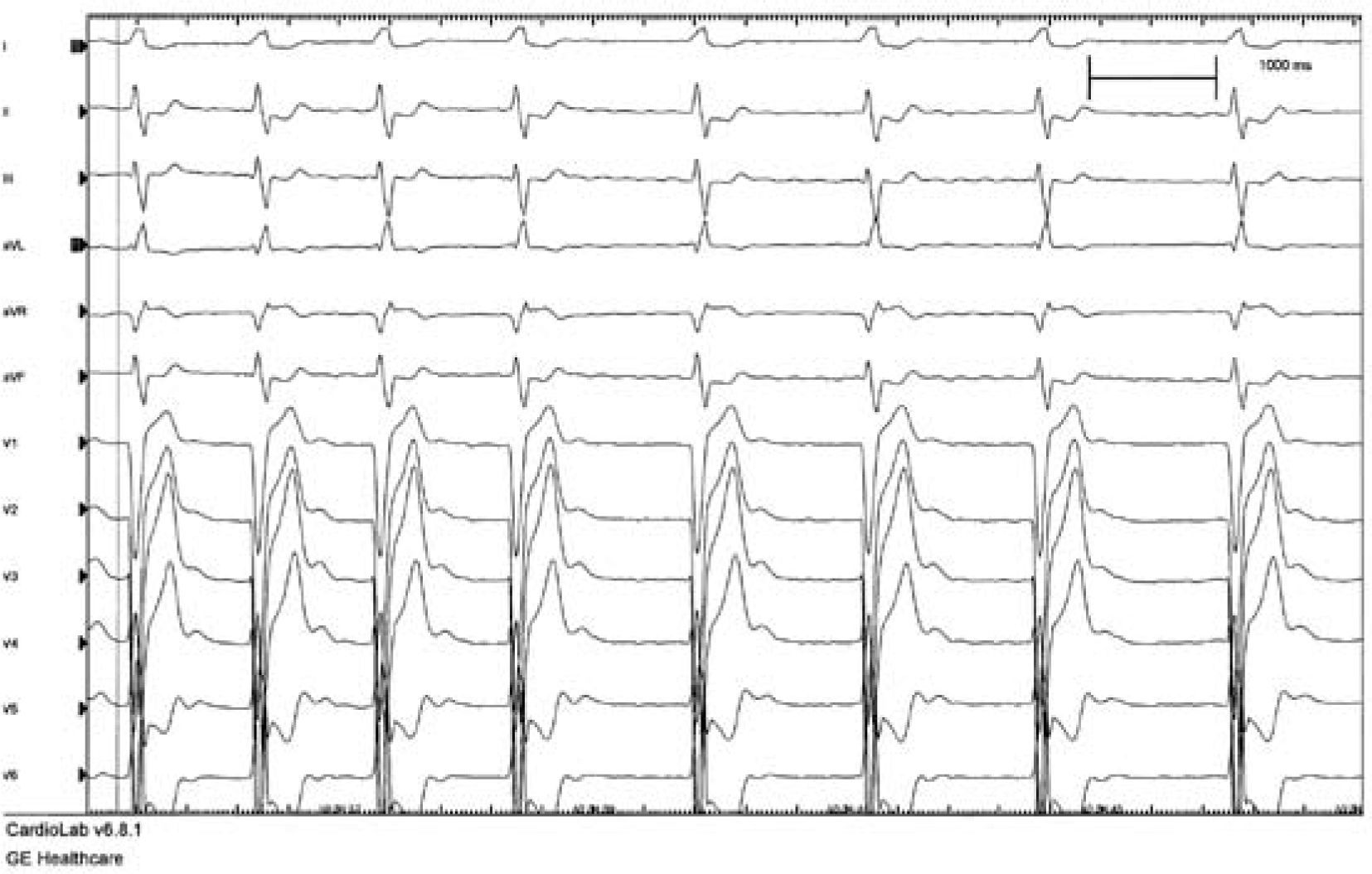
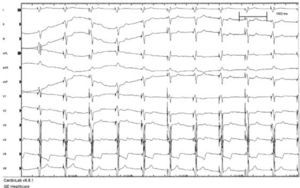
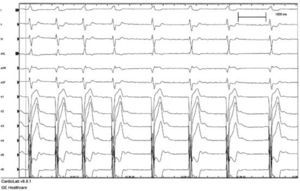
La TRC consiste en la estimulación eléctrica del ventrículo izquierdo mediante un impulso eléctrico del tipo del marcapasos (MCP) convencional, de tal forma que la despolarización y, por lo tanto, la contracción del ventrículo izquierdo a partir del punto de inserción del electrodo se adelanta en cada latido a lo que correspondería por la existencia del BRI. El resultado de esta forma de estimulación sobre el electrocardiograma (ECG) lo podemos observar en las figuras 1 y 2.
Imagen ECG de TRC. Trazado ECG de 12 derivaciones simultáneas del paciente sometido al implante que se muestra en la imagen siguiente. Se aprecia que el ritmo es estimulado en todos los complejos, que están precedidos de espiga y son de una morfología fija, sin evidencia de fusión del ritmo propio. Como se observa en V1, el patrón del ritmo estimulado no semeja al BRI, al ser positivo fundamentalmente. En las derivaciones I y aVL hay negatividad inicial y predominante, debida a que el ritmo se origina en el extremo izquierdo del corazón, donde se ha alojado el electrodo introducido por el seno coronario. El ritmo auricular es de FA, y el modo de estimulación es VVI.
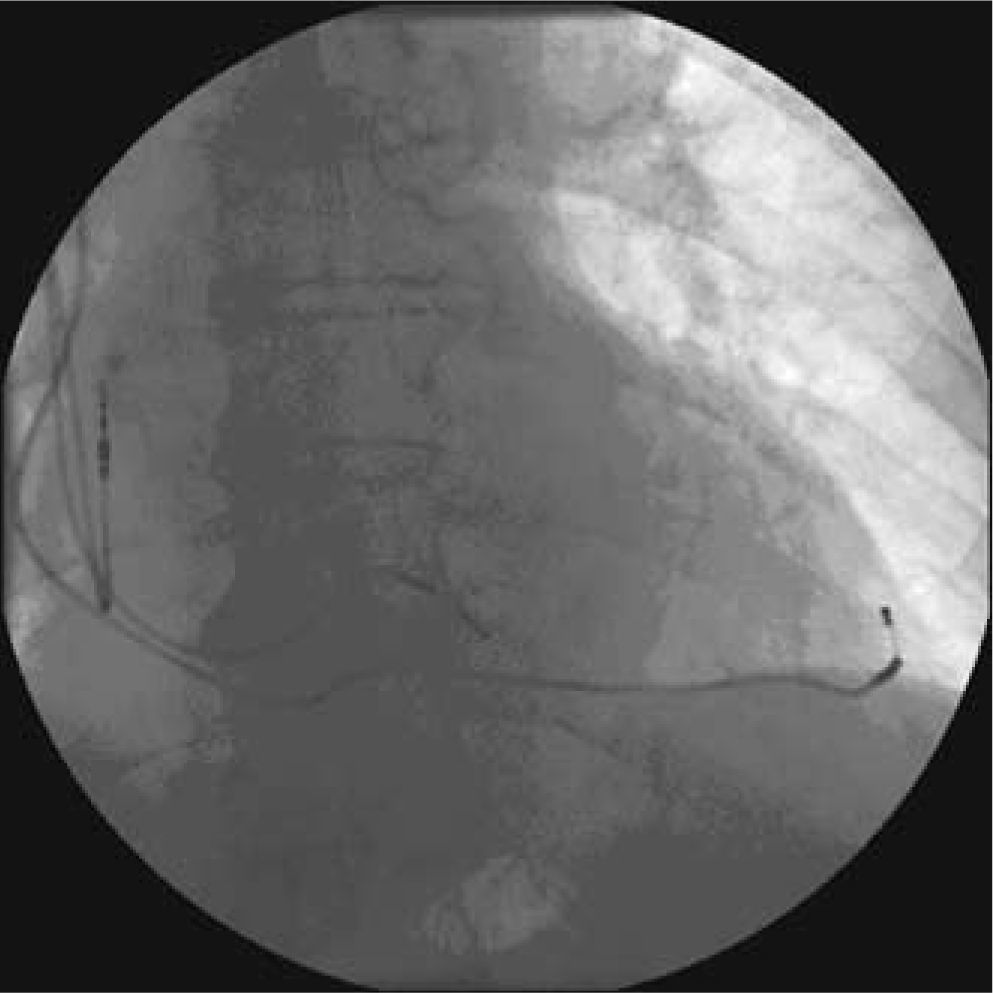
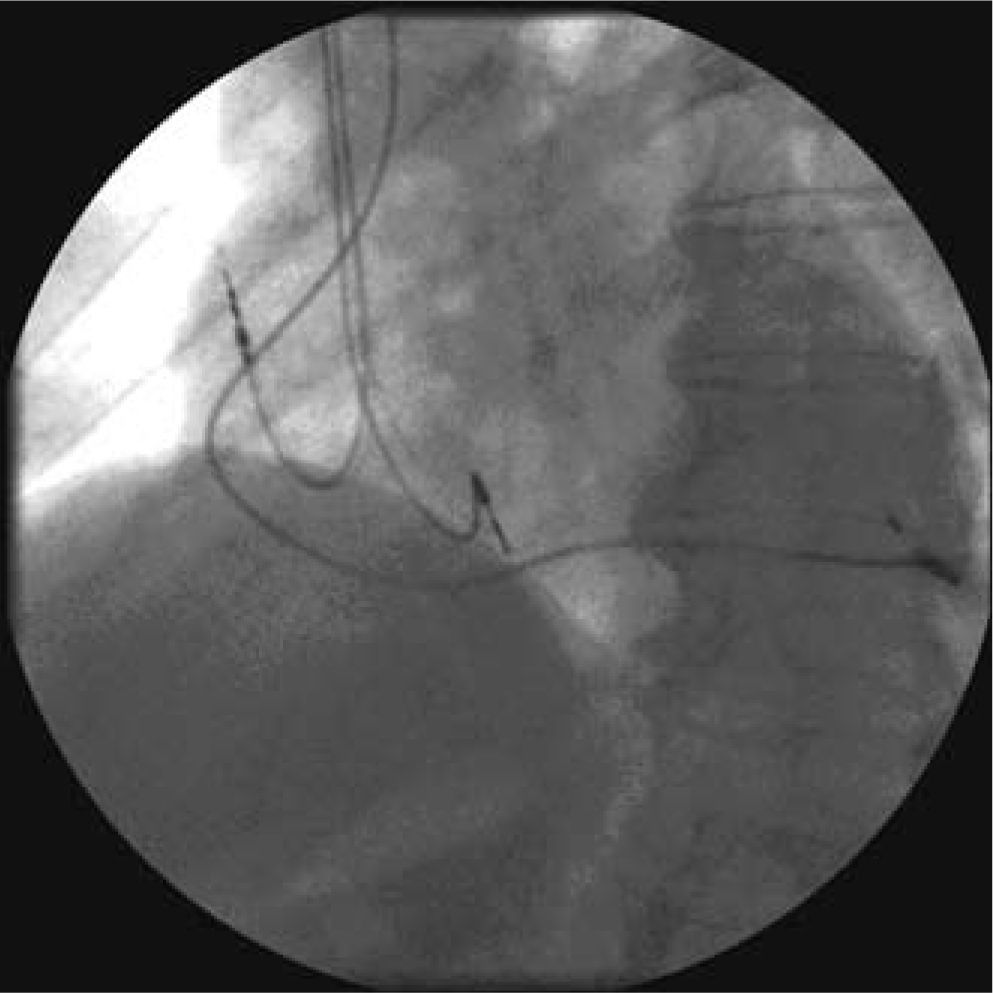
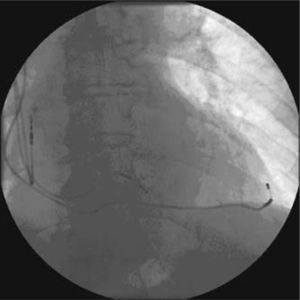
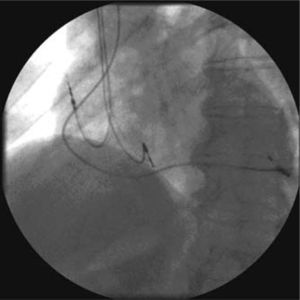
Habitualmente, la estimulación se realiza desde la superficie epicárdica del ventrículo izquierdo a partir de una vena tributaria del seno coronario, alojando un electrodo de 4-6 F en la posición más lateral que sea posible (Figs. 3 y 4). El electrodo emite una descarga eléctrica como la de un MCP convencional, sincronizando la descarga o sensado a la actividad eléctrica ventricular o auricular, semejante a los modos de estimulación VVI o DDD, respectivamente. La imagen fluoroscópica de un sistema de TRC se aprecia en las figuras 3y 4.
La TRC es el único tratamiento capaz de mejorar los parámetros de función sistólica del ventrículo izquierdo asociando un menor consumo de oxígeno (VO2) a nivel tisular. Otros tratamientos, como los fármacos inotrópicos, mejoran también la función sistólica pero conllevan un aumento en el consumo miocárdico de oxígeno.
El primer uso clínico de la estimulación desde el seno coronario para fallo cardíaco grave fue realizado por Cazeau en 199414, si bien un trabajo pionero realizado en España por De Teresa, et al. llamó la atención en relación con el concepto de estimulación sobre el ventrículo izquierdo en el contexto del postoperatorio de cirugía cardíaca15.
Desde el punto de vista técnico, la resincronización cardíaca es una intervención exigente para el operador. La curva de aprendizaje asocia unos tiempos de intervención y escopia prolongados, incluso una tasa de fallos del implante percutáneo significativa. Datos de los tiempos iniciales de la técnica y el efecto de la curva de aprendizaje están recogidos en el registro europeo CONTAK16.
En el momento actual la tasa de éxito en el implante para centros experimentados se sitúa en más de un 97%. Además del implante exitoso del electrodo en una vena tributaria del seno coronario, otros problemas pueden comprometer la función de resincronización, notablemente el desarrollo de altos umbrales de estimulación y la captura diafragmática por estimulación de las ramas del nervio frénico. Cuando esta captura es muy frecuente y no es corregible mediante ajuste de la energía de salida o polaridad del electrodo puede hacer fracasar la TRC.
Como método de rescate para su colocación ante el fallo del implante endovenoso se puede realizar de forma quirúrgica17. Algunos autores abogan por el mapeo intraoperatorio durante la intervención para rentabilizar el efecto electrofisiológico y hemodinámico en su colocación18. En nuestro país existen también aportaciones a la técnica quirúrgica19.
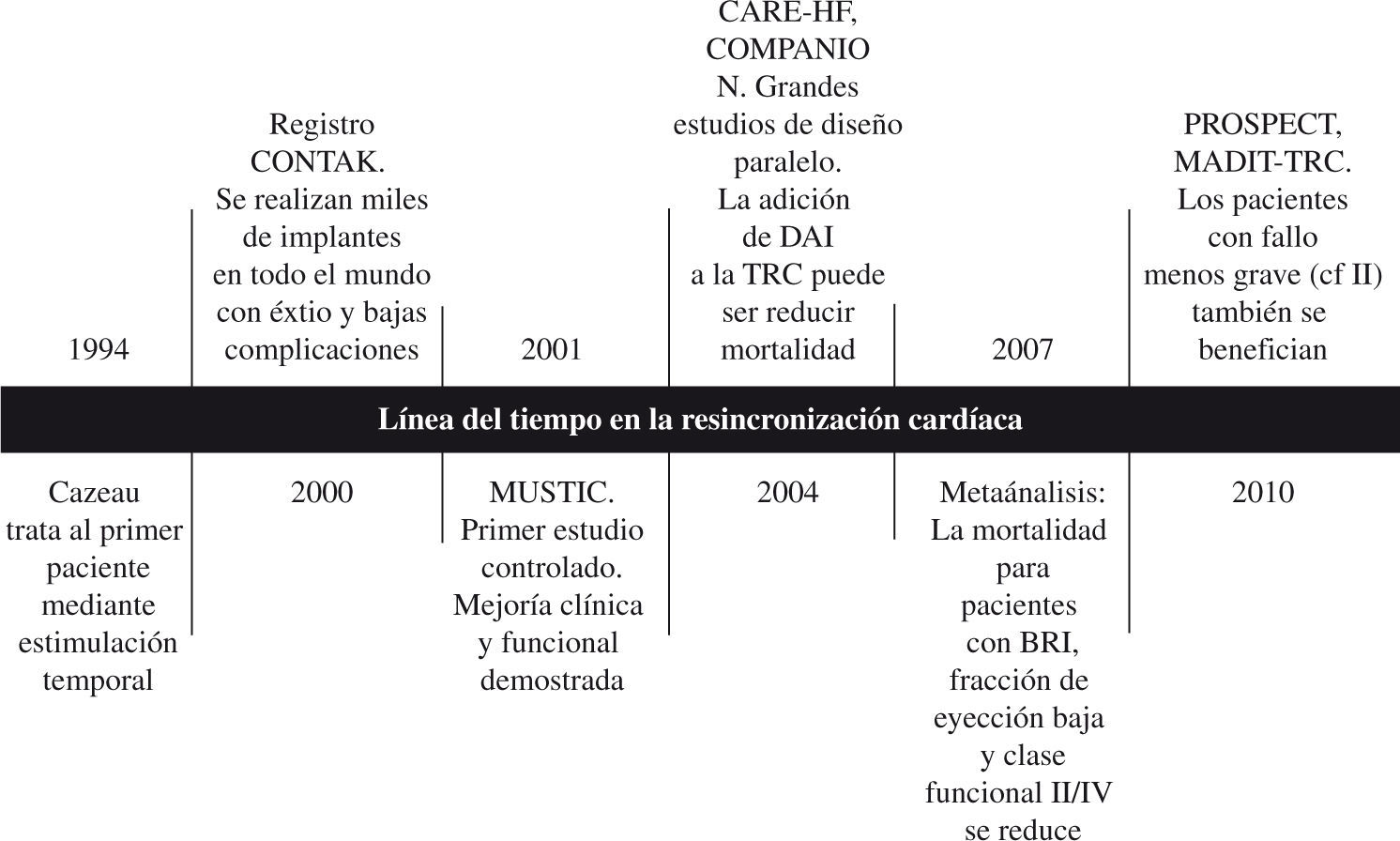
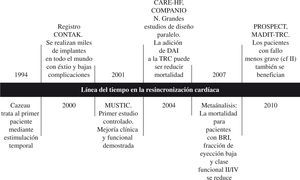
De forma gráfica el recorrido histórico de la TRC se muestra en la figuras 5. En poco más de una década ha pasado de ser una técnica casi experimental a estar recomendada en las guías de forma clara y con evidencia que respalda efectos favorables sobre la clínica y la supervivencia en contextos que detallamos a continuación (Fig. 5).
Efectividad clínica de la terapia de resincronzación cardíacaEn los aproximadamente 10 años de disponibilidad de la técnica se han comunicado diversos estudios aleatorizados controlados, estudios sin control o abiertos y registros como para establecer la efectividad y seguridad de la TRC. El primer estudio con diseño cruzado aleatorizado fue el MUSTIC (Multisite Stimulation in Cardiomyopathies), que halló que la TRC mejoraba la clase clínica funcional de la New York Heart Association (NYHA), la calidad de vida, la distancia de la caminata de 6 min y el VO2 pico.
Posteriormente, separados por un corto espacio de tiempo, se publicaron dos grandes estudios, el CARE-HF y el COMPANION. Estos estudios incluían un número mucho mayor de pacientes. Su diseño era controlado con grupos separados e incluían la mortalidad, bien como objetivo combinado o secundario.
El CARE-HF demostró un 36% de reducción de la mortalidad. El COMPANION incluyó dos brazos dentro de la TRC, uno con MCP simple y otro asociando función de desfibrilador automático implantable (DAI). En este último estudio hubo una tendencia a una mejor supervivencia, si bien no significativa, a favor de la rama que asociaba DAI con respecto a la terapia de MCP resincronizador aislada20. Estos estudios fueron confirmatorios en cuanto a la mejoría de síntomas y parámetros funcionales.
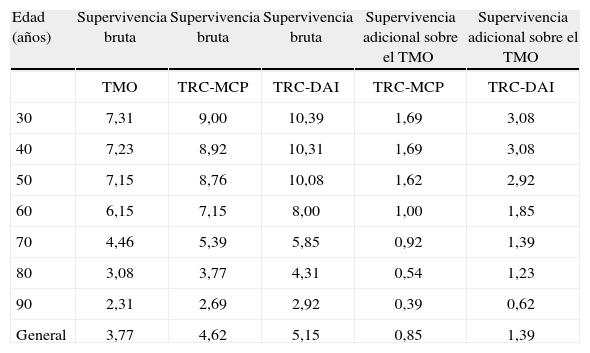
Como resumen de la magnitud cuantitativa del efecto clínico, en la Tabla I se muestra la supervivencia estimada para los pacientes con fallo cardíaco grave sometidos a terapia convencional y TRC. Todas las cifras reflejan años de supervivencia mediana por décadas (filas) para grupos de tratamiento, las tres primeras columnas es supervivencia bruta en años. Las dos últimas es lo que se gana adicionalmente con la resincronización con y sin desfibrilador comparado con el tratamiento médico óptimo (TMO). Se aprecia como para los pacientes por debajo de 60 años el efecto combinado DAI-TRC puede aportar una sobrevida adicional superior a 3 años. Estos datos son aportados por Foley, et al.21.
Supervicencia para la TRC con functión mcp y DAI
| Edad (años) | Supervivencia bruta | Supervivencia bruta | Supervivencia bruta | Supervivencia adicional sobre el TMO | Supervivencia adicional sobre el TMO |
| TMO | TRC-MCP | TRC-DAI | TRC-MCP | TRC-DAI | |
| 30 | 7,31 | 9,00 | 10,39 | 1,69 | 3,08 |
| 40 | 7,23 | 8,92 | 10,31 | 1,69 | 3,08 |
| 50 | 7,15 | 8,76 | 10,08 | 1,62 | 2,92 |
| 60 | 6,15 | 7,15 | 8,00 | 1,00 | 1,85 |
| 70 | 4,46 | 5,39 | 5,85 | 0,92 | 1,39 |
| 80 | 3,08 | 3,77 | 4,31 | 0,54 | 1,23 |
| 90 | 2,31 | 2,69 | 2,92 | 0,39 | 0,62 |
| General | 3,77 | 4,62 | 5,15 | 0,85 | 1,39 |
Hasta la fecha hay publicados estudios que incluyen a más de 4.000 pacientes. Esta acumulación de evidencia ha sido agregada en metaanálisis22. En él se observó una gran probabilidad de mejora en la clase funcional (59 vs 37%; riesgo relativo [RR]: 1,6; intervalo de confianza 95%: 1,3-1,9), una reducción de la tasa de hospitalización por IC (RR: 0,63; intervalo de confianza 95%: 0,43-0,93) y una reducción de la mortalidad por cualquier causa (RR: 0,78; intervalo de confianza 95%: 0,67-0,91), debido principalmente a menos muertes por IC progresiva (RR: 0,64; intervalo de confianza 95%: 0,49-0,84).
Es importante señalar que en ningún estudio sobre la TRC se ha observado un efecto negativo. Por otro lado, también es cierto que hasta la fecha ningún estudio ha logrado demostrar como objetivo primario e independiente una reducción de la mortalidad global mediante TRC. Las posibilidades de llevar a cabo ensayos clínicos de gran tamaño, teniendo en cuenta la complejidad de la intervención, la existencia de particularidades debidas a diferencias en el material y la programación de los dispositivos, se reducen frente a los ensayos clínicos referidos a terapia farmacológica convencional.
Los estudios han comparado el TMO con la TRC, bien mediante MCP como la adición de capacidad de DAI. La magnitud del efecto sobre la prolongación de la supervivencia se ha estimado separado para décadas de edad y distinguiendo el efecto de la terapia farmacológica óptima de la de la TRC con o sin DAI asociada. Este cálculo se recoge en la Tabla I.
Todos estos estudios tienen en común la inclusión de pacientes con disfunción ventricular grave, fallo cardíaco, clase funcional III o IV de la NYHA (91% de los pacientes) y QRS con morfología de BRI, prolongado en todos los casos más de 120ms pero con un valor medio más alto. La media de anchura del QRS en los estudios ha oscilado entre 155-209ms.
Si bien en ningún estudio aislado se ha logrado demostrar una reducción de mortalidad, ésta sí se ha demostrado en la agrupación de estudios, observando una reducción del 22%. El número necesario de pacientes a tratar durante 6 meses para salvar una vida es de 29. El beneficio sobre la situación funcional se demostró al observar el porcentaje de pacientes que mejoran al menos una clase funcional de la NYHA sobre la basal. En el grupo de estudios sobre resincronización esta mejora oscila en el rango del 63-82%. Esta mejoría sintomática también se ha asociado a menos descompensaciones de la IC y menor requerimiento de reingreso hospitalario por descompensación cardíaca en un 37%. Sin embargo, también se conoce que hasta un 30% de pacientes con esos criterios de inclusión pueden no tener cambios significativos de la clase funcional y, en consecuencia, sobre la calidad de vida. Este grupo de pacientes son los que se han dado en denominar los «no respondedores».
Como se ha dicho anteriormente, en estos estudios se ha asimilado de forma completa la disincronía cardíaca a la prolongación del QRS. Se ha propuesto de diversas formas la selección de pacientes mediante otras técnicas y parámetros. La ecocardiografía se perfiló como una opción válida en la selección, pero en el momento actual se considera que no es una técnica adecuada.
Desde su comienzo la TRC se ha orientado hacia formas gravemente sintomáticas de fallo cardíaco, fundamentalmente a pacientes en clase funcional III de la NYHA. La alta mortalidad en clase IV al año y la morbimortalidad asociada a una intervención quirúrgica en estos pacientes han centrado la población de destino de la TRC en la clase funcional III. Acerca de la clase funcional IV existe escasa información. Un estudio controlado, no aleatorizado realizado por Castel, et al.21 en 40 pacientes no muestra beneficio clínico, pudiendo ser debido a la falta de potencia por el tamaño muestral estudiado.
Seguridad de la terapia de resincronizaciónLos datos referidos a diez estudios publicados recogen 13 eventos mortales en un grupo total de 3.113 pacientes, lo que significa un 0,42%. Ampliando los datos a 17 estudios se sabe que el porcentaje de éxito en el implante es del 90%. Complicaciones comunes a la intervención de implante de MCP, como el desplazamiento de electrodo (8,5%), complicaciones del bolsillo (6,7%) o infección (1,4%) han sido descritas. En el reciente estudio PROSPECT el explante de los dispositivos fue necesario en el caso de los DAI-TRC en un 1,3%, y en el caso del DAI simple en un 0,7%. Este dato indica una baja tasa de complicaciones, si bien el riesgo relativo por el hecho de incluir el electrodo de seno coronario es casi doble al que corresponde con el DAI simple.
Indicaciones para la terapia de resinronización cardíacaLas guías de práctica clínica de la ESC recogen como indicación para la TRC las siguientes (Tabla II).
Indicaciones para la TRC
| Indicaciones TRC | Criterios | Indicación |
| IC | ||
| TRC con MCP o DAI recomendado para reducir morbimortalidad | Clase funcional III/IV Fracción de eyección del ventrículo izquierdo (FEVI) ≤ 35%, QRS ≥ 120 ms RS, TMO | I A |
| TRC preferentemente TRC-DAI para reducir la morbimortalidad o prevenir la evolución de la enfermedad | Clase funcional II FEVI ≤ 35%, QRS ≥ 150 ms RS, TMO | I A |
| En IC con FA | ||
| TRC-MCP o DAI | Clase funcional III/IV FEVI ≤ 35%, QRS ≥ 130 ms Dependencia de MCP por ablación del nodo A-V | IIa B |
| TRC-MCP o DAI | Clase funcional III/IV FEVI ≤ 35%, QRS ≥ 130 ms Ritmo ventricular lento | IIa C |
| En IC + indicación tipo i para implantación de MCP | ||
| TRC-MCP o DAI | Clase funcional III/IV FEVI ≤ 35%, QRS ≥ 120 ms | I B |
| TRC-MCP o DAI | Clase funcional III/IV FEVI ≤ 35%, QRS ≤ 120 ms | IIa C |
| TRC-MCP o DAI | Clase funcional II FEVI ≤ 35%, QRS ≤ 120 ms | IIb C |
| En IC no candidato a trasplante | ||
| Dispositivo asistencia ventricular izquierda | Clase funcional IIIb/IV FEVI ≤ 25% VO < 14 ml/kg/min2 | IIb B |
Como se ha dicho anteriormente, hasta un tercio de pacientes con fallo cardíaco presentan BRI. Si bien es un porcentaje significativo, deja a la mayoría de pacientes que sufren IC fuera del campo de acción de la resincronización. Se postuló la posibilidad de ampliar el concepto de asincronía más allá del dato del BRI basándose en la medición de tiempos de activación mecánica por ecocardiografía. No se ha llegado a establecer un concepto definido por ecocardiografía para la asincronía cardíaca, sino que se han empleado varias medidas especialmente relacionadas con el tissue doppler imaging (TDI). Lamentablemente, estas medidas son excesivamente subjetivas y parece que poco estables en el tiempo.
En la práctica se realiza el implante frecuentemente en grados menos avanzados de fallo cardíaco, como la clase funcional II. En esta estrategia, dado que la limitación funcional es menos importante, se busca una prevención de la progresión de la enfermedad. En el estudio MADIT-TRC el objetivo primario consistía en muerte o evento de fallo cardíaco, y no fue distinto entre los pacientes que eran portadores de TRC. El beneficio se centró en la prevención de los eventos de IC durante el tiempo de seguimiento, que fue de 2,4 años. En este estudio todos los pacientes recibieron un DAI que incluía resincronización en un brazo de la aleatorización y en el otro no. En el análisis preespecificado de subgrupos se halló que el beneficio era semejante en cardiopatía isquémica y no isquémica. Se observó que se benefician más los pacientes con QRS extremadamente anchos, superiores a 150ms.
El ensayo clínico que trató de demostrar si era útil la TRC en pacientes con QRS estrecho y asincronía por ecocardiografía, el RethinQ Study Investigators vio como estos pacientes con asincronía definida por ecocardiograma no se beneficiaban de la TRC23. Sólo el subgrupo con QRS de duración superior a 120ms obtenía beneficio clínico.
Grados funcionales menos graves (NYHA I y II)La TRC se comenzó a aplicar en los estadios funcionales graves. El primer paciente descrito se encontraba en fallo grave en unidad de cuidados intensivos. Los primeros estudios sólo trataron de incluir pacientes en clases funcionales III y IV.
Sin embargo, a medida que la TRC se ha hecho más accesible se vio como en la práctica había muchos pacientes en clase II tratados de facto con resincronización. Se considera, además, que el fallo cardíaco es un fenómeno evolutivo que tiende a autoperpetuarse mediante un «remodelado adverso». Terapias eficaces y precoces contra este proceso como los inhibidores de la enzima convertidora de angiotensina (IECA) y β-bloqueadores tienen como objetivo frenar este remodelado.
Por este motivo, se han diseñado de forma específica estudios sobre la efectividad de la TRC en pacientes con grados menores de fallo cardíaco. Los estudios relevantes en este grupo poblacional son: RAFT (Tang, et al.24), MADIT-TRC (Moss, et al.25) y REVERSE (REsynchronization re VErses Remodeling in Systolic left vEntricular dysfunction) (Linde, et al.26).
Optimización de la respuesta terapéutica. Abordaje de los no respondedoresComo se ha dicho anteriormente, si bien con las indicaciones actuales de implante la mayoría de pacientes mejoran en términos clínicos, funcionales y pronósticos, existe un porcentaje de pacientes que se consideran no respondedores por no mejorar su clase funcional en al menos un grado.
Entre las razones que se especulan para dicha ausencia de respuesta está el hecho de que a pesar de existir bloqueo de rama en el ECG no exista retraso de activación mecánica. Otra razón es la implantación del electrodo en zonas poco favorables. La colocación de electrodos está determinada por la existencia y posibilidad de acceso a una rama del sistema venoso coronario donde un electrodo pueda ser alojado de forma estable y sense y estimule adecuadamente. Otro motivo para la ausencia de respuesta es la alta carga de cicatriz transmural en algunos pacientes que hace imposible cualquier ganancia de función.
De estos tres factores resulta especialmente interesante, desde el punto de vista quirúrgico, el segundo, dado que la colocación del electrodo por vía epicárdica quirúrgica permite una elección de sitio más amplia sin limitaciones por la anatomía coronaria18.
Trabajos recientes han explorado mediante mapeo global del ventrículo izquierdo la respuesta fisiológica en términos de función sistólica evaluada mediante la dP/dt a la estimulación en cada zona del ventrículo izquierdo. Hallaron que en casi todos los pacientes existe al menos una zona en la que la mejora de la dP/dt es óptima. Frecuentemente, esta zona no coincide con aquella a la cual se tiene acceso de forma percutánea en la colocación del electrodo del seno coronario, y suele tratarse de áreas remotas al infarto de miocardio18,27,28.
Las esperanzas depositadas en una mejor selección de pacientes basada en la ecocardiografía para predecir la respuesta no ha alcanzado buenas expectativas, pues la sensibilidad, especificidad y reproductibilidad de las medidas ecocardiográficas por ecocardiografía es modesta, como se demostró en el estudio PROSPECT29.
Consideraciones quirúrgica: cirugía en la terapia de resincronización cardíaca. ¿primera o segunda elección?Limitaciones del intervencionismo percutáneo, cirugía ante el fracaso del implante endovascularLa posición ideal de la estimulación ventricular izquierda es un factor determinante en la mejora de la función cardíaca. La implantación percutánea de un electrodo de estimulación en el seno coronario o en una de sus ramas tiene ciertas limitaciones30–32. Los electrodos implantados por vía endovascular y mediante cirugía para resincronización proporcionan parámetros de estimulación agudos y tardíos muy similares33,34.
Cuando no es posible la implantación de forma percutánea, la colocación epicárdica tiene sus indicaciones y puede ser una alternativa eficaz. Sin embargo, una primera intención quirúrgica puede estar determinada con vistas a una mejor identificación de la zona óptima a estimular. Tal indicación ofrece un acceso ilimitado a toda la pared libre ventricular. Además, se puede realizar un mapeo de la superficie ventricular para mejorar los resultados clínicos, funcionales y de parámetros electro-fisiológicos26,27.
La tasa de fracaso en la implantación de electrodos por vía endovenosa es variable, según los datos comunicados por los diversos estudios; así, en el caso del MUSTIC se comunicó una tasa de fracaso del 8%, con un 13,5% de migraciones precoces35. En otro estudio, el MIRACLE, no se pudo implantar el electrodo ventricular en el 7,53% de los casos y precisaron recolocación precoz el 3,78%30.
Se puede observar que existe una tasa de fracaso asociada a la implantación que está determinada por la experiencia de los equipos, a la que se suman los defectos de estimulación consecuencia de la zona elegida para la estimulación y en la que la anatomía del sistema venoso cardíaco desempeña un papel determinante. La colocación del electrodo en zonas anteriores del sistema venoso puede empeorar los índices hemodinámicos debido a la estimulación temprana del tabique interventricular con la pérdida de la sincronía ventricular izquierda. La valoración epicárdica permite una mayor libertad en la elección del lugar de implantación del electrodo. La monitorización hemodinámica y electrofisiológica valorando la respuesta se hace imprescindible. Es en este contexto donde el concepto de no respondedor cobra relevancia, como ya hemos señalado, y en el que la cirugía debe ser considerada una opción en la TRC.
Abordajes quirúrgicosEl abordaje quirúrgico del ventrículo izquierdo para realizar la resincronización puede llevarse a cabo de dos formas, la minitoracotomía como abordaje tradicional o mediante cirugía mínimamente invasiva utilizando dispositivos de toracoscopia. Una tercera opción todavía muy restringida es el implante mediante cirugía robótica con el dispositivo da Vinci (Intuitive Surgical Inc, EE.UU.)18,19,36,42.
La toracotomía es un procedimiento que se acompaña de una mayor morbimortalidad que la toracoscopia, máxime si tenemos en cuenta el perfil de pacientes a los que se va a realizar el procedimiento37. Además, la toracoscopia se acompaña de unos resultados similares o superiores a la toracotomía38. Por este motivo, la minitoracotomía apenas se utiliza en la resincronización ventricular, y casi siempre es un procedimiento de rescate de una toracoscopia fallida34.
De lo anteriormente expuesto deducimos que la cirugía tiene una serie de indicaciones en la TRC. Estas indicaciones se están extendiendo conforme aumenta la experiencia de los grupos de trabajo, disminuye la morbimortalidad asociada al procedimiento y mejoran los resultados de la implantación. Dicho esto, cabe señalar que la cirugía tiene ciertas ventajas e inconvenientes respecto al procedimiento convencional endovascular, y entre ellas se encuentran38, como ventajas e inconvenientes al abordaje quirúrgico:
- –
Mayor accesibilidad a la superficie epicárdica. Fundamentalmente la cara lateral, en la que algunos estudios han señalado la superioridad en la mejora clínica cuando se implanta en dicha zona el electrodo39,40.
- –
Selección de la zona de implante evitando las regiones con grasa epicárdica y fibróticas. En el apartado siguiente veremos la importancia de la elección del punto de implante. Sólo la cirugía ofrece una posibilidad de elección amplia del punto de estimulación sin limitarse al calibre o a la distribución del sistema venoso coronario.
- –
Implantación y fijación mediante sutura, lo que evita la posible migración del dispositivo.
- –
La gran desventaja que presenta es el someter al paciente a una mayor agresión, que se fundamenta en una anestesia general, si bien los resultados en términos de morbimortalidad son excelentes. A esto se añade que el fracaso en la técnica mínimamente invasiva conlleva que haya que recurrir a procedimientos mucho más agresivos, si bien es cierto que la tasa de fracaso respecto al procedimiento percutáneo es menor34,41.
En este sentido, Maessen, et al. comunican los resultados de una serie tratada mediante toracoscopia para optimizar la colocación del electrodo en la selección de la zona a estimular18. La técnica quirúrgica es sencilla y común a diversos grupos de trabajo18,19,38,42.
Se implantan electrodos a nivel auricular y ventricular para poder llevar a cabo las mediciones por vía endovenosa. Abordaje por toracoscopia a nivel del tercer espacio intercostal en línea axilar anterior y en el séptimo espacio intercostal también en la línea axilar anterior, la cámara de vídeo se introduce por el quinto espacio intercostal en la línea media axilar. Se abre el pericardio y se procede a la colocación del sistema de mapeo provisto de 12 sensores. Este sistema engloba las regiones anterior, lateral y posterolateral de la superficie epicárdica. Se evalúa el efecto de la estimulación biventricular en cada una de las 12 posibles regiones seleccionadas, y donde se alcance la mayor rentabilidad de estimulación se procederá a la fijación del electrodo.
Este autor analizó una serie de 14 pacientes que tras fracaso en la colocación convencional por vía endovenosa se trataron mediante abordaje quirúrgico. En esta muestra observó un incremento del volumen del 41% y una dP/dt máxima de 21%, ambos con rango de significación. Se valoró como la elección de la peor de las zonas a estimular no se acompañaba de ninguno de los efectos beneficiosos de dicha estimulación; es más, se podía producir un deterioro de la función ventricular.
El alto número de pacientes no respondedores a TRC, que puede llegar al 10-30% en algunas series30–32, puede estar en relación con una colocación subóptima del electrodo del seno coronario. En este sentido, la cirugía ofrece un ilimitado número de opciones en la elección de la zona a implantar y una escasa agresión quirúrgica.
En línea con el mismo abordaje por toracoscopia están los resultados de Fernández, et al.19, que refuerzan las indicaciones de la cirugía en la TRC y que resumimos brevemente. Se procede a la colocación de electrodo bipolar por vía endovenosa en aurícula derecha. A continuación el paciente se coloca en decúbito lateral derecha a 30-60° y se procede a la realización de tres incisiones de aproximadamente 1-1,5cm a la altura del cuarto y octavo espacio intercostal; posteriormente, se colocan los trocares con colapso pulmonar y bajo visión toracoscópica. Por una de las incisiones se introduce un toracoscopio dotado de una fuente de luz y una cámara de vídeo. Se realiza la apertura pericárdica para poder exponer la cara lateral del corazón identificando las arterias marginales, posteriormente se implanta un electrodo epicárdico unipolar.
Después de realizar la medición de umbrales se fija definitivamente el extremo del electrodo y se introduce dentro de la cavidad torácica un segmento de éste de unos 20-25cm para evitar la tracción con la expansión pulmonar. El extremo proximal del electrodo se dirige hacia el exterior del tórax a través de una apertura anterior. A continuación, ayudado por una guía rígida, se avanza a través del tejido celular subcutáneo hasta la región pectoral, donde se implanta un generador de MCP bicameral al que se conectan los electrodos auricular y ventricular en los pacientes en ritmo sinusal. En el caso de pacientes en fibrilación auricular (FA) el electrodo ventricular se conecta a un generador unicameral alojado en la zona subcostal.
Estos autores comunican como resultado no morbimortalidad operatoria ni intrahospitalaria. Tiempos quirúrgicos 92,4±31min. Hubo que reconvertir un paciente a minitoracotomía. El promedio de umbral de estimulación intraoperatorio del electrodo ventricular izquierdo fue 1,21±0,9 V a 0,5ms. El estudio mediante ecocardiografía Doppler demostró recuperación, al menos parcial, de la sincronía mecánica ventricular septo - pared libre en todos los casos. En el 50% de los pacientes con insuficiencia mitral se observó una disminución en el grado de gravedad. Los parámetros de estimulación del electrodo ventricular izquierdo en el seguimiento no experimentaron cambios estadísticamente significativos respecto a los valores intraoperatorios. No se observó fallo del estímulo ventricular izquierdo ni desplazamiento del electrodo en ningún caso. En referencia a los parámetros quirúrgicos, Doll, et al. comunican unos tiempos quirúrgicos por minitoracotomía de 100±22min, con unos valores umbral de 1,4±0,5 V, una amplitud de la onda R de 10,7±2,8mV y una impedancia de 577±108 Ohm44.
Dekker, et al., en una serie de 11 pacientes también derivados a cirugía tras fracaso de la terapéutica endovascular en los que analizaron seis posibles localizaciones de implantación del electrodo epicárdico en la cara anterior, lateral y posterolateral del ventrículo izquierdo, comunican unos resultados mediante estimulación biventricular de aumento de los siguientes parámetros: volumen (+39%; p=0,01), dP/dt máxima (+20%; p=0,02), en la fracción de eyección (+30%; p=0,007), y una reducción del volumen telediastólico (–6%; p=0,04)43.
La combinación del estudio electrofisiológico y el mapeo ecocardiográfico sirve de guía al cirujano para la elección de la mejor zona en la implantación, evitando las áreas de miocardio cicatrizado. Más recientemente, el uso de guías de presión-volumen orientan hacia una mejor elección del sitio a estimular43. Esta aplicación puede mejorar el éxito de la estimulación biventricular en pacientes con IC.
De forma histórica, el implante de electrodos directamente en la superficie epicárdica del ventrículo izquierdo ha sido la técnica más utilizada inicialmente para la resincronización ventricular14,44. La inserción de electrodos en las venas epicárdicas del ventrículo izquierdo relegó a un segundo plano el papel del implante quirúrgico, al que se atribuyó una elevada morbimortalidad perioperatoria y parámetros de estimulación inapropiados. En la actualidad, la cirugía es considerada una técnica de rescate para los casos en los que fracasa el procedimiento percutáneo33,34,41.
Conclusiones- –
La TCR ha demostrado ser un tratamiento eficaz en pacientes en IC con disfunción sistólica y alteraciones de la sincronía ventricular.
- –
Actualmente la cirugía es una opción de rescate para los pacientes en los que el tratamiento endovascular no es posible.
- –
La relación riesgo-beneficio de la TRC mediante toracoscopia hace que debamos tener presente sus indicaciones en el tratamiento de los pacientes con disfunción sistólica e IC.