En las últimas 2 décadas el número de dispositivos de estimulación cardiaca (DEC) implantados se ha incrementado progresivamente en nuestro medio. Paralelamente, se ha producido un incremento en el número de infecciones asociadas, lo cual podría deberse, al menos en parte, a una población diana cada vez más envejecida y con mayor comorbilidad. Las infecciones de dispositivos de estimulación cardiaca (IDEC) abarcan tanto la infección del bolsillo del generador, de los electrodos o incluso de estructuras cardiacas adyacentes. El mecanismo de infección más frecuente es la contaminación de los electrodos y/o del generador durante el procedimiento de implante o los días posteriores. Existen factores de riesgo modificables y no modificables relacionados con el huésped, el procedimiento quirúrgico y el dispositivo. En el documento se revisan las distintas medidas de prevención de IDEC, así como su grado de evidencia y recomendación.
In the last two decades the number of cardiovascular implantable electronic devices (CEICD) has progressively increased in our environment. In parallel, there has been an increase in the number of associated infections, which could be due, at least in part, to an ageing target population with increased comorbidity. Infections of CEICD include infection of the generator pocket, electrodes or even adjacent cardiac structures. The most common mechanism of infection is contamination of the electrodes and/or generator during the implantation procedure or in the following days. There are modifiable and non-modifiable risk factors related to the host, the surgical procedure and the device. The document reviews the different measures for the prevention of infection of CEICD and their level of evidence and recommendation.
Las infecciones de dispositivos de estimulación cardiaca (IDEC) han aumentado en las últimas décadas. Entre las causas de esta tendencia, destaca el incremento en el número de indicaciones, así como la mayor edad y comorbilidad de los pacientes. El mecanismo de infección más frecuente es la contaminación del generador durante el procedimiento del implante o los días posteriores. Dada su trascendencia para el paciente y el sistema sanitario, resulta especialmente relevante revisar los potenciales factores de riesgo y las principales medidas de prevención.
Incidencia de las infecciones de dispositivos de estimulación cardiacaEn las últimas 2 décadas el número de dispositivos de estimulación cardiaca (DEC) implantados se ha incrementado progresivamente en nuestro medio, fundamentalmente gracias a los avances tecnológicos y a la ampliación de sus indicaciones1. Paralelamente, se ha producido un incremento en el número de infecciones asociadas, lo cual podría deberse, al menos en parte, a una población diana cada vez más envejecida y con mayor comorbilidad2. Es complejo conocer con exactitud la prevalencia de las IDEC debido a la heterogeneidad de las distintas cohortes disponibles. Los primeros estudios observaron una incidencia situada entre el 0,13 y el 19,9%3,4. En un estudio de base poblacional realizado en Minnesota entre 1975 y 2004, la incidencia global fue de 1,9 por cada 1.000 dispositivos/año (intervalo de confianza [IC] al 95%: 1,1-3,1)5. Más recientemente, un estudio basado en los datos de los seguros médicos estadounidenses entre 2000 y 2012, que incluyó más de 4 millones de procedimientos quirúrgicos, mostró un aumento de la incidencia del 1,45 al 3,41% (p<0,001) para dicho periodo6, con un mayor riesgo asociado al implante de dispositivos de terapia de resincronización cardiaca (TRC). En 2016 Rennert-May et al. revisaron 191.610 DEC implantados en EE. UU. en el año 2016, identificando 8.060 casos de IDEC (4,2%)7. En nuestro medio, un estudio de cohortes retrospectivo realizado en el Hospital Clinic de Barcelona describió 138 episodios de IDEC diagnosticados a lo largo de los últimos 40 años y comparó 2 periodos de tiempo (1981-2000 frente a 2001-2020), poniendo de manifiesto una prevalencia 4,5 veces mayor en el segundo periodo: 25 (18%) frente a 113 (82%) casos de IDEC, correspondiendo el 4,1 y el 10,2% del total de endocarditis infecciosas diagnosticadas en dicho centro del primer y segundo periodo, respectivamente8.
Un dato a tener en cuenta es que la incidencia de infección asociada a procedimientos de revisión o sustitución de DEC es de 2 a 5 veces mayor con respecto a un primer implante9.
Patogenia y etiologíaLas IDEC abarcan tanto la infección local del bolsillo del generador como la infección sistémica, que afecta a los electrodos del dispositivo de electroestimulación. El mecanismo de infección más frecuente es la contaminación del generador durante el procedimiento de implante o los días posteriores. Durante la cirugía, la herida quirúrgica se va colonizando por la flora residente de la piel adyacente, fundamentalmente de la zona pectoral y axilar, en las cuales reside una alta concentración de microorganismos; de hecho, se considera que a los 40-60min del inicio de la intervención la herida quirúrgica ya está contaminada. Esto no implica que se desarrolle necesariamente una infección10,11, para lo cual tendrían que concurrir una serie de factores predisponentes, como la presencia de hematomas en el postoperatorio, entre otros. Este mecanismo suele ser el responsable de las infecciones precoces, definidas como aquéllas que se producen en los primeros 6 meses12. Hay autores que reducen el periodo a los primeros tres meses13 mientras que otros, sin embargo, lo amplían incluso hasta el primer año postimplante14.
El segundo mecanismo implica la infección de los electrodos en un primer momento, y posteriormente del dispositivo, desde un foco a distancia (por ejemplo, un catéter venoso) en el contexto de una infección sistémica (diseminación hematógena). Este mecanismo es el responsable de la mayor parte de las infecciones tardías.
Tras la adhesión inicial al dispositivo, los microorganismos experimentan complejas variaciones genéticas que conducen a la formación de una biopelícula o biofilm. Debido a la arquitectura de la biopelícula y a los problemas de difusión de los antimicrobianos a su través, es posible que algunas poblaciones bacterianas estén sometidas, al menos de forma transitoria, a concentraciones subinhibitorias de antibióticos, aumentando la probabilidad de seleccionar mutantes resistentes. Rodeados de esta estructura, los gérmenes desarrollan variantes de colonias que muestran un comportamiento diferente, volviéndose resistentes al sistema inmunitario del huésped y a los agentes antimicrobianos, propiciando que sea prácticamente imposible la curación del paciente sin la retirada del dispositivo completo9,15.
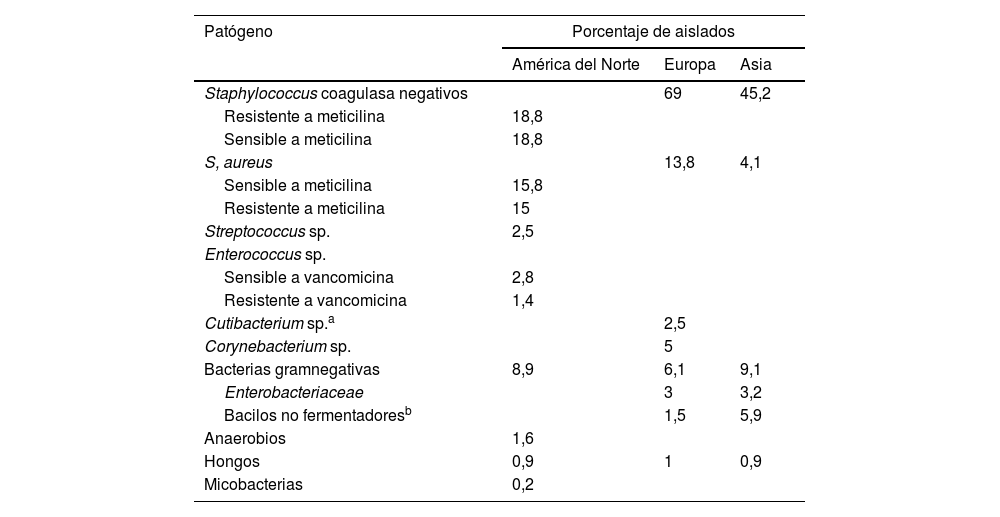
Con respecto a la etiología, en una reciente revisión realizada por autores de la Clínica Mayo, analizando las diversas series publicadas, los microorganismos aislados con mayor frecuencia (70-90%) son bacterias grampositivas, flora residente de la piel en el escenario de la infección local del bolsillo del dispositivo de electroestimulación, especialmente estafilococos coagulasa negativos (38%) y Staphylococcus aureus (31%) (tabla 1)16. Estos microorganismos no tienen un efecto patógeno en su localización habitual; de hecho, evitan el sobrecrecimiento de otras bacterias gramnegativas u hongos no residentes (y potencialmente patógenos), representando el principal mecanismo de defensa contra estos. La etiología en el caso de las infecciones a distancia va a depender del foco primario de la bacteriemia. Es importante recalcar que el riesgo de infección secundaria a una siembra hematógena en pacientes con bacteriemia por S. aureus portadores de un DEC es elevado, motivo por el que esta circunstancia hace que se las considere «complicadas» por definición17. En esta serie, los bacilos gramnegativos (BGN) se aislaron en un 6-9% de los casos, mientras que otros microorganismos como estreptococos, anaerobios y hongos se aislaron con menor frecuencia16. En cualquier caso, ante la sospecha de una IDEC, la punción-aspiración mediante aguja con la asepsia requerida de la bolsa del dispositivo constituye una herramienta de gran ayuda para el diagnóstico microbiológico18.
Principales patógenos aislados en pacientes intervenidos de IDEC pertenecientes a 3 grandes cohortes de América del Norte, Europa y Asia
| Patógeno | Porcentaje de aislados | ||
|---|---|---|---|
| América del Norte | Europa | Asia | |
| Staphylococcus coagulasa negativos | 69 | 45,2 | |
| Resistente a meticilina | 18,8 | ||
| Sensible a meticilina | 18,8 | ||
| S, aureus | 13,8 | 4,1 | |
| Sensible a meticilina | 15,8 | ||
| Resistente a meticilina | 15 | ||
| Streptococcus sp. | 2,5 | ||
| Enterococcus sp. | |||
| Sensible a vancomicina | 2,8 | ||
| Resistente a vancomicina | 1,4 | ||
| Cutibacterium sp.a | 2,5 | ||
| Corynebacterium sp. | 5 | ||
| Bacterias gramnegativas | 8,9 | 6,1 | 9,1 |
| Enterobacteriaceae | 3 | 3,2 | |
| Bacilos no fermentadoresb | 1,5 | 5,9 | |
| Anaerobios | 1,6 | ||
| Hongos | 0,9 | 1 | 0,9 |
| Micobacterias | 0,2 | ||
IDEC: infecciones de dispositivos de estimulación cardiaca.
En definitiva, el diagnóstico de una IDEC es complejo y depende de la experiencia tanto de cardiólogos como de especialistas en enfermedades infecciosas, combinando los hallazgos de la exploración física, analíticos y microbiológicos, así como técnicas avanzadas de diagnóstico por imagen, existiendo distintos criterios clasificatorios16.
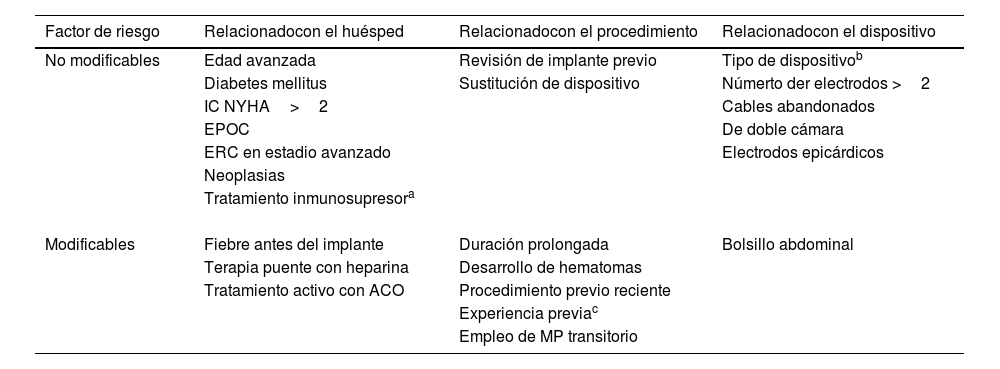
Factores de riesgoExisten factores de riesgo modificables y no modificables relacionados con el huésped, el procedimiento quirúrgico y el dispositivo (tabla 2). Entre los factores no modificables, podemos distinguir los siguientes16:
- -
Relacionados con el huésped: edad avanzada, diabetes mellitus, insuficiencia cardiaca NYHA>2, enfermedad pulmonar obstructiva crónica (EPOC), enfermedad renal crónica en estadio avanzado, neoplasias, corticoterapia u otro tipo de tratamiento inmunosupresor.
- -
Relacionados con el procedimiento: revisión/manipulación de un implante previo, sustitución de dispositivo.
- -
Relacionados con el dispositivo: tipo de dispositivo (más riesgo para TRC y DAI), número de electrodos superior a 2, existencia de cables abandonados o con trayecto sinuoso, dispositivos de doble cámara, presencia de electrodos epicárdicos.
Factores de riesgo para las IDEC
| Factor de riesgo | Relacionadocon el huésped | Relacionadocon el procedimiento | Relacionadocon el dispositivo |
|---|---|---|---|
| No modificables | Edad avanzada | Revisión de implante previo | Tipo de dispositivob |
| Diabetes mellitus | Sustitución de dispositivo | Númerto der electrodos >2 | |
| IC NYHA>2 | Cables abandonados | ||
| EPOC | De doble cámara | ||
| ERC en estadio avanzado | Electrodos epicárdicos | ||
| Neoplasias | |||
| Tratamiento inmunosupresora | |||
| Modificables | Fiebre antes del implante | Duración prolongada | Bolsillo abdominal |
| Terapia puente con heparina | Desarrollo de hematomas | ||
| Tratamiento activo con ACO | Procedimiento previo reciente | ||
| Experiencia previac | |||
| Empleo de MP transitorio |
ACO: anticoagulantes orales; EPOC: enfermedad pulmonar obstructiva crónica; ERC: enfermedad renal crónica; IC: insuficiencia cardiaca; IDEC: infecciones de dispositivos de estimulación cardiaca; MP: marcapasos.
Con respecto a los factores de riesgo modificables, cabe destacar16:
- -
Relacionados con el huésped: presencia de fiebre antes del implante, terapia puente con heparina, tratamiento activo con anticoagulantes orales.
- -
Relacionados con el procedimiento: duración prolongada, desarrollo de hematomas, procedimientos previos recientes, experiencia previa del cirujano/cardiólogo que implanta, empleo de un marcapasos (MP) transitorio.
- -
Relacionados con el dispositivo: realización de un bolsillo abdominal.
En 2018 la Organización Mundial de la Salud (OMS) realizó una serie de recomendaciones basadas en la evidencia disponible en relación con la prevención de la infección del sitio quirúrgico (ISQ)19. Estas medidas pueden parecer básicas pero su cumplimiento óptimo es clave. Con respecto a las medidas prequirúrgicas, la OMS recomienda la realización de una ducha preoperatoria con jabón, evitar maquinillas no eléctricas en el rasurado y que sea realizado lo más próximo posible al procedimiento. En este sentido recomienda también el empleo de clorhexidina al 2% en solución alcohólica como antiséptico preoperatorio, así como un correcto lavado de manos, frotándose las manos y los antebrazos ya sea utilizando agua y jabón o productos validados a base de alcohol, siempre durante el tiempo recomendado por el fabricante, normalmente de 2 a 5min. Durante la cirugía se aconseja asegurar una técnica estéril intraoperatoria y limitar el número de personas en el quirófano, así como el número de apertura de puertas durante el procedimiento. Tras la cirugía es clave no mantener la profilaxis antibiótica20 y revisar periódicamente las heridas quirúrgicas para detectar signos de infección.
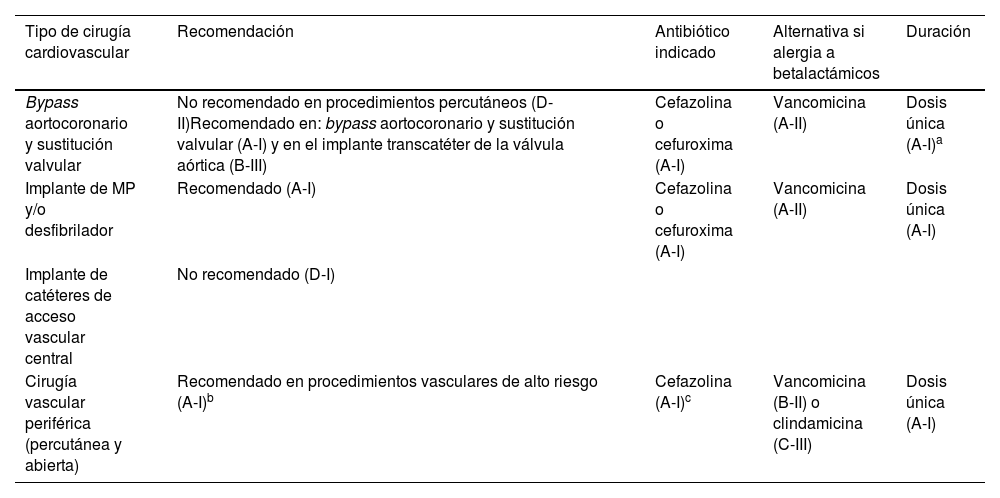
Profilaxis antibióticaLa Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC), conjuntamente con la Asociación Española de Cirujanos (AEC), revisaron y actualizaron las recomendaciones de profilaxis antimicrobiana en un documento de consenso publicado recientemente21. La eficacia posible de los antibióticos empleados como profilaxis depende directamente de que sus concentraciones plasmáticas y consecuentemente tisulares sean lo más elevadas posible. Para ello es clave llevar a cabo su infusión próxima al momento de la incisión, repitiendo la dosis si es necesario, cuando los parámetros farmacocinéticos y farmacodinámicos del antibiótico empleado lo aconsejen. Así pues, en la cirugía de implante de DEC se recomienda la administración de una cefalosporina de primera o segunda generación, como cefazolina o cefuroxima, 1h antes de la incisión y en dosis única (tabla 3). En pacientes con una alergia probada, podría administrarse vancomicina o teicoplanina intravenosa (IV) perfundida de 90 a 120min antes del procedimiento. Daptomicina y linezolid son regímenes alternativos en aquéllos en los que no pueda emplearse ninguna de las opciones anteriores18. En cualquier caso, es importante resaltar que la elección de la profilaxis antibiótica prequirúrgica deberá tener en cuenta en última instancia la epidemiología local y, especialmente, la resistencia a betalactámicos.
Principales pautas de profilaxis antibiótica prequirúrgica en cirugía cardiovascular
| Tipo de cirugía cardiovascular | Recomendación | Antibiótico indicado | Alternativa si alergia a betalactámicos | Duración |
|---|---|---|---|---|
| Bypass aortocoronario y sustitución valvular | No recomendado en procedimientos percutáneos (D-II)Recomendado en: bypass aortocoronario y sustitución valvular (A-I) y en el implante transcatéter de la válvula aórtica (B-III) | Cefazolina o cefuroxima (A-I) | Vancomicina (A-II) | Dosis única (A-I)a |
| Implante de MP y/o desfibrilador | Recomendado (A-I) | Cefazolina o cefuroxima (A-I) | Vancomicina (A-II) | Dosis única (A-I) |
| Implante de catéteres de acceso vascular central | No recomendado (D-I) | |||
| Cirugía vascular periférica (percutánea y abierta) | Recomendado en procedimientos vasculares de alto riesgo (A-I)b | Cefazolina (A-I)c | Vancomicina (B-II) o clindamicina (C-III) | Dosis única (A-I) |
MP: marcapasos.
Si se emplean cefalosporinas, administrar una nueva dosis de 1g/cada 3h hasta la finalización del procedimiento; no se debe continuar la profilaxis una vez concluida la cirugía (A-II).
Se sugiere añadir un segundo antibiótico con actividad frente a bacilos gramnegativos (gentamicina) si hay riesgo de exposición a la flora intestinal (B-III).Fuente: Adaptada de del Toro López et al.21.
Se recomienda una dosis intraoperatoria adicional cuando el procedimiento se prolongue más de 2 veces la vida media del antibiótico empleado. En el caso de la cefazolina, es necesario administrar una segunda dosis intraoperatoria a las 3h21. No existe evidencia suficiente para mantener la profilaxis antibiótica una vez finalizado el procedimiento quirúrgico. En este sentido, se realizó un ensayo clínico multicéntrico, aleatorizado y de diseño cruzado, que evaluaba si prolongar la antibioterapia perioperatoria reducía la incidencia de IDEC20. Para ello, se comparó la profilaxis prequirúrgica estándar con cefazolina frente a la administración prequirúrgica de cefazolina más vancomicina, junto al lavado del bolsillo con bacitracina intraprocedimiento y cefalexina oral durante dos días más. Tras evaluar 19.603 pacientes de 28 centros, no se encontraron diferencias significativas en las tasas de infección entre ambos grupos: 99 (1,03%) casos en el grupo de tratamiento convencional frente a 78 (0,78%) entre los que recibieron profilaxis prolongada (odds ratio: 0,77; IC 95%: 0,56-1,05; p=0,1).
Otras medidasExisten otra serie de medidas específicas para intentar prevenir las IDEC.
Medidas prequirúrgicasEn los pacientes que tienen fiebre o signos de infección activa, el procedimiento debe retrasarse hasta que el paciente permanezca afebril durante, al menos, 24h22.
- -
Descolonización de S. aureus: En el caso de pacientes colonizados el tratamiento tópico nasal con mupirocina y el lavado con clorhexidina ha demostrado reducir el riesgo de infección por dicho microorganismo en diversos estudios de cirugía cardiotorácica23,24, aunque no disponemos de estudios específicos ni subanálisis para la cirugía de implante de DEC. En un metaanálisis que incluyó 17 estudios (34.859 pacientes), se evidenció una reducción significativa del riesgo de ISQ por S. aureus (riesgo relativo [RR]: 0,44; IC 95%: 0,32-0,61) tras una estrategia de descolonización universal, aunque los resultados no fueron estadísticamente significativos en el caso de ISQ por S. aureus resistente a meticilina (SARM) (RR: 0,25; IC 95%: 0,05-1,28), sin que esta circunstancia pudiera achacarse en principio a la potencia estadística25.
- -
Cobertura frente a SARM: En las últimas décadas, la prevalencia de SARM ha aumentado en la comunidad y ha dejado de considerarse un patógeno limitado exclusivamente al entorno hospitalario o nosocomial, especialmente en EE. UU. A pesar de ello, actualmente no hay datos suficientes que respalden la utilización rutinaria de vancomicina IV como profilaxis antibiótica prequirúrgica en nuestro medio26,27. En el caso de pacientes colonizados por SARM sí podría considerarse su empleo en monoterapia o de forma combinada17.
- -
Anticoagulación y prevención de hematomas: Uno de los principales factores de riesgo de IDEC es la formación de hematomas en el bolsillo del generador durante el postoperatorio precoz. La primera medida para evitar hematomas es la hemostasia cuidadosa del campo quirúrgico. En aquellos casos en los que esta sea dificultosa, existe la posibilidad de emplear un drenaje que evitaría la formación de hematomas y su potencial sobreinfección posterior28; otros métodos profilácticos son la compresión, el uso de ácido tranexámico tópico o de diversos hemostáticos absorbibles29.
Asimismo, se recomienda optimizar la terapia anticoagulante en el perioperatorio. En este sentido, se aconseja suspender los dicumarínicos 24h antes del procedimiento para conseguir un INR por debajo de 2 y reiniciarlos 24-48h después. Con respecto a los anticoagulantes orales de acción directa (ACOD), en el escenario de una cirugía electiva de implante de MP o desfibrilador, el estudio BRUISE CONTROL-2 mostró un riesgo de hematoma del bolsillo similar en el grupo de pacientes que mantuvo el ACOD hasta la misma mañana de la cirugía con respecto a quienes lo suspendieron 48h antes del procedimiento, considerándose adecuadas ambas estrategias30. Dos ensayos clínicos aleatorizados han demostrado que mantener la anticoagulación oral con warfarina hasta la cirugía disminuye el riesgo de desarrollar un hematoma del bolsillo frente a la terapia puente con heparina en aquéllos que van a implantarse un MP o un desfibrilador31,32.
Los antiagregantes plaquetarios también aumentan significativamente el riesgo de sangrado, si bien no todos lo hacen en igual medida. Globalmente, se aconseja su suspensión 5-10 días antes de la intervención16, considerando la vida media del fármaco en cuestión. No obstante, teniendo en cuenta el potencial riesgo cardiovascular de la interrupción del tratamiento crónico con ácido acetilsalicílico (AAS), este no debería interrumpirse en pacientes con cardiopatía isquémica. Por el contrario, siempre que sea posible, el tratamiento con tienopiridinas (como el clopidogrel) debe suspenderse antes de la cirugía, especialmente si está en combinación con AAS33.
Si el paciente desarrollase finalmente un hematoma en el bolsillo del generador, se debe evitar su drenaje o evacuación durante las primeras semanas a menos que esté a tensión, exista una dehiscencia de suturas o el dolor sea muy intenso, puesto que la reintervención precoz aumenta drásticamente el riesgo de infección22,34.
Medidas periprocedimiento- -
Irrigación local del bolsillo con antisépticos y/o antibióticos: Si bien se recomienda la irrigación profusa del bolsillo con suero salino, la instilación local de un antibiótico o antiséptico no ha demostrado ningún beneficio para prevenir las IDEC35.
- -
Envoltura antibiótica: Se están estudiando distintas estrategias novedosas para reducir el riesgo de IDEC. Una de ellas es el uso de una envoltura para el DEC, fabricada con una malla polimérica recubierta con agentes antibacterianos que se absorbe completamente en 9 semanas. Está diseñada para liberar localmente minociclina y rifampicina, alcanzando una alta concentración en el tejido local en 2h, la cual se mantiene durante un periodo de 7-10 días para prevenir las infecciones y la formación de biofilm. Los estudios previos retrospectivos y de casos-control fueron muy prometedores, con reducciones significativas de IDEC36,37. Sin embargo, dada la baja tasa de IDEC, el número de pacientes tratados necesario para prevenir una infección en el ensayo clínico WRAP-IT fue alto, por lo que se recomienda su uso fundamentalmente en pacientes de alto riesgo38, como aquéllos con una puntuación ≥ 6 en la escala PADIT, que incluye las siguientes variables: procedimientos previos en la misma bolsa, edad, deterioro de función renal, inmunodepresión y tipo de procedimiento39.
Una vez revisado brevemente el origen y las causas de las IDEC, concluimos que deben incrementarse los esfuerzos para identificar y reducir los factores de riesgo modificables en la práctica clínica diaria, tanto aquéllos relacionados con el huésped como con el procedimiento, con objeto de mejorar la supervivencia de los pacientes portadores, a menudo de edad avanzada y pluripatológicos, así como disminuir la estancia hospitalaria y reducir los costes derivados de esta enfermedad. El cumplimiento estricto de las medidas de control de la infección en el momento de la implantación del DEC es fundamental para reducir el riesgo de infección del dispositivo; otras estrategias complementarias, como la cobertura frente a SARM en la profilaxis antibiótica prequirúrgica o el uso de envolturas antibióticas para el DEC, se han mostrado coste-eficaces fundamentalmente en pacientes de alto riesgo.
FinanciaciónL.E.L.C. cuenta con el apoyo del Plan Nacional de I+D+I 2013-2016 y del Instituto de Salud Carlos III, Subdirección General de Redes y Centros de Investigación Cooperativa, Ministerio de Economía, Industria y Competitividad, Red Española de Investigación en Enfermedades Infecciosas (RD16/0016/0001)-cofinanciado por el Fondo Europeo de Desarrollo Regional’Una forma de hacer Europa, Programa Operativo Crecimiento Inteligente 2014-2020’.
Conflicto de interesesLELC ha sido asesor científico de Angelini, ponente de Angelini, ViiV, Gilead y Correvio, y ha realizado tareas de formación para ViiV. Los demás autores no tienen nada que declarar.
Al Dr. Juan Gálvez por su dedicación y pasión por las infecciones cardiovasculares.