La coartación aórtica es una de las enfermedades congénitas cardiovasculares más frecuentes, y su resolución quirúrgica se acompaña de un 11% de complicaciones a largo plazo, entre las cuales se encuentran los aneurismas y pseudoaneurismas. El objetivo del presente trabajo consiste en reportar la experiencia de nuestro centro en el manejo quirúrgico de los aneurismas de aorta descendente poscirugía de coartación aórtica.
MétodosTrabajo retrospectivo de 6 casos intervenidos desde enero de 2006 hasta abril de 2014, con antecedentes de corrección quirúrgica de coartación aórtica con parche en la infancia y diagnóstico de aneurisma de aorta descendente en el seguimiento.
ResultadosDe 6 pacientes, 4 eran varones y 2 mujeres; la edad promedio al momento de la primera cirugía fue de 8,2±2,9años, y la de la corrección del aneurisma de aorta descendente fue de 34,3±5,1años; el tiempo transcurrido desde la primera cirugía a la reintervención fue de 26±5años. Se realizó el reemplazo de la aorta descendente con prótesis de PTRC y se emplearon 2 estrategias de perfusión: en 5 pacientes se utilizó circulación extracorpórea y en uno se llevó a cabo derivación auriculofemoral con centrífuga. Cuatro pacientes registraron complicaciones menores (hemotórax, neumotórax, quilotórax, síndrome de Horner, disfonía y cefalea), y un paciente falleció. Los pacientes se encontraron asintomáticos durante un seguimiento promedio de 44,8meses.
ConclusionesEn pacientes jóvenes y con escasas comorbilidades, la cirugía ofrece una resolución definitiva para los aneurismas poscirugía de coartación aórtica, presentando una morbimortalidad aceptable
Aortic coarctation is one of the most common congenital cardiovascular diseases and its surgical correction implies an 11% morbidity at long term follow up, among which are the aneurysms and pseudoaneurysms. The purpose of this study is to describe our experience regarding the surgical management of descending aortic aneurysms after surgery for aortic coarctation.
MethodsRetrospective analysis of 6 surgeries performed between January 2006 and April 2014 in patients with history of patch aortoplasty for coarctation of the aorta during their childhood and who were diagnosed with descending aortic aneurysm during follow up.
ResultsFrom a total of 6 patients, 4 were male and 2 female, the mean age at time of the first surgery for correction of the coarctation of the aorta was 8.2±2.9years, and for the descending aortic aneurysm surgery it was 34.3±5.1years. The mean time elapsed between the first surgery and the re-intervention was 26±5years. Replacement of the descending thoracic aorta was performed using a collagen coated braided polyester prosthesis. Two perfusion strategies were used; in 5 patients surgery was performed using extracorporeal circulation, and in one patient atrial femoral bypass with centrifuge pump was used. Four patients had minor complications (haemothorax, pneumothorax, chylothorax, Horner's syndrome, dysphonia, and headache), and one patient died. All patients were asymptomatic at a mean follow up of 44.8months.
ConclusionsIn young patients with few comorbidities, surgery offers a definitive solution for postoperative aneurysms of the descending aorta with an acceptable morbidity and mortality.
La coartación aórtica (CAo) es una de las enfermedades congénitas cardiovasculares más frecuentes, y su historia natural ha cambiado radicalmente con la corrección quirúrgica introducida en 1944 por Crafoord y Nylin1. A lo largo de los años se han llevado a cabo diferentes técnicas quirúrgicas para su tratamiento; entre las más antiguas se incluyen la aortoplastia con parche sintético y la derivación extraanatómica con prótesis; y entre las más modernas, la resección con interposición de prótesis o la anastomosis término-terminal. A pesar del tratamiento de esta patología, se han descrito numerosas complicaciones a largo plazo de los pacientes con CAo corregida, siendo las más frecuentes la hipertensión arterial postoperatoria, definida como niveles de presión arterial sistólica y diastólica igual o mayores a 140 y 90mmHg, respectivamente, al momento del alta o en los controles subsecuentes2,3; enfermedad coronaria prematura, entendiéndose como tal aquella que se presenta antes de los 55años en varones y de los 65años en mujeres2,4; recoartación, así como complicaciones aórticas mayores; estas últimas incluyen aneurismas, pseudoaneurismas, rotura aórtica, disección aórtica, infecciones y fístulas, requiriendo reintervención quirúrgica en aproximadamente el 11% de los casos2.
MétodosSe realizó un estudio de carácter retrospectivo en el cual se incluyeron todos los pacientes con diagnóstico de aneurisma de aorta descendente (AAoD) posterior a cirugía de coartación de aorta que ingresaron al Hospital Universitario Fundación Favaloro entre enero de 2006 y abril de 2014. Los criterios de inclusión que se tomaron en cuenta para este trabajo fueron los siguientes: pacientes varones y mujeres que fueron referidos al Hospital Universitario Fundación Favaloro con diagnóstico de AAoD y antecedentes de corrección quirúrgica de CAo en la infancia con parche de poliéster trenzado.
Se realizó una revisión completa de las historias clínicas de los pacientes que cumplían con los criterios y se registraron los datos de cada uno en un formulario diseñado para tal fin. Posteriormente, los resultados fueron tabulados utilizando el software Microsoft Excel 2011.
Las variables consideradas para el estudio fueron: sexo (masculino o femenino), edad al momento de la cirugía (años), talla (metros), peso (kilogramos), edad a la que fueron intervenidos por primera vez los pacientes (años), tiempo transcurrido entre la primera intervención quirúrgica y la cirugía para la corrección del AAoD (años), antecedentes, síntomas al ingreso, estudios preoperatorios (electrocardiograma, radiografía de tórax, ecocardiograma, resonancia magnética o angiotomografía), diámetro transverso del aneurisma (milímetros); datos intraoperatorios (tiempo quirúrgico, tiempo de bomba, tiempo de pinzamiento aórtico, sitios de canulación, temperatura corporal [°C], protección medular, tipo de prótesis utilizada); días en el área de terapia intensiva, horas en asistencia respiratoria mecánica, estadía hospitalaria (días), complicaciones y tiempo de seguimiento en el postoperatorio (meses) (tabla 1). Estas variables fueron introducidas en una hoja de cálculo de Excel y se procedió a la tabulación de los datos.
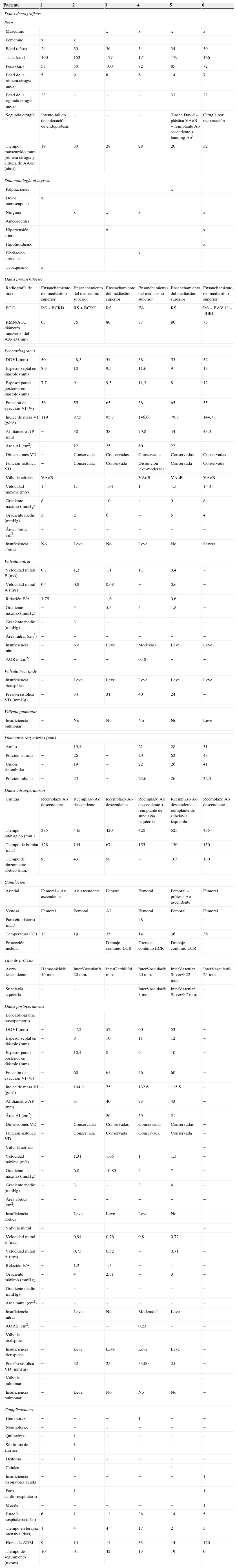
Pacientes intervenidos de cirugía de reemplazo de aorta torácica descendente posterior a cirugía de coartación de aorta, entre enero de 2006 y abril de 2014, en el Hospital Universitario Fundación Favaloro
| Paciente | 1 | 2 | 3 | 4 | 5 | 6 |
|---|---|---|---|---|---|---|
| Datos demográficos | ||||||
| Sexo | ||||||
| Masculino | x | x | x | x | ||
| Femenino | x | x | ||||
| Edad (años) | 24 | 39 | 36 | 34 | 34 | 39 |
| Talla (cm.) | 160 | 153 | 177 | 171 | 179 | 166 |
| Peso (kg.) | 58 | 50 | 100 | 72 | 85 | 72 |
| Edad de la primera cirugía (años) | 5 | 9 | 8 | 6 | 14 | 7 |
| Edad de la segunda cirugía (años) | 23 | − | − | − | 33 | 22 |
| Segunda cirugía | Intento fallido de colocación de endoprótesis | − | − | − | Tirone David+plástica VAoB+reimplante Ao ascendente+banding Aoa | Cirugía por recoartación |
| Tiempo transcurrido entre primera cirugía y cirugía de AAoD (años) | 19 | 30 | 28 | 28 | 20 | 32 |
| Sintomatología al ingreso | ||||||
| Palpitaciones | x | |||||
| Dolor interescapular | x | |||||
| Ninguna | x | x | x | x | ||
| Antecedentes | ||||||
| Hipertensión arterial | x | x | ||||
| Hipotiroidismo | x | |||||
| Fibrilación auricular | x | |||||
| Tabaquismo | x | |||||
| Datos preoperatorios | ||||||
| Radiografía de tórax | Ensanchamiento del mediastino superior | Ensanchamiento del mediastino superior | Ensanchamiento del mediastino superior | Ensanchamiento del mediastino superior | Ensanchamiento del mediastino superior | Ensanchamiento del mediastino superior |
| ECG | RS+BCRD | RS+BCRD | RS | FA | RS | RS+BAV 1°+BIRI |
| RMN/ATC: diámetro transverso del AAoD (mm) | 65 | 75 | 80 | 87 | 86 | 75 |
| Ecocardiograma | ||||||
| DDVI (mm) | 50 | 48,5 | 54 | 58 | 53 | 52 |
| Espesor septal en diástole (mm) | 8,3 | 10 | 9,5 | 11,6 | 9 | 13 |
| Espesor pared posterior en diástole (mm) | 7,7 | 9 | 9,5 | 11,3 | 8 | 12 |
| Fracción de eyección VI (%) | 56 | 55 | 65 | 38 | 65 | 55 |
| Índice de masa VI (g/m2) | 119 | 87,5 | 95,7 | 146,6 | 79,8 | 144,7 |
| AI diámetro AP (mm) | − | 30 | 38 | 79,8 | 44 | 43,3 |
| Área AI (cm2) | − | 12 | 25 | 60 | 22 | − |
| Dimensiones VD | − | Conservadas | Conservadas | Conservadas | Conservadas | Conservadas |
| Función sistólica VD | − | Conservada | Conservada | Disfunción leve-moderada | Conservada | Conservada |
| Válvula aórtica | VAoB | − | − | VAoB | VAoB | VAoB |
| Velocidad máxima (m/s) | 1,4 | 1,1 | 1,61 | 1 | 1,5 | 1,43 |
| Gradiente máximo (mmHg) | 8 | 4 | 10 | 4 | 9 | 8 |
| Gradiente medio (mmHg) | 3 | 2 | 6 | − | 5 | 4 |
| Área aórtica (cm2) | − | − | − | − | − | − |
| Insuficiencia aórtica | No | Leve | No | Leve | No | Severa |
| Válvula mitral | ||||||
| Velocidad mitral E (m/s) | 0,7 | 1,2 | 1,1 | 1,1 | 0,4 | − |
| Velocidad mitral A (m/s) | 0,4 | 0,8 | 0,68 | − | 0,6 | − |
| Relación E/A | 1,75 | − | 1,6 | − | 0,6 | − |
| Gradiente máximo (mmHg) | − | 5 | 5,5 | 5 | 1,8 | − |
| Gradiente medio (mmHg) | − | 3 | − | − | − | − |
| Área mitral (cm2) | − | − | − | − | − | − |
| Insuficiencia mitral | − | No | Leve | Moderada | Leve | Leve |
| AORE (cm2) | − | − | − | 0,18 | − | − |
| Válvula tricúspide | ||||||
| Insuficiencia tricuspídea | − | Leve | Leve | Leve | Leve | Leve |
| Presión sistólica VD (mmHg) | − | 34 | 31 | 40 | 24 | − |
| Válvula pulmonar | ||||||
| Insuficiencia pulmonar | − | No | No | No | No | Leve |
| Diámetros raíz aórtica (mm) | ||||||
| Anillo | − | 19,4 | − | 21 | 28 | 31 |
| Porción sinusal | − | 26 | − | 29 | 62 | 43 |
| Unión sinotubular | − | 19 | − | 22 | 26 | 41 |
| Porción tubular | − | 23 | − | 23,6 | 26 | 32,5 |
| Datos intraoperatorios | ||||||
| Cirugía | Reemplazo Ao descendente | Reemplazo Ao descendente | Reemplazo Ao descendente | Reemplazo Ao descendente+reimplante de subclavia izquierda | Reemplazo Ao descendente+reimplante de subclavia izquierda | Reemplazo Ao descendente |
| Tiempo quirúrgico (min.) | 385 | 445 | 420 | 420 | 525 | 435 |
| Tiempo de bomba (min.) | 128 | 144 | 67 | 155 | 130 | 150 |
| Tiempo de pinzamiento aórtico (min.) | 93 | 43 | 58 | − | 105 | 130 |
| Canulación | ||||||
| Arterial | Femoral+Ao ascendente | Ao ascendente | Femoral | Femoral | Femoral+prótesis Ao ascendente | Femoral |
| Venosa | Femoral | Femoral | AI | Femoral | Femoral | Femoral |
| Paro circulatorio (min.) | − | − | − | 48 | − | − |
| Temperatura (°C) | 13 | 19 | 35 | 14 | 36 | 36 |
| Protección medular | − | − | Drenaje continuo LCR | Drenaje continuo LCR | Drenaje continuo LCR | − |
| Tipo de prótesis | ||||||
| Aorta descendente | Hemashield® 16mm | InterVascular® 20mm. | InterGard® 24mm. | InterVascular® 20mm. | InterVascular Silver® 22mm. | InterVascular® 24mm. |
| Subclavia izquierda | − | − | − | InterVascular® 8mm. | InterVascular Silver® 7mm. | − |
| Datos postoperatorios | ||||||
| Ecocardiograma postoperatorio | ||||||
| DDVI (mm) | − | 47,2 | 52 | 60 | 53 | − |
| Espesor septal en diástole (mm) | − | 8 | 10 | 11 | 12 | − |
| Espesor pared posterior en diástole (mm) | − | 10,4 | 8 | 9 | 10 | − |
| Fracción de eyección VI (%) | − | 60 | 65 | 46 | 60 | − |
| Índice de masa VI (g/m2) | − | 104,8 | 75 | 132,6 | 115,5 | − |
| AI diámetro AP (mm) | − | 31 | 40 | 73 | 43 | − |
| Área AI (cm2) | − | − | 26 | 59 | 21 | − |
| Dimensiones VD | − | Conservadas | Conservadas | Conservadas | Conservadas | − |
| Función sistólica VD | − | Conservada | Conservada | Conservada | Conservada | − |
| Válvula aórtica | − | |||||
| Velocidad máxima (m/s) | − | 1,31 | 1,65 | 1 | 1,3 | − |
| Gradiente máximo (mmHg) | − | 6,8 | 10,85 | 4 | 7 | − |
| Gradiente medio (mmHg) | − | 3 | − | 3 | 4 | − |
| Área aórtica (cm2) | − | − | − | − | − | − |
| Insuficiencia aórtica | − | Leve | Leve | Leve | No | − |
| Válvula mitral | − | − | ||||
| Velocidad mitral E (m/s) | − | 0,94 | 0,76 | 0,8 | 0,72 | − |
| Velocidad mitral A (m/s) | − | 0,73 | 0,52 | − | 0,71 | − |
| Relación E/A | − | 1,2 | 1,4 | − | 1 | − |
| Gradiente máximo (mmHg) | − | 4 | 2,31 | − | 3 | − |
| Gradiente medio (mmHg) | − | − | − | − | − | − |
| Área mitral (cm2) | − | − | − | − | − | − |
| Insuficiencia mitral | − | Leve | No | Moderadab | Leve | − |
| AORE (cm2) | − | − | − | 0,23 | − | − |
| Válvula tricúspide | − | − | ||||
| Insuficiencia tricuspidea | − | Leve | Leve | Leve | Leve | − |
| Presión sistólica VD (mmHg) | − | 32 | 25 | 33,00 | 25 | − |
| Válvula pulmonar | − | − | ||||
| Insuficiencia pulmonar | − | Leve | No | No | No | − |
| Complicaciones | ||||||
| Hemotórax | − | − | − | 1 | − | − |
| Neumotórax | − | − | 1 | − | − | − |
| Quilotórax | − | 1 | − | − | 1 | − |
| Síndrome de Horner | − | 1 | − | − | − | − |
| Disfonía | − | 1 | − | − | − | − |
| Cefalea | − | − | − | − | 1 | − |
| Insuficiencia respiratoria aguda | − | − | − | − | − | 1 |
| Paro cardiorrespiratorio | − | 1 | − | − | − | 1 |
| Muerte | − | − | − | − | − | 1 |
| Estadía hospitalaria (días) | 6 | 11 | 12 | 38 | 14 | 5 |
| Tiempo en terapia intensiva (días) | 1 | 4 | 4 | 17 | 2 | 5 |
| Horas de ARM | 9 | 14 | 14 | 33 | 14 | 120 |
| Tiempo de seguimiento (meses) | 104 | 91 | 42 | 13 | 19 | 0 |
AAoD: aneurisma de aorta descendente; AI: aurícula izquierda; Ao: aorta; AORE: área de orificio regurgitante; AP: anteroposterior; ARM: asistencia respiratoria mecánica; ATC: angiotomografía; BAV 1°: bloqueo auriculoventricular de primer grado; BCRD: bloqueo completo de rama derecha; BIRI: bloqueo incompleto de rama izquierda; DDVI: diámetro diastólico del ventrículo izquierdo; ECG: electrocardiograma; FA: fibrilación auricular; LCR: líquido cefalorraquídeo; RMN: resonancia magnética; RS: ritmo sinusal; VAoB: válvula aórtica bicúspide; VD: ventrículo derecho; VI: ventrículo izquierdo.
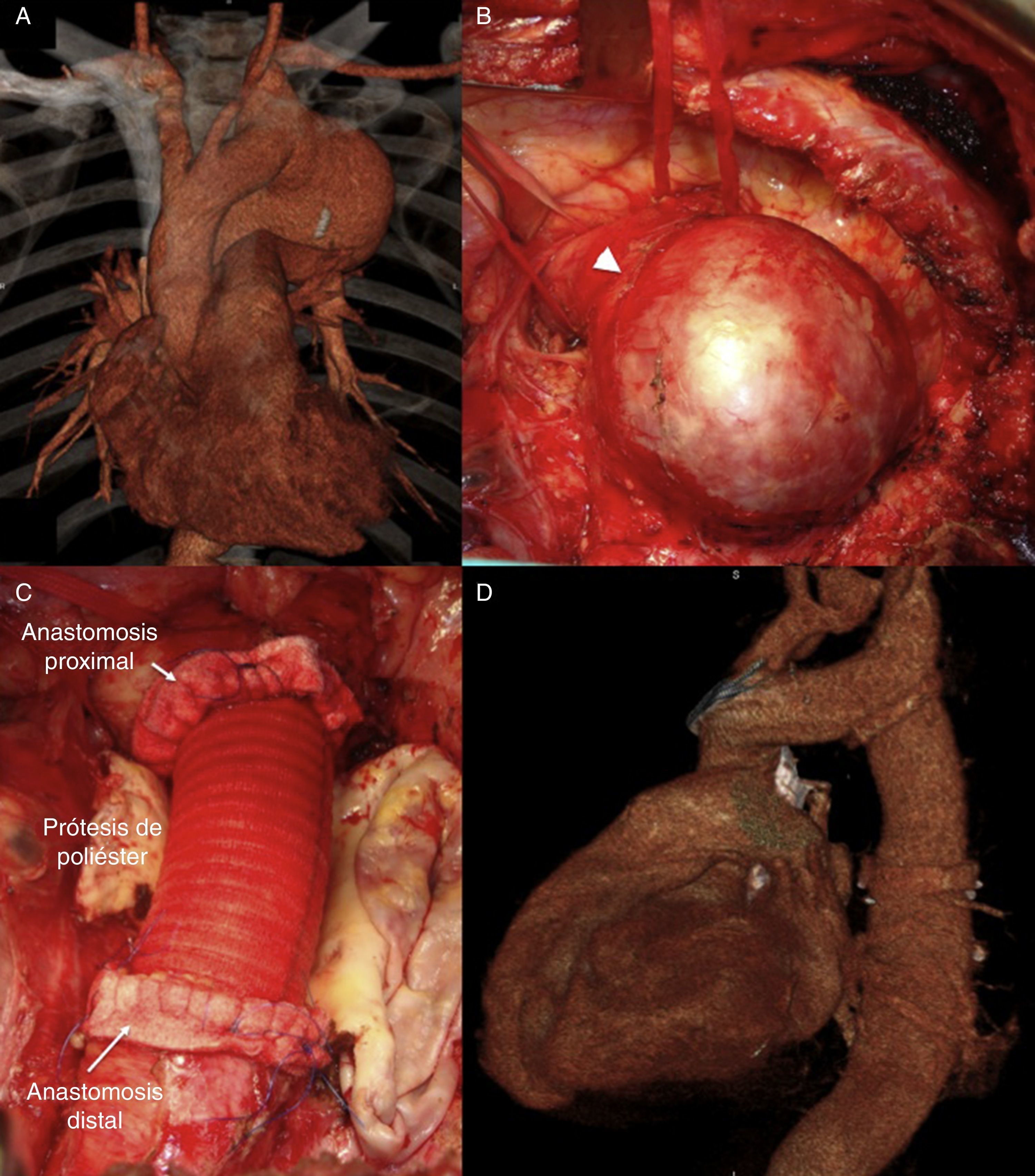
La estrategia quirúrgica se llevó a cabo por medio de toracotomía izquierda con resección de la quinta costilla y desfuncionalización del pulmón izquierdo. Se utilizó doble perfusión, anterógrada y retrógrada, con canulación femoral y aórtica en la mayoría de los casos; se realizó el reemplazo de la aorta torácica descendente con prótesis de poliéster trenzado recubierto de colágeno (PTRC) (tabla 1). En 3 pacientes se realizó drenaje continuo de líquido cefalorraquídeo (LCR) durante la cirugía y las primeras 72h del postoperatorio mediante el uso de un catéter intratecal de 18-gauge entre el segundo y tercer espacio intervertebral lumbar como método de protección espinal, con el fin de evitar la hipoperfusión medular como consecuencia de la hipertensión a nivel espinal producida por el pinzamiento aórtico; el catéter permite la monitorización de la presión del LCR (que se mantuvo entre 8 y 10mmHg), así como el drenaje pasivo del mismo.
ResultadosDe los 6 pacientes intervenidos, 4 (67%) eran varones y 2 (33%) mujeres. En cuanto a las edades, la edad máxima fue de 39años y la mínima de 24años, teniendo como promedio una edad de 34,3±5,1años. El tiempo promedio entre la cirugía de corrección en la infancia y la cirugía del AAoD fue de 26,2±4,9años. En cuanto a los antecedentes, el 33% (n=2) de los pacientes tenían hipertensión arterial y el 16,7% (n=1), fibrilación auricular. El 33% (n=2) de los pacientes se encontraban sintomáticos al momento del diagnóstico, uno con dolor interescapular y el otro con palpitaciones; los demás estaban asintomáticos y fueron diagnosticados por hallazgo en controles clínicos. El estudio diagnóstico inicial en los 6 pacientes fue la radiografía de tórax, en la cual se evidenció ensanchamiento del mediastino; posteriormente, se solicitó un estudio de mayor complejidad en cada uno de los pacientes (a 2 pacientes se les realizó resonancia magnética y a los 4 restantes una angiotomografía computarizada [ATC]). En todos los pacientes se diagnosticó AAoD con un diámetro transverso promedio de 78±8,2mm. Adicionalmente, como estudio prequirúrgico se realizó una ecocardiografía, en la cual 4 pacientes tenían válvula aórtica bicúspide (VAoB) con apertura conservada, uno con insuficiencia leve y uno con insuficiencia severa; aquel paciente que presentó insuficiencia aórtica severa se encontraba asintomático y además tenía función y diámetros ventriculares izquierdos conservados, y un diámetro máximo de la porción sinusal de la raíz de la aorta de 43mm, motivo por el cual se decidió un manejo expectante de la valvulopatía y dilatación de la raíz. Así también, un paciente (caso 4) presentó insuficiencia mitral moderada por dilatación del anillo y prolapso bivalvar secundario a miocardiopatía dilatada; este paciente se encontraba asintomático al momento de la cirugía y sin signos de insuficiencia cardiaca, y debido a esto se decide no intervenir sobre la válvula mitral y realizar solamente la cirugía del AAoD, con controles ecocardiográficos posteriores.
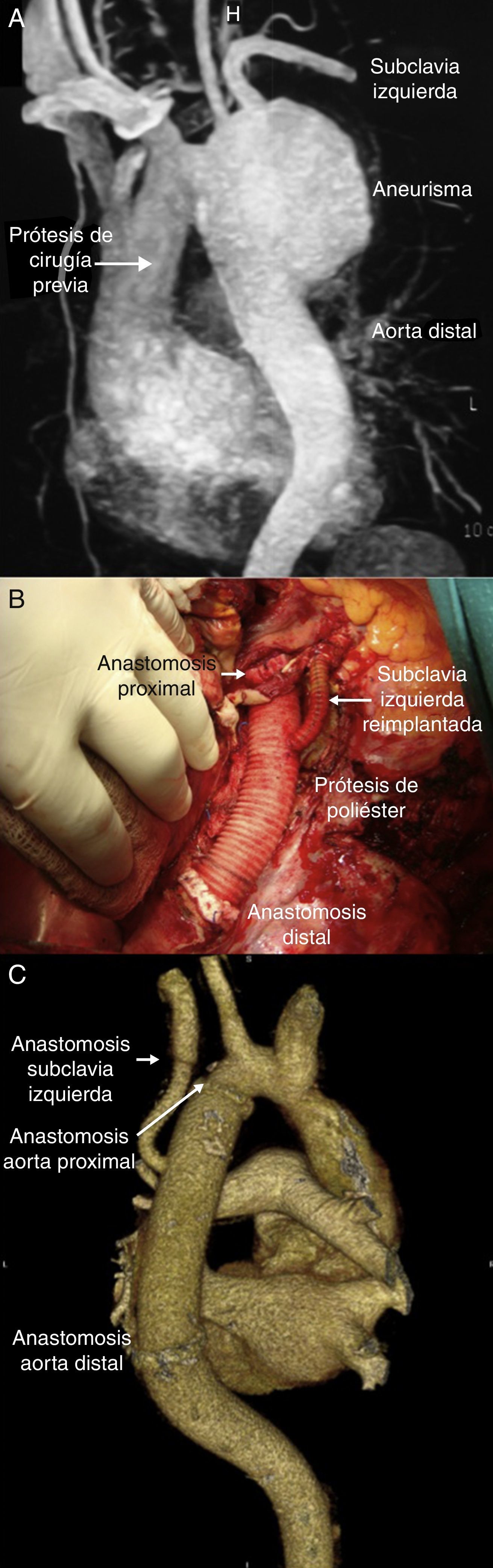
Un paciente del estudio (caso 5) presentó, además del AAoD, un aneurisma de la raíz de la aorta con una porción sinusal y unión sinotubular de 62mm de diámetro; inicialmente se planteó la idea de realizar una sola intervención en la cual se sustituyera la raíz de la aorta y simultáneamente realizar ligadura de la arteria subclavia izquierda y esqueletización de la carótida izquierda y tronco braquiocefálico, pero esta estrategia quirúrgica se descartó debido al grado de asimetría entre el diámetro proximal y distal del aneurisma y a la debilidad de los tejidos; además la cirugía antes mencionada implicaría un procedimiento de gran riesgo para el paciente debido a su larga duración, magnitud de la disección y cantidad estimada de sangrado. Como resultado final se decidió realizar la corrección de los aneurismas en 2 tiempos quirúrgicos: primero se resolvió el aneurisma de la raíz de la aorta con una cirugía de Tirone David y plástica de la VAoB (dando como resultado, a través de una ecocardiografía transesofágica intraoperatoria, una VAoB con apertura conservada y sin signos de insuficiencia, con coaptación valvar adecuada), y 3 meses después se realizó la corrección del AAoD mediante la técnica mencionada.
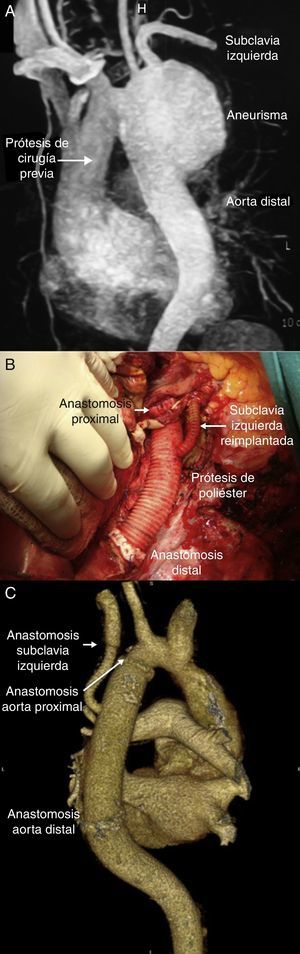
A los 6 pacientes se les realizó reemplazo de la aorta torácica descendente con prótesis de PTRC de un diámetro promedio de 22±2,8mm (InterGard® y Hemashield® del grupo Maquet, e InterVascular®), y en 2 de ellos se realizó el reimplante de la arteria subclavia izquierda con interposición de tubo de poliéster trenzado (InterVascular®) de 7 y 8mm de diámetro, respectivamente (figs. 1 y 2). En el 83% de los pacientes (n=5) se utilizaron dispositivos de circulación extracorpórea (CEC), y en un paciente se realizó mediante derivación auriculofemoral izquierda utilizando una centrífuga (Stockert®). De los pacientes tratados mediante CEC, 3 fueron con hipotermia profunda (13 a 19°C), y en uno de ellos se realizó parada circulatoria de 48min por rotura del aneurisma durante la disección. En cuanto a los tiempos quirúrgicos, se obtuvo una media de 438,3±43min del total de la cirugía; el tiempo de bomba promedio fue 129±29,4min, y la media del tiempo de pinzamiento aórtico, de 85,8min.
La estadía de los pacientes en el área de terapia intensiva fue de 5,5±5,3días, el tiempo medio de asistencia respiratoria mecánica fue de 34h (9 a 120h). La estadía hospitalaria promedio fue de 14,3±11días.
Como complicaciones menores en el postoperatorio se registraron: neumotórax (n=1), hemotórax organizado que requirió intervención por videotoracoscopia (n=1), quilotórax (n=2), un paciente presentó en el sexto día postoperatorio un cuadro clínico característico de síndrome de Horner (miosis y ptosis palpebral izquierda) y disfonía, y un caso de cefalea frontal luego del retiro del catéter de drenaje de LCR. Se registró un óbito al quinto día postoperatorio, posterior a presentar insuficiencia respiratoria aguda seguida de paro cardiorrespiratorio, por probable tromboembolismo pulmonar. El promedio de seguimiento de los pacientes fue de 44,8meses; actualmente los 5 pacientes continúan en seguimiento clínico e imagenológico sin complicaciones y asintomáticos.
DiscusiónLos aneurismas y pseudoaneurismas del sitio quirúrgico se presentan en el 1 al 9% de los pacientes, generalmente entre los 6 y 16años luego de la cirugía, independientemente de la técnica utilizada previamente (sea esta quirúrgica o endovascular, angioplastia con balón o stent)5,6. La técnica que más se ha relacionado con este tipo de complicación es la aortoplastia con parche sintético con una incidencia que varía entre el 6,5 y el 28%, descendiendo progresivamente con la aortoplastia con colgajo de subclavia izquierda (0 al 17%), la aortoplastia con tubo protésico (3 al 6%) y la anastomosis término-terminal (1,2 al 3%). Entre otros factores que se asocian a la aparición de estas complicaciones en el posquirúrgico se encuentran la presencia de VAoB7 (evidenciada en el 66,7% de los casos, n=4) y los defectos intrínsecos de la pared aórtica que esta enfermedad conlleva, tales como degeneración quística de la íntima y la apoptosis prematura de las células musculares lisas; todos estos cambios resultan en una mayor debilidad de la pared de la aorta, especialmente vulnerable en las líneas de sutura de cirugías previas5,8. Estos datos se correlacionan con el estudio histopatológico de las muestras enviadas al laboratorio de nuestra institución, donde se reporta una pérdida de fibras elásticas y depósitos intensos de material mucoide y áreas microquísticas en la túnica media de la aorta.
Varias teorías se han postulado para explicar la formación de aneurismas poscoartación. Entre ellas, la reacción inflamatoria crónica a la prótesis, cambios degenerativos de la pared aórtica por aterosclerosis temprana y el estrés parietal que el flujo turbulento y la hipertensión arterial producen5,6; en cuanto a los cambios en la pared de la aorta, como se mencionó anteriormente, los reportes de anatomía patológica de nuestros pacientes soportan la teoría, ya que en ellos se evidenció la presencia de lesiones ateromatosas intimales focales con centros lipídicos necróticos y calcificación.
Sin embargo, diferentes características anatómicas de los aneurismas indican mecanismos varios en su formación. Mientras que los pseudoaneurismas nacen de las líneas de sutura o de las reestenosis del istmo aórtico, los verdaderos aneurismas locales usualmente se forman en el extremo opuesto al parche del injerto6; en nuestra experiencia, vimos que el parche sintético de la aortoplastia formaba parte de la pared aneurismática y, aunque en menor magnitud, también se pudo observar cierta dilatación en la pared opuesta al parche, como cita la bibliografía.
Los factores de riesgo que se han reportado como predictores independientes de aparición de aneurismas del sitio quirúrgico en el seguimiento son: en primer lugar, la edad avanzada al momento de la cirugía correctiva de CAo (se ha identificado el punto de corte de 13,5años como límite por encima del cual el riesgo aumenta en forma exponencial), en segundo lugar la asociación con VAoB, y en tercer lugar la utilización de parche de sintético de poliéster trenzado en la corrección2,6,9,10.
La forma de presentación es variable. La mayoría de los casos son pacientes asintomáticos en los cuales el hallazgo de un aneurisma aórtico se realiza en forma incidental por medio de una imagen, como ocurrió en el 66,7% (n=4) de nuestra población; he aquí la importancia del seguimiento periódico de estos pacientes. Otra forma de presentación es el dolor torácico, presente en el 16,6% (n=1) de los pacientes, que puede ser tanto precordial como interescapular y de considerable intensidad; en este caso debe descartarse además otro tipo de complicación aórtica, como la rotura o disección. Menos frecuente, pero característica, es la presentación de síntomas respiratorios como disnea, debido a la compresión extrínseca de la vía aérea por la masa aneurismática, hemoptisis, neumonía, formación de fístulas aortobronquiales, o bien disfonía por compromiso del nervio laríngeo recurrente. La muerte súbita es otra rara forma de presentación, y se debe tanto a rotura aórtica o como consecuencia de la cardiopatía isquémica prematura ya comentada en este tipo de pacientes.
En cuanto al diagnóstico definitivo, este se realiza mediante imágenes de alta resolución; entre las más utilizadas se encuentra la angiorresonancia y la ATC multicorte, estudios que fueron utilizados en 2 y 4 de los pacientes, respectivamente.
Una vez diagnosticado el aneurisma (definido como diámetro de la dilatación mayor al 150% del diámetro de la aorta diafragmática) es obligada su resolución, ya que existe un alto índice de rotura y muerte dentro de los 15años de seguimiento8,11.
Las formas de resolución actualmente utilizadas son la cirugía convencional y el implante de endoprótesis por vía endovascular. Con respecto a la corrección endovascular, las series más recientes son la de Hörmann et al., con 4 pacientes, de los cuales ninguno presentó complicaciones graves, y la de Yazar et al., con 13 pacientes y el 7,7% de mortalidad9,12. Entre las complicaciones observadas en esta última serie se cuentan hemiplejía izquierda permanente, parálisis frénica, síndrome de Horner, trombosis venosa profunda, infarto agudo de miocardio y neumonía9, de las cuales solo el síndrome de Horner se presentó en un paciente estudiado en el presente trabajo. Se debió reintervenir al 23% de los pacientes por endofugas o acodamiento del stent. En el seguimiento a 3años, un paciente presentó neumonía recurrente por compresión extrínseca del aneurisma debido a un crecimiento excesivo por medio de una endofuga que derivó finalmente en necesidad de neumonectomía izquierda y aneurismectomía9.
La corrección de aneurismas y pseudoaneurismas post-CAo no es sencilla. Si bien se han reportado aceptables resultados con la resolución endovascular, esta no está exenta de complicaciones graves tales como endofugas (14,6%), complicaciones neurovasculares (4,2%), neumonía (2,1%) o muerte (2,1%); otro aspecto a tener en cuenta es la limitación técnica cuando no existen sitios de anclaje proximal para la endoprótesis por compromiso de los vasos supraaórticos, agregando además la escasa experiencia de los operadores por tratarse esto de una enfermedad poco frecuente. Es importante mencionar también que se desconoce la evolución a largo plazo de las endoprótesis implantadas por esta vía en este tipo de pacientes, generalmente jóvenes y cuya pared aórtica está enferma y débil. No existen datos concluyentes que demuestren una menor incidencia de isquemia medular con el implante de endoprótesis comparada con la cirugía abierta, de la misma manera que tampoco se han podido demostrar menores gastos, ya que si bien la resolución endovascular conlleva menos días de internación inicialmente, esto es contrarrestado con la necesidad de implantar más de una prótesis, más reintervenciones y la repetición de imágenes de alta resolución en el seguimiento13.
En cuanto a la corrección quirúrgica de los aneurismas poscirugía de coartación de aorta, la serie más grande publicada sobre este tema corresponde a Knyshov et al. en 1996, quienes reportan una experiencia de 48 casos de un total de 891 pacientes (5,1%) operados previamente de CAo entre 1960 y 1985 que evolucionaron con aneurisma de aorta en el sitio quirúrgico; se realizó la corrección quirúrgica a 30 pacientes, la mayoría mediante resección e implante de prótesis, obteniendo una mortalidad del 13,3% (n=4), con la salvedad que todos fueron operados en calidad de urgencia (3 por rotura aneurismática y uno por erosión hemorrágica del parche sobre el esófago). Con respecto a las complicaciones, la parálisis frénica o recurrencial se reporta con una incidencia del 6,6 y del 13,1% respectivamente, la cual concuerda parcialmente con los datos antes descritos (uno de nuestros pacientes [16,6%] presentó parálisis recurrencial con subsecuente disfonía). Además, los 18 pacientes que no fueron operados fallecieron en el seguimiento a 15años8.
Si bien el tratamiento quirúrgico es invasivo, estos pacientes suelen ser jóvenes, con escasas comorbilidades, y se cuenta con una resolución definitiva en la mayoría de los casos, comprobada en el seguimiento a largo plazo con más de 6décadas de experiencia.
ConclusionesLa incidencia de aneurismas poscoartación es poco frecuente. Sin embargo, estos pacientes deben tener un seguimiento médico de por vida para el diagnóstico oportuno de esta y otras complicaciones.
Una vez diagnosticada, su resolución es mandataria dado el alto riesgo de rotura en el seguimiento. La cirugía y las recientes técnicas de protección medular tienen similares resultados inmediatos de morbimortalidad que la resolución por vía endovascular. Teniendo en cuenta además que se trata en su mayoría de pacientes jóvenes y sin comorbilidades graves, sumado a que se desconoce la evolución a largo plazo de las endoprótesis, la resolución de este tipo de enfermedad debería ser siempre discutida en forma multidisciplinaria, teniendo en cuenta como primera opción la cirugía, reservando para casos seleccionados la resolución por vía endovascular.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.