This issue of Cirugía Cardiovascular contains a thoughtful overview entitled “Cirugía de restauración ventricular después del estudio STICH”, that includes a careful and comprehensive background analysis of their aptly termed “anatomo-physio-pathological fundamentals of cardiac insufficiency” from dilated hearts that become spherical as they remodel away from their normal elliptical or conical shape1. The authors define past and novel procedures that summarize results from worldwide registry trials that confirm the value of ventricular volume reduction accomplished by a surgical procedure that offsets this volume surrogate for mortality in dilated hearts, they address how and why the STICH trial contradicts this sound biological principle of surgically reducing left ventricular (LV) volume management2, and finally they introduce plans to develop a Latin American Registry, whose objective is to expand the basic science and clinical importance of restoring the conical shape to the failing LV chamber that is dilated and spherical.
Cardiac performance is linked to the form/function relationship whereby “anatomy is destiny”. Disturbances in normal form lead to a spectrum of changes in this relationship, and become accompanied by cardiac insufficiency that is due to disruption of normal cellular processes. The broadness of the authors’ vision is established in their first paragraph, where they state that despite alterations of molecular, neuro-hormonal, and genetic processes, the underlying factor remains the changes in volume and geometry (shape) of the left ventricle. Their “complexity of remodeling” statement may reflect the progressive end result (or shrapnel) created by exploding normality when the conical chamber becomes spherical from ischemic, valvular, or non-ischemic disease.
My thought is that elegance is simplicity, and complexity is confusion. This theme was shown in physics by Einstein with E=mc2 and Newton where force=mass x acceleration. I believe it also exists in medicine, where closed arteries need to be opened (by surgical or angioplasty methods) and spherical chambers must be made conical to return them to nature. Others may think my reality only reflects surgical simplicity.
The unifying role of increased volume as the surrogate to cardiac insufficiency in dilated hearts is firmly established for ischemic and valvular disease3,4. The authors have provided a superb infrastructure and focused reference lists to address each item mentioned above, yet I suspect the reader’s first question is linked to asking why the title includes the terms “post STICH Era”. Some historical perspective helps in finding an answer. Hippocrates analyzed the natural history of disease without intervention, and made these observations without need for a statistician. Current natural history studies confirm the adverse effects of ventricular stretch in the dilated heart in each of these categories, but we now introduce interventions aimed at changing this time course and must interact with statisticians to determine if we have found “evidence-based medicine reasons” to change management. The bottom line is that statisticians count and surgeons cut and both must do it properly. Valid conclusions only happen when creditable data is submitted for analysis. This “post STICH era” manuscript asks this question by stating “surgical experience could have been critical on results”, thereby providing an observation that reaffirms the central theme of our surgical discipline.
The STICH trial was originally developed to harness this information in a prospective randomized trial rather than a registry, and concluded that surgical ventricular restoration (SVR) does not need to be added to coronary artery bypass grafting (CABG) in patients with ischemic dilated cardiomyopathy2. The reporting of this conclusion in the New England Journal of Medicine (NEJM), a major scientific journal, has led to a conclusion by the cardiology community that volume reduction is not essential in ischemic patients with dilated hearts, and thereby establishes “the post STICH era” cited in this paper’s title. The validity of this conclusion about ventricular restoration is linked to three possibilities that include first, did evidence-based medicine provide “creditable” results? Second, is SVR concept improper? And third, are trial results improper? The answers to these questions determine the fate of treating heart failure by SVR in dilated hearts. If the trial results were not creditable, then the decision to abandon SVR after ischemic cardiomyopathy has absolutely had no relationship to linking this conclusion to publication of a flawed report in a renowned journal, or justifying it because the National Institutes of Health (NIH) supported a non-creditable report.
The post-ischemic ventricle develops dilated cardiomyopathy, but it is only one of several causes of this process. Sphericity of the dilated ventricle is a unifying concept that applies to ischemic disease because the remote muscle stretches after loss of the area of infarction, to valve disease with left- or right-sided insufficiency of the inflow (mitral or tricuspid) or outflow (aortic or pulmonary) valves, or to ventricular myocyte damage in idiopathic cardiomyopathy. Following comments about the STICH trial, my discussion initiates with this global approach because it is my conviction that ventricular restoration surgery will become the centerpiece of the evolution of cardiac surgery. The invalid conclusions of the STICH trial simply reflect a delaying step in our specialty’s effort to embark on this pathway.
Stich and its role in ventricular restorationThis report will begin with an analysis of the limitations of the STICH trial because interest in ventricular restoration surgery is futile if the report results are considered valid. Satisfying entry criteria is an essential component, and the STICH trail required LV end systolic volume index (LVESVI) of 60ml/m2 by cardiac magnetic resonance imaging (CMR) and necrosis of 35% of the LV anterior lateral wall5. Neither of these criteria was used, and 13% of patients had no history of infarction, implying SVR was used in hibernating hearts and thus departs from any known indication for this procedure for LV rebuilding. The STICH recommendations to use CABG without SVR were reached after measuring volume in only 161/490 patients by echocardiogram (that underestimates volume6), and more importantly introduced a conclusion that contradicts registry data showing benefits of SVR in 7,000 patients worldwide (where volume is accurately measured5). STICH reduced LV volume by 19% in patients where it was measured, and these findings contrast to ~ 40% reduction in>1,600 patients reported worldwide; some of these values are shown in figure 2 in the paper by Herreros, et al.1. The STICH ventricular restoration procedure target endpoint differs from worldwide reports; did their procedure provide only small LV plication or limited cavity rebuilding?
Two aspects may account for their achieving a limited rebuilding endpoint. The first relates to prior experience with surgically addressing the anatomy of the ventricular target region. The second addresses the STICH trial responsibility to validate proper surgical experience before including participation by inexperienced centers. In current practice, most patients have undergone prior revascularization by thrombolysis, percutaneous angioplasty, or coronary grafting so that the ventricular target in ischemic dilated cardiomyopathy has changed from dyskinesia (or aneurysm) to akinesia. Consequently, the ventricular surface is not scarred, the muscle is thick as the scar occupies the inner half to two thirds of ventricular wall, and the damaged region does not collapse with venting. This new rebuilding target differs from the aneurysm that existed before reperfusion, and thereby requires learning of novel management approaches which are relatively easy to acquire.
The Surgical Therapy Committee entry criteria for an adequate SVR included demonstration by each surgeon that rebuilding resulted in at least 30% volume reduction by CMR at four months. Submission of patients for trial analysis could not be done without meeting this specification. Despite this background, the 490 STICH patients were selected from 110 worldwide centers (~ 4 cases/center) where surgeons had to accomplish a somewhat new procedure; there is no evidence that these critical guidelines were validated before accepting SVR results for statistical analysis. Consequently, the report comment “surgical experience could have been critical on results” is a critical and important question.
The only patients who can be considered for “acceptable SVR” were patients where LVESVI was reduced by 30% by CMR, yet separation of patients into this group was not analyzed in the NEJM report. This identical question relating to a cohort undergoing an acceptable SVR procedure was asked by me when STICH outcomes were debated at American Association of Thoracic Surgery in 20095. The STICH authors only partially answered this question at the 2010 American College of Cardiology (ACC) meeting, and then employed this analysis to arrive at the same abandon SVR conclusion as was made in the NEJM publication. This 2010 ACC analysis now includes results before and four months after LV restoration in 275/490 CABG and SVR patients, whose volume was measured by echo but not by CMR. Within this group, 69/275 patients had pre-SVR LVESVI<60/ml2, thereby representing 25% of patients who should have been excluded from the STICH trial because LV volume was too small for restoration. Moreover, the patient number with>35% entry criteria ejection fraction was not described, so that determination could not be made if other trial participants did not fulfill proper entry criteria.
Acceptable SVR entry LVESVI was achieved in the range 60-90ml/m2 in 89/275 patients and>90ml/m2 in 117/275 patients, but the required>30% LVESVI reduction was achieved in only 38 and 44%, respectively, within this cohort. Consequently, the 2010 STICH report showed only 41% of studied patients had undergone an acceptable SVR procedure that conformed to Surgical Therapy Committee guidelines. Moreover, 225/490 patients or 46% of the CABG and SVR patients underwent left ventricular restoration without any knowledge of LV volume before and after the procedure. The STICH trial conclusions about SVR were then made upon the median value of all studied patients (205/490) that entered the trial with LVESVI>60ml/m2. This analysis included (i) only 41% of patients with acceptable SVR where>30% LVESVI reduction was achieved, and (ii) simultaneously included 51% (120/205) of patients who underwent an inadequate procedure.
This report provided no information about the remainder of the patients (220/490) where volume was not measured postoperatively. These updated findings amplify my prior conclusions that the STICH trial efforts toward “evidence-based medicine information” became foiled by non-creditable results5. Moreover, providing any SVR clinical conclusion that is based upon a median value which includes 51% of patients with an inadequate procedure implies that “statisticians defied Nature from an inadequate database”.
Post stich era casualtiesThe first casualty of this report is the enormous heart failure population with dilated hearts that occupy more than half of the congestive heart failure (CHF) population, with the remainder showing diastolic dysfunction and normal systolic performance7. Misguided conclusions in ischemic dilated cardiomyopathy patients hamper proper treatment decisions, since evaluation of necrosis and accurate volume measurement is essential to permit selection of hearts whose prognosis may be improved after restoration reduces their volume>30% below preoperative levels.
The second issue relates to the evolution of novel cardiac surgical approaches as well as potential funding of surgical trials. The structure function relationship prevails in cardiac surgery, and I believe surgical ventricular restoration reflects a new but currently unrealized surgical goal. Geometrically reducing ventricular volume will become a unifying approach for treatment of ischemic, valvular, and non-ischemic causes of dilated cardiomyopathy. Misconceptions from the STICH trial will delay evolution of this next large step in our specialty’s development of broad new surgical treatment objectives. Moreover, the concept of a left ventricular assist device (LVAD) as a “bridge to transplantation” and development of permanent assist devices may become overshadowed by employing LVAD as a “bridge to restoration”. Restoration may also become the surgical creation of a scaffold that permits the eventual marriage of our macroscopic approach with cell therapy. Finally, subsequent funding of surgical trials will likely be impeded by the serious flaws in the STICH report, so that future government interest in funding another surgical trial becomes impaired.
The third casualty is scientific integrity since this report delays evolution of requesting that our cardiolo-gist colleagues should measure volume rather than ejection fraction as the natural surrogate for development of adverse clinical findings in dilated hearts. This problem is keynoted by a recent experience; seven years were spent toward seeking the collaboration with a prominent CHF cardiologist to become primary author and submit a joint manuscript to a major medical journal that focuses upon measuring volume in CHF patients rather than conventional ejection fraction. The paper was initially revised and then was subsequently immediately rejected based upon NEJM STICH results showing volume is not critical. The potential open ear to progress gets closed when inaccurate findings cloud the truth.
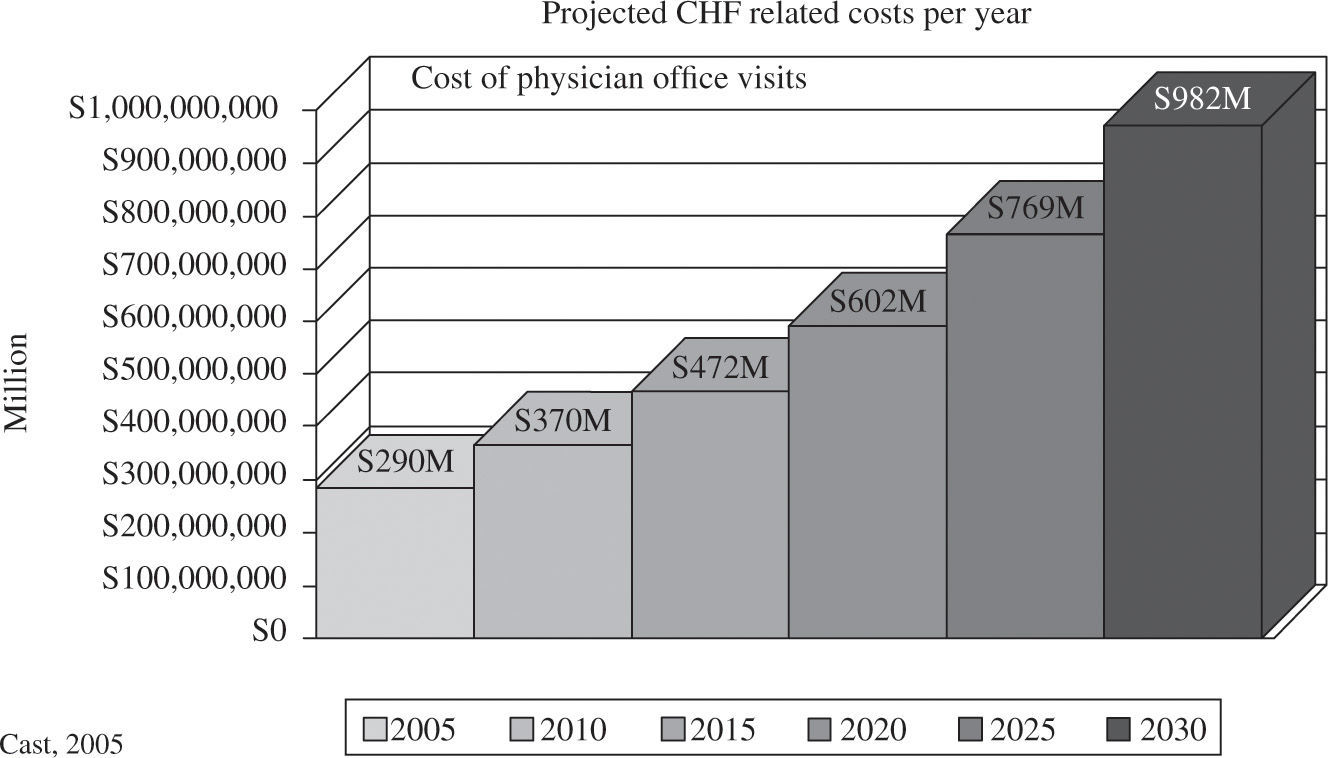
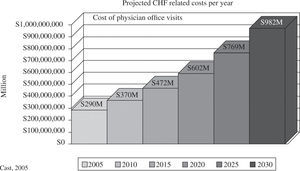
The fourth casualty is healthcare costs, as expectations are that expenses for CHF treatment may exceed $1 trillion/year in 2030 (Fig. 1)8 as we manage the symptoms, rather than change the spherical structure towards its normal conical form. Congestive heart failure will this cause healthcare bankruptcy, but correction of this deficiency is possible with three components. The first involves changing the energy source by restoring the native heart rather than relying only upon assist devices and transplantation. The second is innovation that simply alters traditional thinking toward recognizing the importance of measuring ventricular volume and understanding how to alter it surgically. The final component is education, which requires development of programs to teach these two straightforward skills.
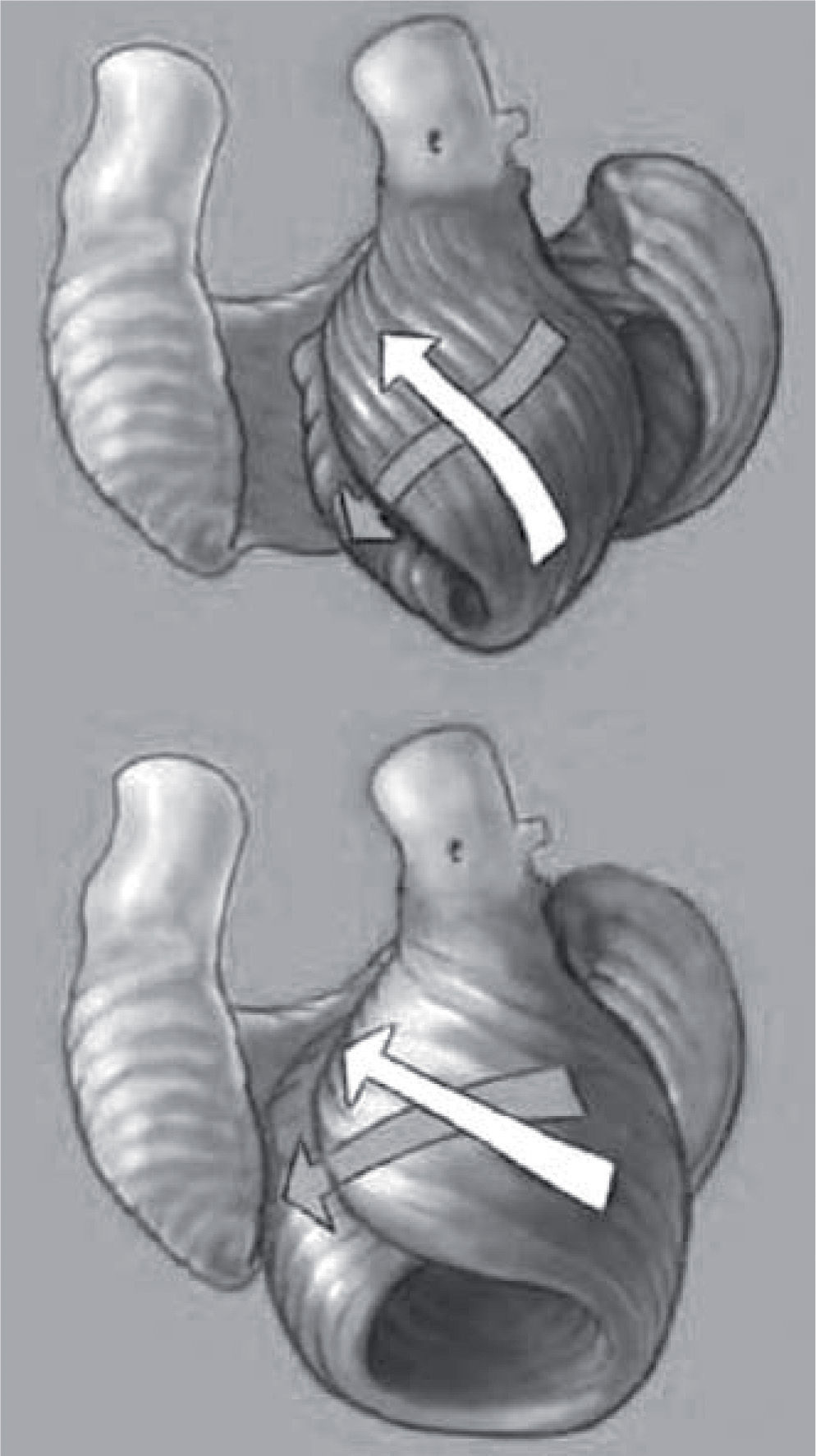
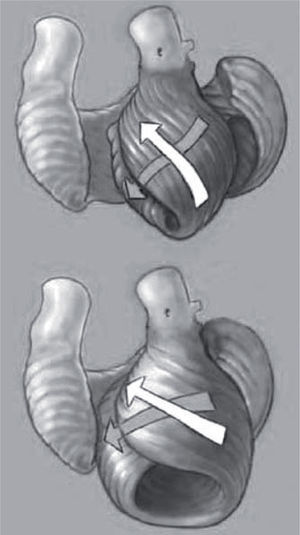
Anatomy is destinyMyocardial performance is closely linked to cardiac fiber orientation, and the normal conical heart has both oblique helical fibers that Torrent-Guasp, et al. call the helical fibers of the apical loop (containing inner descending and outer ascending fibers to conform to the left and right arms of the helix), and circumferential circular or horizontal fibers called the basal loop9,10. Their fiber orientation pathways determine function, as shown by Sallin who demonstrated that ejection fraction is 60% when the normal helical fibers contract, and falls to 30% if transverse fibers shorten11. The development of a spherical configuration will change the orientation of the helical fibers toward a more transverse position (Fig. 2), and thus diminish contractile force in a manner that is independent of an accompanying disease entity. Certainly, further impairment will develop if the fibers are lost by underlying ischemia, or by non-ischemic myocyte disease, or become damaged by stretching in valve disease, where collagen framework is lost and fibers lengthen and thicken.
Ventricular shape. The changes between the normal elliptic left ventricle (above), containing an apex, and the dilated spheric heart (below) where apex is globally stretched, are compared to show differences in the underlying circumferential and helical loops that comprise ventricular architecture. Note the circumferential loop has transverse fibers similar in both shapes. The inner helical loop changes from a normal oblique configuration (shown by arrows at ~ 60° angulation) that enhances contractile force, to a more transverse configuration (shown by more horizontal arrows) as the dilated chamber stretches to cause fiber orientation changes that diminish contractile force.
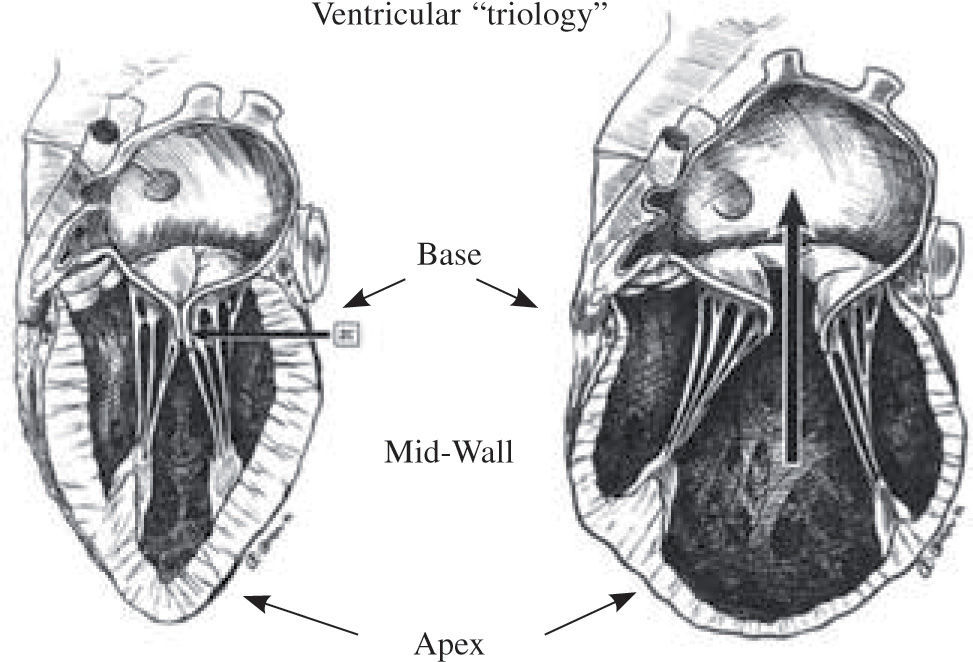
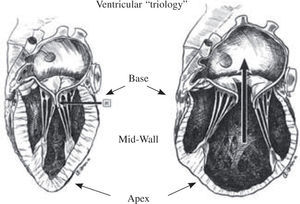
The concept of LV restoration is to rebuild the chamber into its normal anatomic elliptical or conical position, and thereby change the stretched, more transverse fibers back into their oblique natural helical pathways. The term “pacopexy” procedure was introduced several years ago12 to pay tribute to Torrent-Guasp’s legendary contribution, as the goal was to rebuild anatomy towards normal. This three-dimensional view of fiber orientation is spatially helpful in understanding cardiac configuration, but there is also a two-dimensional element that must be considered. The normal LV chamber contains a “ventricular trilogy” composed of the conical apex, mid-wall or equatorial plane, and base (Fig. 3)13. Each of these components is changed when the conical heart becomes spherical, and each of them must be kept in mind during restoration. With a dilated chamber, the apex is lost as it comes circular, the mid-wall stretches to alter the sphericity index toward reducing the normal longitudinal length:width ratio from 2:1 to 1:1, and the base stretches to structurally change the coaptation position of the mitral leaflets. This alteration expands development of functional mitral regurgitation beyond that caused by tethering of the leaflets due to ventricular stretch, and widening of the papillary muscle bases to alter natural leaflet angulation between annulus and LV wall.
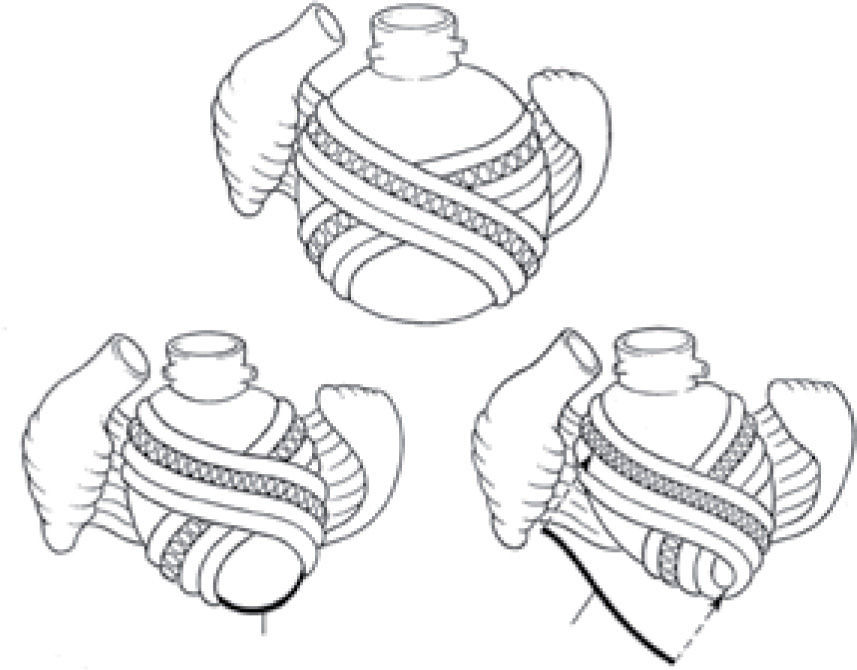
Fiber orientation in dilated spherical ventricle (above), whereby the “coils within coils” fiber orientation is more transverse: this configuration impairs function. Anticipated changes in fiber orientation following surgical ventricular restoration are shown below. A spherical form may persist by placing the patch in a flatter (lower left), rather than oblique direction (lower right). The treatment of “form versus disease” is accomplished by rebuilding this normal oblique configuration of the cardiac helix, and the solid line (lower right) reflects the oblique angulation of the surgical closure that rebuilds the natural ellipse. This left ventricular oblique reconfiguration may be accomplished with sutures or a patch, but the upper placement site within the septum just below the aortic valve annulus often contains normal muscle.
The surgical strategy must also consider each of these “ventricular trilogy” factors because late results after surgical ventricular restoration are closely linked to achievement of this goal. The recent report by Pocar, et al.14 has shown that ventricular geometry (sphericity) and mitral regurgitation (MR) impact prognosis and why the decision making process during surgical management in dilated CHF patients is principally determined by how these two prognosis-related factors are managed by the decisions made13. Consequently, aside from traditional evaluation of ejection fraction and LV end systolic and end diastolic volume indices, measurements must be made of mid-wall width (LV end diastolic dimension), widening of the bases of the papillary muscles and mitral valve annulus at the base, since decisions about the surgical goals will consider each of these during planning the procedure aimed at rebuilding more normal anatomic size and shape.
Size and ShapeVentricular volume is the surrogate for mortality in dilated cardiomyopathy15, and was considered in the STICH trial objectives. However, restoring the more normal conical ventricular shape becomes another important consideration. Dor, et al. have made a monumental contribution by focusing our attention on excluding the scar in ischemic cardiomyopathy16, but focusing the procedure only upon excluding the scar in very dilated chambers will sometimes leave a widened mid-wall with increased sphericity17. Rebuilding a more conical chamber is thereby only possible if the restoration approach creates a more conical geometry by aiming at a higher point on the septum, and this region will not contain scar. The adverse consequences of leaving a more spherical chamber and a higher LVESVI were recently addressed in reports by Ferrazzi, et al. who demonstrated higher mortality if LV end diastolic diameter was>70mm17 and Di Donato, et al.18 who followed Dor patients and found late mortality worsened if LVESVI was>60ml/m2. Reconstruction of shape was introduced by Guilmet, et al. in 198419, and Suma20 and Isomura, et al.21 applied a pacopexy type procedure that was called septal anterior ventricular exclusion (SAVE). Recent studies show such shape procedures have achieved better long-term results when outcomes were compared with Dor’s endo-ventricular circular patch plasty13.
The authors address ventricular shape in three ways in the current manuscript. First, they suggest using a mannequin to create an apex and prevent excessive narrowing of the LV chamber, which reflects an extension of Dor’s technique of using an intra-ventricular balloon to avoid compromising the ventricular lumen. This method is extensively emphasized with surprising company recognition in this paper, yet it was not used in the RESTORE database that achieved results similar to those obtained by its use in Istituto Policlinico San Do-nato in Milan. These favorable results may be related to the fact that larger chambers are less likely to become compromised by the restoration without an intra-ventricular sizing device. Diastolic dysfunction in them, as in many SVR patients with or without a sizing device, may relate problems in myocardial protection that causes stunning of endocardium that comprises the descending segment of the helical ventricular myocardial band22, since this part of the inner shell occupies the septum and lateral wall so that its stunning will result in both septum injury and associated diastolic dysfunction10,22.
The innovative procedure for mitral replacement in dilated cardiomyopathy described by Buffolo, et al.23 and Miki, et al.24 alters ventricular shape toward normal by approximating the papillary muscles to the mitral annulus. Repositioning of the elliptical form and reduced sphericity index results as the longitudinal axis becomes diminished as the postero-medial and anterior lateral muscles are brought toward the annulus when the stretched leaflets are excluded. The diseased septum is not addressed in ischemic cardiomyopathy by this procedure, and subsequent reports will likely address its capacity to supplement other forms of ventricular restoration.
The third method described by Buffolo and his group25 and Trainini, et al.26 that creates a more conical or elliptical ventricular shape is termed a type of “pacopexy” procedure, with the proper goal of restoring the helical configuration with an apical vortex. Only muscle is used and the approach thus differs from the original pacopexy procedure suggested in 200112 and subsequently performed as the SAVE procedure by Suma20, but it mirrors the muscular procedure described by Matsui, et al.27. The central theme is to rebuild the helical form, but the roles of approximating the ascending and descending segments of the myocardial band is a bit misleading. The same anatomy is accomplished with or without a thin long patch because the problem is not with the bringing of one segment over the other by a suture line. Rather, it is the construction of a conical form that rebuilds shape by restoring the oblique pathway of the helical fibers that were made more transverse when the chamber became spherical (Fig. 4). Consequently, reforming the helical configuration with either a thin patch or employing direct muscle attachment interposes an essentially common method. While rebuilding the ellipse restores the correct shape, attention must also be directed toward the cardiac base since it forms part of the “ventricular trilogy”; a narrower dimension is required to permit proper leaflet coaptation and limit mitral regurgitation. Consequently, attention toward narrowing the widened base by either annuloplasty or mitral valve replacement may complete the desired goal of reconstructing the conical form containing the proper dimension of base, mid-wall, and apical structures that are needed in the form/function relationship.
Changes in “ventricular trilogy” whereby dilation varies ventricular geometry by making the apex circular, widening of the mid-wall that joins with the circular apex to cause tethering on the mitral valve apparatus, and widening of the base, so that the point of coaptation of mitral leaflets is adversely altered.
The seminal observations of Vincent Dor became the yardstick of our growth toward innovating techniques that may avert further remodeling in ischemic cardiomyopathy. His endo-ventricular circular patch plasty (EVCPP) method achieved the vital endpoint of excluding the scar16. Several reports document that the Dor procedure leaves a less elliptical chamber than has been reported when shape or form became the surgical goal21,28-30. The scar in ischemic disease has always been the focal point, yet this region is fixed after the infarction. Progressive dilation stretches the remote region and thus widens the mid-wall or equatorial diameter, so that procedures aimed at excluding only the disease will leave a larger chamber that has been shown to have a more limited prognosis than exists when the left ventricular end-systolic volume index is reduced to a greater extent18. Ferrazzi, et al.17 and Di Donato, et al.18 reported adverse effects when SVR procedures maintain the wider mid-wall that defines the higher end-systolic volume index (ESVI) or raised equatorial dimension markers.
These observations open the door toward the development and enactment of concepts that focus upon form rather than disease. For example, achievement of a more conical chamber after anterior infarction requires elliptical shape reconstruction guidelines that (i) creates an apex and (ii) narrows the mid-wall by placing either direct sutures or a patch beyond the scar-related endpoint; they select form rather than disease as the surgical goal (Fig. 4). The third ventricular trilogy component of basal width must also be addressed, as previously discussed regarding mitral valve interventions.
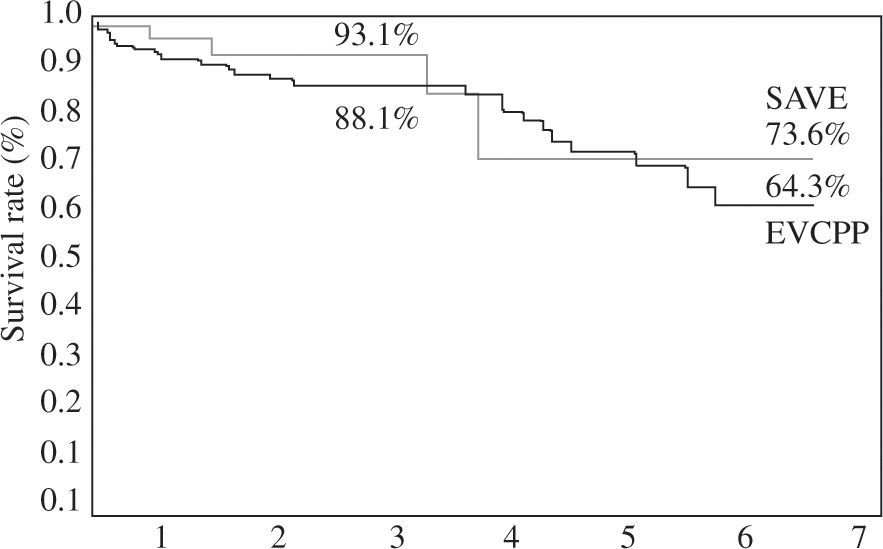
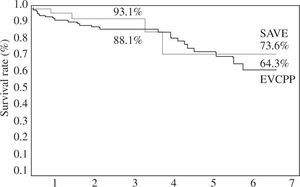
Toward this end, Isomura, et al. recently compared the Dor procedure with the surgical anterior ventricular exclusion (SAVE) or pacopexy procedure21 in dilated ischemic cardiomyopathy, and reported this form-related surgical approach improved eight-year survival in a presentation to the Japanese Surgical Society 2009 (Fig. 5). A fundamental change in concept follows this observation, as sutures to form the ellipse must now deal with normal or non-scarred muscle within the high septum just below the aortic valve. Natural opposition follows this conceptual change, but the limitations of leaving a bigger chamber must be consistently recognized18, and then offset with the data showing the advantages of a more conical shape13,21. This architectural goal is achieved by using either a patch or direct sutures to create the conical chamber whose suture line becomes a “curtain” within the LV that forms the more elliptical or conically shaped chamber. The apex and mid-wall elements become rearranged so that a more normal sphericity index that aims toward a 0.5 ratio is achieved.
Long-term survival after employing endo-ventricular circular patch plasty (EVCPP) (n=98) as described by Dor, or surgical anterior septal exclusion (SAVE) (n=75) as described by Suma. Image used with permission of Tadashi Isomura from upcoming manuscript in preparation. Note improved eight-year survival following SAVE procedure.
Addressing the concept of form rather than disease has wider application in dilated hearts without scar, since repairing only the valve in patients with dilated heart disease after aortic and mitral regurgitation does not offset the complications related to progression toward worsening CHF and development fatal arrhythmia if the ESVI is 55ml/m2 or greater 31,32. The entire LV wall is normal in these patients, and I suspect that construction of a conical chamber by placing a thin patch between the apex and sub-aortic septum will become a future option in valvular disease. This approach has been used by Suma in non-ischemic disease, where the pacopexy or SAVE procedure shows ~7 0% five-year survival and New York Heart Association (NYHA) grade I/II functional performance in the septum is the major site of malfunction33,34. Moreover, an earlier study by Batista, et al. showed that excluding the lateral wall in patients with valvular heart disease improved prognosis35.
The central theme is thus related to restoration of an elliptical chamber, coupled with simultaneously addressing the widened base, and the goals are achieved by employing rebuilding methods that use non-scarred muscle to achieve the correct ventricular form30,34. The conical geometric objective may thereby become a unifying goal in developing SVR for ischemic and non-ischemic cardiomyopathy procedures that include valve disease. This management format does not disregard the disease, since the scar is excluded, the abnormal valve is made competent, and the predominant non-ischemic region is excluded, but form is simultaneously changed to restore more normal size and shape in a manner that uses normal muscle to achieve the correct form.
Latin american registry of surgery for ventricular restorationDevelopment of a collaborative team that combines the talent of surgical, medical, and basic science contributors will offer new insights into this process in their distribution to the recipients of their output. This team is similar to the RESTORE team that aimed at a similar goal several years ago, and is now fortunate enough to draw upon the broad experience of its leaders who are at the forefront of understanding and managing CHF. As they accumulate data from many sources, they should learn from the flaws of the STICH trial and thus ensure that each of the participating centers has demonstrable competence in doing left ventricular surgical restoration. The status of the post STICH era is that non-creditable data has sadly retarded the development in understanding the geometric reasons for cardiac failure in the dilated heart, as well as simultaneous global interest in the innovative procedures to treat this process, which reflect our next step in evolution of novel surgical approaches. I hope that these mistakes will not be repeated.
Conclusions: Macroscopic versus microscopic approachesThe initiation of this manuscript on ventricular restoration in the post STICH era defined the challenge of the future in cardiac surgery by outlining the enormous population worldwide suffering with congestive heart failure that stems from ischemic and non-ischemic origin. Moreover, they define that the change of the normal elliptical or conical chamber to a spherical form is the simple reason for cardiac insufficiency. Recognition of our treatment limitations is the vital first step into innovation and evolution, and the authors have taken this route. Unfortunately, the medical and surgical world is still struggling to come to grips with the failure of current approaches, and only treat the underlying cause of ventricular stretch (i.e. ischemia or valve disease), pursue the aftermath (i.e. molecular, neuro-humoral, and genetic factors), but collectively fail to address the underlying process.
The ongoing inability of the spectrum of drugs like beta blockers, ACE inhibitors, and spirolactone to initiate long-term alleviation of this process in the medical world is matched in the surgical community by our ongoing approaches to treat the closed vessels, or fix the leaky valve from an intrinsic or dilated heart disease. The mainstream of both disciplines simultaneously steers clear of focusing upon the dilated ventricle, which is often not materially helped by remedying only its underlying cause of stretch.
The RESTORE team established a motto by saying we address the “triple V”, or the vessel, valve, and ventricle. Despite this early effort, left ventricular restoration remains in its infancy, as evidenced by the STICH trial that needed 110 centers to harvest 490 patients. The trial’s flawed results dampen evolution of the required next step by presenting non-creditable data. Our limitation is “protection of yesterday”, and thereby taking a microscopic approach to the multiple causes of a unifying and macroscopic cardiac problem of the dilated ventricle. Innovation requires that both the medical and surgical communities begin to appreciate the established limitations of focusing only upon the underlying cause, and turn toward recognizing that fixing the disastrous secondary problem of the stretched dilated ventricle by use of the patient’s native tissue will become the novel arena for future management.
The manuscript I have had the chance to review has provided a thoughtful, comprehensive, and creative approach to this process. Words do not mean action, and hopefully the Latin American community can draw together to provide leadership, since the medical and surgical worlds in the United States, Europe, and Asia are still in the incubator in addressing this essential change in our attitudes. Truth will always win, and the readily achievable task of macroscopically rebuilding a more conical form which reconstructs the helical ventricular myocardial band so beautifully shown to us by Francisco Torrent-Guasp will create our surgical future.
Este número de Cirugía Cardiovascular incluye una amplia revisión titulada «Cirugía de restauración ventricular después del estudio STICH», con un análisis cuidadoso de lo que sus autores denominan «fundamentos anatomofisiopatológicos de la insuficiencia cardíaca» en corazones dilatados que se vuelven esféricos, lejos de su forma normal elíptica o cónica1. Los autores definen procedimientos antiguos y modernos que resumen resultados de diversos registros que confirman el valor de la reducción ventricular a través de un procedimiento que subroga el volumen por la mortalidad en corazones dilatados, comentan cómo y por qué el estudio STICH contradice este principio biológico de la reducción de volumen ventricular izquierdo (VI)2, y finalmente introduce planes para el desarrollo de un Registro Latinoamericano cuyo objetivo es expandir la ciencia básica y la importancia clínica de restaurar la forma cónica al VI en fallo.
La función cardíaca está ligada a la relación forma/ función donde «anatomía es destino». Las alteraciones de la forma normal conducen a cambios en esta relación y se acompañan de insuficiencia cardíaca debida a las de los procesos celulares normales. La amplitud de miras de los autores se establece en el primer párrafo, donde mencionan que a pesar de las alteraciones del proceso molecular, neurohormonal y genético, el factor subyacente sigue siendo el cambio volumétrico y geométrico del VI. Su «complejidad del remodelado» puede reflejar el resultado final creado al alterar la normalidad cuando una cámara cónica se vuelve esférica por enfermedad isquémica, valvular o no isquémica.
Mi opinión es que elegancia es sencillez y complejidad, confusión. Esto se demostró en física por Einstein con su E=mc2, y con Newton con fuerza=masa × aceleración. También creo que existe en medicina, donde las arterias ocluidas necesitan ser abiertas (por métodos quirúrgicos o por dilatación) y las cámaras esféricas deben volverse cónicas para retornarlas a la naturaleza. Otros pueden pensar que mi realidad sólo refleja simpleza quirúrgica.
El papel unificador del aumento de volumen en la insuficiencia cardíaca en corazones dilatados está firmemente establecido en la enfermedad isquémica y valvular3,4. Los autores proporcionan una soberbia infraestructura y una amplia lista de referencias para cada punto de discusión, de modo que sospecho que la primera pregunta del lector estaría ligada al por qué el título incluye el término «después del STICH». La perspectiva histórica ayuda a encontrar la respuesta. Hipócrates analizó la historia natural de la enfermedad sin intervención e hizo sus observaciones sin un estadístico. Los estudios actuales de la historia natural confirman los efectos adversos del estiramiento ventricular en el corazón dilatado, pero ahora introducimos intervenciones que intentan cambiar este curso y debemos interactuar con los estadísticos para determinar si encontramos «razones de medicina basada en la evidencia» para cambiar el manejo. El mensaje es que los estadísticos cuentan y los cirujanos cortan y que ambos deben hacerlo bien. Las conclusiones válidas sólo existen cuando se han analizado datos creíbles. Este trabajo «después del STICH» hace esta pregunta al confirmar que «la experiencia quirúrgica podría haber tenido influencia crítica en los resultados», proporcionando, por lo tanto, una observación que reafirma el tema central de nuestra disciplina quirúrgica.
El estudio STICH fue diseñado para armar esta información en un estudio prospectivo aleatorizado más que en un registro, y concluyó que no era necesario asociar restauración ventricular quirúrgica (SVR) a la cirugía de revascularización miocárdica en pacientes con cardiomiopatía isquémica2. Comunicar estos resultados en el New England Journal of Medicine (NEJM), una revista muy prestigiosa, ha llevado a la comunidad cardiológica a la conclusión de que la reducción de volumen no es esencial en pacientes isquémicos con corazones dilatados y, por lo tanto, establece «la era post-STICH» que se menciona. La validez de esta conclusión sobre la SVR se relaciona con tres probabilidades que incluyen: a) ¿aportó la medicina basada en la evidencia resultados «creíbles»?; b) ¿es inapropiado el concepto de SVR?, y c) ¿son los resultados del estudio inapropiados? Las respuestas a estas preguntas determinan el destino del tratamiento de la insuficiencia cardíaca mediante SVR en corazones dilatados. Si los resultados del estudio no fueron acreditables, entonces la decisión de abandonar la SVR después de la cardiopatía isquémica no tiene ninguna relación con la publicación de un informe inapropiado en una revista renombrada, o bien justificarla porque el National Institutes of Health (NIH) patrocinó un informe no acre-ditable.
El ventrículo postisquémico desarrolla cardiomiopatía dilatada, si bien es sólo una de las causas de este proceso. La esfericidad del ventrículo dilatado es un concepto unificador que se aplica a la cardiopatía isqué-mica porque el músculo se estira tras perder un área de infarto, que se aplica a la cardiopatía valvular con insuficiencia valvular derecha o izquierda, o se aplica al daño del miocito ventricular en la cardiomiopatía idiopática. Tras unos comentarios acerca del estudio STICH, mi discusión se inicia con este abordaje global, ya que estoy convencido de que la SVR debe convertirse en la pieza central de la evolución de la cirugía cardíaca. Las conclusiones inválidas del estudio STICH reflejan simplemente un retraso en los esfuerzos de nuestra especialidad para embarcarse en este camino.
Stich y su papel en la restauración ventricularEste informe empieza con un análisis de las limitaciones de STICH, ya que el interés en SVR es fútil si los resultados del estudio se consideran válidos. Unos criterios de inclusión satisfactorios son un componente esencial, y STICH requería un índice de volumen telediastólico de VI de 60ml/m2 por cardiorresonancia5. No se utilizó ninguno de estos criterios, y el 13% de los pacientes no tenía historia de infarto, implicando que SVR se utilizó en corazones hibernados, lejos de indicaciones conocidas para este procedimiento de reconstrucción de VI. Las recomendaciones STICH de utilizar cirugía coronaria sin SVR se alcanzaron después de medir el volumen de VI sólo en 161/490 pacientes por ecocardiograma, que infraestima el volumen6. Más aún, introdujo una conclusión que contradice los datos del registro que muestran beneficio de SVR en 7.000 pacientes tratados en todo el mundo, registro en el que se medía el volumen de forma exacta5. STICH redujo el volumen VI en el 19% de pacientes cuando se midió, y estos hallazgos contrastan con un 40% de reducción en más de 1.600 pacientes comunicados, con algunos de los valores mostrados en la figura 2 del trabajo de Herreros, et al.1. El procedimiento punto final objetivo de SVR de STICH difiere de otras comunicaciones… ¿Su procedimiento proporcionó sólo pequeñas plicaturas de VI o reconstrucción cavitaria limitada?
Dos aspectos pueden justificar el alcanzar un punto final limitado. El primero se relaciona con la experiencia previa con el manejo quirúrgico de la región diana. El segundo se refiere a la responsabilidad de STICH de validar una experiencia quirúrgica apropiada antes de incluir centros sin experiencia. En la práctica actual, la mayoría de pacientes han sido revascularizados previamente con trombólisis, dilatación percutánea o cirugía coronaria, de modo que la diana ventricular en la cardiomiopatía isqué-mica ha cambiado de la discinesia (o aneurisma) a la acinesia. Por consiguiente, la superficie ventricular no está cicatrizada, el músculo es grueso, ya que la cicatriz ocupa de la mitad a dos tercios de la pared ventricular y la región dañada no se colapsa al drenar el corazón. Este nuevo objetivo de reconstrucción difiere del aneurisma que existía antes de la reperfusión y, por lo tanto, requiere aprendizaje que es relativamente fácil.
Los criterios de entrada del Comité de Terapia Quirúrgica para una SVR adecuada incluyeron la confirmación por cada cirujano de que la reconstrucción resultara en al menos una reducción de volumen del 30% por cardiorresonancia a los 4 meses. No se podía incluir pacientes sin esta especificación. A pesar de ello, los 490 pacientes STICH se seleccionaron de 110 centros de todo el mundo (unos 4 casos/centro) en los que los cirujanos debían acometer un procedimiento nuevo; no hay evidencia de que estas guías críticas fuesen validadas antes de aceptar los resultados de SVR para análisis estadístico. Por consiguiente, el comentario de que «la experiencia quirúrgica podría haber tenido influencia crítica en los resultados» es una pregunta muy importante.
Los únicos pacientes que pueden considerarse como «SVR aceptables» fueron pacientes en los que el índice de volumen telediastólico de VI se redujo un 30% por cardiorresonancia, aunque esta separación de pacientes no se analizó en la publicación del NEJM. Yo hice esta idéntica cuestión acerca de un grupo que fue sometido a una SVR aceptable cuando se debatieron los resultados de STICH en la American Association for Thoracic Surgery (AATS) de 20095. Los autores de STICH sólo respondieron de forma parcial en la reunión anual de 2010 del American College of Cardiology (ACC) y utilizaron este análisis para llegar a la misma conclusión de abandonar SVR que fue hecha en la publicación del NEJM. Este análisis de 2010 en el ACC incluye ahora resultados de 4 meses antes y 4 meses después de restauración ventricular en 275/490 pacientes con cirugía coronaria y SVR cuyo volumen se midió por ecocardiograma pero no por cardiorresonancia. En este grupo, 69/275 pacientes tenían índices de volumen telesistólico preoperatorios de menos de 60ml/m2, representando un 25% de los pacientes que debían haber sido excluidos de STICH porque el volumen de VI era demasiado pequeño para la restauración. Más aún, el número de pacientes con fracción de eyección de más del 35% como criterio de inclusión no se describió, de modo que la determinación podría no haberse hecho si otros participantes en el estudio no hubiesen tenido criterios de entrada apropiados.
Se alcanzó un índice de volumen telediastólico en el rango de 60-90ml/m2 en 89/275 pacientes y más de 90ml/m2 en 117/275 pacientes, pero la reducción requerida del 30% en el índice de volumen telesistólico sólo se alcanzó en el 38 y 44%, respectivamente. Por consiguiente, el informe STICH 2010 mostró que sólo el 41% de los pacientes habían recibido una SVR aceptable de acuerdo con las guías del Comité de Terapia Quirúrgica. Más aún, 225/490 pacientes o 46% de los revascularizados y pacientes SVR fueron sometidos a restauración de VI sin conocimiento alguno del volumen de VI antes del procedimiento. Las conclusiones del estudio STICH sobre SVR se establecieron sobre una mediana de todos los pacientes estudiados (205/490) que entraron en el estudio, con un índice de volumen telesistólico superior a 60ml/m2. Este análisis incluyó: a) sólo un 41% de pacientes con SVR aceptable donde se alcanzó una reducción superior al 30% del índice de volumen telesistólico, y b) incluyó simultáneamente un 51% (120/205) de pacientes con un procedimiento inadecuado.
Este informe no proporcionó información sobre el resto de pacientes (220/490), cuyo volumen no se midió después de la intervención. Estos datos actualizados amplifican mis conclusiones previas de que los esfuerzos del estudio STICH hacia una «medicina basada en la evidencia» resultaron inútiles por unos resultados no acreditables5. Además, proporcionar una conclusión clínica sobre SVR, que se basa en un valor de mediana que incluye el 51% de pacientes con un procedimiento inadecuado, implica que los estadísticos «desafían a la Naturaleza con una base de datos inadecuada».
Víctimas de la era post-stichLa primera víctima de esta publicación es la enorme población de insuficiencia cardíaca con corazones dilatados que ocupa más de la mitad de la población de insuficiencia cardíaca, con la restante mostrando disfunción diastólica y capacidad sistólica normal7. Conclusiones equivocadas en pacientes de cardiomiopatía isquémica dilatada ponen en riesgo decisiones terapéuticas, ya que la evaluación de la necrosis y una medición exacta del volumen es esencial para permitir la selección de los corazones, cuyo pronóstico puede mejorar si la restauración reduce su volumen más del 30%.
El segundo tema se relaciona con la evolución de procedimientos quirúrgicos novedosos así como con la potencial financiación de estudios controlados. La relación estructura/función prevalece en cirugía cardíaca, y creo que SVR refleja un nuevo pero no realizado objetivo quirúrgico. La reducción ventricular geométrica debe convertirse en un abordaje unificador en el tratamiento de la cardiomiopatía dilatada valvular, isquémica y no isquémica. Conceptos equivocados de STICH retrasarán la evolución de este nuevo largo paso del desarrollo de nuevos y amplios objetivos de tratamiento en nuestra especialidad. Más aún, los conceptos de asistencia circulatoria como «puente para trasplante» y el desarrollo de sistemas de asistencia permanentes pueden quedar ensombrecidos por el empleo de sistemas de asistencia como «puente para la restauración». La restauración puede también llegar a ser la creación quirúrgica de un andamio que permita la unión del abordaje macroscópico y la terapia celular. Finalmente, la financiación de ensayos clínicos puede quedar muy limitada por las serias limitaciones del estudio STICH, de modo que el interés futuro del gobierno en financiar otro ensayo quirúrgico puede empeorar.
La tercera víctima es la integridad científica, ya que este informe retrasa la evolución de requerir que nuestros colegas cardiólogos deberían medir el volumen más que la fracción de eyección de forma natural para el desarrollo de eventos clínicos adversos en corazones dilatados. Ese problema se describe con una experiencia reciente; se emplearon 7años buscando la colaboración de un cardiólogo prominente en insuficiencia cardíaca como primer autor y enviando un artículo conjunto a una revista médica mayor, que focalizara sobre la medida del volumen en pacientes de insuficiencia cardíaca más que la convencional fracción de eyección. El trabajo fue inicialmente revisado y fue inmediatamente rechazado al basarse en los resultados del STICH NEJM, que demuestran que el volumen no es crítico. La potencial ventana al progreso se cierra cuando resultados inexactos nublan la verdad.
La cuarta víctima es el coste del cuidado de la salud, ya que las expectativas son que los gastos por insuficiencia cardíaca pueden exceder el billón de dólares en 2030 (Fig. 1)8, ya que manejamos síntomas más que cambios en la estructura esférica hacia la forma normal cónica. La insuficiencia cardíaca causará la bancarrota del sistema de salud, pero la corrección de esta deficiencia es posible con tres componentes. El primero incluye cambiar la fuente de energía restaurando el corazón nativo más que fiarse de sistemas de asistencia y trasplante. El segundo es la innovación que simplemente altera el pensamiento tradicional hacia: a) reconocimiento de la importancia de medir el volumen ventricular, y b) entender cómo alterarlo quirúrgicamente. El componente final es la educación que requiere desarrollar programas para enseñar estos dos puntos.
Anatomía es destinoLa capacidad miocárdica está muy relacionada con la orientación de las fibras cardíacas, y el corazón cónico normal tiene fibras oblicuas helicoidales que Torrent Guasp llama fibras helicoidales del asa apical (que contiene fibras internas descendentes y externas ascendentes que conforman los brazos derecho e izquierdo de la hélice), y fibras circulares circunferenciales o fibras horizontales llamadas asa basal9,10. Las vías de orientación de las fibras determinan función, como demostró Sallin, quien demostró que la fracción de eyección es del 60% cuando las fibras helicoidales normales se contraen, y cae al 30% si se acortan las fibras transversas11. El desarrollo de una configuración esférica cambiará la orientación de las fibras helicoidales hacia una posición transversa (Fig. 2) y así disminuirá la fuerza contráctil de modo que sea independiente de una enfermedad acompañante. Se producirá un empeoramiento si se pierden las fibras por isquemia subyacente o por enfermedad no isquémica del miocito, o llegan a dañarse por el estiramiento en la enfermedad valvular, donde se pierde el colágeno y las fibras se alargan y engrosan.
El concepto de restauración del VI consiste en reconstruir la cámara a su posición anatómica normal elíptica o cónica y, por consiguiente, cambiar las fibras transversales a su orientación natural helicoidal oblicua. El término «pacopexia» fue introducido hace unos años12 como tributo a la legendaria contribución de Torrent-Guasp, cuyo objetivo fue retornar la anatomía a la normalidad. Esta visión tridimensional de la orientación de las fibras es especialmente útil a la hora de comprender la configuración cardíaca, si bien existe un elemento bidimensional a configurar. El VI normal contiene una «trilogía ventricular» compuesta de un ápex cónico, un plano ecuatorial y la base (Fig. 3)13. Cada componente cambia cuando el corazón cónico se vuelve esférico y cada uno debe considerarse durante la SVR. En una cámara dilatada, se pierde el ápex a medida que se vuelve circular, la pared media se estira para alterar el índice de esfericidad para reducir la relación longitudinal normal longitud:anchura de 2:1 a 1:1, y la base se estira para cambiar la posición de coaptación de los velos mitrales. Esta alteración expande el desarrollo de insuficiencia mitral (IM) funcional más allá de lo causado por la retracción de los velos por el estiramiento ventricular y el ensanchamiento de las bases de los músculos papilares para alterar el ángulo normal entre el anillo y la pared del VI.
La estrategia quirúrgica debe también considerar cada uno de los factores de la «trilogía ventricular», ya que los resultados tardíos después de SVR se relacionan estrechamente con este objetivo. La reciente comunicación de Pocar14 ha demostrado que la geometría ventricular (esfericidad) y la IM afectan al pronóstico y por qué el proceso de decisión durante el tratamiento quirúrgico de la insuficiencia cardíaca dilatada está determinado principalmente por cómo se manejan estos dos factores relacionados con el pronóstico13. Por consiguiente y junto a la evaluación de la fracción de eyección y los índices de volúmenes telesistólico y telediastólico del VI, las mediciones deben hacerse desde la anchura de la pared media (dimensión telediastólica del VI), ensanchando las bases de los músculos papilares y el anillo mitral, ya que las decisiones sobre los objetivos quirúrgicos considerarán cada uno de ellos durante la planificación del procedimiento intentando reconstruir el tamaño y forma anatómicos normales.
Tamaño y formaEl volumen ventricular es un factor de mortalidad en la cardiomiopatía dilatada15 y se consideró en los objetivos de STICH. Sin embargo, restaurar la morfología ventricular cónica normal es otra consideración importante. Dor ha hecho una contribución monumental al focalizar nuestra atención en excluir la cicatriz en la cardiomiopatía isquémica16, pero orientando el procedimiento sólo en la exclusión de la cicatriz en cámaras muy dilatadas dejará en ocasiones una pared medioventricular ensanchada con esfericidad aumentada17. Reconstruir hacia una cámara más cónica sólo es posible si la SVR crea una geometría más cónica hacia un punto más elevado del septo y esta región no contiene cicatriz. Las consecuencias adversas de dejar una cámara más esférica y un índice de volumen telesistólico del VI (IVTSVI) más elevado han sido comentadas por Ferrazzi, et al., quienes demostraron una mortalidad superior si el diámetro telediastólico era superior a 70mm17, y por Di Donato, quien, siguiendo los pacientes de Dor, encontró una mortalidad tardía peor si el IVTSVI fue superior a 60ml/m218. La reconstrucción de la forma fue introducida por Guilmet en 198419, y Suma20 e Isomura21 aplicaron un procedimiento tipo «pacopexia» que fue llamado septal anterior ventricular exclusion (SAVE). Estudios recientes muestran que estos procedimientos han conseguido mejores resultados tardíos cuando se compararon los mismos con la plastia circular endoventricular de Dor13.
En el presente trabajo1 los autores se refieren a la forma ventricular de tres maneras. La primera, sugieren utilizar un maniquí para crear un ápex y previenen un estrechamiento excesivo del VI, lo que refleja una extensión de la técnica de Dor de utilizar un balón intraventricular para evitar comprometer la luz ventricular. Este método es muy apoyado en el trabajo, ya que no fue utilizado en la base de datos de RESTORE, que tuvo resultados similares a los obtenidos con su uso en el Istituto Policlinico San Donato de Milán. Estos resultados favorables pueden relacionarse con el hecho de que cámaras grandes parecen quedar menos comprometidas por la restauración sin un sistema de medición intraventricular. La disfunción diastólica en ellos, como en muchos pacientes SVR con o sin sistema de medición, puede relacionarse con problemas de protección miocárdica, que causa aturdimiento miocárdico que comprende el segmento descendente de la banda miocárdica ventricular helicoidal22, ya que esta parte interna ocupa el septo y la pared lateral de modo que su aturdimiento resultará en agresión septal y disfunción diastólica asociada10,22.
El procedimiento innovador de sustitución mitral en la cardiomiopatía dilatada descrito por Buffolo23 y por Miki24 altera la forma ventricular hacia la normalidad al aproximar los músculos papilares al anillo mitral. La reposición de la forma elíptica y la reducción del índice de esfericidad resulta, a medida que el eje longitudinal disminuye, ya que los músculos anterolateral y posteromedial se acercan al anillo cuando se excluyen los velos estirados. El septo enfermo no se toca en este procedimiento.
El tercer método descrito por Buffolo y su grupo25 y Trainini26, que crea una forma ventricular más elíptica o cónica, se define como un tipo de «pacopexia», que tiene el objetivo de restaurar la configuración helicoidal con un vórtice apical. Sólo se utiliza músculo, y difiere de la «pacopexia» original sugerida en 200112 y posterior-mente realizada como procedimiento SAVE por Suma20, si bien se identifica con el procedimiento muscular descrito por Matsui27. El tema central es reconstruir la forma helicoidal, pero el papel de aproximar los segmentos ascendente y descendente es algo equívoco. La misma anatomía se consigue con o sin parche, ya que el problema no es acercar un segmento sobre el otro por una línea de sutura. Más bien, es la construcción de una forma cónica que reconstruye la forma restaurando la vía oblicua de las fibras helicoidales que se hicieron transversas cuando la cámara se volvió esférica (Fig. 4). Por lo tanto, reformar la configuración helicoidal con un parche fino o emplear músculo interpone un método esencialmente común. Mientras que reconstruir la elipse restaura la forma correcta, debe dirigirse la atención a la base cardíaca, ya que forma parte de la «trilogía ventricular»; se requiere una dimensión más estrecha para permitir una coaptación apropiada de los velos y limitar la IM. Por consiguiente, estrechar la base ampliada mediante anuloplastia o sustitución mitral puede completar el objetivo deseado de reconstruir la forma cónica que contenga la dimensión apropiada de la base, pared medioventricular y estructuras apicales, que son necesarias en la relación forma/función.
Forma contra enfermedadLas observaciones de Dor se han convertido en la guía de nuestro desarrollo hacia técnicas innovadoras que puedan evitar más remodelado en la cardiomiopatía isquémica. Su plastia circular endoventricular con parche alcanzó el punto final vital de excluir la cicatriz16. Varios trabajos documentan que la intervención de Dor deja una cámara menos elíptica de lo que se ha comunicado cuando la forma es el objetivo quirúrgico21,28-30. La cicatriz en la enfermedad isquémica siempre ha sido el foco, ya que esta región es fija después del infarto. La dilatación progresiva estira la región remota ensanchando así la pared medioventricular o el diámetro ecuatorial, de modo que los procedimientos que tienden a excluir sólo la enfermedad dejarán una cámara mayor, que tiene un pronóstico más limitado que cuando el IVTSVI sufre una mayor reducción18. Ferrazzi17 y Di Donato18 comunicaron efectos adversos cuando las intervenciones de SVR mantienen paredes medioventriculares más amplias, lo que define un mayor volumen telesistólico o dimensiones ecuatoriales superiores.
Estas observaciones abren la puerta hacia el desarrollo de conceptos que focalizan en la forma más que en la enfermedad. Por ejemplo, conseguir una cámara más cónica después de un infarto anterior requiere unas guías de reconstrucción elíptica que: a) crea un ápex, y b) estrecha la pared media al colocar suturas directas o un parche más allá del punto final relacionado con la cicatriz; seleccionan la forma más que la enfermedad como objetivo quirúrgico (Fig. 4). El tercer componente de la trilogía ventricular de la amplitud basal debe también considerarse, como ya se ha discutido en relación con las intervenciones valvulares mitrales.
Hacia este extremo, Isomura ha comparado recientemente la intervención de Dor con el SAVE o la «pacopexia»12 en la cardiomiopatía isquémica, y ha comunicado la supervivencia a 8años de este procedimiento relacionado con la forma en una presentación en la Japanese Surgical Society en 2009 (Fig. 5). Un cambio fundamental en el concepto sigue a esta observación, ya que las suturas que han de formar la elipse deben ahora tratar con músculo normal o no cicatricial en la parte alta del septo justo por debajo de la válvula aórtica. Ha habido una oposición natural a este cambio conceptual, pero las limitaciones de dejar una cámara más grande deben ser reconocidas18 y argumentadas con datos que muestren las ventajas de una forma más cónica13,21. Este objetivo arquitectural se alcanza utilizando un parche o suturas directas para crear una cámara cónica cuya línea de sutura se convierte en una «cortina» dentro del VI que forma una cámara más elíptica o cónica. El ápex y la pared medioventricular se reordenan de modo que se obtiene un índice de esfericidad más normal hacia una relación de 0,5.
Dirigirse al concepto de forma más que al de enfermedad tiene una mayor aplicación en corazones dilatados sin cicatriz, ya que con la reparación sólo de la válvula en los pacientes con corazón dilatado después de insuficiencia aórtica o mitral no se eliminan las complicaciones relacionadas con la progresión hacia insuficiencia cardíaca y aparición de arritmias fatales si el volumen telesistólico es superior a 55ml/m231,32. La pared del VI es normal en estos pacientes, y yo sospecho que la construcción de una cámara cónica al colocar un parche entre el ápex y la región subaórtica será una opción futura en la enfermedad valvular. Este abordaje ha sido utilizado por Suma en la enfermedad no isquémica, donde la «pacopexia» o el SAVE muestran una supervivencia aproximada a 5años del 70% con capacidad funcional en clase NYHA I/II. El septo es el lugar principal de malfunción33,34. Más aún, un estudio previo de Batista demostró que excluyendo la pared lateral en pacientes con cardiopatía valvular mejoraba el pronóstico35.
El tema central se relaciona así con la restauración de una cámara elíptica junto con el tratamiento simultáneo de una base ensanchada, y los objetivos se consiguen empleando métodos de reconstrucción que utilizan músculo no cicatricial para corregir la forma ventricular30,34. El objetivo de la geometría cónica puede llegar a ser unificador en el desarrollo de SVR para la cardiomiopatía isquémica y no isquémica que incluya la cardiopatía valvular. Este formato de tratamiento no elimina la enfermedad, ya que la cicatriz se excluye, la válvula anormal se vuelve competente y se excluye la región no isquémica predominante, pero la forma se cambia para restaurar un tamaño y forma más normales, de modo que se utiliza músculo para corregir la forma.
Registro latinoamericano de restauración ventricularEl desarrollo de un equipo colaborador que combine el talento científico quirúrgico, médico y de ciencia básica ofrecerá nuevas perspectivas en este proceso en su distribución a los receptores de sus resultados. Este equipo es similar al RESTORE, que tuvo un objetivo similar hace unos años, grupo que es afortunado ahora para aprovechar la amplia experiencia de sus líderes, quienes están al frente del entendimiento y el manejo de la insuficiencia cardíaca congestiva. Al acumular datos de muchos orígenes, deberían aprender de las debilidades de STICH y asegurar así que cada uno de los centros participantes tiene una competencia demostrable al realizar la restauración ventricular quirúrgica. El estado de la era post-STICH es que datos no acreditables han retrasado tristemente el desarrollo del entendimiento de las razones geométricas de la insuficiencia cardíaca en el corazón dilatado así como el interés global simultáneo en procedimientos innovadores para tratar este proceso que refleja nuestro próximo paso evolutivo en abordajes quirúrgicos novedosos. Espero que estos errores no se repitan.
Conclusiones: Abordajes macroscópicos frenta a microscópicosEl inicio de este manuscrito sobre la restauración ventricular en la era post-STICH1 definió el reto del futuro en la cirugía cardíaca al delinear la enorme población en todo el mundo que sufre insuficiencia cardíaca congestiva que tiene origen isquémico y no isquémico. Más aún, define que el cambio de una cámara normal elíptica o cónica a una forma esférica es la sencilla razón de la insuficiencia cardíaca. El reconocimiento de nuestras limitaciones de tratamiento es el primero paso vital en la innovación y la evolución, y los autores han tomado este camino. Desafortunadamente, el mundo médico y quirúrgico todavía lucha con los fracasos de los actuales abordajes y sólo trata la causa subyacente del estiramiento ventricular (p. ej. isquemia o enfermedad valvular), persigue la consecuencia (p. ej. molecular, neurohumoral y factores genéticos), pero falla colectivamente al dirigirse al proceso subyacente.
La incapacidad actual del espectro de fármacos como los B-bloqueadores, Inhibidores de la enzima converti-dora de angiotensina (ACE) y espironolactona para iniciar la mejoría a largo plazo de este proceso en el mundo médico se replica en el mundo quirúrgico con nuestros abordajes para tratar vasos cerrados o arreglar válvulas incompetentes. La corriente principal de ambas disciplinas de forma simultánea aclara el foco sobre los ventrículos dilatados, a los que, con frecuencia, no se ayuda materialmente al remediar sólo la causa subyacente de estiramiento.
El equipo RESTORE estableció un lema al decir que nos dirigíamos a la «triple V» o el vaso, la válvula y el ventrículo. A pesar de este esfuerzo, la restauración ventricular izquierda permanece en su infancia, como ha evidenciado el estudio STICH, que necesitó 110 centros para incluir 490 pacientes. Los resultados pobres del estudio limitan la evolución del siguiente paso requerido al presentar datos no acreditables. Nuestra limitación es «protección de ayer» y, por consiguiente, tomar un abordaje microscópico a las múltiples causas de un problema unificador y macroscópico del ventrículo dilatado. La innovación requiere que las comunidades médica y quirúrgica empiecen a apreciar las limitaciones establecidas de focalizar sólo en la causa subyacente y reconocer que arreglar el desastroso problema secundario del ventrículo dilatado mediante la utilización del tejido nativo del paciente será un área novedosa del tratamiento futuro.
El trabajo que he tenido la oportunidad de revisar ha proporcionado un abordaje atento, exhaustivo y creativo a este proceso. Las palabras no significan acción, y espero que la comunidad latinoamericana pueda unirse para proporcionar liderazgo, ya que los mundos médico y quirúrgico en EE.UU., Europa y Asia todavía están en la incubadora a la hora de dirigirse a este cambio esencial en nuestras actitudes. La verdad siempre prevalece y la tarea alcanzable de reconstruir macroscópicamente una forma más cónica que reconstituya la banda miocárdica ventricular helicoidal que tan bellamente nos mostró Torrent-Guasp creará nuestro futuro quirúrgico.